Method Article
بروتوكول بسيطة وسريعة لغير إنزيمي فصل الطازجة الأنسجة البشرية لتحليل التسلل اللمفاويات
* These authors contributed equally
In This Article
Summary
This protocol describes the rapid non-enzymatic dissociation of fresh human tissue fragments for qualitative and quantitative assessment of CD45+ cells (lymphocytes/leukocytes) present in various normal and malignant human tissues. Additionally, the supernatant obtained from the primary tissue homogenate can be collected and stored for further analysis or experimentation.
Abstract
يتم قبول قدرة الخلايا الخبيثة للتهرب من الجهاز المناعي، ويتميز ورم الهروب من كل من الاستجابات المناعية الفطرية والتكيفية، والآن باعتبارها السمة المميزة مهمة من السرطان. أبحاثنا حول سرطان الثدي يركز على الدور الفعال الذي تلعبه الورم تسلل الخلايا الليمفاوية في تطور الورم ونتائج المرضى. لتحقيق هذا الهدف، وضعنا منهجية لعزل السريع للخلايا اللمفاوية سليمة من الأنسجة العادية وغير العادية في محاولة لتقييمها الداني إلى حالتها الأصلية. الخليط أعدت باستخدام عرض dissociator الميكانيكية على حد سواء زيادة سلامة وخلية الانتعاش مع الحفاظ على مستقبلات سطح التعبير مقارنة الأنسجة هضمها انزيم ل. وعلاوة على ذلك، لم الهضم الأنزيمي من المواد غير القابلة للذوبان المتبقية لا يتعافى CD45 + خلايا إضافية تشير إلى أن القياسات الكمية والنوعية في جناسة الأساسي من المرجح أن تعكس بصدق تسلل مجموعات سكانية فرعية في fragm الأنسجةوالأنف والحنجرة. الخلايا اللمفاوية في هذه الخليط يمكن أن يكون بسهولة تتميز باستخدام المناعية (النمط الظاهري، والانتشار، وغيرها) أو الجزيئية (DNA، RNA و / أو البروتين) النهج. ويمكن أيضا خلايا CD45 + أن تستخدم لتنقية حيوانية، والتوسع في المختبر أو الحفظ بالتبريد. فائدة إضافية لهذا النهج هو أن طاف النسيج الأساسي من الخليط يمكن استخدامها لتوصيف ومقارنة السيتوكينات، كيموكينات، والمناعية المستضدات الموجودة في الأنسجة الطبيعية والخبيثة. وينبغي لهذه الوظائف البروتوكول بشكل جيد للغاية لأنسجة الثدي الإنسان وتكون قابلة للتطبيق لمجموعة واسعة من أنسجة طبيعية وغير طبيعية.
Introduction
The tumor microenvironment is composed of various cell types with numerous studies showing they each play distinct and important roles in tumorigenesis1,2. These include, but are not limited to, infiltrating immune cells, stromal cells, endothelial cells and tumor cells3. Ex vivo studies of tumor infiltrating lymphocytes (TIL; CD45+ cells or leukocytes, which are predominantly lymphocytes in breast tumors) from fresh human tissue samples is made difficult by their low frequency, the small sample sizes often available for research and the potential for loss of viability during extraction. Because immune cells infiltrating tumors are usually present as passengers rather than permanent residents in general they are easier to release from the tissue matrix.
Dissociating tumor tissue while maintaining cellular integrity is technically challenging and has traditionally been performed using a combination of mechanical and enzymatic steps to prepare single cell suspensions4-8. This approach involves lengthy incubation periods and is associated with a significant reduction in cell viability as well as the loss of cell surface receptors by enzymatic cleavage. High quality flow cytometric studies characterizing TIL in the tumor microenvironment as well as clean purifications of CD45+ subpopulations by flow cytometry or antibody-coated beads are more difficult to achieve from enzyme-digested tumor tissue. In addition, the supernatant (SN) from the resulting tumor homogenate is not amenable to further analysis including quantification of secreted proteins (cytokines, chemokines, immunoglobulins or tumor antigens) or experimental treatment of normal cells, because of the potential for protein degradation in the enzymatic digests.
In our search for a method to prepare single cell homogenates from breast tissues [including tumor, non-adjacent non-tumor (NANT) and normal (from mammary reductions) breast tissues] without enzymatic digestion, we tested a variety of mechanical homogenization techniques. Homogenates prepared using a mechanical dissociator had increased cell viability (2-fold) and total cell recovery (2-fold) while preserving surface receptor expression. Enzymatic digestion of the remaining insoluble material did not recover additional CD45+ cells suggesting they were all released in the initial homogenate. Thus, this rapid and simple approach allows both qualitative and quantitative assessment of the CD45+ subpopulations present in various normal and malignant human tissues. An added advantage of this approach is that the SN from the initial homogenate (primary tissue SN) can be collected and stored for further analysis or experimentation.
Protocol
ملاحظة: تم الحصول على جميع العينات باستخدام بروتوكول افقت عليها لجنة الأخلاقيات الطبية من معهد جول بورديه مع الموافقة المسبقة الخطية التي تم الحصول عليها من كل مريض.
1. إعداد جناسة الأنسجة
- تشريح الأنسجة مقطوعة (الأنسجة الخبيثة وطبيعية مقطوعة من غرفة العمليات) هي في مختبر علم الأمراض من قبل موظفين مدربين لبيك اب فوري. الورم، NANT (تؤخذ هذه المسافة ابعد من الورم ممكن) وتتم معالجة شظايا الأنسجة الطبيعية بشكل روتيني ضمن 1 - 3 ساعة من الاستئصال الجراحي في مختبر BSL2 باستخدام إجراءات موحدة لالأنسجة البشرية السلامة الأحيائية. ويتضح مخطط تدفق بروتوكول في الشكل 1.
- تزن كل أجزاء الأنسجة (عادي، NANT وورم) وقياس الطول والعرض، والارتفاع (الطول × العرض × الارتفاع). هذا هو خطوة هامة لتطبيع احق من القطعان الخلية، والحمض النووي الريبي المستخرج، الخ
NOTE: مجموعة من حجم العينة هو 100 إلى 10،000 مم 3 مع عدم وجود الدهون إذا أمكن ذلك. - بصمة جزء الورم على شريحة زجاجية لH & E تلطيخ للتحقق من أن الأنسجة هي في الواقع جزء من الورم.
- القيام بذلك عن طريق الضغط على المجهر شريحة زجاجية على جزء الورم وتطبيق ضغط لطيف مع أصابعك لبضع ثوان.
- إصلاح الشريحة مع الأيزوبروبانول لمدة 2 دقيقة تليها خطوة الغسيل في الماء. مباين الأنسجة لمدة 30 ثانية مع الهيماتوكسيلين ماير.
- غسل الشريحة في ستة حمامات من الماء. وصمة عار في فلوكسين B 2٪ لمدة 15 ثانية.
- يغسل في حمام من الماء تليها أربع حمامات الأيزوبروبانول والنهاية مع حمام واحد من الماء.
- احتضان في الأيزوبروبانول لمدة 1 دقيقة، واستنزاف. واضح في اثنين من حمامات الزيلين.
- جبل مع الزيلين مقرها المتوسطة المتزايدة. دراسة لالخلوية الورم (الشكل 2).
ملاحظة: في المقام الأول، وخلايا الورم العصا إلى الشريحة مطبوع - واللحمية، اللمفاوية أو إعلاننادرا ما تبقى ipose خلايا، وترك فراغات بين الخلايا السرطانية (الشكل 2).
- وضع جزء الأنسجة في طبق ثقافة صغير يحتوي على 1 مل من يعرف كيميائيا، وخالية من مصل المتوسطة خلية المكونة للدم (المشار إليها فيما يلي باسم المتوسطة) في درجة حرارة الغرفة والزهر ذلك الى قطع صغيرة (~ 1 - 2 مم 2) باستخدام العقيمة مشرط.
- نقل كل شيء (شظايا الأنسجة + متوسطة) إلى الميكانيكي أنبوب dissociator C.
- شطف طبق بيتري ومشرط مع 2 مل من المتوسط باستخدام ماصة باستور وإضافة ذلك إلى C أنبوب (حجم متوسط لتفارق = 3 مل).
- استخدام A.01 برنامج dissociator الميكانيكية للأنابيب C (البرنامج الأكثر لطيف) إلى التجانس شظايا الأنسجة في تعليق خلية واحدة. وضع أنبوب C في الجهاز وتشغيل البرنامج مرتين على التوالي (دورة واحدة = 25 ثانية).
ملاحظة: تم إنشاء هذا الإجراء التجانس والتحقق من صحتها لنسيج الثدي الإنسان، توم أخرىأو الأنسجة أو أنواع قد تحتاج إلى استخدام برنامج مختلف، وينبغي أن يتم اختبارها أولا. - إزالة أنبوب C من أجهزة وصب جناسة مباشرة الى مصفاة الخلية 40 ميكرومتر جالسا على أنبوب 50 مل. باستخدام نفس ماصة باستور كما في الخطوة 1.6، ونقل أي السائل المتبقي في الأنبوب C إلى مصفاة الخلية.
- نقل السائل المصفى في أنبوب 15 مل باستخدام 1 مل ممص مكروى طرف. مؤقتا حفاظ على مصفاة الخلية وأنبوب 50 مل به.
- شطف أنبوب C مع 3 مل إضافية متوسطة ونقل هذا، مرة أخرى باستخدام نفس ماصة باستور كما في الخطوة 1.6، إلى مصفاة الخلية لا يزال جالسا على أنبوب 50 مل. يسجل أكبر قدر ممكن من السائل المتبقي المحاصرين في الأنسجة unhomogenized في أنبوب 50 مل عن طريق تحريك برفق حول مصفاة مع ماصة باستور نظيفة أو 1 مل غيض أن يتم طرح بعد ذلك بعيدا لتجنب تلويث شطافة.
- وضع مصفاة الخلية رأسا على عقب على رانه أنبوب C الأصلي وشطف مع 3 مل من المتوسط بحيث تنخفض الأنسجة unhomogenized مرة أخرى في أنبوب C.
- إعادة التجانس كما في الخطوة 1.7 لدورتين للبرنامج A.01.
- صب هذا جناسة الثاني من خلال مصفاة الخلية يجلس على أنبوب 50 مل، وشطف أنبوب C مرة أخرى مع 3 مل المتوسطة (كما في الخطوة 1.10) ونقل مع ماصة باستور لمصفاة الخلية يجلس على أنبوب 50 مل الضغط مرة أخرى كحد أقصى كمية السائل من النسيج الضام المتبقية المحاصرين في مصفاة الخلية.
- في هذه المرحلة، وبلغ حجم التداول ~ 2.5 مل في أنبوب 15 مل و~ 9 مل في أنبوب 50 مل.
2. فصل طاف الأنسجة والخلايا
- الطرد المركزي الخليط في 15 مل و 50 مل أنابيب لمدة 15 دقيقة في 600 XG في درجة حرارة الغرفة.
- صب SN من أنبوب 15 مل في أنبوب نظيفة وتخزين مؤقتا في 4 درجات مئوية. هذا طاف = الورم الرئيسي، NANT أو منظمة الشفافية الدولية العاديةوأوضح ssue SN (الحجم النهائي 2.5 مل) في وقت لاحق وaliquoted قبل التخزين في -80 درجة مئوية لمدة التحليلات المستقبلية (انظر أدناه).
- تجاهل طاف من أنبوب 50 مل.
- و resuspend بلطف كل من الكريات خلية في الحجم النهائي من 1 مل المتوسطة. لفترة وجيزة، أولا كسر بلطف بيليه الخلية في كل من أنابيب (من خلال الاستفادة من أنبوب على سطح صلب). resuspend الكرية خلية فضفاض في 50 مل مع 500 ميكرولتر من المتوسطة ونقل هذا التعليق الخلية في أنبوب 15 مل ل resuspend بيليه الثاني. كرر هذه الخطوة مرة واحدة مع الثانية 500 ميكرولتر من المتوسطة لاسترداد الحد الأقصى من الخلايا.
- نقل 10 ميكرولتر من تعليق خلية إلى أنبوب صغير، مع مزيج 10 ميكرولتر من اللون الأزرق التريبان (التخفيف 1: 1) وحساب عدد خلايا قابلة للحياة باستخدام عدادة الكريات.
ملاحظة: عند هذه النقطة جزء من تعليق الخلية كما يمكن تحليلها من قبل التدفق الخلوي لتقييم حجم الخلية، تحبب وإذا رغبت في عدد محدود من علامات حيوانية لمزيد من PRECتقييم ايسي لتوزيع الخلية النسبي في جناسة قبل تحليل مستفيض أو التجريب. كل التحليلات التي التدفق الخلوي تتضمن وضع العلامات CD45 للتطبيع المجموعات السكانية الفرعية. - بيليه الخلايا بواسطة الطرد المركزي في 300 x ج لمدة 10 دقيقة في درجة حرارة الغرفة. خلايا من الورم، NANT، أو الأنسجة الطبيعية جاهزة الآن لمزيد من التنقية أو التحليل. هذه الخطوات الإضافية هي أفضل عندما تجرى على نفس يوم الجراحة.
ملاحظة: للحصول على تحليل تدفق cytometric ولكن ليس الفرز الخلية خلايا الدم الحمراء المتبقية يجب هي lysed بعد وضع العلامات الأجسام المضادة عن طريق إضافة 0.4 مل من الدم الحمراء العازلة تحلل الخلية إلى خلية بيليه، vortexing لالفور ل1 ثانية واحتضان ما لا يقل عن 10 دقيقة في غرفة درجة الحرارة (محمية من الضوء) قبل التحليل.
3. توضيح طاف الأنسجة
- الطرد المركزي 1.5 مل أنابيب مع SN الأنسجة في 15،000 x ج لمدة 15 دقيقة على 4 درجات مئوية.
- إزالة بعناية رانه طاف دون لمس أو إزعاج بيليه. نقل إلى أنبوب نظيفة (أو أنابيب) تبعا لعدد وحجم مأخوذة المطلوب.
- تخزين طاف في -80 درجة مئوية لاستخدامها في المستقبل.
4. الدم المرضى
- جمع عينة الدم من كل مريض كعنصر تحكم من قبل بزل الوريد إلى أنابيب heparinized اليوم قبل الجراحة. أجهزة الطرد المركزي الدم في 400 x ج لمدة 10 دقيقة في 20 درجة مئوية مع قبالة الفرامل للحصول على البلازما ومعطف الشهباء.
- إزالة البلازما وتوضيح ذلك بواسطة الطرد المركزي عند 10،000 x ج لمدة 15 دقيقة في 20 درجة مئوية. قسامة وتخزين البلازما في -80 درجة مئوية لاستخدامها في المستقبل. تمييع معطف الشهباء في المتوسط
- فصل الخلايا وحيدة النواة باستخدام معيار-ficoll hypaque التدرج الطرد المركزي قبل التحليل الفوري، حيوانية العزلة، DNA / RNA / استخراج البروتين أو الحفظ بالتبريد.
5. التدفق الخلوي
- خلايا التسمية وفقا لتصنيعتعليمات آر في 4 درجات مئوية، محمية من الضوء. ليز خلايا الدم الحمراء في تعليق خلية من شظايا الأنسجة بعد وضع العلامات الأجسام المضادة عن طريق إضافة 0.4 مل من خلية تحلل العازلة لبيليه الخلية.
- دوامة فورا ل1 ثانية واحتضان ما لا يقل عن 10 دقيقة في درجة حرارة الغرفة، محمية من الضوء. تمرير الخلايا المسمى في تدفق عداد الكريات للحصول على البيانات دون غسل.
النتائج
الهضم الأنزيمي من شظايا الأنسجة مع أي من الحلول المتاحة تجاريا تفارق الأنسجة أو مخاليط مختبر مختلفة من كولاجيناز، الدناز و / أو مثبطات هيالورونيداز، يلتصق مجموعة واسعة من المستقبلات على سطح الخلايا. لدينا دراسات، ركزت في البداية على خلايا CD4 + T التسلل أورام الثدي، وعرضت بسرعة مع مشكلة فنية كبيرة بسبب انشقاق مستقبلات CD4 السطح باستخدام الأنزيمية القياسية البروتوكولات الهضم 4-8. نحن اختبار مجموعة متنوعة من الإنزيمات كولاجيناز مع أو بدون الدناز ومثبطات هيالورونيداز، وجدت أن كولاجيناز الأول والثاني ازالتها بالكامل CD4 من سطح الخلية، على الرغم من ارتفاع قابلية الخلايا اللمفاوية (الشكل 3A). ولوحظ وجود تأثير معتدل على CD4 مع كولاجيناز الرابع في أوقات قصيرة الحضانة (1 - 2 ساعة) مع انخفاض العلامات الأجسام المضادة CD4 الكشف في العقدة الليمفاوية هضم ونسيج الورم مقارنة مع الدم عسر الهضم ونخاع العظام من المريض نفسه (الشكل 3B. ملاحظة أنه نظرا للقيود على الأنسجة التي نتلقاها كنا قادرين على مقارنة العقدة الليمفاوية هضم وعسر الهضم ونسيج الورم). تم تأكيد هذه الخسارة من CD4 لتكون منتجا ثانويا الفني للكولاجيناز الرابع الهضم بمقارنة خلايا CD4 + T عسر الهضم ويهضم المعزولة من الدم متبرع سليم (لا تظهر البيانات). في حين أن هذه الخلايا CD4 لو T يمكن عزله عن كولاجيناز-IV هضمها شظايا الأنسجة باستخدام حبات مغناطيسية، تحتوي على السكان النقي في كثير من الأحيان كميات من التلوث متفاوتة من قبل خلايا أخرى من المكروية الورم، وبالتالي كانت دون المستوى الأمثل لأغراض تجريبية لدينا.
في بحث مستمر عن أفضل نهج، في عام 2008 اختبرنا dissociator الميكانيكية جديد دون استخدام الإنزيمات. أنتج هذا الجهاز الخليط أنسجة الثدي بسرعة وبنزاهة مستقبلات سطح الحفاظ 9. تدفق تمثيلي الخلوي نقطة قطع الورم الخليط خلية FOLLOوتظهر التفكك الجناح ووضع العلامات مع الأجسام المضادة محددة ضد الخلايا الظهارية (EpCAM) والكريات البيض (CD45) في الشكل 3C. هذه الصور هي الملاحظات الروتينية نموذجية لالخليط ورم الثدي. هذا البروتوكول لا يغير كثيرا من جدوى CD45 + الخلايا (الخلايا الميتة 4٪)؛ ومع ذلك، هناك خسائر كبيرة في EpCAM + خلايا قابلة للحياة (الخلايا الميتة 38٪ في الورم هو موضح، تتراوح ما بين الأورام). وعلى الرغم من هذه الخسارة، وEpCAM + قابلة للحياة وCD45 + مجموعات فرعية يمكن فصل على أساس حجم وهيكل في الخلايا الظهارية كبيرة (= الخلايا السرطانية)، والخلايا الظهارية الصغيرة وCD45 + CD45 الخلايا الكبيرة والصغيرة + الخلايا (معظم خلايا ، والتي هي أساسا الخلايا الليمفاوية، الشكل 3C).
الزيادة الكبيرة في CD45 + خلايا قابلة للحياة تم الحصول عليها باستخدام هذا النهج تسمح اكتساب متعدد الألوان استنساخه تدفق الخلوي البيانات (باستخدامما يصل الى عشرة ألوان) لتوصيف أكثر بالكامل فرعية سمسم في سرطان الثدي. وتظهر تدفق تمثيلي الخلوي نقطة المؤامرات من مجموعات فرعية رئيسية سمسم في الشكل (4)، مع تجاربنا الأخيرة تدل على أن من الممكن أيضا لكشف وتحديد الطفيفة خلايا T و B مجموعات فرعية التسلل الورم 10-12، بما في ذلك تلطيخ الخلايا لT الكنسي و عوامل النسخ خلية B 12. تستند استراتيجيات النابضة لالخلايا الليمفاوية على الخلايا CD45 + قابلة للحياة تحديدها مع وصمة عار الجدوى (ملاحظة: يمكن أن الأورام تختلف اختلافا كبيرا في كمية الحطام الخلوي والخلايا الظهارية الميتة اعتمادا على نوع فرعي قبل الميلاد، الصف، الخ). وقد استخدم هذا النهج بنجاح لتنقية مجموعات سكانية فرعية لمفاوية من جناسة مع حبات مغناطيسية أو الخلية الفرز لتحليل التعبير الجيني باستخدام ميكروأرس أو QRT-PCR 9. وسطاء القابلة للذوبان في SN، بما في ذلك السيتوكينات والمناعية، تم كميا باستخدام bead- المناعية مقرها مع ما يترتب على البيانات تطبيع مع حجم جزء الأنسجة. مقارنة بين التعبير خلوى (بركة TH1 / TH2 / Th7 / Th9 / Th17) أو الكلية المناعية (ايغا، فريق الخبراء الحكومي الدولي، مفتش، الغلوبولين المناعي) في BC SN مع SN من أنسجة الثدي العادية تكشف زيادات في كل المرتبطة نسيج الورم (الشكل 5). وهذه SN في الأنسجة الأولية كما تم تحليلها بشكل فعال لمستضدات 10-12 وتستخدم لعلاج تجريبي الخلايا الليمفاوية من المتبرعين الأصحاء، وبالتالي إعادة إنتاج النمط الظاهري سمسم في الخلايا الطبيعية 9.
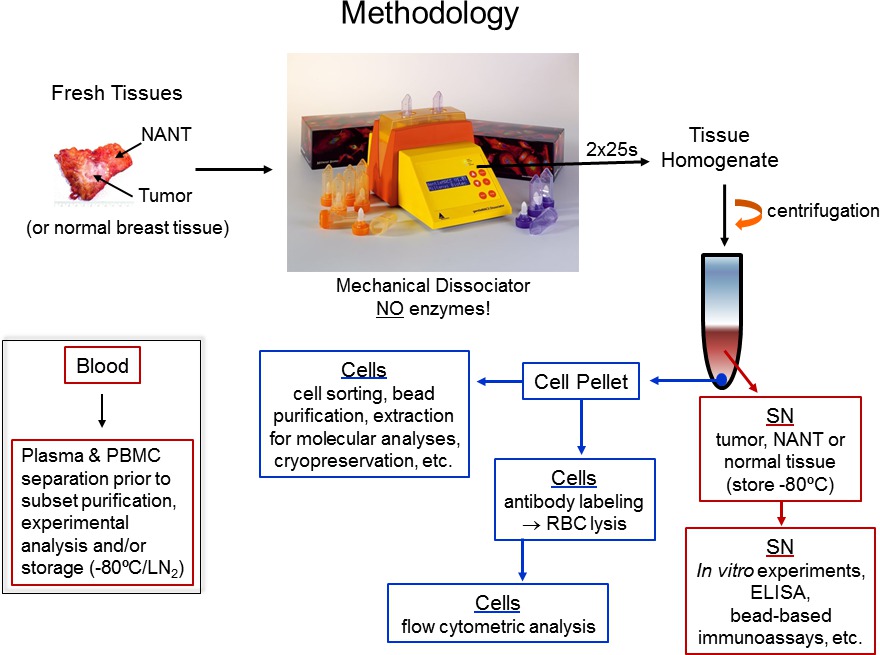
ويبين بروتوكول 1. الشكل الرسم البياني. الإجراء لدينا لمعالجة الأنسجة البشرية الطازجة وبعض الأساليب التحليلية التي يمكن بعد ذلك أن تستخدم لتقييم الخلايا الليمفاوية التسلل الأنسجة البشرية.

الشكل 2. H & E الملون صورة الأنسجة بصمة ورم الثدي. هذه بصمة، والتي اتخذت من ورم الثدي الأنسجة جزء جديد، ويظهر وجود الخلايا السرطانية مع المساحات المفتوحة التي تعكس المناطق التي لم نقلها. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

. الشكل 3. الأمثل من التفكك نسيج الثدي لتحليل الخلايا اللمفاوية تحليل تدفق cytometric من: (A) CD4 التعبير على سطح الخلايا الليمفاوية من عسر الهضم وكولاجيناز I / II هضم أنسجة الورم. (B) CD4 التعبير على الخلايا الليمفاوية من العقدة الليمفاوية وأورام الأنسجة هضمها الطرافةح كولاجيناز الرابع وبالمقارنة مع الدم ونخاع العظم خلايا غير مهضوم من نفس المريض. و (C) تحليل مجموع الكريات البيض (CD45 +) والخلايا الظهارية (EpCAM +) من نسيج الورم بسرعة فصلها ميكانيكيا باستخدام وصف بروتوكول هنا. ويتم تقييم جدوى الخلايا الظهارية وCD45 + الخلايا باستخدام بروتوكول لدينا عن طريق إدماج قابل للتثبيت الجدوى صباغة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

تم تنفيذ الشكل 4. ورم تسلل مجموعات فرعية لمفاوية في جناسة. متعدد الألوان تحليل تدفق cytometric في يوم الجراحة بعد التفكك الميكانيكية باستخدام بروتوكول الموصوفة هنا. خلايا قابلة للحياة ومجموعات سكانية فرعية اللمفاويات كبرىإعادة مبين: CD3 هو وعاء خلية T علامة، CD4 و CD8 T هي علامات فرعية الخلايا الرئيسية وCD19 هو علامة الخلية عموم B. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
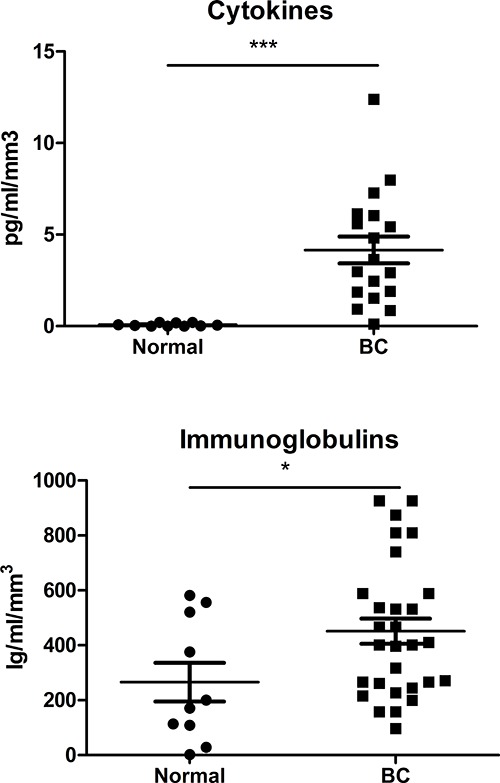
الرقم 5. وسطاء القابلة للذوبان في طاف. لجنة من السيتوكينات (TH1 / TH2 / Th7 / Th9 / Th17) تم تقييم والمناعية (ايغا، فريق الخبراء الحكومي الدولي، مفتش، الغلوبولين المناعي) باستخدام المناعية القائم على حبة لتحليل SN المستمدة من المعتاد، وقبل الميلاد الأنسجة باستخدام بروتوكول الموصوفة هنا.
Discussion
توضح هذه الدراسة طريقة الأمثل لإعداد السريع من الخليط أنسجة الثدي العادية والخبيثة دون الهضم الأنزيمي للفرز لاحق الخلية، والاستخراج، والحفظ بالتبريد و / أو تحليل المظهري من CD45 + القطعان. والهدف من هذا النهج التجريبي لإنتاج صور للسمسم التي تعكس بشكل وثيق دولتهم في الجسم الحي ومقارنتها مع الأنسجة الطبيعية مع التلاعب الحد الأدنى للأنسجة جديدة من غرفة العمليات. حتى الآن، وقد مختبرنا تستخدم هذا البروتوكول لتحليل> 250 قبل الميلاد الأنسجة الطازجة (الورم وNANT)،> 35 أنسجة الثدي العادية من تخفيضات الثديية. من حيث المبدأ، ينبغي أن يكون هذا البروتوكول المعمول به مباشرة إلى أنواع الورم أو الأنسجة الأخرى؛ ومع ذلك، قد يكون بعض التحسين اللازمة (أي برنامج الميكانيكية التفكك، وعدد من الدورات، وحجم وسائل الإعلام، وما إلى ذلك). لأنسجة لمفاوية مع انخفاض تسلل، وذلك باستخدام جزء الأنسجة أكبر قد يكون necessآرى، وهو ما نقوم به لأنسجة طبيعية حيث عدد اللمفاويات منخفضة. بدلا من ذلك، يمكن إضافة خطوة الطرد المركزي كثافة التدرج لإثراء تعليق الكريات البيض. ويشمل هذا التحليل من T و B القطعان الخلية البشرية التسلل أورام الثدي تقييما ل> 100 علامات التدفق الخلوي (التدفق الخلوي البيانات ل74 علامات متاح في البيانات التكميلية من قو-Trantien، وآخرون. 9) وتنقية الخلايا اللمفاوية محددة مجموعات سكانية فرعية للتحليلات المناعية والجزيئية لاحقة. وعلاوة على ذلك، لدينا تقييم السيتوكينات، كيموكينات، والمناعية مستضدات الأورام في SN الورم الرئيسي (مقارنة NANT وSN النسيج العادي) 10،11 كانعكاس لهذه سطاء الجزيئية في المكروية الورم. لقد اختبرنا أيضا تأثير علاج الخلايا الليمفاوية في الدم الطرفية من المانحين صحية مع ورم SN وأظهرت أن العديد من التغييرات التعبير الجيني في الكشف عن سمسم يمكن استنساخها على وجه التحديد <سوب> 9.
في المكروية، وتقام على الخلايا السرطانية واللحمية أكثر إحكاما في مصفوفة الأنسجة من الخلايا المناعية، والتي هي المهاجرة مميز. الطريقة الموصوفة هنا يوفر وسيلة بسيطة وسريعة لعزل وتحليل سمسم دون الهضم الأنزيمي. لدينا العديد من المحاولات للانضمام إلى هذا النهج التجانس الميكانيكية مع الهضم الأنزيمي القصير من أجل إنتاج خلايا قابلة للحياة ومستقبل اللمفاوية إيجابي والظهارية من نفس الورم جزء لم تكلل بالنجاح. الأنسجة التجانس النشرات كفاءة الخلايا الليمفاوية ولكن النتائج في خسائر كبيرة في بقاء الخلية السرطانية. والهضم الأنزيمي قصيرة من الأنسجة يحرر الخلايا السرطانية قابلة للحياة (يزداد إجمالي عدد بوصفها وظيفة من الزمن الهضم) ولكن لديه نتيجة لانخفاض مواز في التعبير عن العديد من مستقبلات السطح، واضحة خاصة على الخلايا الليمفاوية. وهكذا، على التحليل المقارن لخلايا الورم وسمسم من نفس تومأو أنه لا يزال من الضروري معالجة منفصلة اثنين شظايا ورم متتابعة.
حاليا، فإن غالبية الدراسات الرامية إلى تميز سمسم قد استخدمت الأنزيمية الهضم (ساعات لO / N) إلى جانب كثير من الأحيان مع بعض شكل من أشكال تشريح الميكانيكية 4-8. توسيع سمسم لمزيد من التحليل أو العلاج ينطوي عموما خارج الحي زراعة اللاحقة سمسم أو شظايا نسيج الورم مع وكلاء تنشيطية (أيام إلى أسابيع) 13-15. طريقة سريعة وغير الأنزيمية للتفكك النسيج الموصوفة هنا يوفر وسيلة بسيطة وقابلة للتكرار لاستخراج CD45 سليمة + الخلايا من شظايا الأنسجة العادية وغير العادية قبل توسعها أو التحليل. يمكن ربما يتم تطوير هذا الاستحواذ السريع لCD45 + الخلايا من المرضى الذين يخضعون tumorectomy لاستخدامها في فحص العلامات البيولوجية النذير. وبالإضافة إلى ذلك، قد تسفر عن سمسم مع إمكانية أكبر للتوسع خارج الحي قبل بالتبني immunotherapy.
Disclosures
The authors declare that no conflict of interest exists.
Acknowledgements
كان مدعوما من المنح هذا العمل fromthe صندوق البلجيكي للبحوث العلمية (FNRS)، LES AMIS DE L'معهد بورديه، FNRS في العملية Télévie، سرطان خطة بلجيكا، فون مبو]-Marteaux، فون JC Heuson وفون برسي.
Materials
| Name | Company | Catalog Number | Comments |
| GentleMacs Dissociator | Miltenyi Biotec | 130-093-235 | BD Medimachine is somewhat equivalent |
| Centrifuge 5810 R | Eppendorf | or other standard table top centrifuge | |
| Centrifuge 5417 R | Eppendorf | or other standard microcentrifuge | |
| Esco Class II A2 Biosafety Cabinet | ESCO global | or other standard BSL2 hood | |
| Inverted Microscope | Nikon eclipse TS100 | or other microscope compatible for a hemacytometer | |
| Bürker Chamber | Marienfield | 640210 | or other standard hemacytometer |
| Navios Flow Cytometer | Beckman Coulter | or other flow cytometer (8-10 color recommended) | |
| GentleMacs C-Tube | Miltenyi Biotec | 130-096-344 | BD Medimachine uses Filcon |
| Cell Culture Dish | Sarstedt | 72,710 | or other non-pyrogenic plasticware |
| Disposable Scalpel | Swann-Morton | 0510 | or standard single use sterile scalpel |
| BD Cell Strainer 40 µm | Becton Dickinson | 734-0002 | or other non-pyrogenic plasticware |
| BD Falcon Tube 50 ml | Becton Dickinson | 352070 | or other non-pyrogenic plasticware |
| BD Falcon Tube 15 ml | Becton Dickinson | 352097 | or other non-pyrogenic plasticware |
| BD FACS Tube 5 ml | Becton Dickinson | 352008 | or other non-pyrogenic plasticware |
| Sterile Pasteur Pipette 5 ml | VWR | 612-1685 | or other non-pyrogenic plasticware |
| Microfuge Tube 1.5 ml | Eppendorf | 7805-00 | or other non-pyrogenic plasticware |
| X-Vivo 20 | Lonza | BE04-448Q | serum-free medium recommended |
| Phosphate buffered saline | Lonza | BE17-516F | standard physiological PBS |
| Trypan blue | VWR | 17942E | or other vital stain |
| VersaLyse | Beckman Coulter | A09777 | for flow cytometry experiments |
| Fixable viability Dye eFluor 780 | eBioscience | 65-0865-14 | for flow cytometry experiments |
| anti-CD3 FITC | BD Biosciences | 345763 | for flow cytometry experiments |
| anti-CD3 Vio Blue | Miltenyi Biotec | 130-094-363 | for flow cytometry experiments |
| anti-CD4 PE | BD Biosciences | 345769 | for flow cytometry experiments |
| anti-CD4 APC | Miltenyi Biotec | 130-091-232 | for flow cytometry experiments |
| anti-CD8 ECD | Beckman Coulter | 737659 | for flow cytometry experiments |
| anti-CD8 PerCP | BD Biosciences | 345774 | for flow cytometry experiments |
| anti-CD19 APC-Vio770 | Miltenyi Biotec | 130-096-643 | for flow cytometry experiments |
| anti-CD45 VioGreen | Miltenyi Biotec | 130-096-906 | for flow cytometry experiments |
References
- Chen, D. S., Mellman, I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 39 (1), 1-10 (2013).
- Boudreau, A., van't Veer, J. L., Bissell, M. J. An 'elite hacker': breast tumors exploit the normal microenvironment program to instruct their progression and biological diversity. Cell Adh Migr. 6 (3), 236-248 (2012).
- Gajewski, T. F., Schreiber, H., Fu, Y. X. Innate and adaptive immune cells in the tumor microenvironment. Nat Immunol. 14 (10), 1014-1022 (2013).
- Quezada, S. A., et al. Limited tumor infiltration by activated T effector cells restricts the therapeutic activity of regulatory T cell depletion against established melanoma. J Exp Med. 205 (9), 2125-2138 (2008).
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. J Immunol Methods. 372 (1-2), 119-126 (2011).
- McCauley, H. A., Guasch, G. Serial orthotopic transplantation of epithelial tumors in single-cell suspension. Methods Mol Biol. 1035, 231-245 (2013).
- Gros, A., et al. Myeloid cells obtained from the blood but not from the tumor can suppress T-cell proliferation in patients with melanoma. Clin Cancer Res. 18 (19), 5212-5223 (2012).
- Zirakzadeh, A. A., Marits, P., Sherif, A., Winqvist, O. Multiplex B cell characterization in blood, lymph nodes, and tumors from patients with malignancies. J Immunol. 190 (11), 5847-5855 (2013).
- Gu-Trantien, C., et al. CD4(+) follicular helper T cell infiltration predicts breast cancer survival. J Clin Invest. 123 (7), 2873-2892 (2013).
- Buisseret, L., et al. Lymphocytes Infiltrating Breast Cancer : Density, Composition And Organization. Annals of Oncology. 25 (1), 17 (2014).
- Garaud, S., et al. Characterization of B Cells Infiltrating Human Breast Cancer. Annals of Oncology. 25 (1), 18 (2014).
- Gu-Trantien, C., et al. Cxcl13-Producing Follicular Helper T Cells In Human Breast Cancer. Annals of Oncology. 25 (1), 17 (2014).
- Yee, C. The use of endogenous T cells for adoptive transfer. Immunol Rev. 257 (1), 250-263 (2014).
- Butler, M. O., et al. Ex vivo expansion of human CD8+ T cells using autologous CD4+ T cell help. PLoS One. 7 (1), 30229 (2012).
- Ye, Q., et al. Engineered artificial antigen presenting cells facilitate direct and efficient expansion of tumor infiltrating lymphocytes. J Transl Med. 9, 131 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved