Method Article
Eine einfache und schnelle Protokoll zum Nicht enzymatisch Dissociate Frische menschlichen Geweben zur Analyse der infiltrierenden Lymphozyten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
This protocol describes the rapid non-enzymatic dissociation of fresh human tissue fragments for qualitative and quantitative assessment of CD45+ cells (lymphocytes/leukocytes) present in various normal and malignant human tissues. Additionally, the supernatant obtained from the primary tissue homogenate can be collected and stored for further analysis or experimentation.
Zusammenfassung
Die Fähigkeit von Tumorzellen, das Immunsystem, gekennzeichnet durch Tumorflucht sowohl angeborenen und erworbenen Immunreaktionen entziehen wird nun als ein wichtiges Merkmal von Krebs angenommen. Unsere Forschung zu Brustkrebs konzentriert sich auf die aktive Rolle, die Tumor-infiltrierenden Lymphozyten in der Tumorprogression und der Behandlungserfolg spielen. Auf dieses Ziel, eine Methodik für die schnelle Isolierung von intakten lymphatischen Zellen von normalen und abnormalen Geweben haben wir in dem Bemühen, zu bewerten nahe ihrem nativen Zustand. Homogenate mit einem mechanischen Dissoziator zeigen sowohl erhöhte Lebensfähigkeit und Zellgewinnung unter Beibehaltung Oberflächenrezeptorexpression im Vergleich zum Enzym verdaute Gewebe vorbereitet. Außerdem hatte enzymatische Verdauung der verbleibenden unlöslichen Materials zusätzliche CD45 + Zellen anzeigt, dass qualitative und quantitative Messungen im Primär Homogenat wahrscheinlich wirklich infiltrieren Subpopulationen im Gewebe fragm reflektieren nicht wiederherstellenEintr. Die lymphoiden Zellen in diesen Homogenaten man einfach mit immunologischen (Phänotyp, Proliferation usw.) oder Molekular (DNA, RNA und / oder Protein), gekennzeichnet nähert. CD45 + Zellen können auch für die Reinigung Subpopulation, in vitro Expansion oder Kryokonservierung verwendet werden. Ein zusätzlicher Vorteil dieses Ansatzes ist, dass die Primärgewebe Stand aus den Homogenaten kann verwendet werden, um in normalen und malignen Geweben zu charakterisieren und zu vergleichen, Cytokine, Chemokine, Immunglobuline und Antigenen werden. Diese Protokoll-Funktionen sehr gut für den menschlichen Brustgewebe und sollte für eine breite Vielzahl von normalen und abnormalen Geweben.
Einleitung
The tumor microenvironment is composed of various cell types with numerous studies showing they each play distinct and important roles in tumorigenesis1,2. These include, but are not limited to, infiltrating immune cells, stromal cells, endothelial cells and tumor cells3. Ex vivo studies of tumor infiltrating lymphocytes (TIL; CD45+ cells or leukocytes, which are predominantly lymphocytes in breast tumors) from fresh human tissue samples is made difficult by their low frequency, the small sample sizes often available for research and the potential for loss of viability during extraction. Because immune cells infiltrating tumors are usually present as passengers rather than permanent residents in general they are easier to release from the tissue matrix.
Dissociating tumor tissue while maintaining cellular integrity is technically challenging and has traditionally been performed using a combination of mechanical and enzymatic steps to prepare single cell suspensions4-8. This approach involves lengthy incubation periods and is associated with a significant reduction in cell viability as well as the loss of cell surface receptors by enzymatic cleavage. High quality flow cytometric studies characterizing TIL in the tumor microenvironment as well as clean purifications of CD45+ subpopulations by flow cytometry or antibody-coated beads are more difficult to achieve from enzyme-digested tumor tissue. In addition, the supernatant (SN) from the resulting tumor homogenate is not amenable to further analysis including quantification of secreted proteins (cytokines, chemokines, immunoglobulins or tumor antigens) or experimental treatment of normal cells, because of the potential for protein degradation in the enzymatic digests.
In our search for a method to prepare single cell homogenates from breast tissues [including tumor, non-adjacent non-tumor (NANT) and normal (from mammary reductions) breast tissues] without enzymatic digestion, we tested a variety of mechanical homogenization techniques. Homogenates prepared using a mechanical dissociator had increased cell viability (2-fold) and total cell recovery (2-fold) while preserving surface receptor expression. Enzymatic digestion of the remaining insoluble material did not recover additional CD45+ cells suggesting they were all released in the initial homogenate. Thus, this rapid and simple approach allows both qualitative and quantitative assessment of the CD45+ subpopulations present in various normal and malignant human tissues. An added advantage of this approach is that the SN from the initial homogenate (primary tissue SN) can be collected and stored for further analysis or experimentation.
Protokoll
HINWEIS: Alle Proben wurden unter Verwendung eines Protokolls von der Medizinischen Ethik-Kommission des Instituts Jules Bordet mit schriftlicher Einwilligung von jedem Patienten erhalten genehmigt erworben.
1. Herstellung des Gewebehomogenats
- Sezieren resezierten Gewebe (malignen und normalen Gewebe aus dem OP-Saal resezierten) sind in der Pathologie-Labor durch geschultes Personal zur sofortigen Abholung. Tumor, NANT (aufgenommen am weitesten Abstand von der Tumor wie möglich) und Normalgewebefragmente werden routinemäßig auf 1 bearbeitet - 3 h chirurgische Exzision in einem BSL2 Labor unter Verwendung von Standardverfahren der biologischen Sicherheit für menschliche Gewebe. Ein Ablaufdiagramm des Protokolls ist in Abbildung 1 dargestellt.
- Wiegen Sie alle Gewebestücke (normal, NANT und Tumor) und messen Sie die Länge, Breite und Höhe (Länge x Breite x Höhe). Dies ist ein wichtiger Schritt für die anschließende Normalisierung des Zellpopulationen, extrahierte RNA usw.
NEINTE: Der Bereich der Stichprobengröße ist 100 bis 10.000 mm 3 ohne Fett, wenn möglich. - Impressum der Tumorfragment auf einem Objektträger für H & E Färbung, um zu überprüfen, dass das Gewebe ist eigentlich ein Teil des Tumors.
- Tun Sie dies, indem Sie einen Glasobjektträger auf den Tumor-Fragment und mit leichtem Druck mit den Fingern für ein paar Sekunden.
- Befestigen Sie die Folie mit Isopropanol für 2 Minuten, gefolgt von einem Waschschritt in Wasser. Gegenfärbung des Gewebes für 30 Sekunden mit Mayers Hämatoxylin.
- In sechs Bäder Wasser Waschen Sie den Objektträger. Fleck in Phloxin B 2% für 15 Sekunden.
- In einem Bad aus Wasser, gefolgt von vier Bäder Isopropanol und Finish mit einem Bad aus Wasser waschen.
- Inkubiere in Isopropanol für 1 min und Drain. Klar in zwei Bäder Xylol.
- Montieren Sie mit Xylol basiert Eindeckmedium. Untersuchen der Tumorzellzahl (Abbildung 2).
HINWEIS: Vor allem, Tumorzellen haften an der aufgedruckten Rutsche - das Stroma, lymphatischen oder Ad-ipose Zellen selten bleiben, so dass Zwischenräume zwischen den Tumorzellen (Abbildung 2).
- Mit einer sterilen - Legen Sie die Gewebefragment in einer kleinen Kulturschale mit 1 ml der chemisch definierten, serumfreien hämatopoetischen Zellmedium bei Raumtemperatur in kleine Stücke (2 mm 2 bis 1) (im Folgenden als Medium bezeichnet), und in Würfel schneiden Skalpell.
- Bringen Sie alles, was (Gewebefragmente + Medium) zu einer mechanischen Dissoziator C Rohr.
- Mit 2 ml Medium mit einer Pasteurpipette gründlich die Petrischale und Skalpell und addieren sie zum C Rohr (Volumen des Mediums für die Dissoziation = 3 ml).
- Verwenden Sie die mechanische Dissoziator Programm A.01 für C Rohre (die schonendste Programm), um die Gewebefragmente in eine Einzelzellsuspension zu homogenisieren. Stellen Sie das C-Rohr in der Vorrichtung und zweimal das Programm in Folge (ein Zyklus = 25 sec).
HINWEIS: Diese Homogenisierung Verfahren hergestellt wurde und für den menschlichen Brustgewebe, andere tum validiertoder oder Gewebetypen müssen vielleicht ein anderes Programm verwenden und sollten zuerst getestet werden. - Entfernen Sie das C-Rohr aus dem Gerät und dekantiert die Homogenat direkt in ein 40 um Zellsieb auf einem 50-ml-Tube sitzt. Mit der gleichen Pasteur-Pipette, wie in Schritt 1.6, übertragen jede in der C-Rohr in die Zelle Sieb zurückbleibende Flüssigkeit.
- Übertragen Sie die gefilterte Flüssigkeit in einen 15-ml-Röhrchen mit einem 1 ml Mikropipettenspitze. Vorübergehend halten die Zellsieb und seine 50-ml-Tube.
- Mit weiteren 3 ml Medium spülen C Röhrchen sammeln und diese wieder mit dem gleichen Pasteur-Pipette, wie in Schritt 1.6, auf die Zellsieb noch auf dem 50-ml-Tube sitzt. Drücken Sie eine maximale Menge der Restflüssigkeit in der nicht homogenisierten Gewebe eingeklemmt in die 50-ml-Röhrchen durch leichtes Verschieben der ganzen Sieb mit einem sauberen Pasteurpipette oder 1 ml-Spitze, die dann weggeworfen wird, um zu vermeiden, eine Verunreinigung des Eluats.
- Legen Sie die Zellsieb kopfüber auf ter Original C Rohr und spülen Sie mit 3 ml Medium, so dass die nicht homogenisierten Gewebe fällt zurück in die C-Rohr.
- Re-Homogenisierung, wie in Schritt 1.7 für zwei Zyklen des A.01 Programms.
- Gießen Sie diese zweite Homogenat durch die Zelle Sieb auf dem 50-ml-Tube sitzt, spülen Sie das C-Rohr wieder mit 3 ml Medium (wie in Schritt 1.10) und Transfer mit dem Pasteur-Pipette an die Zelle Sieb auf dem 50-ml-Tube sitzt wieder drückte maximal Flüssigkeitsmenge aus dem Rest Bindegewebes im Zellsieb gefangen.
- Zu diesem Zeitpunkt ist ein Volumen von ~ 2,5 ml in 15 ml-Röhrchen und ~ 9 ml in 50-ml-Röhrchen.
2. Trennung der Gewebeüberstand und Zellen
- Zentrifugieren Homogenate in 15 ml und 50 ml-Röhrchen für 15 min bei 600 × g bei Raumtemperatur.
- Dekantiert man die SN aus dem 15-ml-Röhrchen in ein sauberes Röhrchen und vorübergehend bei 4 ° C zu lagern. Dieser Überstand = Primärtumor, NANT oder normale tiUSGABE SN (Endvolumen 2,5 ml) wird anschließend geklärt und aliquotiert vor der Lagerung bei -80 ° C für zukünftige Analysen (siehe unten).
- Überstand verwerfen aus dem 50-ml-Tube.
- Vorsichtig resuspendieren beiden Zellpellets in einem Endvolumen von 1 ml Medium. Kurz gesagt, zuerst sanft brechen die Zellpellets in beiden Röhren (durch Tippen auf das Rohr auf eine harte Oberfläche). Resuspendieren Sie das lose Zellpellet in den 50 ml mit 500 ul Medium und übertragen diese Zellsuspension in die 15-ml-Tube, um die zweite Pellet resuspendieren. Wiederholen Sie diesen Schritt einmal mit der zweiten 500 ul Medium für maximale Rückgewinnung von Zellen.
- Transfer 10 ul der Zellsuspension in ein kleines Röhrchen, mischen mit 10 ul Trypanblau (Verdünnung 1: 1) und die Anzahl der lebensfähigen Zellen unter Verwendung eines Hämocytometers.
HINWEIS: An diesem Punkt eine Fraktion der Zellsuspension können auch mittels Durchflusscytometrie analysiert, um die Zellgröße, Granularität zu bewerten und, falls gewünscht eine begrenzte Anzahl von Subpopulation Marker für weitere precise Abschätzung der Zellverteilung in dem Homogenat vor der umfassenden Analyse oder Experimente. Alle Analysen mittels Durchflusszytometrie integrieren CD45 Kennzeichnung für die Normalisierung der Subpopulationen. - Pellet die Zellen durch Zentrifugation bei 300 × g für 10 min bei Raumtemperatur. Die Zellen aus dem Tumor, NANT oder normales Gewebe sind nun bereit für die weitere Reinigung oder Analyse. Diese zusätzlichen Schritte sind am besten, wenn am selben Tag wie die Chirurgie durchgeführt.
HINWEIS: Für Durchflusszytometrieanalyse aber nicht zell Sortieren der Rest Erythrozyten sollten nach der Antikörper-Markierung nach Zugabe von 0,4 ml von roten Blutzellen Lysepuffer zu dem Zellpellet sofort Vortexen für 1 sec und Inkubieren von mindestens 10 min bei Raum lysierenden Temperatur (lichtgeschützt) vor der Analyse.
3. Klärung der Gewebeüberstand
- Zentrifugieren 1,5-ml-Röhrchen mit Gewebe SN bei 15.000 xg für 15 min bei 4 ° C.
- Entfernen Sie vorsichtig ter Überstand ohne sie zu berühren oder das Pellet aufzurühren. Transfer in ein sauberes Röhrchen (oder Röhren) in Abhängigkeit von der Anzahl und Volumen der Aliquote gewünscht.
- Lagern Sie den Überstand bei -80 ° C für eine spätere Verwendung.
4. Patient Blut
- Sammeln einer Blutprobe von jedem Patienten als Kontrolle durch Venenpunktion in heparinisierte Röhrchen am Tag vor der Operation. Zentrifugieren des Bluts bei 400 · g für 10 min bei 20 ºC mit der Bremse aus, um das Plasma und Buffy-Coat erhalten.
- Entfernen Sie das Plasma und klären sie durch Zentrifugation bei 10.000 × g für 15 min bei 20 ºC. Aliquot und speichern Plasma bei -80 ° C für zukünftige Verwendung. Verdünnen Sie die Buffy-Coat in Medium
- Trenne die mononukleäre Zellen unter Verwendung von Standard-Ficoll-Hypaque-Gradienten-Zentrifugation vor der unmittelbaren Analyse Subpopulation Isolierung, DNA / RNA / Protein-Extraktion oder Kryokonservierung.
5. Durchflusszytometrie
- Etikett Zellen nach der Herstellungr Angaben bei 4 ° C, vor Licht geschützt. Lyse der roten Blutzellen in Zellsuspensionen aus Gewebefragmenten nach der Antikörper-Markierung nach Zugabe von 0,4 ml der Zell-Lyse-Puffer zu dem Zellpellet.
- Vortex sofort für 1 Sekunde und Inkubation von mindestens 10 Minuten bei Raumtemperatur, vor Licht geschützt. Führen Sie die markierten Zellen in einem Durchflusszytometer für die Datenerfassung ohne Waschen.
Ergebnisse
Enzymatische Verdauung von Gewebefragmenten entweder im Handel erhältlich Gewebedissoziation Lösungen oder verschiedene Labor Mischungen Kollagenase, DNase und / oder Hyaluronidase-Inhibitoren sind, schneiden eine Vielzahl von Rezeptoren auf der Oberfläche von Zellen. Unsere Studien, zunächst auf CD4 + T-Zellen infiltrieren Brusttumoren fokussiert wurden schnell mit einem großen technischen Problem wegen Spaltung Oberfläche CD4-Rezeptoren unter Verwendung von Standardprotokollen enzymatische Verdauung 4-8 dargestellt. Wir testeten eine Vielzahl von Collagenaseenzyme mit und ohne DNase-und Hyaluronidase-Inhibitoren, Feststellung, dass Collagenase I und II vollständig entfernt CD4 von der Zelloberfläche, trotz hoher Lymphozyten Lebensfähigkeit (3A). Eine moderate Wirkung auf CD4 wurde mit Collagenase IV in kurzen Inkubationszeiten beobachtet (1 - 2 h) mit niedriger CD4 Antikörpermarkierung in Faul Lymphknoten und Tumorgewebe festgestellt, verglichen mit unverdauten Blut und Knochenmark desselben Patienten (3B; beachten Sie, dass aufgrund der Beschränkungen auf das Gewebe, die wir erhalten konnte das verdauten und unverdauten Lymphknoten und Tumorgewebe) zu vergleichen. Dieser Verlust an CD4 wurde bestätigt, das ein Nebenprodukt der technischen Kollagenase IV Verdauung durch Vergleichen unverdaute verdaut und CD4 + T-Zellen von gesunden Spender Blut isoliert werden (Daten nicht gezeigt). Während diese CD4 lo T-Zellen können aus Kollagenase IV verdaute Gewebefragmente mit magnetischen Kügelchen isoliert werden, die gereinigten Populationen enthalten häufig unterschiedliche Mengen an Verunreinigungen durch andere Zellen aus dem Tumor-Mikroumgebung und so waren nicht optimal für unsere Versuchszwecken.
In einer kontinuierlichen Suche nach einem besseren Ansatz, im Jahr 2008, die wir getestet eine neue mechanische Dissoziator ohne Enzyme. Diese Vorrichtung erzeugt Brustgewebe-Homogenaten schnell und mit Oberflächenrezeptor Integrität gewahrt 9. Vertreter Durchflusszytometrie Dot-Plots des Tumors Zellhomogenaten folloFlügel Dissoziation und Markierung mit spezifischen Antikörpern gegen Epithelzellen (EpCAM) und Leukozyten (CD45) sind in Figur 3C gezeigt. Diese Bilder sind typische Routinebeobachtungen für Brusttumor Homogenaten. Dieses Protokoll hat die Lebensfähigkeit der CD45 + Zellen (4% tote Zellen) nicht signifikant; jedoch gibt es einen beträchtlichen Verlust an lebensfähigen EpCAM + Zellen (38% tote Zellen im Tumor gezeigt, variiert zwischen Tumoren). Trotz dieser Verluste kann die lebensfähige EpCAM + und CD45 + Teilmengen auf der Grundlage der Größe und Struktur in große Epithelzellen (= Tumorzellen), kleine Epithelzellen und große CD45 + Zellen und kleinen CD45 + Zellen (die meisten Zellen getrennt werden , die hauptsächlich sind Lymphozyten; 3C).
Der deutliche Anstieg der lebensfähigen CD45 + Zellen mit diesem Ansatz erhalten ermöglicht die Übernahme von reproduzierbaren multicolor Durchflusszytometrie Daten (mitbis zu zehn Farben), sich stärker prägen die TIL Teilmengen bei Brustkrebs. Repräsentative Durchflusscytometrie-Dot-Plots der Haupt TIL Teilmengen sind in Abbildung 4 dargestellt, mit den bisherigen Experimenten, die zeigen, dass es auch möglich ist, nachzuweisen und zu quantifizieren minor T und B-Zellen, die den Tumor infiltrierenden Subsets 10-12, einschließlich intrazelluläre Färbung für kanonisches T und B-Zell-Transkriptionsfaktoren 12. Gating Strategien für Lymphozyten auf lebensfähigen CD45 + Zellen mit einer Lebensfähigkeit Fleck identifiziert wurden. (Anmerkung: Tumoren kann stark in der Menge von Zelltrümmern und abgestorbenen Epithelzellen in Abhängigkeit von der BC-Subtyp, grade, etc variieren). Dieser Ansatz wurde erfolgreich verwendet, um Lymphozyten-Subpopulationen aus dem Homogenat mit magnetischen Kügelchen oder Zellsortierung zur Genexpressionsanalyse mit Mikroarrays oder qRT-PCR 9 zu reinigen. Lösliche Mediatoren in der SN, einschließlich Cytokine und Immunglobuline, wurden unter Verwendung einer Perlen- quantifiziert Immunoassay mit den mit der Größe der Gewebefragment normalisiert resultierenden Daten. Ein Vergleich der Cytokin-Expression (ein Th1 / Th2 / Th7 / Th9 / Th17 Pool) oder Gesamt-Immunglobuline (IgA, IgE, IgG, IgM) in BC SN mit SN von normalem Brustgewebe zeigt Steigerungen sowohl mit dem Tumorgewebe verbunden (Fig 5). Diese primären Gewebe SN wurden ebenfalls wirksam für Antigene 10-12 analysiert und verwendet werden, um experimentell zu behandeln Lymphozyten von gesunden Spendern, wodurch der TIL Phänotyp in normalen Zellen 9 reproduzieren.
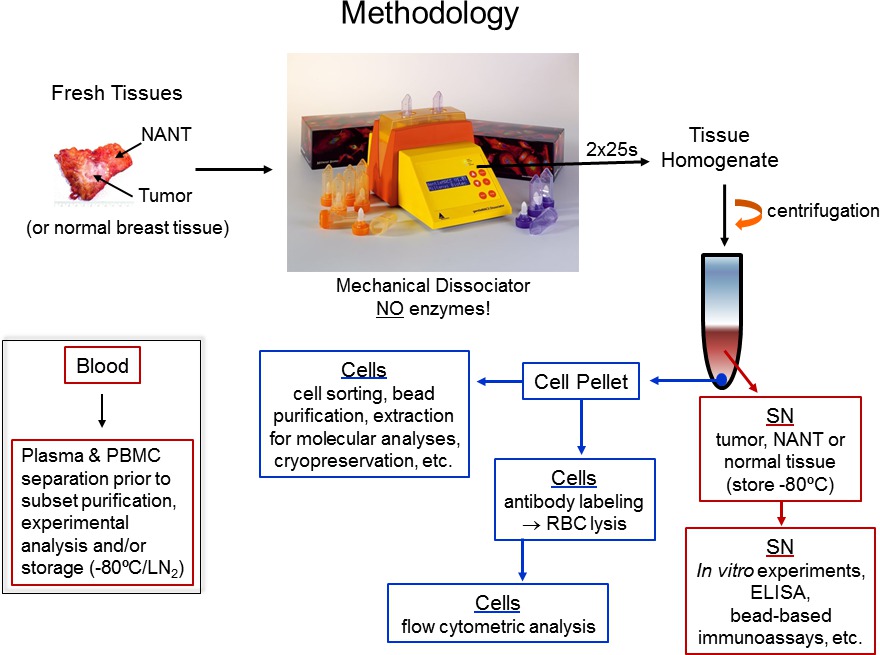
Abbildung 1. Protokoll Flussdiagramm. Unser Verfahren für die Verarbeitung von frischen menschlichen Geweben und einige analytische Ansätze, die dann verwendet werden, um Lymphozyten infiltrieren menschlichen Geweben zu bewerten sind gezeigt.

Abbildung 2: H & E gefärbten Bild einer Brusttumorgewebe Impressum. Dieser Aufdruck, von einem frischen Brusttumorgewebefragment aufgenommen wurde, zeigt das Vorhandensein von Tumorzellen mit den Freiflächen-Reflexionsflächen, die nicht übertragen wurden. Bitte klicken Sie hier, um eine größere Version zu sehen dieser Zahl.

. Figur 3. Optimierung des Brustgewebes Dissoziationskonstante für Lymphozytenanalyse Durchflusszytometrieanalyse von: (A) CD4-Oberflächenexpression auf Lymphozyten von unverdauter und Kollagenase I / II verdaut Tumorgewebe; (B) CD4-Expression auf Lymphozyten aus Lymphknoten und Tumorgewebe verdaut Witzh Kollagenase IV und verglichen, um unverdautes Blut und Knochenmarkzellen von dem gleichen Patienten; und (C) Analyse der gesamten Leukozyten (CD45 +) und Epithelzellen (EpCAM +) aus Tumorgewebe stark mechanisch durch die hier beschriebene Protokoll dissoziiert. Die Lebensfähigkeit der Epithelzellen und CD45 + -Zellen mit unserem Protokoll wird über den Einbau von fixierbar Lebensfähigkeit Farbstoff beurteilt. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 4. Tumor infiltriert Lymphozyten-Untergruppen in dem Homogenat. Multicolor Durchflusszytometrie wurde am Tag der Operation nach der mechanischen Dissoziation unter Verwendung der hier beschriebenen Protokoll. Die lebensfähigen Zellen und große Lymphozytensubpopulationen einWieder gezeigt: CD3 ist ein Pan-T-Zell-Marker, CD4- und CD8-T-Zellen sind wichtige Untergruppe Marker und CD19 ist ein pan B-Zell-Marker. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
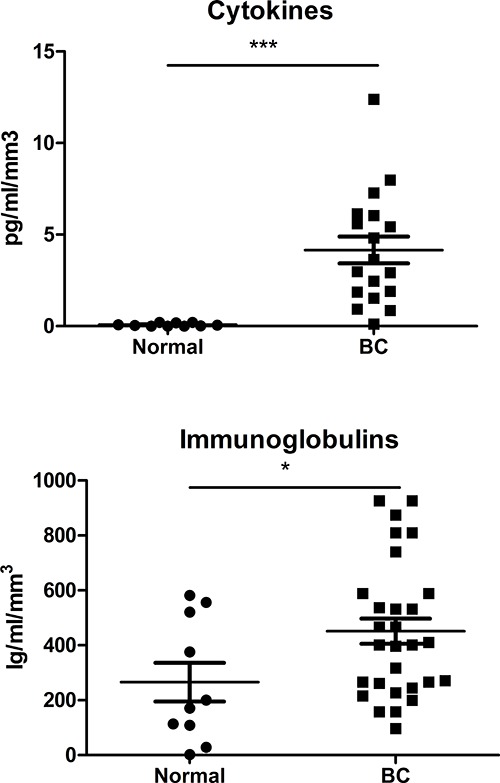
Abbildung 5. lösliche Mediatoren im Überstand. Eine Gruppe von Zytokinen (Th1 / Th2 / Th7 / Th9 / Th17) und Immunoglobulinen (IgA, IgE, IgG, IgM) wurde mit Kügelchen basierenden Immunoassays analysiert SN von normalen und BC abgeleitet beurteilt Geweben mit der hier beschriebenen Protokoll.
Diskussion
Diese Studie beschreibt ein optimiertes Verfahren für die schnelle Herstellung von normalen und malignen Brust Gewebehomogenaten ohne enzymatische Verdauung für nachfolgende Zellsortierung, Extraktion, Kryokonservierung und / oder phänotypische Analyse von CD45 + Subpopulationen. Das Ziel dieser experimentellen Ansatz ist es, Bilder der TIL, die ihre in vivo Zustand genau wieder und vergleichen sie mit normalen Geweben mit minimaler Manipulation der Gewebe frisch aus dem OP-Saal zu produzieren. Bis heute hat unser Labor dieses Protokoll zur Analyse> 250 frische BC Gewebe (Tumor und NANT),> 35 normalen Brustgewebe aus Brustreduktionen. Im Prinzip sollte dieses Protokoll direkt auf andere Tumor oder Gewebetypen sein; jedoch können einige Optimierung erforderlich sein (dh die mechanische Dissoziation Programm, Anzahl der Zyklen, Datenträger etc.). Für Gewebe mit geringer Lymphozyten-Infiltration, mit einem größeren Gewebefragment kann necess seinary, das ist, was wir für den normalen Geweben, wo die Lymphozytenzahl niedrig zu tun. Alternativ könnte eine Dichtegradientenzentrifugation Schritt zugegeben werden, um die Leukozyten-Suspension zu bereichern. Diese Analyse menschlicher T- und B-Zell-Subpopulationen infiltrierenden Brusttumoren schließt eine Bewertung von> 100 Marker mittels Durchflusszytometrie (Durchflusszytometrie Daten für 74-Marker in den Ergänzungsdaten von Gu-Trantien, et al. 9 verfügbar) und Reinigung von spezifischen Lymphozyten Subpopulationen für nachfolgende immunologische und molekulare Analysen. Ferner haben wir Cytokine, Chemokine, Immunglobuline und Tumorantigene in der Primärtumor SN bewertet (im Vergleich zu NANT und Normalgewebe SN) 10,11 als Reflexion dieser molekularen Mediatoren in der Tumor-Mikroumgebung. Außerdem haben wir testeten die Wirkung der Behandlung der peripheren Blutlymphozyten von gesunden Spendern mit Tumor SN und gezeigt, daß viele Veränderungen der Genexpression, die in dem TIL erkannt spezifisch vervielfältigt 9.
In ihrer Mikroumgebung werden die Tumor und Stromazellen enger in der Gewebematrix als die Immunzellen, die charakteristisch sind wandernde gehalten. Das hier beschriebene Verfahren stellt eine einfache und schnelle Möglichkeit zum Isolieren und Analysieren TIL ohne enzymatische Verdauung. Unsere zahlreichen Versuche, diese mechanische Homogenisierung Ansatz mit einer kurzen enzymatische Verdauung anzuschließen, um tragfähige und Rezeptor positive lymphoide und Epithelzellen aus der gleichen Tumorfragment, waren nicht erfolgreich zu produzieren. Gewebehomogenisierung effizient frei Lymphozyten, aber führt zu einem signifikanten Verlust an Tumorzelllebensfähigkeit. Eine kurze enzymatische Verdauung des Gewebes unter Bildung lebensfähiger Tumorzellen (die Gesamtzahl als eine Funktion der Verdauungszeit), hat aber zur Folge, dass eine parallele Abnahme der Expression von vielen Oberflächenrezeptoren, besonders deutlich auf Lymphozyten. So ist für die vergleichende Analyse von Tumorzellen und TIL aus derselben tumoder es ist noch notwendig, zwei aufeinanderfolgende Tumorfragmente getrennt zu verarbeiten.
Derzeit haben die meisten Studien zur Charakterisierung TIL enzymatische Verdauung (Stunden bis O / N) häufig mit irgendeiner Form der mechanischen Präparation 4-8 gekoppelt beschäftigt. Expansion von TIL für die weitere Analyse oder Therapie beinhaltet im Allgemeinen die nachfolgenden ex vivo Kultivierung von TIL oder Tumorgewebefragmente mit stimulierenden Mitteln (Tage bis Wochen), 13-15. Die schnelle, nicht-enzymatische Verfahren zur hier beschriebenen Gewebedissoziation stellt ein einfaches und reproduzierbares Mittel zum Extrahieren von intakten CD45 + Zellen aus normalen und abnormalen Gewebefragmente vor ihrer Expansion oder Analyse. Diese schnelle Akquisition von CD45 + Zellen aus Patienten, die sich Tumorektomie könnte möglicherweise zur Verwendung in einem prognostischen Biomarker Assay entwickelt werden. Darüber hinaus kann es mit TIL größeres Potenzial für ex vivo Expansion ergeben vor immunothe Adoptivtherapie.
Offenlegungen
The authors declare that no conflict of interest exists.
Danksagungen
Diese Arbeit wurde durch Zuschüsse unterstützt fromthe belgischen Fonds für wissenschaftliche Forschung (FNRS), Les Amis de l'Institut Bordet, FNRS Arbeit Télévie, Plan Krebs Belgien, Fonds Lambeau-Marteaux, Fonds JC Heuson und Fonds Barsy.
Materialien
| Name | Company | Catalog Number | Comments |
| GentleMacs Dissociator | Miltenyi Biotec | 130-093-235 | BD Medimachine is somewhat equivalent |
| Centrifuge 5810 R | Eppendorf | or other standard table top centrifuge | |
| Centrifuge 5417 R | Eppendorf | or other standard microcentrifuge | |
| Esco Class II A2 Biosafety Cabinet | ESCO global | or other standard BSL2 hood | |
| Inverted Microscope | Nikon eclipse TS100 | or other microscope compatible for a hemacytometer | |
| Bürker Chamber | Marienfield | 640210 | or other standard hemacytometer |
| Navios Flow Cytometer | Beckman Coulter | or other flow cytometer (8-10 color recommended) | |
| GentleMacs C-Tube | Miltenyi Biotec | 130-096-344 | BD Medimachine uses Filcon |
| Cell Culture Dish | Sarstedt | 72,710 | or other non-pyrogenic plasticware |
| Disposable Scalpel | Swann-Morton | 0510 | or standard single use sterile scalpel |
| BD Cell Strainer 40 µm | Becton Dickinson | 734-0002 | or other non-pyrogenic plasticware |
| BD Falcon Tube 50 ml | Becton Dickinson | 352070 | or other non-pyrogenic plasticware |
| BD Falcon Tube 15 ml | Becton Dickinson | 352097 | or other non-pyrogenic plasticware |
| BD FACS Tube 5 ml | Becton Dickinson | 352008 | or other non-pyrogenic plasticware |
| Sterile Pasteur Pipette 5 ml | VWR | 612-1685 | or other non-pyrogenic plasticware |
| Microfuge Tube 1.5 ml | Eppendorf | 7805-00 | or other non-pyrogenic plasticware |
| X-Vivo 20 | Lonza | BE04-448Q | serum-free medium recommended |
| Phosphate buffered saline | Lonza | BE17-516F | standard physiological PBS |
| Trypan blue | VWR | 17942E | or other vital stain |
| VersaLyse | Beckman Coulter | A09777 | for flow cytometry experiments |
| Fixable viability Dye eFluor 780 | eBioscience | 65-0865-14 | for flow cytometry experiments |
| anti-CD3 FITC | BD Biosciences | 345763 | for flow cytometry experiments |
| anti-CD3 Vio Blue | Miltenyi Biotec | 130-094-363 | for flow cytometry experiments |
| anti-CD4 PE | BD Biosciences | 345769 | for flow cytometry experiments |
| anti-CD4 APC | Miltenyi Biotec | 130-091-232 | for flow cytometry experiments |
| anti-CD8 ECD | Beckman Coulter | 737659 | for flow cytometry experiments |
| anti-CD8 PerCP | BD Biosciences | 345774 | for flow cytometry experiments |
| anti-CD19 APC-Vio770 | Miltenyi Biotec | 130-096-643 | for flow cytometry experiments |
| anti-CD45 VioGreen | Miltenyi Biotec | 130-096-906 | for flow cytometry experiments |
Referenzen
- Chen, D. S., Mellman, I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 39 (1), 1-10 (2013).
- Boudreau, A., van't Veer, J. L., Bissell, M. J. An 'elite hacker': breast tumors exploit the normal microenvironment program to instruct their progression and biological diversity. Cell Adh Migr. 6 (3), 236-248 (2012).
- Gajewski, T. F., Schreiber, H., Fu, Y. X. Innate and adaptive immune cells in the tumor microenvironment. Nat Immunol. 14 (10), 1014-1022 (2013).
- Quezada, S. A., et al. Limited tumor infiltration by activated T effector cells restricts the therapeutic activity of regulatory T cell depletion against established melanoma. J Exp Med. 205 (9), 2125-2138 (2008).
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. J Immunol Methods. 372 (1-2), 119-126 (2011).
- McCauley, H. A., Guasch, G. Serial orthotopic transplantation of epithelial tumors in single-cell suspension. Methods Mol Biol. 1035, 231-245 (2013).
- Gros, A., et al. Myeloid cells obtained from the blood but not from the tumor can suppress T-cell proliferation in patients with melanoma. Clin Cancer Res. 18 (19), 5212-5223 (2012).
- Zirakzadeh, A. A., Marits, P., Sherif, A., Winqvist, O. Multiplex B cell characterization in blood, lymph nodes, and tumors from patients with malignancies. J Immunol. 190 (11), 5847-5855 (2013).
- Gu-Trantien, C., et al. CD4(+) follicular helper T cell infiltration predicts breast cancer survival. J Clin Invest. 123 (7), 2873-2892 (2013).
- Buisseret, L., et al. Lymphocytes Infiltrating Breast Cancer : Density, Composition And Organization. Annals of Oncology. 25 (1), 17 (2014).
- Garaud, S., et al. Characterization of B Cells Infiltrating Human Breast Cancer. Annals of Oncology. 25 (1), 18 (2014).
- Gu-Trantien, C., et al. Cxcl13-Producing Follicular Helper T Cells In Human Breast Cancer. Annals of Oncology. 25 (1), 17 (2014).
- Yee, C. The use of endogenous T cells for adoptive transfer. Immunol Rev. 257 (1), 250-263 (2014).
- Butler, M. O., et al. Ex vivo expansion of human CD8+ T cells using autologous CD4+ T cell help. PLoS One. 7 (1), 30229 (2012).
- Ye, Q., et al. Engineered artificial antigen presenting cells facilitate direct and efficient expansion of tumor infiltrating lymphocytes. J Transl Med. 9, 131 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten