Method Article
一种简单快速议定书非酶离解新鲜人组织的浸润淋巴细胞的分析
* 这些作者具有相同的贡献
摘要
This protocol describes the rapid non-enzymatic dissociation of fresh human tissue fragments for qualitative and quantitative assessment of CD45+ cells (lymphocytes/leukocytes) present in various normal and malignant human tissues. Additionally, the supernatant obtained from the primary tissue homogenate can be collected and stored for further analysis or experimentation.
摘要
恶性细胞逃避免疫系统,从先天性和适应性免疫应答特征为肿瘤逃逸的能力现在被接受为癌症的重要标志。我们对乳癌的研究主要集中在积极的作用,肿瘤浸润淋巴细胞肿瘤进展和患者预后发挥。为了实现这一目标,我们制定了正常和异常组织完整淋巴样细胞的快速分离的方法,努力以评估他们接近他们的原生状态。匀浆用机械离解秀既增加了活力和细胞的恢复,同时保持表面受体的表达相比,酶消化的组织准备。另外,剩余的不溶物的酶消化未恢复额外的CD45 +细胞表示在初级匀浆的定量和定性测量可能真正反映在组织fragm浸润亚耳鼻喉科。在淋巴样细胞中这些匀浆可以容易地使用免疫(表型,细胞增殖等 )或分子(DNA,RNA和/或蛋白质),其特征接近。 CD45 +细胞也可以用于亚群纯化, 体外扩增或冷冻保存。这种方法的一个额外的好处是,从匀浆主组织上清液可用于表征和比较细胞因子,趋化因子,免疫球蛋白和抗原存在于正常和恶性组织。这个协议功能非常好为人类乳房组织和应适用于各种各样的正常和异常组织。
引言
The tumor microenvironment is composed of various cell types with numerous studies showing they each play distinct and important roles in tumorigenesis1,2. These include, but are not limited to, infiltrating immune cells, stromal cells, endothelial cells and tumor cells3. Ex vivo studies of tumor infiltrating lymphocytes (TIL; CD45+ cells or leukocytes, which are predominantly lymphocytes in breast tumors) from fresh human tissue samples is made difficult by their low frequency, the small sample sizes often available for research and the potential for loss of viability during extraction. Because immune cells infiltrating tumors are usually present as passengers rather than permanent residents in general they are easier to release from the tissue matrix.
Dissociating tumor tissue while maintaining cellular integrity is technically challenging and has traditionally been performed using a combination of mechanical and enzymatic steps to prepare single cell suspensions4-8. This approach involves lengthy incubation periods and is associated with a significant reduction in cell viability as well as the loss of cell surface receptors by enzymatic cleavage. High quality flow cytometric studies characterizing TIL in the tumor microenvironment as well as clean purifications of CD45+ subpopulations by flow cytometry or antibody-coated beads are more difficult to achieve from enzyme-digested tumor tissue. In addition, the supernatant (SN) from the resulting tumor homogenate is not amenable to further analysis including quantification of secreted proteins (cytokines, chemokines, immunoglobulins or tumor antigens) or experimental treatment of normal cells, because of the potential for protein degradation in the enzymatic digests.
In our search for a method to prepare single cell homogenates from breast tissues [including tumor, non-adjacent non-tumor (NANT) and normal (from mammary reductions) breast tissues] without enzymatic digestion, we tested a variety of mechanical homogenization techniques. Homogenates prepared using a mechanical dissociator had increased cell viability (2-fold) and total cell recovery (2-fold) while preserving surface receptor expression. Enzymatic digestion of the remaining insoluble material did not recover additional CD45+ cells suggesting they were all released in the initial homogenate. Thus, this rapid and simple approach allows both qualitative and quantitative assessment of the CD45+ subpopulations present in various normal and malignant human tissues. An added advantage of this approach is that the SN from the initial homogenate (primary tissue SN) can be collected and stored for further analysis or experimentation.
研究方案
注:使用经研究所朱尔·博尔代的医学伦理委员会与每个病人获得书面知情同意的协议被收购所有标本。
1.制备组织匀浆
- 解剖手术切除组织(恶性和正常组织从手术室切除)是在病理实验室由受过训练的人员立即拾取。肿瘤,NANT(取最远的距离肿瘤的可能),并在1个正常组织碎片常规处理 - 3小时手术切除使用标准的生物安全程序,人体组织在BSL2实验室。该协议的流程图被示于图1。
- 权衡所有组织碎片(正常,NANT和肿瘤),测量的长度,宽度,和高度(长度×宽度×高度)。这对于细胞亚群的随后正常化的一个重要步骤,提取的RNA, 等等。
NOTE:样本量的范围为100至10,000 mm 3的无脂 肪如果可能的话。 - 印上与H&E染色载玻片的肿瘤片段,以验证该组织实际上是肿瘤的一部分。
- 通过按肿瘤片段显微镜载玻片和应用温和的压力,用手指几秒钟做到这一点。
- 修复用异丙醇进行2分钟,随后在水中的洗涤步骤的幻灯片。染液组织30秒,Mayer的苏木。
- 在水6浴洗幻灯片。在桃红B染色的2%,持续15秒。
- 在水一浴跟四个浴池异丙醇和完成与水一浴洗。
- 孵育在异丙醇1分钟和漏。清除二甲苯的两个浴室。
- 安装用二甲苯基于安装中。检查对肿瘤细胞结构( 图2)。
注:主要,肿瘤细胞坚持印记幻灯片 - 间质,淋巴或广告ipose细胞很少残留,而使肿瘤细胞之间的空间( 图2)。
- 放置在含有1ml的化学上确定的,无血清造血细胞培养基的小培养皿所述组织片段(以下简称为培养基)在室温和切块成小块(约1 - 2平方毫米 ),使用无菌的手术刀。
- 转让的一切(组织碎片+介质)的机械离解Ç管。
- 冲洗培养皿并手术刀用2ml使用巴氏吸管介质的,这增加了C管(培养基体积为离解= 3毫升)中。
- 使用机械离解程序A.01对于C管(最温和的程序),以均匀的组织碎片成单细胞悬浮液。放置了C管中的装置和连续运行该程序两次(一个周期= 25秒)。
注意:此均质过程已经建立和验证人类乳房组织,其它匝或者或组织类型可能需要使用不同的程序,应首先进行测试。 - 从装置删除C管,并直接倒出匀浆成40μm的细胞过滤器安置在一个50ml管中。使用相同的巴斯德吸管如在步骤1.6,转移剩余在C管的细胞过滤的任何液体。
- 过滤后的液体转移到一个15毫升的管中,使用1毫升微量移液器尖端。暂时保持细胞过滤和50ml管中。
- 冲洗了C管与另外3毫升培养基并传送此,再次使用相同的巴斯德吸管如在步骤1.6,该细胞过滤仍然落座于50ml管中。通过轻轻地移动它周围的过滤器,用干净巴斯德吸管或1毫升提示,随后丢弃,以避免污染洗脱液挤被困在unhomogenized组织进50毫升管中的残留液体的最大量。
- 将细胞过滤对T倒挂他原来的C管和漂洗用3ml培养基,使得unhomogenized组织降回到C管。
- 再均匀化作为用于A.01程序的两个周期的步骤1.7。
- 倾通过细胞过滤网落座于50ml管中该第二匀浆,再次冲洗了C管用3ml培养基(如在步骤1.10),并使用巴斯德吸管转移到细胞过滤落座于50ml管中再次挤压的最大从残留的结缔组织截留在细胞过滤的液体量。
- 在这一点上,约2.5毫升的体积是在15ml试管和〜9毫升50毫升管。
2.分离的组织上清和细胞
- 离心在15毫升匀浆和50ml试管15分钟,在600×g离心,在室温下进行。
- 滗从15毫升管中的SN到干净的管中并暂时储存在4℃。这上清=原发肿瘤,NANT或正常TIssue SN(最终体积2.5ml)中,随后澄清并在-80℃下以供将来分析(见下文)在存储之前等分。
- 丢弃从50ml管中的上清液。
- 在1毫升培养基中的终体积轻轻悬浮两种细胞粒料。简要地说,首先轻轻(轻敲管上的硬表面)打破在两个管中的细胞沉淀。重悬松散细胞沉淀在50ml的用500μl培养基中,该细胞悬浮液转移到15毫升管重新悬浮所述第二颗粒。与第二500μl的培养基中对细胞的最大回收重复此步骤一次。
- 转移10微升细胞悬浮液至小管中,混合10微升台盼蓝(稀释1:1),并计算使用血球存活细胞的数目。
注意:在这一点上的细胞悬浮液的一小部分,也可以通过流式细胞术分析来评估细胞大小,粒度并且如果需要的亚群的标记有限数量的更多PREC在匀浆中相对细胞分布之前广泛分析或实验伊势评估。所有的分析流式细胞仪结合CD45标签的亚正常化。 - 通过离心沉淀细胞,在300×g离心10分钟,在室温下。从肿瘤,NANT,或正常组织的细胞是现在已准备好用于进一步纯化或分析。这些额外的步骤是最好在同一天进行的外科手术时。
注:对于流式细胞仪分析,但不是细胞分选的残余红细胞应抗体标记后,加入0.4红血细胞裂解缓冲液,以细胞沉淀,立即为1秒涡旋并温育至少10分钟,在室温进行裂解温度(避光)分析之前。
3.澄清组织的上清液
- 离心1.5 mL管与组织SN在15000 XG为15分钟,在4℃。
- 小心地取出吨他上清液不接触或干扰球。转移到一个干净的试管(或管),这取决于所述数量和期望的等分试样的体积。
- 存储上清液在-80℃下以供将来使用。
4.患者血
- 收集从每个病人作为对照通过静脉穿刺到肝素化管中的前一天,以外科手术的血液样品。离心血液于400×g离心10分钟,在20ºC与制动切断以获得血浆和血沉棕黄层。
- 取出血浆,并通过离心,在20ºC澄清它以10,000×g离心15分钟。等分试样并储存血浆在-80℃下以供将来使用。淡化捉鬼外套中等
- 分离使用标准聚蔗糖 - 泛影葡胺密度梯度离心之前立即进行分析,亚群分离,DNA / RNA /蛋白质的提取或超低温保存的单核细胞。
5.流式细胞仪
- 根据制造标签的细胞的r指令在4℃,避光。裂解红血细胞在从抗体标记后的组织碎片的细胞悬浮液通过加入0.4毫升的细胞裂解缓冲液,以细胞沉淀。
- 涡旋立即1秒和孵化至少在室温下10分钟,避光。通过在流式细胞仪进行数据采集,而不洗涤标记的细胞。
结果
组织碎片用可商购的组织离解的溶液或胶原酶的各种实验室的混合物,DNA酶和/或透明质酸酶抑制剂酶消化,切割各种各样的受体的细胞的表面上。我们的研究中,最初集中在CD4 + T细胞浸润乳腺肿瘤,很快出现一个主要的技术问题,是由于使用标准酶消化协议4-8表面的CD4受体的裂解。我们测试了多种胶原酶的酶有或无DNA酶和透明质酸酶抑制剂,发现胶原酶I和II完全从细胞表面除去的CD4,尽管高淋巴细胞活力( 图3A)。上观察到的CD4适度效果用胶原酶IV在短的温育时间 - 以较低的CD4抗体标记在消化淋巴结和肿瘤组织中检测到(1 2小时)相比,来自同一患者未消化血液和骨髓(图3B;注意,由于在组织上的限制,我们得到我们无法比较消化和未消化的淋巴结和肿瘤组织)。这个损失的CD4被证实是胶原酶IV消化通过比较未消化和消化的CD4 + T细胞从健康供体的血液中分离出来的技术副产物(数据未示出)。虽然这些CD4 LO T细胞可以从胶原酶IV消化的组织片段使用磁珠进行分离,纯化的群体经常含有来自肿瘤微环境变化的污染量通过其它细胞,因此是不理想的,为实验的目的。
在一个不断寻求更好的方法,在2008年,我们测试了新的机械离解,而无需使用酶。该装置产生的乳腺组织匀浆迅速且表面受体的完整性保持9。流式细胞点图,肿瘤细胞匀浆弗洛的代表流翼离解和标签与针对上皮细胞(EpCAM的)和白细胞(CD45)特异性抗体示于图3C。这些图像是典型的常规观测乳腺肿瘤匀浆。这个协议不显著改变CD45 +细胞(4%死细胞)的活力;然而,有一个相当大的损失可行的EpCAM +细胞(38%死亡细胞在肿瘤中所示;肿瘤之间变化)。尽管这方面的损失,在可行的EpCAM +和CD45 +亚群可以被隔离的大小和结构的基础上,为大的上皮细胞(=肿瘤细胞),小上皮细胞和大的CD45 +细胞和小CD45 +细胞(大部分细胞,这是主要的淋巴细胞; 图3C)。
使用这种方法获得的可行的CD45 +细胞显著增加允许收购重复性多色的流式细胞仪数据(使用多达10种颜色),以更充分地表征TIL亚群的乳腺癌。流式细胞点图的主要的TIL子集的代表性流程示于图4中 ,与我们的最近的实验表明,还可以用于检测和量化次要T和B细胞亚群浸润肿瘤10-12,包括细胞内染色用于规范T和B细胞转录因子12。对于淋巴细胞门控策略基于识别与生存力染色存活的CD45 +细胞( 注:肿瘤可以差别很大细胞碎片并根据公元前亚型,等级等死上皮细胞的量 )。这种方法已被成功地用于从具有磁性珠或细胞用于使用微阵列或QRT-PCR 9基因表达分析排序匀浆纯化淋巴细胞亚群。在SN,包括细胞因子和免疫球蛋白的可溶性调解员,一直在使用bead-量化基于免疫测定用归到组织片段的大小所得到的数据。细胞因子的表达(一Th1 / Th2细胞/ Th7时/ TH9 / Th17细胞池)或总免疫球蛋白(IgA的,的IgE的IgG,IgM抗体)在公元前SN与正常乳腺组织的SN的比较揭示了增加都与肿瘤组织相关的( 图5)。这些主要组织的SN的也用于抗原10-12得到有效分析并用于实验来自健康供体的淋巴细胞治疗,从而再现的TIL表型在正常细胞中9。
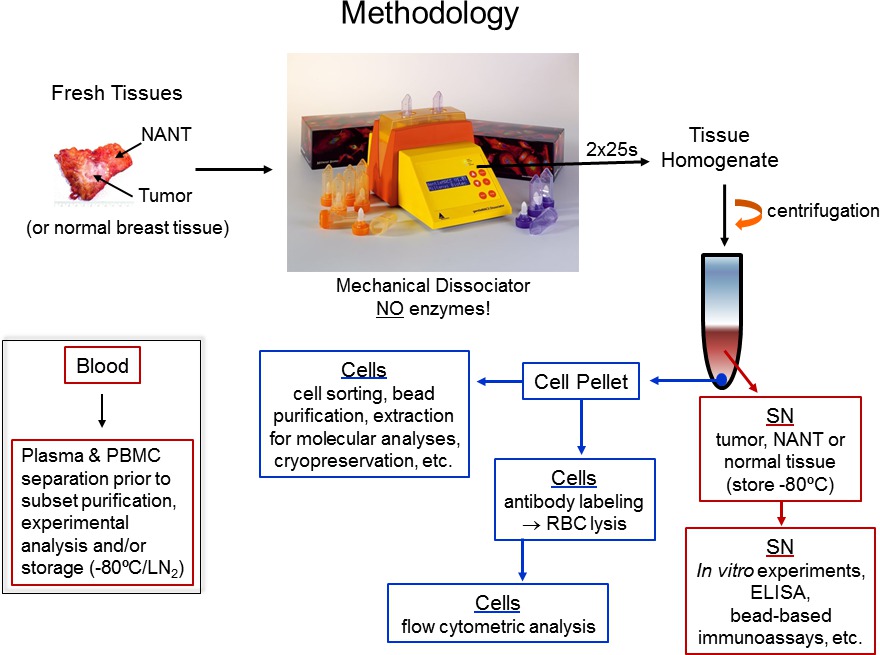
图1.协议流程图。我们的用于处理新鲜的人体组织,并且随后可以用来评估淋巴细胞浸润人体组织部分的分析方法的过程被示出。

图2. H&E染色乳腺肿瘤组织印记的形象。这种印记,从一个全新的乳腺肿瘤组织片段拍摄,显示肿瘤细胞与开放空间反映了未转移的区域存在。 请点击此处查看大图这个数字。

图3.优化乳腺组织分离的细胞分析,流式细胞仪分析:(A)CD4表面上未消化和胶原酶I / II淋巴细胞表达消化肿瘤组织; (B)从淋巴结和肿瘤组织消化机智淋巴细胞CD4表达ħ胶原酶IV和相比未消化的血细胞和骨髓细胞来自同一患者;和(C)分析总白细胞(CD45 +)和从肿瘤组织的上皮细胞(EpCAM的+)的快速使用的协议在这里描述的机械分离。上皮细胞和CD45 +使用我们的协议细胞的活力,通过对可修复的可行性染料纳入评估。 请点击此处查看该图的放大版本。

使用这里描述的协议,手术当天进行机械分离后图4.肿瘤浸润淋巴细胞亚群在匀浆。多色流式细胞分析。活细胞和主要淋巴细胞亚群一重新显示:CD3是一个泛T细胞标记,CD4和CD8是主要的T细胞亚群的标记和CD19是一个泛B细胞标记。 请点击此处查看该图的放大版本。
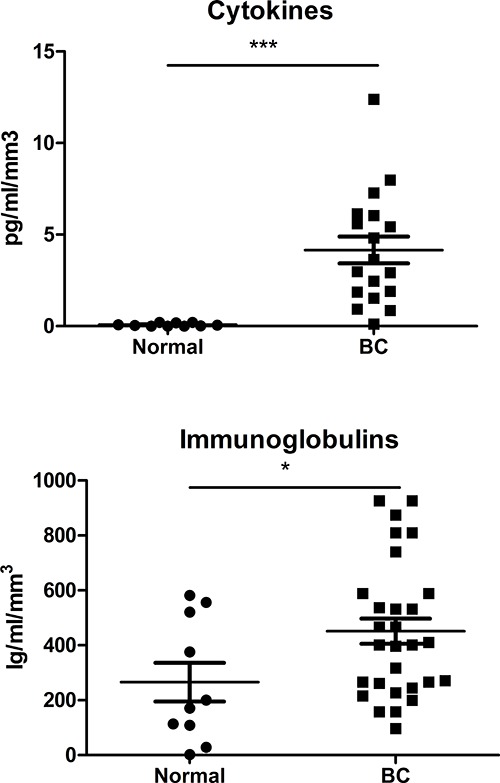
图5.可溶性介质在上清液中。细胞因子的面板(Th1 / Th2细胞/ Th7时/ TH9 / Th17细胞)和免疫球蛋白(IgA的,的IgE的IgG,IgM抗体)用基于珠的免疫测定分析的SN从正常和BC衍生评估组织中使用这里描述的协议。
讨论
该研究描述了在正常和恶性乳腺组织匀浆中迅速地制备无酶消化用于随后的细胞分选,提取,冷冻保存和/或CD45 +亚群的表型分析的优化方法。本实验方法的目标是产生紧密反映其在体内的状态,将它们与从手术室新鲜组织的最低限度的操作比较正常组织的TIL的图像。到今天为止,我们的实验室已使用此协议分析> 250新鲜BC组织(肿瘤和NANT),> 35正常乳腺组织,从乳腺减少。原则上,这个协议应直接适用于其它肿瘤或组织类型;然而,一些优化可能是必要的( 即,机械解离方案,周期数,介质体积等 )。对于组织具有低淋巴细胞浸润,使用较大的组织片段可以是necess元,这是我们做的正常组织,其中淋巴细胞计数低。或者,密度梯度离心步骤可以被添加,以丰富的白细胞悬浮液中。人T细胞和B细胞亚群浸润乳腺肿瘤的这种分析包括> 100标记通过流式细胞术评估(流式细胞术数据为74的标记可在谷-Trantien的等人 9的补充数据,),以及特异性淋巴细胞纯化亚群对随后的免疫和分子分析。此外,我们已评估细胞因子,趋化因子,免疫球蛋白和肿瘤抗原在原发肿瘤的SN(相比NANT和正常组织的SN)10,11作为在肿瘤微环境这些分子介质的反射。我们也测试了一种治疗外周血淋巴细胞来自健康供体与肿瘤的SN和示出的许多在TIL检测的基因表达的变化可以特异性再生的效果 9。
在他们的微环境中,肿瘤和基质细胞中的组织基质比免疫细胞,这是典型的迁徙更紧密地保持。这里介绍的方法提供了分离和分析TIL没有酶消化一个简单而快速的方式。我们多次试图加入这个同质化的机械方法的短酶消化,产生可行的和受体阳性淋巴细胞和上皮细胞来自同一肿瘤片段都没有成功。组织均化有效地释放淋巴细胞但导致显著损失的肿瘤细胞生存力。该组织的一个短酶消化释放活肿瘤细胞(总数随着消化时间的函数),但具有在许多表面受体,在淋巴细胞特别明显的表达的平行下降的后果。因此,对于肿瘤细胞和TIL的来自同一匝的比较分析或它仍然是必要的,以分别处理两个连续肿瘤片段。
目前,大多数研究旨在表征TIL雇用酶消化(小时,O / N)经常加上某种形式的机械清扫4-8。膨胀的TIL作进一步的分析或治疗通常涉及随后离体培养的TIL或刺激剂的肿瘤组织碎片(天至数周)13-15。对于这里描述的组织离解的快速,非酶促方法提供用于提取完整的CD45 +细胞从正常和异常组织片段之前,他们的膨胀或分析一种简单和可再现的方法。此迅速采集CD45 +细胞从接受肿瘤切除术的患者也可能会被用于在预后生物标志物测定中使用而开发。此外,它可能会产生的TIL与体外扩增潜力更大到代管immunothe之前rapy。
披露声明
The authors declare that no conflict of interest exists.
致谢
这项工作得到了资金支持fromthe比利时科学研究基金(FNRS),莱斯阿美族DE L'研究所博尔德,FNRS操作Télévie,比利时计划癌症,全宗朗博-Marteaux,全宗JC Heuson和全宗Barsy。
材料
| Name | Company | Catalog Number | Comments |
| GentleMacs Dissociator | Miltenyi Biotec | 130-093-235 | BD Medimachine is somewhat equivalent |
| Centrifuge 5810 R | Eppendorf | or other standard table top centrifuge | |
| Centrifuge 5417 R | Eppendorf | or other standard microcentrifuge | |
| Esco Class II A2 Biosafety Cabinet | ESCO global | or other standard BSL2 hood | |
| Inverted Microscope | Nikon eclipse TS100 | or other microscope compatible for a hemacytometer | |
| Bürker Chamber | Marienfield | 640210 | or other standard hemacytometer |
| Navios Flow Cytometer | Beckman Coulter | or other flow cytometer (8-10 color recommended) | |
| GentleMacs C-Tube | Miltenyi Biotec | 130-096-344 | BD Medimachine uses Filcon |
| Cell Culture Dish | Sarstedt | 72,710 | or other non-pyrogenic plasticware |
| Disposable Scalpel | Swann-Morton | 0510 | or standard single use sterile scalpel |
| BD Cell Strainer 40 µm | Becton Dickinson | 734-0002 | or other non-pyrogenic plasticware |
| BD Falcon Tube 50 ml | Becton Dickinson | 352070 | or other non-pyrogenic plasticware |
| BD Falcon Tube 15 ml | Becton Dickinson | 352097 | or other non-pyrogenic plasticware |
| BD FACS Tube 5 ml | Becton Dickinson | 352008 | or other non-pyrogenic plasticware |
| Sterile Pasteur Pipette 5 ml | VWR | 612-1685 | or other non-pyrogenic plasticware |
| Microfuge Tube 1.5 ml | Eppendorf | 7805-00 | or other non-pyrogenic plasticware |
| X-Vivo 20 | Lonza | BE04-448Q | serum-free medium recommended |
| Phosphate buffered saline | Lonza | BE17-516F | standard physiological PBS |
| Trypan blue | VWR | 17942E | or other vital stain |
| VersaLyse | Beckman Coulter | A09777 | for flow cytometry experiments |
| Fixable viability Dye eFluor 780 | eBioscience | 65-0865-14 | for flow cytometry experiments |
| anti-CD3 FITC | BD Biosciences | 345763 | for flow cytometry experiments |
| anti-CD3 Vio Blue | Miltenyi Biotec | 130-094-363 | for flow cytometry experiments |
| anti-CD4 PE | BD Biosciences | 345769 | for flow cytometry experiments |
| anti-CD4 APC | Miltenyi Biotec | 130-091-232 | for flow cytometry experiments |
| anti-CD8 ECD | Beckman Coulter | 737659 | for flow cytometry experiments |
| anti-CD8 PerCP | BD Biosciences | 345774 | for flow cytometry experiments |
| anti-CD19 APC-Vio770 | Miltenyi Biotec | 130-096-643 | for flow cytometry experiments |
| anti-CD45 VioGreen | Miltenyi Biotec | 130-096-906 | for flow cytometry experiments |
参考文献
- Chen, D. S., Mellman, I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 39 (1), 1-10 (2013).
- Boudreau, A., van't Veer, J. L., Bissell, M. J. An 'elite hacker': breast tumors exploit the normal microenvironment program to instruct their progression and biological diversity. Cell Adh Migr. 6 (3), 236-248 (2012).
- Gajewski, T. F., Schreiber, H., Fu, Y. X. Innate and adaptive immune cells in the tumor microenvironment. Nat Immunol. 14 (10), 1014-1022 (2013).
- Quezada, S. A., et al. Limited tumor infiltration by activated T effector cells restricts the therapeutic activity of regulatory T cell depletion against established melanoma. J Exp Med. 205 (9), 2125-2138 (2008).
- Grange, C., et al. Phenotypic characterization and functional analysis of human tumor immune infiltration after mechanical and enzymatic disaggregation. J Immunol Methods. 372 (1-2), 119-126 (2011).
- McCauley, H. A., Guasch, G. Serial orthotopic transplantation of epithelial tumors in single-cell suspension. Methods Mol Biol. 1035, 231-245 (2013).
- Gros, A., et al. Myeloid cells obtained from the blood but not from the tumor can suppress T-cell proliferation in patients with melanoma. Clin Cancer Res. 18 (19), 5212-5223 (2012).
- Zirakzadeh, A. A., Marits, P., Sherif, A., Winqvist, O. Multiplex B cell characterization in blood, lymph nodes, and tumors from patients with malignancies. J Immunol. 190 (11), 5847-5855 (2013).
- Gu-Trantien, C., et al. CD4(+) follicular helper T cell infiltration predicts breast cancer survival. J Clin Invest. 123 (7), 2873-2892 (2013).
- Buisseret, L., et al. Lymphocytes Infiltrating Breast Cancer : Density, Composition And Organization. Annals of Oncology. 25 (1), 17 (2014).
- Garaud, S., et al. Characterization of B Cells Infiltrating Human Breast Cancer. Annals of Oncology. 25 (1), 18 (2014).
- Gu-Trantien, C., et al. Cxcl13-Producing Follicular Helper T Cells In Human Breast Cancer. Annals of Oncology. 25 (1), 17 (2014).
- Yee, C. The use of endogenous T cells for adoptive transfer. Immunol Rev. 257 (1), 250-263 (2014).
- Butler, M. O., et al. Ex vivo expansion of human CD8+ T cells using autologous CD4+ T cell help. PLoS One. 7 (1), 30229 (2012).
- Ye, Q., et al. Engineered artificial antigen presenting cells facilitate direct and efficient expansion of tumor infiltrating lymphocytes. J Transl Med. 9, 131 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。