Method Article
גזירת הרתי T-cell לימפומה קווים מ כספומט - / - ו P53 - / - עכברים
In This Article
Summary
בסרטון הזה אנחנו מדגימים את פרוטוקול להקים הרתי עכבר לימפומה שורות תאים. על ידי ביצוע בפרוטוקול זה, הקמנו בהצלחה מספר T-cell קווי ATM-/ - ו-p53-/ - עכברים עם לימפומה הרתי.
Abstract
שורות תאים הוקמה הם כלי מחקר ביקורתי זה יכול להפחית את השימוש בחיות מעבדה במחקר. זנים מסוימים של עכברים מהונדסים גנטית, כמו כספומט - / - ו-p53 - / - בעקביות לפתח לימפומה הרתי מוקדם בחיים 1,2, וכך, יכול לשמש מקור אמין עבור הגזירה של T-cell קווי Murine. כאן אנו מציגים פרוטוקול מפורט לפיתוח הוקמה Murine T-cell קווי הרתי לימפומה ללא צורך להוסיף אינטרלויקינים כפי שמתואר בפרוטוקולים הקודמים 1,3. גידולים נבצרו מעכברים בגילאי שלושה עד שישה חודשים, על פי סימן מוקדם של גידולים גלוי מבוססת על התצפית של יציבה כפופה, עמל, נשימה הטיפוח עני מבזבז ב 1,4 זן רגיש. הקמנו בהצלחה מספר T-cell קווי באמצעות פרוטוקול זנים טהורים של ATM - / - [FVB/N- כספומט tm1Led / J] 2 ו - p53 - / - [129/S6- Trp53 tm1Tyj / J] 5 עכברים. בנוסף, אנו מראים כי יותר מ -90% מהאוכלוסייה T-cell הוקמה מבטא CD3, CD4 ו - CD8. בהתאם שורות תאים הוקמה ביציבות, ה-T לתאים שנוצר באמצעות פרוטוקול הנוכחי כבר passaged במשך למעלה משנה.
Protocol
1. Dissection של גידול
- עבור לנתיחה הגידול, מגבת נייר נקייה או לעטוף כירורגית הפנויה מונחת על כרית לנתיחה וריסס עם אתנול 70%.
- עכברים עבור פרוטוקול זה מורדמים שגרתי עם CO 2. מניחים את העכבר מורדמים על כרית לנתיחה ולרסס את שני הצדדים של החיה עם אתנול. העכבר הוא מוחזק במקום על כרית לנתיחה באמצעות ארבעה או יותר סיכות לדחוף מוכנס דרך הרגליים ריססו ביסודיות עם אתנול 70%.
- העור מעל קו האמצע הוא חתך חיק לבסיס הראש באמצעות מספריים סטרילי, תוך הימנעות את השרירים הבסיסית וחודר לתוך החללים בגוף.
- פתח את חלל הבטן עם זוג חדש של מספריים סטרילית מלקחיים נזהר לא לפגוע באיברים פנימיים.
- פתח את חלל בית החזה על ידי הניתוח, להסיט את בית החזה כדי לחשוף את הגידול, בלי לפגוע בכלי הדם.
- הפרד את הגידול מאיברים אחרים, להעביר חלק כ 40-50% של הגידול הכולל (בערך עד 1.5 X 0.8 X 0.8 ס"מ) לתוך PBS קר כל הזמן על הקרח.
- החלק הנותר של הגידול ניתן לשמור עבור מבחני אחרים necropsy המלא ניתן לבצע בשלב זה.
2. לימפומה culturing תאים
- תרסיס הצינור המכיל את הגידול גזור עם אתנול 70% ולהעביר ארון biosafety.
- הוסף 10 מ"ל של מדיום תרבות צלחת פטרי סטרילית 150 מ"מ 2.
- מעבירים את פיסת הגידול לתוך צלחת פטרי על ידי שאיבה עדינה עם טפטפת.
- בנד בשני מחטים סטריליים 18 מד מול הצד משופעים החוצה.
- לנתק את הגידול באמצעות מחטים כפופות.
- מערבולת את המנה, הקש בעדינות מקום בזווית לאסוף את ההשעיה תא צד, תוך הימנעות חתיכות גדולות של הגידול.
- לשאוב את ההשעיה תא ולהעביר לתוך צינור חרוטי 50 מ"ל תוך הימנעות חתיכות גדולות של הגידול.
- לשטוף את צלחת עם 10 מ"ל של מדיום ולהעביר לתוך הצינור אותו תוך הימנעות חתיכות גדולות של הגידול.
- מערבבים את ההשעיה התא מורכב של לימפוציטים ותאי סטרומה בעדינות ולהעביר 5 מ"ל לתוך בקבוקון T-25 רקמות תרבות 10 מ"ל לתוך T-75 הבקבוקון בתרבית רקמה. בעדינות במערבולת צלוחיות.
- השתמש ההשעיה תא שנותר לעשות 2, 4, 10,100 ו 1000 דילולים לקפל בנפח 2.5 הסופי מ"ל (תאים culturing בצפיפויות שונות באמצעות מספר סוגים של כלי תרבות מגדיל את הסבירות של הקמת קו T-cell).
- צלחת 2.0 מ"ל של דילול כל לתוך בארות בודדים של צלחת 6 באר. מערבולת בעדינות את הצלחת.
- דגירה תאים עבור 48 שעות באווירה humidified CO 2 באוויר.
3. האכלה תאים לימפומה
- לאחר 48 שעות של דגירה, מוסיפים 5 מ"ל של מדיום עד בקבוק T-25 ו 10 מ"ל של בינוני עד בקבוק T-75 לאורך הקיר עם הפרעה מינימלית של התאים.
- הוסף 2 מ"ל של המדיום היטב בכל צלחת 6-היטב לאורך הקיר עם הפרעה מינימלית של התאים.
- דגירה תאים נוספים 72 ח
4. Passaging תאים לימפומה
- מעבר ראשוני
- בסוף היום החמישי של דגירה, התאים passaged ביחס 1:1, תוך שמירה על צלוחיות המקורי וצלחות (שמירה על צפיפות התאים בריכוז של כ mL / 3x106 במהלך המעברים first מקדמת הקמת מוצלח של קו תאים רציף).
- עבור בקבוק T-25, להעביר 5 מ"ל של השעיה התא לתוך בקבוק חדש המכיל 5 מ"ל של מדיום. הוסף 5 מ"ל של מדיום לתוך הבקבוק המקורי.
- עבור בקבוק T-75, להעביר 10 מ"ל של השעיה התא לתוך בקבוק חדש המכיל 10 מ"ל של מדיום. הוסף 10 מ"ל של מדיום לתוך הבקבוק המקורי.
- עבור צלחת 6-הבאר, העברת 2 מ"ל של השעיה תא מבאר כל לתוך בארות המקביל צלחת חדשה המכילה 2 מ"ל של המדיום היטב כל אחד. הוסף 2 מ"ל של מדיום לבאר כל הבארות המקורי.
- דגירה כל צלוחיות וצלחות עבור תוספת 72 ח מניסיוננו שורות תאים ביותר מבוססים מן המעבר האלה, אחת לאחת התרבויות (נוכחות של אגרגטים תא חסיד רופף השעיה על תאים סטרומה המצורפת היא אינדיקציה מוקדמת של קו תא הוקמה).
- עבור תרבויות עם פחות או תא אגרגטים לא חסיד רופף ההשעיה, להאכיל את צלוחיות או צלחות על ידי בקפידה החלפת כ -50% של המדיום כל 72 ח כדי למנוע הסרת תאים מן התרבות המקורית, כלי התרבות נשארים עומדים באין מפריע במשך דקות לפחות 5 לתת משקע התאים שבתחתית על ידי כוח הכבידה לפני השאיפה עדין של המדיום supernatant.
- בסוף היום החמישי של דגירה, התאים passaged ביחס 1:1, תוך שמירה על צלוחיות המקורי וצלחות (שמירה על צפיפות התאים בריכוז של כ mL / 3x106 במהלך המעברים first מקדמת הקמת מוצלח של קו תאים רציף).
- שמירה על שורות תאים הוקמה
- שורות תאים הוקמה הם passaged לתוך צלוחיות וצלחות חדשות. עבור T-25 ו-T-75 צלוחיות, מוסיפים 5 מ"ל של המקור אוקטע אחד ההשעיה לתוך 5 מ"ל של מדיום. במשך 6 צלחות היטב, להוסיף 3 מ"ל של ההשעיה המקורית או מעבר לתא לתוך 7 מ"ל של מדיום בבקבוק T-25. פיד ולשמור המקורי או מעבר תרבות אחת על ידי החלפת נפח הסיר עם המדיום תרבות טריים.
- המעבר הוקם שורות תאים לתוך צלוחיות T-25 חדש. שורות תאים יש זמן הכפלה של 18-24 ח תרבויות מתוחזקים באופן שוטף על צפיפות של mL / 1-3x106 ו passaged כל 3 ימים. מוסיפים את נפח הנדרש של תרבות הקטע הקודם המדיום החדש לעשות עד 10 מ"ל. פיד ולשמר את התרבות המקורית.
- אחרי כמה פסקאות, הלא חסיד התאים יהיה לקיים את עצמי ללא בתאי סטרומה חסיד ויש עוד מספר קטן של תאים חסיד מתבצעות על עם כל קטע. מעבר לנקודה זו, התרבויות יכול להישמר בתרבות שאינם מטופלים רקמות T-25 צלוחיות.
5. מקפיא שחזור שורות תאים לימפומה
- שורות תאים מוקפאות במדיום מוכן טרי 1640 RPMI המכיל 20 FBS% ו 10% DMSO.
- תאים מתרבות שעות 48 הישן בבקבוק T-25 (כ 1.5x10 6 תאים / מ"ל) הם centrifuged בסל"ד 1500 במשך 5 דקות בטמפרטורת החדר. לאחר השלכת supernatant, התאים מחדש תלויה 2 מ"ל של מדיום קופאת מקור. שני כרכים 1.0 מ"ל של השעיה תא מהבקבוק כל ממוקמות בתוך מבחנות הקפאה, קפוא מיד -80 ° C, והועבר חנקן נוזלי למחרת.
- תאים הם התאושש אחסון חנקן נוזלי על ידי הפשרה מהירה, ו resuspending מתוכן 10 מ"ל של מדיום תרבות טריים. לחלופין, תאים מופשרים טרי נשטפים פעם בינוני תרבות חמים כדי להסיר את DMSO לפני resuspending ב 10 מ"ל של מדיום תרבות טריים. התאים בתרבית במשך שעות לפחות 72 לפני המעבר שלאחר מכן.
6. נציג תוצאות
כספומט - / - T-cell קו זה פותח באמצעות פרוטוקול ייעודי DWJ-ATM-1 התאפיינה מכתים עם אנטי CD3-FITC, אנטי CD4-APC ואנטי CD8-PE ו cytometry זרימה ניתוח (Figure1). יותר מ -90% מתאי T היו CD3, CD4 ו - CD8 משולשת חיובית.
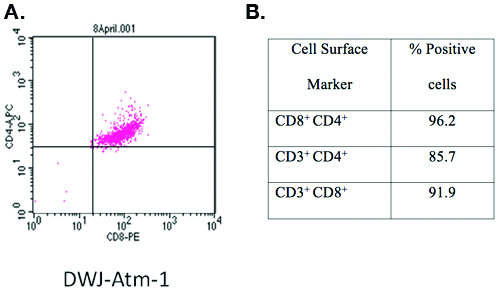
באיור 1. אפיון קו T-cell פותח באמצעות פרוטוקול זה.
שטח פני התא סמנים של כספומט הוקם - / - שורת תאים המיועדים DWJ-ATM-1 התאפיינו מכתים עם אנטי CD3-FITC, אנטי CD4-APC, אנטי CD8-PE ו cytometry ניתוח תזרים. בקצרה, 1x10 6 תאים טריים נשטפו פעם קר PBS (1500 סל"ד / 5 דקות), וטופחו על 4 מעלות צלזיוס למשך 10 דקות עם 200 μL קוקטייל של נוגדנים (כל נוגדן בדילול 1:200 ב-PBS עם BSA 1%. תאים ניתן לבדוק מיד בעוד תאים קבוע טריים או קבוע לצורך ניתוח מאוחר יותר. ערוכים על ידי הוספת פורמלין שנאגרו נייטרלי בריכוז הסופי 4% (כרך / כרך) וטופחו על 4 מעלות צלזיוס למשך 30 דקות, שנקטפו על ידי צנטריפוגה (1,500 סל"ד / 5 דק ') ו resuspended ב 200 μL של PBS עם BSA 1%. סך של 1 X 10 4 תאים נותחו באמצעות FACS BD Calibur מנתח ו CellQuest תוכנה (BD Biosciences, בסן חוזה, קליפורניה).
Discussion
בפרוטוקול זה, אנו מספקים נהלים מפורט להקמת Murine T-cell הקווים משני גנוטיפים עכבר שונים; כספומט - / - [FVB/N- כספומט tm1Led / J] ו - p53 - / - [129/S6- Trp53 tm1Tyj / J] . באמצעות פרוטוקול זה, סך של 6 (מתוך 7 ניסיונות) כספומט - / - ושלושה (מתוך 5 ניסיונות) p53 - / - Murine T-cell קווי הוקמו במעבדה שלנו. נתונים נציג הוכחת כי שורת תאים DWJ-ATM-1, כספומט - / - שורת תאים מורכב האוכלוסייה תא שבו יותר מ 90% של תאים לבטא CD3, CD4 ו - CD8 סמנים משטח לאשר קו המשובטים תא T יכול להיות הוקם באמצעות פרוטוקול שלנו.
פיתוח של T-cell קווי Murine דווחה 3,6,7, אך פרוטוקולים מפורטים להקמת שורות אלו לא תוארו עד כה. אמנם רק שני גנוטיפים עכבר שימשו הגזירה של T-cell קווי Murine במעבדה שלנו, אנו מאמינים כי נהלים אלו חלים על מגוון רחב של T-cell לימפומה ספונטנית למצוא זנים אחרים של עכברים כמו קראס פגום, אחרים בפוטנציה בעלי חיים מינים. Murine T-cell קווים יש יישומים פוטנציאליים בהבנת שאלות בסיסיות באימונולוגיה ואונקולוגיה. נכון לעכשיו, אנו משתמשים אלו שורות תאים במחקרים שנועדו לאפיין מארח הפתוגן אינטראקציות genotoxin-Induced cytotoxicity כולל מנגנונים של תא מעצר מחזור אפופטוזיס. בהתחשב בכך Murine T-cell קווי לשתף שינויים גנומיים כגון מחיקות של PTEN ו FBXW7 במשותף עם חריף תא T לוקמיה לימפובלסטית אדם ו לימפומה, הם גם מתאים במיוחד למחקר סרטן וביולוגיה 8, וייתכן יישומים נוספים עבור מראש המהירה קליניים יעילות הסינון של מערכת החיסון ועל תרופות כימותרפיות סרטן במבחנה. או לא שורות תאים אלה יכולים להיות מופצים in vivo בעכברים או syngeneic או immunocompromised טרם נקבע.
בניגוד פרוטוקולים קודמים בהם הקמת המוצלחת של קו T-cell לקח עד שלושה חודשים 6, שורות תאים שפותחו באמצעות פרוטוקול הנוכחי הוקמו בתוך חודש (בין הקטע 2-8). מצאנו כי נוכחות של אגרגטים תא חסיד באופן רופף על תאים סטרומה המצורפת היא אינדיקציה מוקדמת קריטית של קו תא הוקמה. על מנת לאפשר Murine מתאי T להפיץ ללא הגבלת זמן, מצאנו גם כי חשוב להשאיר את התא הראשוני אגרגטים חסיד רופף באין מפריע במהלך ההאכלות. בנוסף, שמירה על צפיפות התאים בריכוז של כ 3x10 mL / 6 במהלך המעברים ראשונות, אך מקדמת הקמת המוצלחת של קו תאים רציף. מניסיוננו, תאים culturing בצפיפויות שונות באמצעות מספר סוגים של כלי תרבות מגדיל את הסבירות של הקמת קו T-cell. רוב T-cell קווי הוקמו מ-T-75 צלוחיות או 6 צלחות גם 10 או 100 דילולים לקפל אשר מתאימות כ 1x10 1x10 7 או 6 תאים / מ"ל. פרוטוקול הקודם מומלץ תאים culturing ב 5 x 10 6, 1 x10 7, ו 2 x 10 7 תאים לכל היטב היטב 6 צלחות האכלה לאחר 7 ימים (7). הבחנו כי האכלה תרבויות ראשונית 48 שעות 72 שעות ומעבר לאחר מכן, ביום 5 הוא אופטימלי. מחכה כבר לפני האכלה מעבר הראשון יגרום לתאים לאבד את יכולת הקיום שלהם להפסיק את חלוקתם.
הפרמטר האחרון אשר מצאנו הוא קריטי ריבוי מוצלח של Murine T-תאים במבחנה הוא נוכחותם של FBS במדיום תרבות שיכולה לתמוך בצמיחת תאים מהירה. מגרשים שונים וספקים של FBS צריך להיות מוקרן לפני שיזם את הגזירה של T-cell קווי לזיהוי מגיב מתאים. אם Murine T-cell הקווים אינם זמינים עבור ההקרנה, תרבויות העיקרי של לימפוציטים הרתי להציב בארות צלחת 24 באר בריכוז של 6 1x10 לכל מ"ל של מדיום מבחן המכיל concanavalin (1μg / mL) לעידוד צמיחה תאים מהירה היא נאותה. בנוכחות של מקור אופטימלי של FBS, את מספר התאים צריך להכפיל בכל 18-24 ח
Disclosures
Acknowledgements
המחברים מבקשים להודות לד"ר בוריס Reizis מהמחלקה למיקרוביולוגיה ואימונולוגיה באוניברסיטת קולומביה לדיונים מועילים. כמו כן, אנו מבקשים להודות ד"ר מרגרט Bynoe, ד"ר רודמן Getchell ו Deequa Mahamed מהמחלקה למיקרוביולוגיה ולאימונולוגיה במכללה לרפואה וטרינרית באוניברסיטת קורנל לקבלת סיוע טכני עם cytometry זרימה הואנג לו סיוע עם עריכת וידאו. המחברים גם רוצה להודות לחברי דוהמל ו וייס מעבדות לבדיקה ביקורתית הייצור שלהם כתב היד הוידאו, וסטפני Yazinski מן המעבדה וייס הרבייה genotyping p53 - / - עכברים. ניסויים בבעלי חיים בוצעו בהתאם להנחיות והתקנות שנקבעו על ידי טיפול בבעלי חיים באוניברסיטת קורנל מוסדיים ועדת שימוש. מחקר זה מומן בחלקו על ידי קרנות הניתנים על ידי משרד החקלאות האמריקני, מחקר שיתופית המדינה, החינוך, שירות ההדרכה והמקצוע, בריאות בעלי חיים ועל תוכנית המחקר מחלות (עד GED ו RSW) ו-NIH מענקים R03 HD058220 ו R01CA108773 (עד RSW). הסרטון הופק באמצעות in-house מתקני ידי אנשי ממעבדות דוהמל & וייס.
Materials
- דלי קרח
- 70% אתנול
- Dissection משטח המורכב של גוש קצף מכוסה בנייר אלומיניום וסיכות
- שני זוגות מספריים סטרילית מלקחיים קטנים
- סטרילי 150 2 מ"מ צלחת פטרי (תרמו פישר סיינטיפיק, Waltham, MA,. חתול # 08-757-13)
- סטרילי 18 מד מחטים
- 50 מ"ל חרוטי צינורות (קורנינג בע"מ, קורנינג NY: חתול # 430829)
- 10% שנאגרו פורמלין
- תרבות רקמות צלוחיות
- T-25 (TPP, Trasadingen, שוויץ, חתול # 90025)
- T-75 (TPP, Trasadingen, שוויץ, חתול # 90075)
- 6 גם צלחות (קורנינג בע"מ, קורנינג NY: חתול # 3506)
- פוספט סטרילי שנאגרו מלוחים pH 7.2 (PBS)
- תרבות בינוני
- RPMI 1640 עם 25 HEPES מ"מ, 200 מ"מ L-גלוטמין (Lonza, Walkersville, MD, חתול # 12-115F) בתוספת הבאות:
- חום 10% מומת (56 ° C, 30 דקות) בסרום שור העובר (FBS; Hyclone, לוגן, יוטה; חתול # SH30088.03)
- 1% פניצילין וסטרפטומיצין (Mediatech, Manassas, VA; חתול # 30-002-CI)
- 1% חומצות אמינו חיוניות (Mediatech; חתול # 25-025-CI)
- 55 מ"מ 2β-mercaptoethanol (Sigma, סנט לואיס, מיזורי, חתול # M752)
- RPMI 1640 עם 25 HEPES מ"מ, 200 מ"מ L-גלוטמין (Lonza, Walkersville, MD, חתול # 12-115F) בתוספת הבאות:
- דימתיל sulfoxide (DMSO; Calbiochem, La Jolla, CA, חתול # 317275)
- נוגדנים (eBioScience, סן דייגו, קליפורניה)
- אנטי CD3-FITC (קט # 11-0031-85)
- אנטי CD4-APC (קט # 17-0041-83)
- אנטי CD8-PE (קט # 12-081-85)
- שור בסרום אלבומין (BSA, החיים טכנולוגיות, גרנד איילנד, ניו יורק;. חתול # 11018-017)
- Concanavalin (חתול Sigma # C5275)
- 1.8 הקפאת צלוחיות מ"ל (Nunc, רוסקילדה, דנמרק, חתול # 368632)
References
- Barlow, C. Atm-deficient mice: a paradigm of ataxia telangiectasia. Cell. 86, 159-171 (1996).
- Elson, A. Pleiotropic defects in ataxia-telangiectasia protein-deficient mice. Proc Natl Acad Sci U S A. 93, 13084-13089 (1996).
- Kuang, X. Control of Atm-/- thymic lymphoma cell proliferation in vitro and in vivo by dexamethasone. Cancer Chemother Pharmacol. 55, 203-212 (2005).
- Browne, S. E. Treatment with a catalytic antioxidant corrects the neurobehavioral defect in ataxia-telangiectasia mice. Free Radic Biol Med. 36, 938-942 (2004).
- Jacks, T. Tumor spectrum analysis in p53-mutant mice. Curr Biol. 4, 1-7 (1994).
- Chervinsky, D. S., Lam, D. H., Zhao, X. F., Melman, M. P., Aplan, P. D. Development and characterization of T cell leukemia cell lines established from SCL/LMO1 double transgenic mice. Leukemia. 15, 141-147 (2001).
- Sharma, V. M. Notch1 contributes to mouse T-cell leukemia by directly inducing the expression of c-myc. Mol Cell Biol. 26, 8022-8031 (2006).
- Maser, R. S. Chromosomally unstable mouse tumours have genomic alterations similar to diverse human cancers. Nature. 447, 966-971 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved