Method Article
اشتقاق خطوط التوتة تي خلية سرطان الغدد الليمفاوية من أجهزة الصراف الآلي -- / -- و البروتين p53 -- / -- الفئران
In This Article
Summary
In this video we demonstrate a protocol to establish mouse thymic lymphoma cell lines. By following this protocol, we have successfully established several T-cell lines from Atm-/- and p53-/- mice with thymic lymphoma.
Abstract
Established cell lines are a critical research tool that can reduce the use of laboratory animals in research. Certain strains of genetically modified mice, such as Atm-/- and p53-/- consistently develop thymic lymphoma early in life 1,2, and thus, can serve as a reliable source for derivation of murine T-cell lines. Here we present a detailed protocol for the development of established murine thymic lymphoma T-cell lines without the need to add interleukins as described in previous protocols 1,3. Tumors were harvested from mice aged three to six months, at the earliest indication of visible tumors based on the observation of hunched posture, labored breathing, poor grooming and wasting in a susceptible strain 1,4. We have successfully established several T-cell lines using this protocol and inbred strains ofAtm-/- [FVB/N-Atmtm1Led/J] 2 and p53-/- [129/S6-Trp53tm1Tyj/J] 5 mice. We further demonstrate that more than 90% of the established T-cell population expresses CD3, CD4 and CD8. Consistent with stably established cell lines, the T-cells generated by using the present protocol have been passaged for over a year.
Protocol
1. تشريح الأورام
- لتشريح الورم ، يتم وضع منشفة ورقية نظيفة أو ثنى الجراحية المتاح على لوحة التشريح ورشها مع الايثانول 70 ٪.
- يصرح باستخدامها بشكل روتيني الفئران لهذا البروتوكول مع CO 2. ضع الماوس الموت الرحيم على منصة التشريح ورذاذ جانبي الحيوان مع الايثانول. يقام الماوس في مكان على منصة التشريح باستخدام دبابيس دفع أربعة أو أكثر من خلال إدراج الساقين ورشها جيدا مع الايثانول 70 ٪.
- يتم قطع الجلد فوق العانة من خط الوسط الى قاعدة الرأس باستخدام مقص العقيمة ، مع تجنب عضلات الكامنة واختراق في تجاويف الجسم.
- فتح التجويف البطني مع زوج جديد من مقص وملقط معقم والحرص على عدم الاضرار الأعضاء الداخلية.
- فتح التجويف الصدري عن طريق تشريح وتنحرف القفص الصدري للكشف عن الورم ، دون الأوعية الدموية المدمرة.
- تبقى منفصلة الورم من الأجهزة الأخرى ، ونقل قطعة حوالي 40-50 ٪ من الورم الكلي (تقريبا ما يصل الى 1.5 X 0.8 X 0.8 سم) في برنامج تلفزيوني الباردة على الجليد.
- يمكن حفظ الجزء المتبقي من الورم لفحوصات أخرى ، ويمكن إجراء التشريح الكامل في هذا الوقت.
2. زراعة خلايا الغدد اللمفاوية
- رذاذ الأنبوب الذي يحتوي على الورم مع تشريح الإيثانول 70 ٪ ونقلها إلى مجلس الوزراء للسلامة الأحيائية.
- إضافة 10 مل من المتوسط لثقافة عقيمة طبق بيتري 150 مم 2.
- نقل قطعة من ورم في طبق بتري عن طريق الشفط لطيف مع ماصة.
- منحنى اثنين العقيمة إبرة قياس 18 التي تواجه الجانب مشطوف بها.
- فصل الورم باستخدام الإبر عازمة.
- دوامة الطبق ، اضغط برفق ومكان في زاوية لجمع تعليق خلية إلى جنب ، مع تجنب القطع الكبيرة من الورم.
- نضح تعليق الخلية ونقل إلى أنبوب مخروطي 50 مل مع تجنب القطع الكبيرة من الورم.
- غسل لوحة مع 10 مل من متوسطة ونقل في أنبوب نفس الوقت تجنب القطع الكبيرة من الورم.
- مزيج تعليق خلية مكونة من الخلايا الليمفاوية وخلايا انسجة بلطف ونقل 5 مل في دورق نسيج الثقافة T - 25 و 10 مل إلى T - 75 قارورة نسيج الثقافة. دوامة القوارير بلطف.
- تعليق استخدام الخلايا المتبقية لجعل 2 و 4 و 10100 و 1000 التخفيفات أضعاف في حجم 2.5 مل النهائي (خلايا زراعة بكثافات مختلفة باستخدام عدة أنواع من السفن الثقافة يزيد من احتمال إنشاء خط T - الخلية).
- الصفيحة 2.0 مل من كل تخفيف في الآبار الفردية لوحة 6 - جيدا. دوامة بلطف لوحة.
- احتضان الخلايا لمدة 48 ساعة في ترطيب الاجواء 2 أكسيد الكربون في الهواء.
3. تغذية الخلايا الليمفاوية
- بعد 48 ساعة من الحضانة ، إضافة 5 مل من المتوسط إلى القارورة T - 25 و 10 مل من المتوسط إلى القارورة T - 75 على طول الجدار مع الحد الأدنى من اضطراب في الخلايا.
- إضافة 2 مل من المتوسط إلى كل بئر من لوحة 6 - جيدا على طول الجدار مع الحد الأدنى من اضطراب في الخلايا.
- احتضان خلايا لحاء 72 إضافية
4. الركض خلايا الغدد اللمفاوية
- الأولي مرور
- في نهاية اليوم الخامس من الحضانة ، وpassaged الخلايا في نسبة 1:1 ، مع الحفاظ على القوارير واللوحات الأصلية (الحفاظ على كثافة خلايا بتركيز حوالي مل / 3x106 خلال الممرات first يعزز النجاح في إنشاء استمرار خط الخلية).
- للقارورة T - 25 ، ونقل 5 مل تعليق خلية في قارورة جديدة تحتوي على 5 مل من المتوسط. إضافة 5 مل من المتوسط في قارورة الأصلي.
- للقارورة T - 75 ، ونقل 10 مل من تعليق خلية في قارورة جديدة تحتوي على 10 مل من المتوسط. إضافة 10 مل من المتوسط في قارورة الأصلي.
- لوحة 6 - جيدا ، ونقل 2 مل من تعليق خلية من كل بئر في الآبار المماثلة من لوحة جديدة تحتوي على 2 مل من المتوسط في كل بئر. إضافة 2 مل من المتوسط في كل بئر من آبار الأصلي.
- احتضان جميع القوارير واللوحات ل72 ساعة إضافية في تجربتنا وضعت معظم خطوط الخلية من هذه إحدى الفقرات الثقافات (وجود مجاميع فضفاضة ملتصقة الخلية تعليق على خلايا انسجة المرفقة مؤشرا مبكرا على خط خلايا المنشأ).
- لثقافات مع أقل أو لا تعليق خلية المجاميع ملتصقة فضفاضة ، وإطعام قوارير أو من خلال استبدال اللوحات بعناية ما يقرب من 50 ٪ من المتوسط في كل ساعة 72 لتجنب إزالة الخلايا من الثقافة الأصلية ، ويتم ترك السفن ثقافة دائمة ودون عائق ما لا يقل عن 5 دقائق للسماح للخلايا الرواسب في قاع بواسطة الجاذبية قبل التطلع لطيف لطاف المتوسطة.
- في نهاية اليوم الخامس من الحضانة ، وpassaged الخلايا في نسبة 1:1 ، مع الحفاظ على القوارير واللوحات الأصلية (الحفاظ على كثافة خلايا بتركيز حوالي مل / 3x106 خلال الممرات first يعزز النجاح في إنشاء استمرار خط الخلية).
- الحفاظ على خطوط الخلايا المنشأ
- وpassaged خطوط الخلايا أنشئت في قوارير جديدة والصفائح. لT - 25 و T - 75 قوارير ، إضافة 5 مل من النسخة الأصلية أوتعليق إحدى الفقرات في 5 مل من المتوسط. لمدة 6 - جيدا لوحات ، أضف 3 مل من التعليق الأصلي أو مرور خلية واحدة إلى 7 مل من المتوسط في قارورة T - 25. الأعلاف والاحتفاظ الأصلي أو المرور من خلال استبدال ثقافة واحدة حجم إزالة مع مستنبت الطازجة.
- أنشئ ممر خطوط الخلايا في قوارير T - 25 الجديدة. خطوط الخلية وقتا مضاعفة 18-24 ساعة. يتم الاحتفاظ بصورة روتينية الثقافات في كثافة مل / 1 - 3x106 وpassaged كل 3 أيام. إضافة الحجم المطلوب من الثقافة السابقة لمرور متوسطة جديدة لجعل ما يصل الى 10 مل. الأعلاف والإبقاء على الثقافة الأصلية.
- بعد بضع فقرات ، فإن الخلايا غير ملتصقة مصيره دون دعم خلايا انسجة ملتصقة وتنفذ عددا أقل من الخلايا الملتصقة مع بعضها عبر الممر. بعد هذه النقطة ، يمكن الحفاظ على الثقافات في نسيج الثقافة غير المعالجة T - 25 قوارير.
5. تجميد واستعادة خطوط خلية ورم الغدد اللمفاوية
- يتم تجميد خطوط الخلية الطازجة في المتوسط 1640 RPMI تحتوي على 20 ٪ و DMSO FBS 10 ٪.
- وطرد الخلايا من ثقافة قديمة في 48 ساعة T - 25 قارورة (حوالي 1.5x10 6 خلية / مل) في 1500 دورة في الدقيقة لمدة 5 دقائق في درجة حرارة الغرفة. بعد التخلص من طاف ، هي الخلايا إعادة علقت في 2 مل من المتوسط تجميد الباردة. يتم وضع اثنين من 1.0 مل من حجم الخلية تعليق من كل قارورة في قنينات تجميد وتجميدها على الفور عند -80 درجة مئوية ، ونقل إلى النيتروجين السائل في اليوم التالي.
- وتسترد الخلايا من تخزين النيتروجين السائل بواسطة ذوبان سريع ، وإعادة التعليق على محتويات في 10 مل من المتوسط ثقافة جديدة. بدلا من ذلك ، يتم غسل الخلايا إذابة طازجة مرة واحدة في مستنبت دافئ لإزالة DMSO قبل إعادة التعليق في 10 مل من المتوسط ثقافة جديدة. يتم استزراع الخلايا على الأقل قبل مرور 72 ساعة لاحقة.
6. ممثل النتائج
جهاز الصراف الآلي -- / -- تي خلية الخط تطويرها باستخدام هذا البروتوكول ، وعينت DWJ - ATM - 1 تميزت تلطيخ المضادة للCD3 - FITC ، APC - المضادة والمعادية للCD4 CD8 PE وتحليل تدفق الخلوي (Figure1). وكان أكثر من 90 ٪ من الخلايا T - CD3 ، CD4 و CD8 الثلاثي إيجابية.
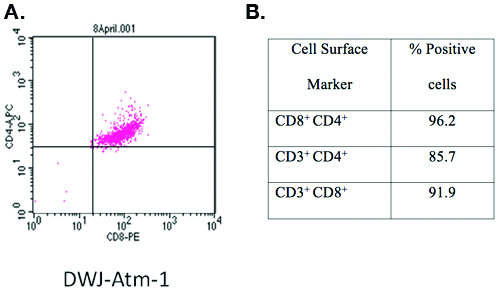
الشكل 1. توصيف خط تي خلية تم تطويرها باستخدام هذا البروتوكول.
علامات سطح الخلية من جهاز الصراف الآلي المنشأة -- / -- خط الخلية المعينة تميزت DWJ - ATM - 1 بواسطة تلطيخ المضادة للCD3 - FITC ومعاداة CD4 - APC ، ومكافحة CD8 - PE وتدفق تحليل الخلوي. لفترة وجيزة ، تم غسلها 1X10 6 خلايا جديدة مرة واحدة في برنامج تلفزيوني الباردة (1500 دورة في الدقيقة / 5 دقائق) ، وحضنت في 4 درجات مئوية لمدة 10 دقيقة مع 200 ميكرولتر من الكوكتيل الأضداد (الأجسام المضادة في كل 1:200 التخفيف في برنامج تلفزيوني مع جيش صرب البوسنة 1 ٪. يمكن فحص الخلايا على الفور في حين تعد الخلايا الثابتة طازجة أو ثابتة لتحليلها لاحقا. بواسطة الفورمالين محايدة مضيفا مخزنة في نهائي تركيز 4 ٪ (المجلد / المجلد) وحضنت في 4 درجة مئوية لمدة 30 دقيقة ، تحصد بواسطة الطرد المركزي (1500 دورة في الدقيقة / 5 دقائق) ومعلق في 200 ميليلتر من برنامج تلفزيوني مع جيش صرب البوسنة 1 ٪. تم تحليل ما مجموعه 1 4 10 X الخلايا باستخدام FACS Calibur دينار بحريني ومحلل البرمجيات CellQuest دينار بحريني (العلوم البيولوجية ، وسان خوسيه ، كاليفورنيا).
Discussion
In this protocol, we provide detailed procedures to establish murine T-cell lines from two different mouse genotypes; Atm-/- [FVB/N-Atmtm1Led/J] and p53-/- [129/S6-Trp53tm1Tyj/J]. By using this protocol, a total of 6 (out of 7 attempts) Atm-/- and three (out of 5 attempts) p53-/- murine T-cell lines have been established in our laboratory. Representative data demonstrating that cell line DWJ-Atm-1, anAtm-/- cell line consists of a cell population in which greater than 90% of the cells express CD3, CD4 and CD8 surface markers confirm that clonal T-cell line can be established using our protocol.
Development of murine T-cell lines has been reported 3,6,7; however, detailed protocols for establishing these lines have not been described previously. Although only two mouse genotypes were used for derivation of murine T-cell lines in our laboratory, we believe that these procedures are applicable to a wide range of spontaneous T-cell lymphomas found in other strains of mice such as Kras defective,and potentially other animal species. Murine T-cell lines have potential applications in understanding basic questions in immunology and oncology. Currently, we are using these cell lines in studies aimed at characterizing host-pathogen interactions and genotoxin-induced cytotoxicity including mechanisms of cell cycle arrest and apoptosis. Given that murine T-cell lines share genomic alterations such as deletions of PTEN and FBXW7 in common with acute human T-cell lymphoblastic leukemias and lymphomas, they are particularly well suited for research in cancer biology 8, and may have further applications for rapid pre-clinical efficacy screening of immunological and cancer chemotherapeutic agents in vitro. Whether or not these cell lines can be propagated in vivo in either syngeneic or immunocompromised mice has not been determined.
In contrast to previous protocols in which successful establishment of a T-cell line took up to three months 6, cell lines developed using the current protocol were established within a month (between passage 2-8). We found that the presence of loosely adherent cell aggregates over attached stromal cells is a critical early indication of an established cell line. In order to allow murine T-cells to propagate indefinitely, we also found that it is important to leave the initial loosely adherent cell aggregates undisturbed during feedings. In addition, maintaining the cell density at a concentration of approximately 3x106/ mL during the first passages also promotes successful establishment of a continuous cell line. In our experience, culturing cells at different densities using several types of culture vessels maximizes the likelihood of establishing a T-cell line. Most T-cell lines were established from T-75 flasks or 6-well plates and 10 or 100 fold dilutions which correspond to approximately 1x107 or 1x106 cells/ mL. A previous protocol recommended culturing cells at 5 x 106, 1 x107,and 2 x 107 cells per well in 6-well plates, and feeding after 7 days (7). We observed that feeding initial cultures at 48 h and passage 72 h later, on day 5 is optimal. Waiting longer before the first feeding and passage will cause the cells to lose their viability and stop dividing.
The last parameter which we found is critical to successful propagation of murine T-cells in vitro is the presence of FBS in the culture medium that can support rapid cell growth. Different lots and suppliers of FBS should be screened prior to initiating the derivation of T-cell lines for identification of an appropriate reagent. If murine T-cell lines are not available for screening, primary cultures of thymic lymphocytes placed in wells of a 24-well plate at a concentration of 1x106 per mL of test medium containing concanavalin A (1μg/ mL) to stimulate rapid cell growth is adequate. In the presence of an optimal source of FBS, the number of cells should double every 18 to 24 h.
Disclosures
No conflicts of interest declared.
Acknowledgements
The authors wish to thank Dr. Boris Reizis from the Department of Microbiology and Immunology at Columbia University for helpful discussions. We also wish to thank Dr. Margaret Bynoe, Dr. Rodman Getchell and Deequa Mahamed from the Department of Microbiology and Immunology at the College of Veterinary Medicine, Cornell University for technical assistance with flow cytometry and Lu Huang for assistance with video editing. The authors also wish to thank the members of Duhamel and Weiss laboratories for their critical review of the manuscript and video production, and Stephanie Yazinski from the Weiss laboratory for breeding and genotyping p53-/- mice. Experiments on animals were performed in accordance with the guidelines and regulations set forth by Cornell University Institutional Animal Care and Use Committee. This research was supported in part by funds provided by the US Department of Agriculture, Cooperative State Research, Education, and Extension Service, Animal Health and Disease Research Program (to G.E.D. and R.S.W.) and NIH grants R03 HD058220 and R01CA108773 (to R.S.W). The video was produced using in-house facilities by the personnel from the Duhamel & Weiss laboratories.
Materials
| Name | Company | Catalog Number | Comments |
| |||
References
- Barlow, C. Atm-deficient mice: a paradigm of ataxia telangiectasia. Cell. 86, 159-171 (1996).
- Elson, A. Pleiotropic defects in ataxia-telangiectasia protein-deficient mice. Proc Natl Acad Sci U S A. 93, 13084-13089 (1996).
- Kuang, X. Control of Atm-/- thymic lymphoma cell proliferation in vitro and in vivo by dexamethasone. Cancer Chemother Pharmacol. 55, 203-212 (2005).
- Browne, S. E. Treatment with a catalytic antioxidant corrects the neurobehavioral defect in ataxia-telangiectasia mice. Free Radic Biol Med. 36, 938-942 (2004).
- Jacks, T. Tumor spectrum analysis in p53-mutant mice. Curr Biol. 4, 1-7 (1994).
- Chervinsky, D. S., Lam, D. H., Zhao, X. F., Melman, M. P., Aplan, P. D. Development and characterization of T cell leukemia cell lines established from SCL/LMO1 double transgenic mice. Leukemia. 15, 141-147 (2001).
- Sharma, V. M. Notch1 contributes to mouse T-cell leukemia by directly inducing the expression of c-myc. Mol Cell Biol. 26, 8022-8031 (2006).
- Maser, R. S. Chromosomally unstable mouse tumours have genomic alterations similar to diverse human cancers. Nature. 447, 966-971 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved