Method Article
胸腺淋巴瘤的T细胞系的推导 ATM - / - P53 - / -鼠标
摘要
在这个视频中,我们展示了一个协议来建立小鼠胸腺淋巴瘤细胞株。通过这个协议,我们已经成功地建立了几个从ATM / T细胞线 - 和p53 - / - 小鼠胸腺淋巴瘤。
摘要
建立的细胞系是一个重要的的研究工具,它可以减少使用实验动物的研究。某些菌株的转基因小鼠, 如 ATM - / - 和 p53 - / -胸腺淋巴瘤不断发展早在生活中1,2,因此,可以作为一个可靠的来源小鼠T细胞株的推导。在这里,我们建立了小鼠胸腺淋巴瘤的T细胞系的发展,而不需要添加白细胞介素1,3以前的协议来描述一个详细的协议。从年龄在3至6个月的小鼠肿瘤收获,最早表现的基础上,弯腰驼背的姿势观察可见肿瘤,呼吸困难,穷人疏导,并在敏感品系1,4浪费。我们已经成功地建立了几个使用此协议的T细胞系和近交系的自动取款机- / - [FVB/N- 自动柜员机tm1Led / J] 2 和p53 - / - [129/S6- Trp53 tm1Tyj / J] 5只。我们进一步表明,既定的T细胞的人口超过90%表示CD3,CD4和CD8。与稳定建立的细胞株,使用本议定书所产生的T细胞已传了一年多。
研究方案
1。肿瘤剖析
- 肿瘤清扫干净的纸巾或一次性手术悬垂放在解剖台上,喷以70%的乙醇。
- 本议定书小鼠常规安乐死的CO 2。安乐死鼠标放置在解剖台上,和动物两侧喷用乙醇。鼠标是在地方上的夹层板,使用四个或更多的推引脚通过插入腿和喷用70%乙醇彻底。
- 从耻骨头的基地使用无菌剪刀,同时也避免了潜在的肌肉和渗透到体腔,在中线的皮肤被切断。
- 打开腹腔,用无菌剪刀和镊子,小心不要损坏内部器官的一双新。
- 通过解剖和偏转左肋揭示不损害血管的肿瘤,打开胸腔。
- 从其他器官中分离出来的肿瘤,转移到一块冷PBS总的肿瘤约40-50%(约1.5 × 0.8 × 0.8厘米)保持在冰上。
- 肿瘤的剩余部分可以保存为其他实验可以在这个时候进行一个完整的尸体剖检。
2。培养淋巴瘤细胞
- 喷雾管中,用70%乙醇和转移到了一个生物安全柜的解剖肿瘤。
- 10毫升培养液中添加150毫米无菌培养皿。
- 转移到培养皿中,用吸管轻轻吸一块肿瘤。
- 弯曲两个无菌18号针头面临斜角方。
- 游离的肿瘤,使用弯曲的针。
- 涡流的菜,请点击轻轻地放在一个角度,一个侧面收集细胞悬液,同时避免了大块肿瘤。
- 吸50 mL锥形管的细胞悬液和转让,同时避免了大块肿瘤。
- 洗净同一管板与10毫升的媒介和转移,同时避免大块肿瘤。
- 混合轻轻的淋巴细胞和基质细胞组成的细胞悬液,并转移到了T - 25的组织培养瓶和10毫升到5毫升的T - 75的组织培养瓶中。轻轻漩涡的烧瓶。
- 使用剩余的细胞悬浮于2.5毫升的最终体积(在使用几种类型的文化船只不同密度的培养细胞最大限度地建立一个T -细胞株的可能性)2,4,10100和1000倍稀释。
- 板2.0毫升每稀释到6孔板个别井。轻轻旋流板。
- 在加湿空气中的CO 2气氛中孵育48 h后的细胞。
3。饲养淋巴瘤细胞
- 孵化48小时后,添加5毫升的中型的T - 75烧瓶烧瓶的T - 25和10毫升介质沿墙,干扰最小的细胞。
- 加入2毫升培养基,每孔的墙沿,干扰最小的细胞的6孔板。
- 孵育细胞额外的72小时
4。传代淋巴瘤细胞
- 初步通过
- 在孵化第五天结束时,在1:1的比例传代细胞,同时保留原瓶和板(约3x106 /毫升的浓度保持在第一段落的细胞密度,促进建立一个成功的连续细胞系)。
- 的T - 25烧瓶,转移到一个新的中等5毫升容量瓶中含有5 ml的细胞悬液。添加到原瓶5毫升的中型。
- 的T - 75烧瓶中,转移到一个新的含有10毫升中等的容量瓶的10 ml的细胞悬液。添加到原瓶10毫升介质。
- 对于6孔板,每口井从传输到相应的一个新的含有2毫升培养基板,每孔井2 ml的细胞悬液。添加到每一个原来的水井以及2毫升培养基。
- 所有额外的72小时孵育瓶和盘子根据我们的经验,大多数细胞系建立了从这些通道之一的文化(松散贴壁细胞悬浮聚合的附着的基质细胞的存在是一个已建立的细胞株的早期迹象)。
- 对于较少或没有松散贴壁细胞悬浮聚合的文化,饲料仔细中期每72小时更换约50%的烧瓶或板为了避免去除细胞的原始文化,文化的船只罚站和不受干扰至少5分钟,让在底部的上清液中期之前温柔的愿望重力细胞泥沙。
- 在孵化第五天结束时,在1:1的比例传代细胞,同时保留原瓶和板(约3x106 /毫升的浓度保持在第一段落的细胞密度,促进建立一个成功的连续细胞系)。
- 维护建立的细胞株
- 建立的细胞株传代成新瓶和盘子。对于T - 25和T - 75烧瓶中,加入5毫升的原件或通过暂停到5毫升中等。对于6孔板中,加入7 mL的容量瓶中的T - 25中型3毫升的原件或通过一个细胞悬液。饲料和更换新鲜培养液中删除的卷保留原或通过一种文化。
- 通道设立了新的T - 25培养瓶细胞株。细胞系有一个倍增时间为18-24小时。文化是经常保持在1 - 3x106 /毫升的密度,每3天传代。以前通过文化需要的量添加到新的介质,以弥补10毫升。饲料和保留了原有的文化。
- 几个段落后,非贴壁细胞会自我维持不贴壁的基质细胞的贴壁细胞数量较少,每个通道进行。除了这一点,可以保持文化的非组织培养治疗的T - 25培养瓶。
5。冻结和恢复淋巴瘤细胞株
- 新鲜配制RPMI 1640培养液含20%胎牛血清和10%DMSO的培养基中的细胞系被冻结。
- 从一个48小时的T - 25瓶(约1.5x10 6细胞/ mL)的旧文化的细胞在室温下5分钟1500转离心。丢弃上清后,细胞重新悬浮在2毫升冷冻结介质。两个1.0毫升细胞悬液卷从每个烧瓶放置在冷冻小瓶,立即冻结在-80 ° C,并转移到液态氮的翌日。
- 从液氮保存的细胞恢复快速解冻,resuspending 10 mL新鲜培养液中的内容。另外,刚刚解冻的细胞在温暖的培养基上进行了一次洗涤之前删除二甲基亚砜10毫升的新鲜培养液resuspending。细胞培养随后通过前至少72 h。
6。代表性的成果
自动取款机- / - T细胞线使用此协议,并指定DWJ - ATM - 1与抗CD3 - FITC,抗CD4 - APC和抗- CD8 - PE和流式细胞仪分析(图1)染色的特点。超过90%的T细胞,CD3,CD4和CD8 +三重阳性。
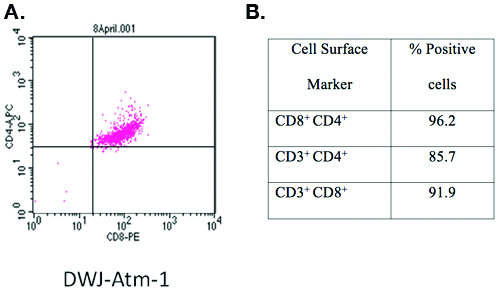
图1:使用该协议所开发的T -细胞系的表征。
/ - -建立ATM的细胞表面标记的细胞株指定DWJ - ATM - 1的特点是染色与抗CD3 - FITC,抗CD4 - APC,抗- CD8 - PE和流式细胞仪分析。简单地说,1X10 6新鲜细胞清洗一次冷PBS(1500转/ 5分),孵育4 ° C为10分钟与200μL抗体鸡尾酒(每个抗体1:200稀释1%BSA的PBS。细胞可以立即进行检查,而新鲜或固定为以后的分析。固定细胞准备加入缓冲的福尔马林在中立在终浓度为4%(体积/体积),并在4 ° C孵育30分钟,离心收获,(1500转/ 5分钟),重悬于200μL1%BSA的PBS。共1 × 10 4细胞进行了分析使用BD流式细胞仪刀魂分析仪和CellQuest软件(BD公司,加利福尼亚州圣何塞) 。
讨论
在这个协议中,我们提供了详细的程序,建立从两个不同的鼠标基因型的小鼠的T 细胞系;自动取款机- / - [FVB/N- ATM tm1Led / A]和p53 - / - [129/S6- Trp53 tm1Tyj / J]。 。通过使用这个协议中,共有6(满分7次尝试)自动取款机- / -三(5次尝试)P53 - / -小鼠的T细胞系已经建立在我们的实验室。 / - -证明该细胞系DWJ - ATM - 1,ATM细胞株有代表性的数据由一个细胞的人口,其中大于90%的细胞表达CD3 +,CD4和CD8表面标记证实,克隆的T细胞可使用我们的协议成立。
小鼠T细胞系的发展有报道 3,6,7;然而,为建立这些线路的详细协议并没有被描述以前。虽然只有两个鼠标基因型在我们的实验室小鼠的T细胞线的推导,我们相信,这些程序适用于自发T细胞淋巴瘤,其他如KRAS基因缺陷的小鼠品系中的一个广泛,以及其他可能动物物种。小鼠T细胞株有潜在的应用理解在免疫学和肿瘤学的基本问题。目前,我们正在利用这些细胞株在宿主 - 病原体相互作用和genotoxin细胞毒作用,包括细胞周期停滞和细胞凋亡的机制特征的研究。鉴于小鼠T细胞株的份额,如PTEN和FBXW7缺失的基因的改变与人类T细胞急性淋巴细胞白血病和淋巴瘤共同,它们特别适合于研究在癌症生物学8,并可能有进一步的应用,快速前在体外免疫学和癌症化疗药物的临床疗效筛选。无论这些细胞株,可在同源或免疫功能低下小鼠体内传播尚未确定。
对比以前的协议,其中的T -细胞系成功建立了3个月6个,开发利用当前协议的细胞株,建立在一个月内(通过2-8之间) 。我们发现,存在较松散贴壁细胞附着的基质细胞聚集建立的细胞株是一个重要的的早期迹象。为了让小鼠T细胞能无限期地传播,我们也发现,重要的是,离开最初的松散贴壁细胞聚集在喂食不受干扰。此外,在第一段落的细胞密度维持在约3X10 6 /毫升的浓度,还促进成功地建立了一个连续的细胞株。根据我们的经验,在使用几种类型的文化船只的不同密度的培养细胞,建立一个T -细胞株的可能性最大化。大多数T细胞系建立了从T - 75培养瓶或6孔板和10或100倍稀释,这对应约1 × 10 7或1 × 10 6细胞/ ml 。一个先前的协议,建议在5 × 10 6,7,1 X10和2 × 10 7 6孔板每孔细胞培养细胞,喂养后7天(7)。我们观察,初步培养后48小时,并通过72小时喂5天,是最佳的。不再等待前一次投料和通过,将导致细胞失去其可行性,并停止分裂。
最后一个参数,我们发现,在体外对小鼠T细胞成功繁殖的关键是,可以支持快速的细胞生长在培养基中的FBS。 FB的不同地段和供应商应开始前确定一个合适的试剂T细胞系的推导的筛选。如果小鼠T细胞株筛选,水井24孔板放置在浓度为1 × 10 6每毫升含有刀豆蛋白A(1μg/毫升),以刺激细胞快速增长试验介质的胸腺淋巴细胞的主要文化是足够的。在FB的最佳来源存在,细胞的数量应该增加一倍每隔18至24小时
披露声明
致谢
作者衷心感谢鲍里斯Reizis在哥伦比亚大学的微生物学和免疫学系博士的有益讨论。我们也希望在康奈尔大学兽医学院,感谢冯富珍博士Bynoe,罗德曼Getchell博士和Deequa Mahamed从微生物学和免疫学系与流式细胞仪和视频编辑的协助下,黄路为技术援助。作者还希望感谢魏斯实验室杜哈明和魏斯实验室的成员,他们的手稿和视频制作,严格审查和斯蒂芬妮Yazinski育种和基因分型p53基因- / -小鼠。在康奈尔大学机构动物护理和使用委员会规定的准则和法规的规定进行动物实验。这项研究是由美国农业部部,合作国家研究,教育和推广服务,动物健康和疾病研究计划(GED和RSW)和美国国立卫生研究院拨款R03 HD058220和R01CA108773(RSW)提供的资金支持部分。视频制作杜哈明魏斯实验室的人员使用的内部设施。
材料
- 冰桶
- 70%的乙醇
- 覆盖铝箔和引脚的泡沫块组成的夹层板
- 两套小无菌剪刀和镊子
- 无菌150毫米2培养皿(赛默飞世尔科技,沃尔瑟姆,马,猫#08-757-13)
- 无菌18表针
- 50 ml锥形管(康宁公司,康宁纽约猫#430829)
- 10%的福尔马林
- 组织培养瓶
- T - 25(TPP,Trasadingen,瑞士,CAT#90025)
- T - 75(TPP,Trasadingen,瑞士,CAT#90075)
- 6孔板(康宁公司康宁公司,纽约;猫#3506)
- 无菌磷酸盐缓冲液pH值7.2(PBS)
- 培养基
- RPMI 1640培养液,与25毫米的HEPES,200毫米以下补充L -谷氨酰胺(龙沙,Walkersville,MD;猫#12 - 115F):
- 10%热灭活(56℃,30分钟)小牛血清(FBS,Hyclone公司,UT斯达康,洛根#SH30088.03猫)
- 1%青霉素和链霉素(Mediatech,弗吉尼亚州马纳萨斯的猫#30 - 002 - CI)
- 1%的不重要的氨基酸(猫#25 - 025 - CI Mediatech)
- 55毫米2β-巯基乙醇(Sigma公司,圣路易斯,密苏里州,猫#M752)
- RPMI 1640培养液,与25毫米的HEPES,200毫米以下补充L -谷氨酰胺(龙沙,Walkersville,MD;猫#12 - 115F):
- 二甲基亚砜(DMSO; Calbiochem,拉霍亚,CA;猫#317275)
- 抗体(eBioscience公司,加利福尼亚州圣迭戈)
- 抗CD3 - FITC(货号#11-0031-85)
- 抗CD4 - APC(货号#17-0041-83)
- 抗- CD8 - PE(货号#12-081-85)
- 牛血清白蛋白(BSA;生命科技,大岛,NY;猫#11018-017)
- 伴刀豆球蛋白A(Sigma公司猫#C5275)
- 1.8毫升冷冻瓶(NUNC,丹麦的罗斯基勒,猫#368632)
参考文献
- Barlow, C. Atm-deficient mice: a paradigm of ataxia telangiectasia. Cell. 86, 159-171 (1996).
- Elson, A. Pleiotropic defects in ataxia-telangiectasia protein-deficient mice. Proc Natl Acad Sci U S A. 93, 13084-13089 (1996).
- Kuang, X. Control of Atm-/- thymic lymphoma cell proliferation in vitro and in vivo by dexamethasone. Cancer Chemother Pharmacol. 55, 203-212 (2005).
- Browne, S. E. Treatment with a catalytic antioxidant corrects the neurobehavioral defect in ataxia-telangiectasia mice. Free Radic Biol Med. 36, 938-942 (2004).
- Jacks, T. Tumor spectrum analysis in p53-mutant mice. Curr Biol. 4, 1-7 (1994).
- Chervinsky, D. S., Lam, D. H., Zhao, X. F., Melman, M. P., Aplan, P. D. Development and characterization of T cell leukemia cell lines established from SCL/LMO1 double transgenic mice. Leukemia. 15, 141-147 (2001).
- Sharma, V. M. Notch1 contributes to mouse T-cell leukemia by directly inducing the expression of c-myc. Mol Cell Biol. 26, 8022-8031 (2006).
- Maser, R. S. Chromosomally unstable mouse tumours have genomic alterations similar to diverse human cancers. Nature. 447, 966-971 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
ISSN 2689-3649
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
我们使用 cookie 来增强您在我们网站上的体验。
继续使用我们的网站或单击“继续”,即表示您同意接受我们的 cookie。