Method Article
Ableitung von Thymuslymphom T-Zell-Linien aus Atm - / - Und P53 - / - Mäuse
In diesem Artikel
Zusammenfassung
In diesem Video zeigen wir ein Protokoll zur Maus Thymuslymphom Zelllinien zu etablieren. Und p53-/ - - Mäusen mit Thymuslymphom Durch Einhalten dieses Protokolls haben wir erfolgreich mehrere T-Zell-Linien von Atm-/ etabliert.
Zusammenfassung
Etablierte Zelllinien sind ein wichtiger Forschungs-Tool, das den Einsatz von Versuchstieren in der Forschung verringern kann. Bestimmte Stämme von genetisch veränderten Mäusen, wie ATM - / - und p53 - / - konsequent zu entwickeln Thymuslymphom früh im Leben 1,2, und damit kann als zuverlässige Quelle für die Ableitung von murinen T-Zell-Linien dienen. Hier präsentieren wir Ihnen ein detailliertes Protokoll für die Entwicklung der etablierten murinen Thymuslymphom T-Zell-Linien, ohne die Notwendigkeit, Interleukine wie in früheren Protokollen 1,3 beschrieben hinzufügen. Die Tumoren wurden von Mäusen im Alter von drei Minuten vor sechs Monaten geerntet, frühestens Hinweis auf sichtbare Tumoren auf der Beobachtung der gekrümmte Haltung basiert, erschwerte Atmung, schlechte Pflege und Verschwendung in einer anfälligen Stamm 1,4. / - - [FVB/N- Atm tm1Led / J] 2 und p53 - / - [129/S6- Trp53 tm1Tyj / J] 5 Mäusen Wir haben bereits mehrere T-Zell-Linien mit diesem Protokoll und Inzuchtstämme von ATM gegründet. Wir zeigen ferner, dass mehr als 90% der etablierten T-Zell-Population CD3, CD4 und CD8 ausdrückt. In Übereinstimmung mit stabil etablierten Zelllinien, die T-Zellen, die durch Verwendung der vorliegenden Protokoll generiert seit über einem Jahr wurden passagiert.
Protokoll
1. Dissection der Tumor
- Für Tumor Dissektion, ist ein sauberes Papiertuch oder Einweg-OP-Tuch auf dem Sezieren Pad gelegt und versprüht mit 70% Ethanol.
- Mäuse für dieses Protokoll werden routinemäßig mit CO 2 getötet. Legen Sie die eingeschläfert Maus auf die Dissektion Pad und Spray beiden Seiten des Tieres mit Ethanol. Die Maus ist in Ort auf die Dissektion Pad mit vier oder mehr Push-Pins durch die Beine gesteckt und gründlich mit 70% Ethanol besprüht statt.
- Die Haut über der Mittellinie ist vom Schambein an der Basis des Kopfes mit einer sterilen Schere, unter Vermeidung der darunter liegenden Muskeln und Eindringen in die Körperhöhlen geschnitten.
- Öffnen der Bauchhöhle mit einem neuen Paar sterile Schere und Pinzette zu vorsichtig, um nicht Schaden der inneren Organe.
- Öffnen Sie die Brusthöhle durch Sezieren und Ablenkung des Brustkorbs, um den Tumor zu offenbaren, ohne Beschädigung der Blutgefäße.
- Separate den Tumor von anderen Organen, und übertragen ein Stück ca. 40-50% des gesamten Tumors (ca. bis zu 1,5 x 0,8 x 0,8 cm) in kaltem PBS auf Eis gehalten.
- Der verbleibende Teil des Tumors kann auch für andere Tests gespeichert werden und eine vollständige Autopsie kann zu diesem Zeitpunkt durchgeführt werden.
2. Anzucht-Lymphom-Zellen
- Spray das Rohr mit dem sezierten Tumor mit 70% Ethanol und Transfer zu einem Biosicherheitswerkbank.
- Fügen Sie 10 ml Kulturmedium in ein steriles 150 mm 2 Petrischale.
- Übertragen Sie die Stück Tumor in der Petrischale durch vorsichtiges Absaugen mit einer Pipette.
- Beugen zwei sterilen 18-Gauge-Nadel mit Blick auf den abgeschrägten Seite nach außen.
- Distanzieren der Tumor mit der gebogenen Nadeln.
- Swirl der Schale, klopfen Sie leicht und in einem Winkel zu der Zellsuspension auf eine Seite zu sammeln, bei gleichzeitiger Vermeidung große Stücke des Tumors.
- Saugen Sie die Zellsuspension und Überführung in eine 50 ml konischen Rohr unter Vermeidung große Stücke des Tumors.
- Waschen Sie die Platte mit 10 ml Medium und Überführung in das gleiche Rohr unter Vermeidung große Stücke des Tumors.
- Mischen Sie die Zellsuspension von Lymphozyten und Stromazellen sanft zusammen und Transfer 5 mL in einen T-25 Zellkulturflasche und 10 ml in einen T-75 Zellkulturflasche. Vorsichtig schwenken die Flaschen.
- Verwenden Sie die restlichen Zellsuspension auf 2, 4, 10.100 und 1000 Verdünnungen in 2,5 ml Endvolumen (Kultivieren von Zellen in verschiedenen Dichten mit verschiedenen Arten von Kulturgefäße maximiert die Wahrscheinlichkeit der Schaffung einer T-Zell-Linie) zu machen.
- Platte 2,0 ml von jeder Verdünnung in einzelne Vertiefungen einer 6-Well-Platte. Vorsichtig schwenken der Platte.
- Inkubieren Sie die Zellen für 48 h in feuchter CO 2-Atmosphäre in der Luft.
3. Feeding-Lymphom-Zellen
- Nach 48 h Inkubation mit 5 ml Medium, um die T-25 Kolben und 10 ml Medium, um die T-75 Kolben an der Wand entlang mit minimaler Störung der Zellen.
- Add 2 ml Medium in jede Vertiefung der 6-Well-Platte an der Wand entlang mit minimaler Störung der Zellen.
- Inkubieren Sie die Zellen für weitere 72 h.
4. Die Passage-Lymphom-Zellen
- Erste Passage
- Am Ende des fünften Tages der Inkubation werden die Zellen im Verhältnis 1:1 passagiert, unter Beibehaltung der ursprünglichen Flaschen und Teller (Beibehaltung der Zelldichte bei einer Konzentration von etwa 3x106 / mL in den ersten Passagen fördert erfolgreiche Etablierung eines kontinuierliche Zelllinie).
- Für die T-25 Kolben, Transfer 5 ml Zellsuspension in eine neue Flasche mit 5 ml Medium. 5 ml Medium in den ursprünglichen Kolben.
- Für die T-75 Kolben, Transfer 10 ml Zellsuspension in eine neue Flasche mit 10 ml Medium. Fügen Sie 10 ml Medium in den ursprünglichen Kolben.
- Für die 6-Well-Platte, Transfer 2 mL Zellsuspension aus jeder Vertiefung in entsprechende Vertiefungen einer neuen Platte mit 2 ml Medium in jede Vertiefung. Add 2 ml Medium in jede Vertiefung der ursprünglichen Brunnen.
- Inkubieren Sie alle Flaschen und Platten für weitere 72 h. In unserer Erfahrung die meisten Zelllinien werden aus diesen Gang sind Kulturen (das Vorhandensein von lose anhaftenden Federung Zellaggregate über die angeschlossenen Stromazellen ist ein frühes Anzeichen einer etablierten Zelllinie) gegründet.
- Für die Kulturen mit weniger oder gar keine lose anhaftenden Federung Zellaggregate, füttern die Flaschen oder Platten durch vorsichtiges ersetzt ca. 50% des Mediums alle 72 h. Um zu vermeiden, Entfernung von Zellen aus dem ursprünglichen Kultur, Kultur Schiffe stehen gelassen und ungestört für mindestens 5 min zu den Zellen Sediment am Boden lassen durch die Schwerkraft, bevor sanfte Aspiration des Überstandes Medium.
- Am Ende des fünften Tages der Inkubation werden die Zellen im Verhältnis 1:1 passagiert, unter Beibehaltung der ursprünglichen Flaschen und Teller (Beibehaltung der Zelldichte bei einer Konzentration von etwa 3x106 / mL in den ersten Passagen fördert erfolgreiche Etablierung eines kontinuierliche Zelllinie).
- Die Aufrechterhaltung etablierten Zelllinien
- Etablierte Zelllinien werden in neuen Flaschen und Platten passagiert. Für T-25 und T-75 Flaschen, 5 ml des Originals oderDurchgang eine Suspension in 5 ml Medium. Für 6-Well-Platten, 3 ml des Originals oder Passage einer Zelle Suspension in 7 ml Medium in einem T-25 Kolben. Feed und bleibt das Original oder eine Passage einer Kultur durch den Austausch des Volumens mit frischem Kulturmedium entfernt.
- Passage etablierten Zelllinien in neue T-25 Flaschen. Die Zell-Linien haben eine Verdoppelung der Zeit von 18-24 h. Die Kulturen werden routinemäßig bei einer Dichte von 1-3x106 / mL gepflegt und passagiert alle 3 Tage. Fügen Sie die benötigte Menge an früherer Stelle Kultur in das neue Medium zu machen bis zu 10 mL. Futter-und behält die ursprüngliche Kultur.
- Nach ein paar Passagen, die nicht haftenden Zellen selbst ohne die anhaftenden Stromazellen erhalten und eine kleinere Anzahl von adhärenten Zellen werden über mit jedem Durchgang durchgeführt. Über diesen Punkt können die Kulturen in nicht-Gewebekultur gehalten werden behandelt T-25 Flaschen.
5. Freezing und Wiederherstellen von Lymphom-Zelllinien
- Die Zelllinien sind in frisch zubereiteten RPMI 1640 Medium mit 20% FBS und 10% DMSO eingefroren.
- Zellen aus einer 48 h alten Kultur in T-25-Kolben (etwa 1.5x10 6 Zellen / ml) werden bei 1500 rpm für 5 min bei Raumtemperatur zentrifugiert. Nach Verwerfen des Überstandes werden die Zellen in 2 ml kaltem Einfriermedium resuspendiert. Zwei 1,0 ml Volumen der Zellsuspension aus jedem Kolben sind in Einfrierröhrchen platziert, sofort bei -80 ° C, und in flüssigem Stickstoff am folgenden Tag.
- Die Zellen werden aus flüssigem Stickstoff Lagerung von schnellen Auftauen, und Resuspendieren der Inhalt in 10 ml frisches Kulturmedium gewonnen. Alternativ sind frisch aufgetauten Zellen einmal in warmem Kulturmedium gewaschen, um die DMSO vor Resuspendieren in 10 ml frisches Kulturmedium zu entfernen. Die Zellen werden für mindestens 72 h vor der anschließenden Passage kultiviert.
6. Repräsentative Ergebnisse
Ein ATM - / - T-Zell-Linie entwickelt, die dieses Protokoll verwenden, und bezeichnet DWJ-ATM-1 wurde durch Färbung mit anti-CD3-FITC, anti-CD4-APC und anti-CD8-PE und Durchflusszytometrie (Abbildung 1) aus. Mehr als 90% der T-Zellen wurden CD3, CD4-und CD8-Triple-positiv.
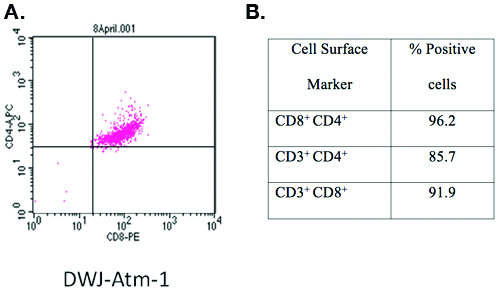
Abbildung 1. Charakterisierung eines T-Zell-Linie entwickelt, die dieses Protokoll verwenden.
Die Zelloberflächenmarker eines etablierten Atm - / --Zelllinie bezeichnet DWJ-ATM-1 durch Färbung mit geprägt waren anti-CD3-FITC, anti-CD4-APC, anti-CD8-PE und Durchflusszytometrie. Kurz gesagt, wurden 1x10 6 frische Zellen einmal mit kaltem PBS (1500 rpm / 5 min) gewaschen und bei 4 ° C für 10 min mit 200 ul Antikörper-Cocktail (jeder Antikörper bei 1:200-Verdünnung in PBS mit 1% BSA. Die Zellen können sofort untersucht werden, während frisch oder fixiert für eine spätere Analyse. fixierten Zellen durch Zugabe von neutral gepuffertem Formalin bei 4% (vol / vol) Endkonzentration bereit sind und über Nacht bei 4 ° C für 30 min, durch Zentrifugation geerntet (1500 rpm / 5 min) und erneut in 200 ul PBS mit 1% BSA. Insgesamt 1 X 10 4 Zellen wurden unter Verwendung eines BD FACS Calibur Analysator und CellQuest Software (BD Biosciences, San Jose, CA) analysiert.
Diskussion
In diesem Protokoll, bieten wir detaillierte Verfahren, um murine T-Zell-Linien aus zwei verschiedenen Maus-Genotypen zu schaffen; Atm - / - [FVB/N- Atm tm1Led / J] und p53 - / - [129/S6- Trp53 tm1Tyj / J] . Durch dieses Protokoll verwenden, insgesamt 6 (von 7 Versuche) Atm - / - und drei (von 5 Versuche) p53 - / - Maus T-Zell-Linien haben in unserem Labor etabliert. Repräsentative Daten zeigen, dass Zelllinie DWJ-ATM-1, ein ATM - / - Zelllinie besteht aus einer Zellpopulation, in denen mehr als 90% der Zellen exprimieren CD3, CD4 und CD8 Oberflächenmarker bestätigen, dass klonale T-Zell-Linie kann gegründet mit unserem Protokoll.
Entwicklung von murinen T-Zell-Linien wurde 3,6,7 gemeldet, aber detaillierte Protokolle für die Festlegung dieser Linien haben bisher nicht beschrieben worden. Obwohl nur zwei Maus-Genotypen für die Ableitung von murinen T-Zell-Linien in unserem Labor verwendet wurden, glauben wir, dass diese Verfahren für eine breite Palette von spontanen T-Zell-Lymphome in andere Stämme von Mäusen wie Kras defekt gefunden werden, und möglicherweise andere Tierarten. Murine T-Zell-Linien haben potentielle Anwendungen in das Verständnis grundlegender Fragen in der Immunologie und Onkologie. Derzeit sind wir mit diesen Zelllinien in Studien zur Charakterisierung Wirt-Pathogen-Interaktionen und genotoxische Wirkung Zytotoxizität einschließlich Mechanismen der Zellzyklus und Apoptose abzielen. Da die murine T-Zell-Linien genomischen Veränderungen wie Deletionen von PTEN und FBXW7 gemeinsam mit akuten menschlichen T-Zell-lymphoblastische Leukämien und Lymphomen zu teilen, sind sie besonders gut für die Forschung in Krebsbiologie 8 geeignet und kann weitere Anwendungen für die schnelle Pre haben -klinische Wirksamkeit Screening von immunologischen und Zytostatika in vitro. Ob diese Zelllinien in vivo propagiert werden kann entweder in syngenen oder immungeschwächten Mäusen wurde nicht bestimmt.
Im Gegensatz zu früheren Protokollen, in denen erfolgreiche Etablierung eines T-Zell-Linie nahm bis zu drei Monaten 6, Zell-Linien entwickelt mit dem aktuellen Protokoll wurden innerhalb eines Monats festgestellt (zwischen Passage 2-8). Wir fanden, dass das Vorhandensein von lose anhaftenden Zellaggregate über befestigt Stromazellen einer kritischen frühen Anzeichen eines etablierten Zelllinie ist. Damit murine T-Zellen auf unbestimmte Zeit zu propagieren, haben wir auch festgestellt, dass es wichtig ist, die erste lose anhaftende Zellaggregate ungestört während des Fütterns zu verlassen. Darüber hinaus erhalten die Zelldichte in einer Konzentration von etwa 3x10 6 / ml in den ersten Passagen fördert auch die erfolgreiche Etablierung eines kontinuierlichen Zelllinie. In unserer Erfahrung, maximiert Kultivieren von Zellen in verschiedenen Dichten mit verschiedenen Arten von Kulturgefäße die Wahrscheinlichkeit der Schaffung einer T-Zell-Linie. Die meisten T-Zell-Linien wurden von T-75 Flaschen oder 6-Well-Platten und 10 oder 100 fache Verdünnungen, die auf ca. 1x10 7 oder 1x10 6 Zellen / ml entsprechen etabliert. Eine vorherige Protokoll empfohlen Kultivieren von Zellen bei 5 x 10 6, 1 x10 7 und 2 x 10 7 Zellen pro Well in 6-well Platten und Fütterung nach 7 Tagen (7). Wir beobachteten, dass die Fütterung ersten Kulturen bei 48 h und 72 h Durchgang später, am Tag 5 ist optimal. Warten mehr vor der ersten Fütterung und Passage führt dazu, dass die Zellen ihre Lebensfähigkeit verlieren und sich zu teilen.
Der letzte Parameter, die wir gefunden ist entscheidend für die erfolgreiche Vermehrung von murinen T-Zellen in vitro ist die Anwesenheit von FBS im Kulturmedium, die eine schnelle Zellwachstum unterstützen kann. Verschiedenen Lose und Lieferanten von FBS sollten vor Beginn der Ableitung von T-Zell-Linien für die Identifizierung eines geeigneten Reagenz zu sehen sein. Wenn murine T-Zell-Linien sind nicht für das Screening zur Verfügung, primären Kulturen von Thymus-Lymphozyten in die Vertiefungen einer 24-Well-Platte in einer Konzentration von 1x10 6 pro ml Testmedium mit Concanavalin A (1 g / mL), um eine schnelle Zellwachstum stimulieren platziert ausreichend ist. In Anwesenheit einer optimalen Quelle der FBS, sollte die Anzahl der Zellen verdoppelt sich alle 18 bis 24 h.
Offenlegungen
Danksagungen
Die Autoren möchten sich Dr. Boris Reizis von der Abteilung für Mikrobiologie und Immunologie an der Columbia University danken für hilfreiche Diskussionen. Wir möchten auch Dr. Margaret Bynoe, Dr. Rodman Getchell und Deequa Mahamed vom Department of Microbiology and Immunology danken an der College of Veterinary Medicine, Cornell University für die technische Unterstützung bei der Durchflusszytometrie und Lu Huang für die Unterstützung bei Videobearbeitung. Die Autoren wollen auch die Mitglieder des Duhamel und Weiss Labors für die kritische Durchsicht des Manuskripts und Video-Produktion, und Stephanie Yazinski danken aus dem Weiss-Labor für die Zucht und Genotypisierung p53 - / - Mäusen. Tierversuche wurden in Übereinstimmung mit den Richtlinien und Vorschriften her von der Cornell University Institutional Animal Care und Verwenden Ausschusses durchgeführt. Diese Arbeit wurde teilweise durch Mittel von der US Department of Agriculture, Cooperative State Research, Education, and Extension Service, Animal Health and Disease Research Program (um GED und RSW) und NIH gewährt R03 HD058220 und R01CA108773 (zum RSW) zur Verfügung gestellt unterstützt. Das Video wurde unter Verwendung von in-house Einrichtungen durch das Personal aus dem Duhamel & Weiss Labors.
Materialien
- Kühler
- 70% Ethanol
- Dissection Pad aus Schaumstoff-Block mit Aluminiumfolie abgedeckt und Stifte
- Zwei Sätze von kleinen sterilen Schere und Pinzette
- Sterile 150 mm 2 Petrischale (Thermo Fisher Scientific, Waltham, MA;. Cat # 08-757-13)
- Sterile 18-Gauge-Nadel
- 50 ml konische Röhrchen (Corning Inc., Corning NY, cat # 430829)
- 10% gepuffertem Formalin
- Zellkulturflaschen
- T-25 (TPP, Trasadingen, Schweiz; cat # 90025)
- T-75 (TPP, Trasadingen, Schweiz; cat # 90075)
- 6-well-Platten (Corning Inc., Corning NY, cat # 3506)
- Sterile Phosphat-gepufferter Kochsalzlösung pH 7,2 (PBS)
- Nährboden
- RPMI 1640 mit 25 mM HEPES, 200 mM L-Glutamin (Lonza, Walkersville, MD; cat # 12-115F) mit den folgenden ergänzt:
- 10% hitzeinaktiviertem (56 ° C, 30 min) fötalem Rinderserum (FBS; Hyclone, Logan, UT, cat # SH30088.03)
- 1% Penicillin und Streptomycin (Mediatech, Manassas, VA; cat # 30-002-CI)
- 1% nicht-essentiellen Aminosäuren (Mediatech; cat # 25-025-CI)
- 55 mM 2β-Mercaptoethanol (Sigma, St Louis, MO, cat # M752)
- RPMI 1640 mit 25 mM HEPES, 200 mM L-Glutamin (Lonza, Walkersville, MD; cat # 12-115F) mit den folgenden ergänzt:
- Dimethylsulfoxid (DMSO; Calbiochem, La Jolla, CA, cat # 317275)
- Antikörper (eBioscience, San Diego, CA)
- anti-CD3-FITC (Kat. # 11-0031-85)
- anti-CD4-APC (Kat. # 17-0041-83)
- anti-CD8-PE (Kat. # 12-081-85)
- Rinderserumalbumin (BSA; Life Technologies, Grand Island, NY;. Cat # 11018-017)
- Concanavalin A (Sigma cat # C5275)
- 1,8 ml Einfrierröhrchen (Nunc, Roskilde, Dänemark, cat # 368632)
Referenzen
- Barlow, C. Atm-deficient mice: a paradigm of ataxia telangiectasia. Cell. 86, 159-171 (1996).
- Elson, A. Pleiotropic defects in ataxia-telangiectasia protein-deficient mice. Proc Natl Acad Sci U S A. 93, 13084-13089 (1996).
- Kuang, X. Control of Atm-/- thymic lymphoma cell proliferation in vitro and in vivo by dexamethasone. Cancer Chemother Pharmacol. 55, 203-212 (2005).
- Browne, S. E. Treatment with a catalytic antioxidant corrects the neurobehavioral defect in ataxia-telangiectasia mice. Free Radic Biol Med. 36, 938-942 (2004).
- Jacks, T. Tumor spectrum analysis in p53-mutant mice. Curr Biol. 4, 1-7 (1994).
- Chervinsky, D. S., Lam, D. H., Zhao, X. F., Melman, M. P., Aplan, P. D. Development and characterization of T cell leukemia cell lines established from SCL/LMO1 double transgenic mice. Leukemia. 15, 141-147 (2001).
- Sharma, V. M. Notch1 contributes to mouse T-cell leukemia by directly inducing the expression of c-myc. Mol Cell Biol. 26, 8022-8031 (2006).
- Maser, R. S. Chromosomally unstable mouse tumours have genomic alterations similar to diverse human cancers. Nature. 447, 966-971 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten