Mesures électrochimiques d'un catalyseur sur support à l'aide d'un potentiostat / galvanostat
Vue d'ensemble
Source : Laboratoire de Dr. Yuriy Román, Massachusetts Institute of Technology
Un potentiostat/galvanostat (souvent dénommée simplement un potentiostat) est un instrument qui mesure actuelle à un potentiel appliqué (opération potentiostatique) ou des mesures potentielles à un courant appliqué (opération galvanostatique) (Figure 1). C’est l’instrument le plus couramment utilisé dans la caractérisation électrochimique des matériaux de l’anode et la cathode pour piles à combustible, électrolyseurs, batteries et supercapacités.
Classiquement, ces matériaux d’anode et la cathode est interfacé avec un potentiostat via une cellule électrochimique de trois électrodes. Les fils des électrodes de la potentiostat sont connectés à l’électrode de référence, la contre-électrode (souvent appelé l’électrode auxiliaire) et l’électrode de travail (qui contient le matériel de test d’intérêt). La cellule électrochimique est ensuite remplie avec une solution d’électrolyte de force ionique élevée, telle qu’une solution acide, alcaline ou sel. Les médias pour cette solution de force ionique élevée sont généralement aqueuse ; Toutefois, pour les applications nécessitant plus d’exploitation windows potentiels cellulaires, tels que des batteries et supercapacités, non aqueux, est souvent utilisé. Les médias de la cellule sont dégazé avec un gaz inerte (pour éviter les réactions secondaires indésirables) ou avec un gaz d’essai (si l’essai la réaction implique un gaz dans l’une des électrodes).
Alternativement, un pont salin ou une membrane sert à maintenir le contact ionique si les deux demi de cellules doivent être mesurées en différents électrolytes. Dans électrocatalyse hétérogène, ce type de cellule « deux compartiments » est souvent utilisé si la molécule de test à l’électrode de travail est également réactive à la contre-électrode. Cela arrive fréquemment que la contre-électrode généralement employée est de platine, qui est un catalyseur très actif de nombreuses réactions. Ici, les cellules dans un compartiment unique est utilisés, où tous les trois électrodes sont dans le même support.
Cette vidéo vous expliquera le processus de polissage d’une électrode de travail, préparer une encre de catalyseur, fixation de l’encre de catalyseur sur l’électrode de travail, préparer la cellule électrochimique et effectuer ensuite des mesures électrochimiques. Les mesures effectuées comprennent : voltampérométrie cyclique (CV), voltamétrie à balayage linéaire (LSV), chronopotentiométrie (CP) et la chronoampérométrie (CA).
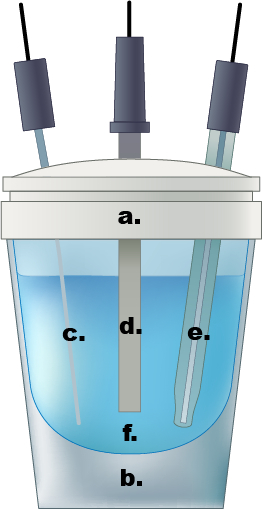
Figure 1. Un exemple d’une cellule électrochimique de compartiment unique. bouchon Teflon a.), b.) verre cellulaire, c.) PT fils contre-électrode, d.) électrode de travail, e.) Électrode de référence Ag/AgCl, f.) 0,5 solution d’électrolyte de l’acide sulfurique aqueux M.
Principles
Le potentiostat peut être utilisé pour appliquer une constante anodique ou cathodique potentiel à l’électrode de travail et de mesurer le courant anodique ou cathodique qui en résulte (chronoamperométrie) ou le potentiostat peut être exploités de façon via une boucle de rétroaction contrôle et appliquer un courant anodique ou cathodique constant avec le potentiel mesuré variant avec le temps de maintenir cela s’applique actuel (chronopotentiométrie). Sinon, espace potentiel peut être exploré avec le temps à l’aide de voltampérométrie cyclique ou voltamétrie à balayage linéaire pour mesurer le potentiel anodique et cathodique par rapport à une vitesse de balayage potentiel appliqué (la dérivée du potentiel en fonction du temps).
Dans toutes ces techniques, même pendant le travail galvanostatique, le potentiostat contrôle du potentiel appliqué et mesure le flux d’électrons de (à) l’électrode de travail à (de) la contre-électrode lorsque l’électrode de travail agit comme l’anode (cathode). Le potentiel appliqué est référencé contre l’électrode de référence, qui contient un système d’oxydoréduction (par exemple, une électrode de chlorure d’argent ou de l’électrode au calomel saturée) avec un potentiel connu et stable qui est interfacé avec la solution d’électrolyte via une fritté poreuse. En fonctionnement normal, le potentiostat dessine un courant négligeable mais non nuls, par le biais de l’électrode de référence ainsi qu’un potentiel exact peut être appliqué à l’électrode de travail. Alors que le potentiostat mesure le flux d’électrons ou de réaction de moitié à l’autre, la solution d’électrolyte termine le circuit en empêchant l’accumulation de la charge à l’anode ou la cathode.
Procédure
1. catalyseur encre et préparation de l’électrode de travail
Consignes de sécurité : Métaux pris en charge sur le noir de carbone peuvent être aspirés dans une enceinte de hood ou équilibre de fumée jusqu'à ce qu’il soit sous forme de suspension que ces poudres sont des dangers de l’inhalation.
- À l’aide d’une balance ci-joint, peser 5 à 10 mg de catalyseur métal/noir de carbone et ajouter un flacon en verre avec un bouchon.
- À l’aide d’une micropipette, diluer le catalyseur avec de l’eau telle que la concentration finale est de 7,5 mg de catalyseur par mL d’eau.
- Tandis que la sonification, 100 µL de solution Nafion 117 / mL de l’eau est ajoutée à la suspension.
- L’encre doit être soniquée pendant au moins 10 min assurer la dispersion uniforme et mélange de l’appui de noir de carbone avec l’agent liant complet.
- Alors que l’encre est sonification, une électrode à disque 3 mm carbone vitreux Nettoyez et polie par le frottement dans un mouvement circulaire qui tournoie sur un tampon doux alumine recouverte de 0,05 solution d’alumine µm. Il puis rincer abondamment à l’eau pour enlever l’alumine.
- Ensuite, 7 µL d’encre est dégoutté sur une électrode à disque carbone vitreux brillant, orientés verticalement 3 mm. L’électrode de travail est ensuite séché à 80 ° c pendant 1 h si le catalyseur est stable à l’air ou évaporé sous un vide faible pendant 30 min si le catalyseur est sensible à air.
2. cellule électrochimique préparation
Consignes de sécurité : Gants, blouse et lunettes de sécurité doivent être portés en permanence, mais est surtout primordiale pour travailler avec la solution d’acide sulfurique. Si des gouttes de solution se renverse sur les poignets, il doit être lavé avec du savon et l’eau pendant 15 minutes. Pour les grands déversements, enlever les vêtements contaminés et l’utilisation de la douche oculaire ou douches doivent servir pendant 15 min, suivie d’une consultation médicale. Les fils électriques ne devraient pas être touchés une fois placé dans la cellule électrochimique.
- Une cellule de verre est remplie avec 10 mL de 0,5 M H2SO4 et dégazé pendant au moins 30 minutes avec un courant d’azote ultra haute pureté
- Les bouchons de téflon des cellules électrochimiques ont 3 ports pour l’électrode de travail contre-électrode et l’électrode de référence
- L’électrode de référence Ag/AgCl est retiré de sa solution de KCl 1 M, rincée avec l’eau distillée et ensuite placée dans la cellule.
- La contre-électrode de fil de platine platiné est rincée avec l’eau distillée et ensuite placée dans la cellule.
- L’électrode de travail séché est rincé à l’eau distillée et ensuite placée dans la cellule.
- Le potentiostat est activée.
- Le plomb de l’électrode blanche est relié à l’abord et connecté à l’électrode de référence.
- Le plomb de l’électrode rouge est ensuite connecté à l’électrode de compteur de fil de Pt.
- Le plomb de l’électrode verte est alors connecté à l’électrode de travail du métal/noir de carbone.
- Un petit ruisseau de purge2 N est laissé bouillonner continuellement dans l’électrolyte.
- Assurer aucune piste ne se touchent et qu’il n’y a pas de contact électrique direct entre les 3 électrodes autrement qu’avec les 0,5 M H2SO4 électrolyte.
3. analyse électrochimique
- Après avoir activé le potentiostat, effectuer au moins 20 conditionnement cycles entre 0 et 0,4 V vs RHE à 50 mV/s à l’aide de CV. Cela est possible en choisissant des CV en tant que technique et en entrant le potentiel supérieur et inférieur limite ainsi que la vitesse de balayage.
- Voltamétrie à balayage linéaire (LSV) est possible alors en choisissant LSV comme technique et en spécifiant un départ potentiel, un potentiel final et une vitesse de balayage. La vitesse de balayage pour LSV est généralement beaucoup moins que les CV, généralement 1 à 2 mV/s afin que les courants capacitifs deviennent beaucoup plus faibles que les courants dus aux réactions de surface faradique
- Chronoampérométrie (CA) s’effectue en choisissant CA ou « Courbe de i-t ampérométrique » comme une technique et en spécifiant le potentiel fixe ainsi que la durée de l’instrument devrait tenir l’électrode de travail comme ce potentiel fixe.
- Chronopotentiométrie (CP) est effectuée en choisissant CP comme technique. CP peut être effectuée par une série d’étapes actuelles lorsqu’un courant est spécifiée pour un certain laps de temps, suivie d’un nouveau courant pour une période de temps déterminée. Ces courants appliqués peuvent s’étendre sur des courants anodiques et cathodiques au sein de la même mesure de CP.
- Lorsque l’analyse électrochimique est terminé, éteignez le potentiostat.
- Déconnectez les câbles d’électrode et stockez-les dans un endroit sec loin des liquides pour prévenir la corrosion.
- Enlever l’électrode de référence et rincer abondamment avec de l’eau distillée. Puis retourner l’électrode de référence directement à sa solution de stockage de 1 M KCl. La pointe de cette électrode ne devrait jamais être autorisée à s’assèchent.
- Retirez la contre-électrode fils de Pt et rincer abondamment à l’eau distillée
- Enlever l’électrode de travail et rincer abondamment à l’eau distillée et ensuite utiliser un Kimwipe avec de l’acétone pour retirer facilement l’encre séchée de catalyseur de la surface de l’électrode de travail. Il est recommandé pour polir les électrodes immédiatement après utilisation.
- Désactiver la purge de2 N.
- Vider l’électrolyte utilisé dans un conteneur à déchets d’acide. Rincez le verre cellulaire et le cap de téflon abondamment avec de l’eau distillée.
Résultats
Cette procédure se traduira en chiffres contenant des parcelles du courant mesuré vs potentiel pour chacun des quatre techniques. Par convention de CV et LSV, les parcelles seront également produits dans le courant mesuré vs potentiel malgré la réalité que ce sont des techniques transitoires que mesurent le courants par rapport à la dérivée temporelle du potentiel.
Applications et Résumé
CV, LSV, CP et CA sont des techniques indispensables pour déterminer l’efficacité de nouveaux matériaux d’électrode pour les piles à combustible, électrolyseurs, batteries et supercapacités ainsi que pour développer les domaines tels que l’oxydation partielle sélective ou la réduction des produits chimiques. Ces méthodes permettent de déterminer les experiences de réactions sur les matériaux d’électrodes différentes par rapport à leur potentiel d’équilibre thermodynamique. Ces méthodes permettent en outre la capacité volumétrique ou gravimétrique des supercondensateurs à déterminer. De même, les taux de charge/décharge des électrodes de batteries ou supercondensateurs peuvent être déterminées avec ces techniques. Ces techniques permettent également la caractérisation de la stabilité électrochimique des matériaux à déterminer. Au-delà de ces techniques de base, des techniques plus avancées comprennent la combinaison des techniques potentiométriques avec méthodes in situ comme IR et spectrométrie de masse.
Passer à...
Vidéos de cette collection:

Now Playing
Mesures électrochimiques d'un catalyseur sur support à l'aide d'un potentiostat / galvanostat
Analytical Chemistry
51.3K Vues

Préparation des échantillons pour analyse
Analytical Chemistry
84.3K Vues

Étalon interne
Analytical Chemistry
204.4K Vues

Méthode de l'addition standard
Analytical Chemistry
319.4K Vues

Courbes d'étalonnage
Analytical Chemistry
794.8K Vues

Spectroscopie ultraviolet-visible (UV-Vis)
Analytical Chemistry
621.9K Vues

La spectroscopie Raman pour l'analyse chimique
Analytical Chemistry
51.0K Vues

Spectrométrie de fluorescence des rayons X
Analytical Chemistry
25.3K Vues

Chromatographie en phase gazeuse (CG) couplée à un détecteur à ionisation de flamme
Analytical Chemistry
281.1K Vues

La chromatographie en phase liquide à haute performance (CLHP)
Analytical Chemistry
383.1K Vues

Chromatographie par échange d'ions
Analytical Chemistry
263.9K Vues

Électrophorèse capillaire (EC)
Analytical Chemistry
93.4K Vues

Introduction à la spectrométrie de masse
Analytical Chemistry
112.0K Vues

Microscopie électronique à balayage (MEB)
Analytical Chemistry
86.8K Vues

Voltammétrie cyclique
Analytical Chemistry
124.3K Vues