Usando um medidor de pH
Visão Geral
Fonte: Laboratório do Dr. Zhongqi He - Departamento de Agricultura dos Estados Unidos
Ácidos e bases são substâncias capazes de doar prótons (H+) e íons hidróxido (OH- ),respectivamente. São dois extremos que descrevem produtos químicos. Misturar ácidos e bases pode cancelar ou neutralizar seus efeitos extremos. Uma substância que não é ácida nem básica é neutra. Os valores de concentração de prótons ([H+]) para a maioria das soluções são inconvenientemente pequenos e difíceis de comparar para que uma quantidade mais prática, pH, tenha sido introduzida. pH foi originalmente definido como o logaritmo decimal da recíproca da concentração molar de prótons,  mas foi atualizado para o logaritmo decimal do recíproco da atividade de íons de
mas foi atualizado para o logaritmo decimal do recíproco da atividade de íons de 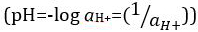 hidrogênio. A primeira definição é agora ocasionalmente expressa como p[H]. A diferença entre p[H] e pH é bastante pequena. Foi declarado que pH = p[H] + 0,04. É prática comum usar o termo 'pH' para ambos os tipos de medições.
hidrogênio. A primeira definição é agora ocasionalmente expressa como p[H]. A diferença entre p[H] e pH é bastante pequena. Foi declarado que pH = p[H] + 0,04. É prática comum usar o termo 'pH' para ambos os tipos de medições.
A escala de pH normalmente varia de 0 a 14. Para uma solução de 1 M de ácido forte, pH=0 e para uma solução de 1 M de base forte, pH=14. Assim, os valores de pH medidos estarão principalmente na faixa de 0 a 14, embora valores fora dessa faixa sejam inteiramente possíveis. A água pura é neutra com pH=7. Um pH menor que 7 é ácido, e um pH maior que 7 é básico. Como a escala de pH é logarítmica, o pH é uma quantidade inafundada. Cada valor de pH inteiro abaixo de 7 é 10x mais ácido do que o próximo inteiro. Por exemplo, um pH de 4 é 10x mais ácido do que um pH de 5 e 100x (10 x 10) mais ácido do que um pH de 6. O mesmo vale para valores de pH acima de 7, cada um dos quais é 10x mais básico (ou alcalino) do que o próximo valor total mais baixo. Por exemplo, um pH de 10 é 10x mais básico que um pH de 9.
Princípios
O pH de uma solução pode ser precisamente e facilmente determinado por medidas eletroquímicas com um dispositivo conhecido como medidor de pH com um eletrodo sensível ao pH (geralmente vidro) e um eletrodo de referência (geralmente cloreto de prata ou calomel). Idealmente, o potencial do eletrodo, E, para o próton pode ser escrito como

onde E é um potencial medido, E0 é o potencial de eletrodo padrão em umH+= 1 mol/L, R é a constante do gás, T é a temperatura em kelvin, F é a constante faraday.
O eletrodo pH utiliza um vidro especialmente formulado, sensível ao pH, em contato com a solução, que desenvolve o potencial (E)proporcional ao pH da solução. O eletrodo de referência foi projetado para manter um potencial constante a qualquer temperatura, e serve para completar o circuito de medição de pH dentro da solução. Ele fornece um potencial de referência conhecido para o eletrodo pH. A diferença nos potenciais do pH e dos eletrodos de referência fornece um sinal milivolt (mV) proporcional ao pH. Na prática, um eletrodo de vidro combinado tem um eletrodo de referência embutido. É calibrado contra soluções tampão da atividade de íons de hidrogênio conhecido. A maioria dos sensores de pH são projetados para produzir um sinal de 0-mV a 7,0 pH, com uma inclinação (teoricamente ideal), ou sensibilidade, de -59,16 mV / pH a 25 °C. Duas ou mais soluções tampão são usadas para acomodar o fato de que a "inclinação" pode diferir ligeiramente do ideal. As soluções de buffer padrão comercial geralmente vêm com informações sobre o valor do pH a 25 °C e um fator de correção a ser aplicado para outras temperaturas.
Procedimento
1. pH Calibração
- Ligue a energia do medidor pressionando o botão "power".
- Conecte a sonda de compensação automática de temperatura (ATC) se estiver disponível e/ou não estiver com o eletrodo.
- Verifique se o modo de medição é pH. Caso não, pressione o botão "MODE" até que o modo "pH" apareça no visor LCD.
- Consulte o guia de referência rápido na parte inferior do medidor ou nas proximidades para obter ajuda, se necessário.
- Use sempre tampões pH frescos, não utilizados e não expirados para calibração. Os buffers devem estar na mesma temperatura das soluções de teste.
- Enxágüe o eletrodo pH com água destilada e, em seguida, com o tampão sendo usado para calibração (ou seja,pH 7,00).
- Mergulhe o eletrodo pH em um tampão de pH neutro (ou seja,pH 7,00). Mexa o tampão com uma barra magnética (a uma taxa moderada para ~30 s) para obter melhores resultados.
- Pressione o botão "CAL/MEAS" (calibração [ou padronização]/easurement) para selecionar a função 'calibração (padronização)'. Defina o valor do pH do buffer no visor do medidor para 7,00.
- Quando a "leitura" estiver estável, pressione o botão "ENTER" para aceitar. A leitura primária piscará brevemente antes que o display secundário comece a rolar pelos buffers disponíveis restantes.
- Enxágüe o eletrodo pH com água destilada e, em seguida, com o tampão a ser usado para a próxima calibração (ou seja,pH 4.01).
- Mergulhe o eletrodo pH no próximo buffer de pH 4.01. O visor do medidor deve ser bloqueado no valor do buffer.
- Quando a "leitura" estiver estável, pressione "ENTER" para aceitar. A leitura primária piscará brevemente e exibirá a porcentagem de eficiência (inclinação) antes que o display secundário comece a rolar pelos buffers restantes disponíveis.
- Repita as etapas 2.2-2.7 para calibrar o tampão pH 10.01.
- O medidor retornará automaticamente ao modo de medição após a conclusão bem sucedida da calibração de 3 pontos.
Notas: (1) Os buffers padrão de pH 4.01 e 10.01 podem ser substituídos por outros buffers apropriados de acordo com a gama de pH das amostras de teste. (2) Para uma calibração única (neutra)-, ou de 2 pontos, pressione o botão "CAL/MEAS" para retornar às medições após a conclusão da calibração. (3) Pode ser utilizada a calibração com mais de 3 pontos para medições mais precisas. (4) Recomenda-se realizar a calibração no início de cada dia. Para um trabalho muito preciso, o medidor de pH deve ser calibrado antes de cada medição. (5) Ajuste manualmente os valores de pH dos buffers se a temperatura difere da temperatura ambiente padrão e nenhuma sonda ATC estiver anexada.
2. medidas de pH
- Confirme se o medidor está no modo de medição de pH.
- Enxágue completamente o eletrodo de pH entre as medidas com água destilada para evitar a contaminação das soluções testadas. Limpe suavemente o eletrodo em um tecido de limpeza de laboratório para remover o excesso de água enxágue. Não esfregue a lâmpada, pois isso pode causar um acúmulo de carga estática. Alternativamente, enxágue o eletrodo com a solução de teste.
- Mergulhe o eletrodo pH em uma solução de teste ou suspensão. Mexa a solução com uma barra magnética (~30 s) com a mesma taxa de agitação para calibrar para melhores resultados.
- O pH é concluído quando a leitura de pH é estável.
- Se necessário e disponível, pressione o botão "HOLD" para congelar a leitura medida. Pressione novamente para retomar a leitura ao vivo.
- Registo o valor do pH (e temperatura, se necessário) anotando ou pressionando o botão "MEMORY" (se aplicável) para armazenar o valor na memória.
- Repita as etapas 3.2-3.6 para várias medidas.
- Enxágue completamente e armazene o eletrodo na solução de armazenamento assim que todas as medidas forem concluídas.
Notas: (1) O tempo de resposta do teste de pH em cada buffer não deve ser superior a 60 s, mas pode ser mais longo para algumas soluções/chorumes de teste. (2) A sonda de eletrodo deve ser limpa usando a solução de limpeza pH-eletrodo uma vez por mês ou quando estiver suja. Uma solução de 0,1 M HCl pode ser usada para limpeza geral. Detergente líquido diluído e alvejante doméstico podem ser usados para limpar graxas e contaminações bacterianas. No entanto, para evitar problemas inesperados, a melhor prática é sempre consultar as recomendações do fabricante de eletrodos. (3) A lâmpada de eletrodo de pH deve estar sempre úmida. Mantenha-o na solução de armazenamento de eletrodos que vem com o eletrodo. Use a solução de buffer pH 4 se não houver solução de armazenamento disponível. Use a solução de buffer pH 7 por um curto período de tempo se nenhum deles estiver disponível.
Resultados
A Figura 1 mostra o pH dos solos agrícolas impactados pelo manejo do cultivo e irrigação das águas subterrâneas. Estas amostras de solo foram coletadas de 5 campos de batata sob diferentes práticas de rotação de cultivo com ou sem irrigação de águas subterrâneas. O pH mais baixo é observado em solos do Campo 4 em séries irrigadas por chuvas e águas subterrâneas. A irrigação de águas subterrâneas aumentou consistentemente o pH do solo em todos os 5 campos. As informações de pH são essenciais para a recomendação de liming os campos de batata adequadamente para promover o crescimento ideal.
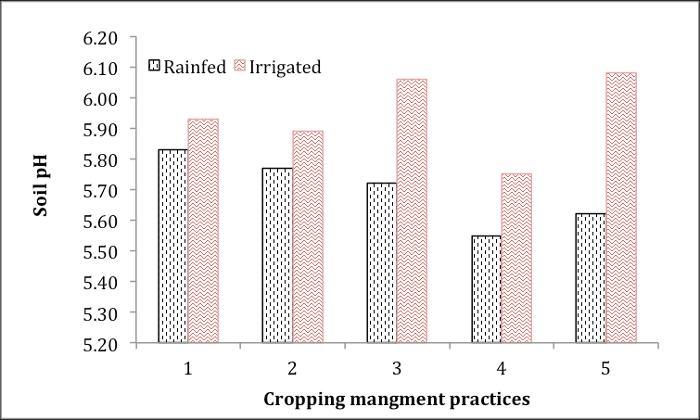
Figura 1. PH de solo de campos de batata sob diferentes práticas de manejo de cultivo com ou sem irrigação subaquática.
Aplicação e Resumo
pH é um dos parâmetros químicos mais medidos de soluções aquosas. É um parâmetro crítico no tratamento de água e esgoto para aplicações municipais e industriais, produção química, pesquisa agrícola e produção. Também é fundamental no monitoramento ambiental, pesquisa química e de ciências da vida, pesquisa bioquímica e farmacêutica, produção eletrônica e muitas outras aplicações. A Figura 2 lista valores de pH de algumas substâncias comuns.
A água pura é neutra, com um pH de 7,00. Quando os produtos químicos são misturados com água, a mistura pode se tornar ácida ou básica. Vinagre e suco de limão são substâncias ácidas, enquanto detergentes de lavanderia e amônia são básicos. Produtos químicos muito básicos ou muito ácidos são considerados "reativos". Esses produtos químicos podem causar queimaduras graves. O ácido da bateria do automóvel é um produto químico ácido que é reativo. As baterias do automóvel contêm uma forma mais forte de um dos ácidos encontrados na chuva ácida. Os limpadores de ralo domésticos geralmente contêm lye, um produto químico muito alcalino que também é reativo.
Em sistemas vivos, o pH de diferentes compartimentos celulares, fluidos corporais e órgãos é geralmente fortemente regulado em um processo chamado homeostase de base ácida. O pH de sangue é geralmente ligeiramente básico com um valor de pH 7.365. Esse valor é frequentemente referido como pH fisiológico em biologia e medicina. A placa pode criar um ambiente ácido local que pode resultar em cárie dentária por desmineralização. Enzimas e outras proteínas têm uma gama de pH ideal e podem ficar inativadas ou desnaturadas fora desta faixa.

Figura 2. A escala de pH e os valores de pH de alguns itens comuns.
Pular para...
Vídeos desta coleção:

Now Playing
Usando um medidor de pH
General Chemistry
344.2K Visualizações

Vidraria de laboratório comuns e seus usos
General Chemistry
653.2K Visualizações

Soluções e Concentrações
General Chemistry
273.0K Visualizações

Determinando a densidade de um sólido e um líquido
General Chemistry
554.7K Visualizações

Determinação de composição percentual em massa em uma solução aquosa
General Chemistry
383.0K Visualizações

Determinação da Fórmula Empírica
General Chemistry
179.9K Visualizações

Determinação das Regras de Solubilidade de Compostos Iônicos
General Chemistry
141.1K Visualizações

Introdução à Titulação
General Chemistry
423.3K Visualizações

Lei dos gases ideais
General Chemistry
78.1K Visualizações

Determinação espectrofotométrica de uma constante de equilíbrio
General Chemistry
158.2K Visualizações

Princípio de Le Châtelier
General Chemistry
263.9K Visualizações

Depressão do ponto de congelamento para determinar um composto desconhecido
General Chemistry
160.4K Visualizações

Determinação das Leis de Velocidade e da Ordem de Reação
General Chemistry
195.7K Visualizações

Uso de Calorimetria de Varredura Diferencial para Medir Mudanças na Entalpia
General Chemistry
44.4K Visualizações

Complexos de Química de Coordenação
General Chemistry
91.2K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados