Verwendung eines pH-Meters
Überblick
Quelle: Labor von Dr. Zhongqi He - United States Department of Agriculture
Säuren und Basen sind Stoffe, die Protonen (H+) und Hydroxid-Ionen (OH–), bzw. zu spenden. Sie sind zwei Extreme, die Chemikalien zu beschreiben. Mischen von Säuren und Basen kann aufheben oder ihre extreme Auswirkungen zu neutralisieren. Eine Substanz, die weder sauer noch grundlegende ist neutral. Die Werte der Proton Konzentration ([H]+]) für die meisten Lösungen sind ungünstig klein und schwer zu vergleichen, so dass ein praktischer Menge, pH, wurde eingeführt. pH war ursprünglich definiert als die dezimalen Logarithmus der Kehrwert der molaren Konzentration von Protonen  , aber auf dem dezimalen Logarithmus des der Kehrwert der Wasserstoff-Ionen Aktivität aktualisiert wurde
, aber auf dem dezimalen Logarithmus des der Kehrwert der Wasserstoff-Ionen Aktivität aktualisiert wurde 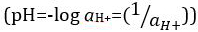 . Die ehemalige Definition wird heute gelegentlich als p [H] ausgedrückt. Der Unterschied zwischen p [H] und pH ist recht klein. Es wurde festgestellt, dass pH = p [H] + 0,04. Es ist üblich, den Begriff "pH" für beide Arten von Messungen zu verwenden.
. Die ehemalige Definition wird heute gelegentlich als p [H] ausgedrückt. Der Unterschied zwischen p [H] und pH ist recht klein. Es wurde festgestellt, dass pH = p [H] + 0,04. Es ist üblich, den Begriff "pH" für beide Arten von Messungen zu verwenden.
Die pH Skala in der Regel reicht von 0 bis 14. Nach einer 1 M Lösung von einer starken Säure pH = 0 und für eine 1 M Lösung eine starke Basis, pH = 14. So werden gemessenen pH-Werte meist im Bereich von 0 bis 14, liegen, obwohl Werte außerhalb dieses Bereichs durchaus möglich sind. Reines Wasser ist neutral mit pH = 7. Einem pH-Wert von weniger als 7 ist sauer, und ein pH-Wert größer als 7 ist einfach. Da die pH-Skala logarithmisch ist, ist pH-Wert eine dimensionslose Quantität. Jedes ganze pH-Wert unter 7 ist 10 X mehr Säure als die nächste ganze Zahl. Zum Beispiel ist ein pH-Wert von 4 10 X mehr Säure als ein pH-Wert von 5 und 100 x (10 x 10) saurer als ein pH-Wert von 6. Das gleiche gilt auch für pH-Werte über 7, von denen jeder 10 x mehr Basic ist (oder alkalisch) als dem nächstniedrigeren ganzen Wert. Zum Beispiel ist ein pH-Wert von 10 10 x mehr Basic als einen pH-Wert von 9.
Grundsätze
Der pH-Wert einer Lösung kann präzise und leicht bestimmt werden durch elektrochemische Messungen mit einer Vorrichtung bekannt als ein pH-Meter mit einem pH-Wert (Proton)-sensible Elektrode (meistens Glas) und einer Referenzelektrode (in der Regel Silberchlorid oder Kalomel). Im Idealfall kann die Elektrode Potenzial, E, für das Proton als geschrieben werden

E eine gemessene Potential, E0 ist die standard Elektrode Potenzial bei einemH += 1 Mol/L, R die Gaskonstante, T ist die Temperatur in Kelvin, F ist die Faraday-Konstante.
Die pH-Elektrode verwendet eine speziell formulierte, pH-empfindliche Glas in Kontakt mit der Lösung, die das Potenzial (E) proportional zu den pH-Wert der Lösung entwickelt. Die Referenzelektrode wurde entwickelt, um eine konstante Potenzial bei einer gegebenen Temperatur beibehalten und dient dazu, den pH-Wert messen Schaltung innerhalb der Lösung abgeschlossen. Freuen Sie sich auf ein bekanntes Bezugspotential für die pH-Elektrode. Der Unterschied in der Potenziale der pH-Wert und Referenz Elektroden liefert ein Millivolt (mV) Signal proportional zum pH. In der Praxis hat eine kombinierte Glaselektrode einen integrierten Bezugselektrode. Es ist gegen Pufferlösungen von bekannten Wasserstoff-Ionen Aktivität kalibriert. Die meisten pH-Sensoren sind entworfen, um ein 0-mV-Signal bei 7,0 pH mit einer (theoretisch ideale) Piste oder Empfindlichkeit der-59.16 produzieren mV / pH bei 25 ° C. Mindestens zwei Pufferlösungen werden verwendet, um der Tatsache Rechnung zu tragen, dass die "Neigung" von Ideal abweichen kann. Kommerzielle standard Pufferlösungen kommen in der Regel mit Informationen auf den pH-Wert bei 25 ° C und einen Korrekturfaktor für andere Temperaturen angewendet werden.
Verfahren
1. pH-Wert Kalibrierung
- Schalten Sie das Messgerät durch Drücken der Taste "Power".
- Legen Sie die automatische Temperatur Kompensation (ATC) Sonde, wenn es verfügbar ist und/oder nicht mit der Elektrode.
- Überprüfen Sie, dass der Messmodus pH-Wert ist. Wenn dies nicht der Fall ist, drücken Sie die Taste "MODE" bis "pH"-Modus auf dem Display angezeigt wird.
- Konsultieren Sie die Kurzanleitung an der Unterseite des Messgeräts oder in der Nähe für Hilfe, wenn nötig.
- Verwenden Sie immer frische, unbenutzte, noch nicht abgelaufenen pH-Puffer für die Kalibrierung. Puffer sollte die gleiche Temperatur wie die Testlösungen.
- Spülen Sie die pH-Elektrode mit destilliertem Wasser und dann mit dem Puffer für die Kalibrierung (d.h., pH 7,00) verwendet wird.
- Tauchen Sie die pH-Elektrode in einen neutralen pH-Puffer (d.h., pH 7,00). Rühren Sie den Puffer mit einer magnetischen Bar (zu einem moderaten Preis für ~ 30 s) für beste Ergebnisse.
- Drücken Sie die "CAL/MEAS" (Kalibrierung [oder Standardisierung] / Easurement)-Taste, um die Kalibrierungsfunktion "(Standardisierung)" wählen. Den Puffer pH-Wert auf die Anzeige um 7.00 Uhr festgelegt.
- Wenn das "lesen" stabil ist, drücken Sie die Taste "ENTER" zu akzeptieren. Die primäre Lesung blinken kurz vor Beginn die sekundäre Anzeige Scrollen durch die verbleibende verfügbare Puffer.
- Spülen Sie die pH-Elektrode mit destilliertem Wasser und dann mit dem Puffer für die nächste Kalibrierung (d.h., pH 4.01) verwendet werden.
- Die pH-Elektrode in die nächste Puffer pH 4.01 eintauchen. Die Anzeige sollte auf der Pufferwert gesperrt werden.
- Wenn das "lesen" stabil ist, drücken Sie "ENTER" zu akzeptieren. Die primäre Lesung wird kurz und anschließend anzeigen Prozent Effizienz (Steigung) vor Beginn die sekundäre Anzeige Scrollen durch die verbleibende verfügbare Puffer.
- Wiederholen Sie die Schritte 2,2-2,7, den pH 10.01-Puffer zu kalibrieren.
- Das Messgerät wird automatisch in den Messmodus nach erfolgreichem Abschluss einer der 3-Punkt-Kalibrierung zurück.
Anmerkungen: (1) die standard-Puffer pH 4.01 und 10.01 können mit anderen geeigneten Puffer pro Test Proben pH-Bereich ersetzt werden. (2) für einen einzigen (Neutral)-, oder 2-Punkt-Kalibrierung, die "CAL/MEAS" drücken, um die Messungen nach Abschluss der Kalibrierung zurück. (3) Kalibrierung mit mehr als 3 Punkte kann für präzisere Messungen verwendet werden. (4) es wird empfohlen, die Kalibrierung zu Beginn eines jeden Tages. Für sehr präzises Arbeiten sollte der pH-Meter vor jeder Messung kalibriert werden. (5) manuell passen Sie die pH-Werte der Puffer an, wenn die Temperatur unterscheidet sich von der standard Raumtemperatur und keine ATC-Sonde befestigt ist.
2. pH Messungen
- Bestätigen Sie, dass das Messgerät auf die pH-Messung-Modus.
- Spülen Sie die pH-Elektrode zwischen den Messungen mit destilliertem Wasser zum Übertrag der getesteten Lösungen zu verhindern. Tupfen Sie die Elektrode an ein Labor Reinigung Gewebe um das überschüssige Wasser zu entfernen. Reiben Sie die Birne nicht, da dies eine statische Aufladung Anhäufung führen kann. Alternativ, spülen Sie die Elektrode mit der Testlösung.
- Tauchen Sie die pH-Elektrode in einer Prüfung Lösung oder Suspension. Rühren Sie die Lösung mit einer magnetischen Bar (~ 30 s) mit der gleichen mitreißenden Rate für Kalibrierung für optimale Ergebnisse zu erzielen.
- Der pH-Wert ist abgeschlossen, wenn der pH-Wert stabil ist.
- Bei Bedarf und zur Verfügung, drücken Sie die Taste "HOLD", den Messwert einzufrieren. Drücken Sie erneut, Lesung wieder aufzunehmen.
- Notieren Sie den pH-Wert (und Temperatur bei Bedarf) durch aufschreiben oder drücken die Taste "MEMORY" (falls zutreffend) zum Speichern des Werts in den Speicher.
- Wiederholen Sie die Schritte 3.2-3.6 für mehrere Messungen.
- Gründlich spülen Sie aus und speichern Sie die Elektrode in Storage-Lösung zu, sobald alle Messungen durchgeführt wurden.
Anmerkungen: (1) die pH-Sonde-Reaktionszeit in den einzelnen Puffern sollte nicht länger als 60 s, kann aber für einige Tests Lösungen/Schlämme länger sein. (2) die Elektrode Sonde mit pH-Elektrode Reinigungslösung einmal im Monat gereinigt werden sollte, oder wenn es schmutzig. Eine 0,1 M HCl-Lösung kann für die allgemeine Reinigung verwendet werden. Verdünnte Reinigungsmittel und Haushalt Bleichmittel können verwendet werden, für die Reinigung von Fett und bakterielle Verunreinigungen. Um unerwartete Probleme zu vermeiden, ist jedoch die beste Praxis bezieht sich immer auf die Elektrode Herstellerempfehlungen. (3) die pH-Elektrode-Lampe sollte stets feucht sein. Bewahren Sie es an die Elektrode-Storage-Lösung, die mit der Elektrode kommt. Verwenden Sie Pufferlösung pH 4, wenn keine Storage-Lösung verfügbar ist. Verwenden Sie Pufferlösung pH 7 für eine kurze Zeit, wenn es keines gibt.
Ergebnisse
Abbildung 1 zeigt den pH-Wert von landwirtschaftlich genutzten Flächen durch Zuschneiden Management und Grundwasser Bewässerung belastet. Diese Bodenproben wurden bei 5 Kartoffelfeldern unter verschiedenen Zuschneiden Drehung Praktiken mit oder ohne Grundwasser Bewässerung entnommen. Der niedrigsten pH-Wert wird in Feld 4 Böden in Rainfed und Grundwasser bewässerten Serie beobachtet. Grundwasser-Bewässerung erhöht konsequent Boden-pH in allen 5 Felder. Die pH-Informationen sind unerlässlich für Empfehlung der Kalkung der Kartoffelfeldern entsprechend, optimales Wachstum zu fördern.
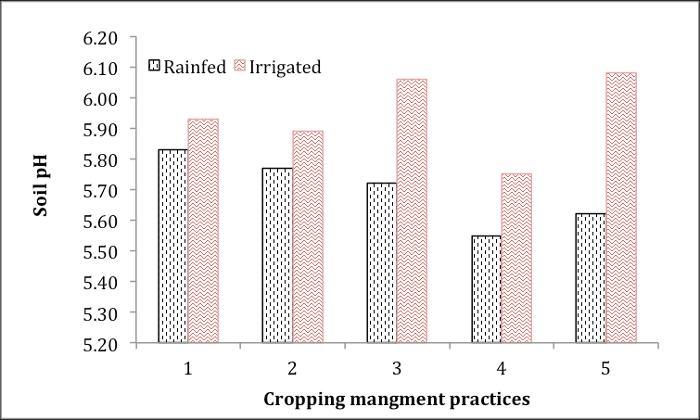
Abbildung 1. Boden-pH von Kartoffelfeldern unter verschiedenen Zuschneiden Managementpraktiken mit oder ohne Unterwasser Bewässerung.
Anwendung und Zusammenfassung
pH ist eines der am häufigsten gemessenen chemische Parameter von wässrigen Lösungen. Es ist ein kritischer Parameter bei Wasser und Abwasser Behandlung für kommunale und industrielle Anwendungen, chemische Produktion, Landwirtschaft Forschung und Produktion. Es ist auch wichtig in biochemischen und pharmazeutischen Forschung, Überwachung, Chemie- und Life Sciences Umweltforschung, Elektronikfertigung und viele weitere Anwendungen. Abbildung 2 listet pH-Werte einiger gemeinsamer Stoffe.
Reines Wasser ist neutral, mit einem pH-Wert von 7,00. Wenn Chemikalien mit Wasser gemischt werden, kann die Mischung entweder saure oder basische geworden. Essig und Zitronensaft sind saure Substanzen, Wasch- und Ammoniak grundlegende. Chemikalien, die sehr einfach oder sehr sauer sind gelten als "reaktiv." Diese Chemikalien können schwere Verbrennungen verursachen. Automobil Batteriesäure ist eine saure Chemikalie, die reaktiv ist. Autobatterien enthalten eine stärkere Form von Säuren in sauren Regen gefunden. Haushalt Abfluss Reiniger enthalten oft Lauge, eine sehr alkalischen Chemikalie, die auch reaktiv ist.
In lebenden Systemen ist der pH-Wert von verschiedenen zellulären Kompartimenten, Körperflüssigkeiten und Organen in einem Prozess namens Säure-Basen-Homöostase in der Regel streng reguliert. Der pH-Wert des Blutes ist in der Regel etwas einfach mit einem Wert von pH 7.365. Dieser Wert wird häufig als physiologischen pH-Wert in Biologie und Medizin bezeichnet. Plaque kann eine saure Umgebung erstellen, die Demineralisation zu Karies führen können. Enzymen und anderen Proteinen können haben einen optimalen pH-Bereich und werden inaktiviert oder denaturiert außerhalb dieses Bereichs.

Abbildung 2. Die pH-Skala und die pH-Werte der einige gemeinsame Elemente.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Verwendung eines pH-Meters
General Chemistry
345.2K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
655.3K Ansichten

Lösungen und Konzentrationen
General Chemistry
273.7K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
555.7K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.3K Ansichten

Ermittlung der Summenformel
General Chemistry
180.7K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.3K Ansichten

Einführung in die Titration
General Chemistry
424.0K Ansichten

Ideale Gasgleichung
General Chemistry
78.3K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.3K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
264.9K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.6K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
195.9K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.4K Ansichten

Komplexchemie
General Chemistry
91.3K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten