שימוש במד pH
Overview
מקור: המעבדה של ד"ר ז'ונגצ'י הוא - משרד החקלאות של ארצות הברית
חומצות ובסיסים הם חומרים המסוגלים לתרום פרוטונים (H+) ויונים הידרוקסיד (OH-), בהתאמה. הם שני קצוות המתארים כימיקלים. ערבוב חומצות ובסיסים יכול לבטל או לנטרל את ההשפעות הקיצוניות שלהם. חומר שאינו חומצי ואינו בסיסי הוא ניטרלי. הערכים של ריכוז פרוטונים ([H+]) עבור רוב הפתרונות הם קטנים באופן לא נוח וקשה להשוות, כך כמות מעשית יותר, pH, הוצגה. pH הוגדר במקור כלוגריתם העשרוני של הריכוז הטוחן של פרוטונים  , אך עודכן לוגריתם עשרוני של ההדדי של פעילות מימן יון
, אך עודכן לוגריתם עשרוני של ההדדי של פעילות מימן יון 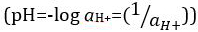 . ההגדרה הקודמת מתבטאת כיום לעתים כ- p[H]. ההבדל בין p [H] ו- pH הוא די קטן. נאמר כי pH = p[H] + 0.04. נהוג להשתמש במונח 'pH' עבור שני סוגי המדידות.
. ההגדרה הקודמת מתבטאת כיום לעתים כ- p[H]. ההבדל בין p [H] ו- pH הוא די קטן. נאמר כי pH = p[H] + 0.04. נהוג להשתמש במונח 'pH' עבור שני סוגי המדידות.
סולם ה- pH נע בדרך כלל בין 0 ל- 14. לתמיסת 1 M של חומצה חזקה, pH =0 ולפתרון של 1 M של בסיס חזק, pH = 14. לפיכך, ערכי pH נמדדים יהיו בעיקר בטווח 0 עד 14, אם כי ערכים מחוץ לטווח זה אפשריים לחלוטין. מים טהורים הם ניטרליים עם pH = 7. חומציות פחות מ-7 היא חומצית, ו-pH גדול מ-7 הוא בסיסי. מכיוון שקנה המידה של ה- pH הוא לוגריתמי, pH הוא כמות ללא ממדים. כל ערך pH שלם מתחת ל-7 הוא פי 10 חומצי יותר מהשלם הבא. לדוגמה, pH של 4 הוא פי 10 יותר חומצי מאשר pH של 5 ו 100x (10 x 10) חומצי יותר מאשר pH של 6. הדבר נכון גם לגבי ערכי pH מעל 7, שכל אחד מהם בסיסי פי 10 (או אלקליין) מהערך השלם הנמוך הבא. לדוגמה, רמת pH של 10 היא פי 10 יותר בסיסית מ- pH של 9.
Principles
ה- pH של פתרון עשוי להיקבע במדויק ובקלות על ידי מדידות אלקטרוכימיות עם מכשיר המכונה מד pH עם אלקטרודה רגישה ל- pH (פרוטון) (בדרך כלל זכוכית) ואלקטרודה התייחסות (בדרך כלל כלוריד כסף או קלומל). באופן אידיאלי, פוטנציאל האלקטרודה, E, עבור הפרוטון יכול להיכתב כמו

כאשר E הוא פוטנציאל נמדד, E0 הוא פוטנציאל האלקטרודה הסטנדרטיב- H += 1 מול / L, R הוא קבוע הגז, T הוא הטמפרטורה בקלווין, F הוא קבוע פאראדיי.
האלקטרודה pH משתמשת זכוכית מנוסחת במיוחד, רגישה ל- pH במגע עם הפתרון, אשר מפתחת את הפוטנציאל (E) פרופורציונלי ל- pH של הפתרון. אלקטרודת הייחוס נועדה לשמור על פוטנציאל קבוע בכל טמפרטורה נתונה, ומשמשת להשלמת מעגל מדידת ה- pH בתוך הפתרון. הוא מספק פוטנציאל התייחסות ידוע לאלקטרודה pH. ההבדל בפוטנציאלים של האלקטרודות pH וייחוס מספק אות מיליוולט (mV) פרופורציונלי ל- pH. בפועל, אלקטרודה זכוכית משולבת יש אלקטרודה התייחסות מובנית. הוא מכויל כנגד פתרונות חיץ של פעילות מימן-יון ידועה. רוב חיישני ה-pH מתוכננים לייצר אות 0-mV ב-7.0 pH, עם שיפוע (אידיאלי תיאורטית) או רגישות, של -59.16 mV / pH ב 25 °C (7 °F). שני פתרונות חיץ או יותר משמשים על מנת להתאים את העובדה כי "השיפוע" עשוי להיות שונה במקצת מאידיאל. פתרונות חיץ סטנדרטיים מסחריים מגיעים בדרך כלל עם מידע על ערך ה- pH ב- 25 °C (70 °F) וגורם תיקון שיש להחיל על טמפרטורות אחרות.
Procedure
1. כיול pH
- הפעל את עוצמת המונה על-ידי לחיצה על כפתור ההפעלה.
- חבר את הבדיקה אוטומטית לפיצוי טמפרטורה (ATC) אם היא זמינה ו/או אינה עם האלקטרודה.
- ודא שמצב המדידה הוא pH. אם לא, לחץ על כפתור "MODE" עד שמצב "pH" יופיע בתצוגת LCD.
- עיין במדריך לעיון מהיר בתחתית המונה או בקרבת מקום לקבלת עזרה במידת הצורך.
- השתמש תמיד במאגרי pH טריים, שאינם בשימוש ולא נוסו לצורך כיול. המאגרים צריכים להיות באותה טמפרטורה כמו פתרונות הבדיקה.
- לשטוף את אלקטרודה pH עם מים מזוקקים ולאחר מכן עם המאגר בשימוש לכיול(כלומר,pH 7.00).
- טובלים את האלקטרודה pH לתוך חוצץ pH נייטרלי(כלומר,pH 7.00). מערבבים את המאגר עם פס מגנטי (בקצב מתון עבור ~ 30 s) לקבלת התוצאות הטובות ביותר.
- לחץ על לחצן "CAL/MEAS" (כיול [או תקינה]/easurement) כדי לבחור בפונקציה 'כיול (סטנדרטיזציה).' הגדר את ערך ה- pH של המאגר בתצוגת המונה ל- 7.00.
- כאשר "קריאה" יציבה, לחץ על לחצן "ENTER" כדי לקבל. הקריאה הראשית תהבהב לזמן קצר לפני שהתצוגה המשנית תתחיל לגלול בין המאגרים הזמינים הנותרים.
- לשטוף את אלקטרודה pH עם מים מזוקקים ולאחר מכן עם המאגר לשמש לכיול הבא(כלומר,pH 4.01).
- טובלים את האלקטרודה pH לתוך החיץ הבא של pH 4.01. יש לנעול את תצוגת המונה בערך המאגר.
- כאשר ה"קריאה" יציבה, הקש על "ENTER" כדי לקבל. הקריאה הראשית תהבהב בקצרה ולאחר מכן תציג את יעילות האחוז (שיפוע) לפני שהתצוגה המשנית תתחיל לגלול בין המאגרים הזמינים הנותרים.
- חזור על שלבים 2.2-2.7 לכיול מאגר pH 10.01.
- המונה יחזור באופן אוטומטי למצב מדידה עם השלמתו המוצלחת של הכיול בן 3 הנקודות.
הערות: (1) המאגרים הסטנדרטיים של pH 4.01 ו- 10.01 עשויים להיות מוחלפים במאגרים מתאימים אחרים לפי טווח ה- pH של דגימות הבדיקה. (2) לכיול יחיד (נייטרלי)-או דו-שלם, לחץ על לחצן "CAL/MEAS" כדי לחזור למדידות לאחר השלמת הכיול. (3) כיול עם יותר מ-3 נקודות עשוי לשמש למדידות מדויקות יותר. (4) מומלץ לבצע את הכיול בתחילת כל יום. לעבודה מדויקת מאוד יש לכייל את מד ה- pH לפני כל מדידה. (5) התאם ידנית את ערכי ה- pH של המאגרים אם הטמפרטורה שונה מטמפרטורת החדר הסטנדרטית ולא מחוברת בדיקה ATC.
2. מדידות pH
- ודא שהמונה נמצא במצב מדידת pH.
- יש לשטוף ביסודיות את האלקטרודה pH בין מדידות במים מזוקקים כדי למנוע זיהום של הפתרונות הנבדקים. כתם בעדינות את האלקטרודה על רקמת ניקוי מעבדה כדי להסיר את עודפי המים לשטוף. אין לשפשף את הנורה שכן זה יכול לגרום הצטברות מטען סטטי. לחלופין, לשטוף את האלקטרודה עם פתרון הבדיקה.
- טובלים את האלקטרודה pH לתוך פתרון בדיקה או מתלה. מערבבים את התמיסה עם פס מגנטי (~30 s) עם קצב ערבוב זהה לכיול לקבלת התוצאות הטובות ביותר.
- ה- pH הושלם כאשר קריאת ה- pH יציבה.
- במידת הצורך וזמין, לחץ על כפתור "החזק" כדי להקפיא את הקריאה הנמדדת. לחץ שוב כדי לחדש את הקריאה בשידור חי.
- הקלט את ערך ה- pH (ואת הטמפרטורה במידת הצורך) על-ידי כתיבה או לחיצה על לחצן "MEMORY" (אם ישים) כדי לאחסן את הערך בזיכרון.
- חזור על שלבים 3.2-3.6 למדידות מרובות.
- יש לשטוף ולאחסן היטב את האלקטרודה בתמיסת האחסון לאחר השלמת כל המדידות.
הערות: (1) זמן התגובה לבדיקת pH בכל מאגר לא צריך להיות יותר מ- 60 s, אך עשוי להיות ארוך יותר עבור פתרונות / השמצה מסוימים לבדיקה. (2) יש לנקות את בדיקת האלקטרודה באמצעות פתרון ניקוי pH-אלקטרודה פעם בחודש, או בכל פעם שהוא מלוכלך. פתרון HCl 0.1 M יכול לשמש לניקוי כללי. חומר ניקוי נוזלי מדולל ואקונומיקה לכביסה ביתית עשויים לשמש לניקוי גריז וזיהומים חיידקיים. עם זאת, כדי למנוע בעיות בלתי צפויות, השיטה הטובה ביותר היא תמיד להתייחס להמלצות יצרן אלקטרודה. (3) נורת האלקטרודה pH צריכה להיות לחה בכל עת. שמור אותו בתמיסת אחסון האלקטרודה שמגיעה עם האלקטרודה. השתמש בפתרון מאגר pH 4 אם אין פתרון אחסון זמין. השתמש בפתרון מאגר pH 7 לזמן קצר אם אף אחד מהם אינו זמין.
Results
איור 1 מראה את רמת ה-pH של קרקעות חקלאיות שהושפעו מהניהול של החיתוך ומהשקיה במי התהום. דגימות קרקע אלה נאספו מ-5 שדות תפוחי אדמה בשיטות סיבוב חיתוך שונות עם או בלי השקיה במי תהום. ה-pH הנמוך ביותר נצפה בקרקעות שדה 4 הן בסדרות המושקות והן במי התהום. השקיית מי תהום הגדילה בעקביות את ה-pH של הקרקע בכל 5 השדות. מידע ה-pH חיוני להמלצה על לימינג שדות תפוחי האדמה כראוי כדי לקדם צמיחה אופטימלית.
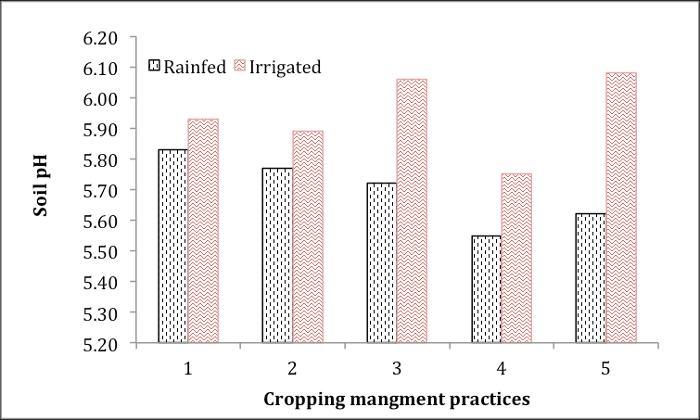
איור 1. pH קרקע של שדות תפוחי אדמה תחת שיטות ניהול חיתוך שונות עם או בלי השקיה מתחת למים.
Application and Summary
pH הוא אחד הפרמטרים הכימיים הנפוצים ביותר של פתרונות מימיים. זהו פרמטר קריטי בטיפול במים ושפכים ליישומים עירוניים ותעשייתיים, ייצור כימי, מחקר חקלאות וייצור. זה גם קריטי ניטור סביבתי, מחקר כימי ומדעי החיים, ביוכימי ומחקר פרמצבטי, ייצור אלקטרוניקה, ויישומים רבים יותר. איור 2 מפרט ערכי pH של חומרים נפוצים מסוימים.
מים טהורים הם ניטרליים, עם pH של 7.00. כאשר כימיקלים מעורבבים עם מים, התערובת יכולה להיות חומצית או בסיסית. חומץ ומיץ לימון הם חומרים חומציים, בעוד דטרגנטים כביסה אמוניה הם בסיסיים. כימיקלים בסיסיים מאוד או חומציים מאוד נחשבים "תגובתי". הכימיקלים האלה יכולים לגרום לכוויות חמורות. חומצת סוללת רכב היא כימיקל חומצי כי הוא תגובתי. סוללות רכב מכילות צורה חזקה יותר של אחת החומצות שנמצאו בגשם חומצי. חומרי ניקוי ביתיים מכילים לעתים קרובות בורית, כימיקל אלקליין מאוד כי הוא גם תגובתי.
במערכות חיות, ה- pH של תאים תאיים שונים, נוזלי גוף ואיברים מוסדר בדרך כלל בחוזקה בתהליך הנקרא הומאוסטזיס בסיס חומצה. ה- pH של הדם הוא בדרך כלל מעט בסיסי עם ערך של pH 7.365. ערך זה מכונה לעתים קרובות pH פיזיולוגי בביולוגיה וברפואה. פלאק יכול ליצור סביבה חומצית מקומית שיכולה לגרום לעששת על ידי demineralization. אנזימים וחלבונים אחרים יש טווח pH אופטימלי והוא יכול להיות מומת או denatured מחוץ לטווח זה.

איור 2. סולם ה- pH וערכי ה- pH של כמה פריטים נפוצים.
Skip to...
Videos from this collection:

Now Playing
שימוש במד pH
General Chemistry
344.3K Views

כלי זכוכית ושימושים נפוצים במעבדה
General Chemistry
653.4K Views

פתרונות וריכוזים
General Chemistry
273.1K Views

קביעת הצפיפות של מוצק ונוזל
General Chemistry
554.7K Views

קביעת הרכב אחוז המסה בפתרון מימי
General Chemistry
383.1K Views

קביעת הנוסחה האמפירית
General Chemistry
180.0K Views

קביעת כללי המסיסות של תרכובות יוניות
General Chemistry
141.1K Views

מבוא לתמצית
General Chemistry
423.4K Views

חוק הגז האידיאלי
General Chemistry
78.1K Views

קביעת ספקטרופוטומטריה של קבוע שיווי משקל
General Chemistry
158.3K Views

עקרון לה שאטלייה
General Chemistry
264.0K Views

דיכאון נקודת הקפאה כדי לקבוע תרכובת לא ידועה
General Chemistry
160.4K Views

קביעת חוקי התעריפים וסדר התגובה
General Chemistry
195.7K Views

שימוש בסריקה דיפרנציאלית קלורימטריה למדידת שינויים באנטלפיה
General Chemistry
44.4K Views

מתחמי כימיה של תיאום
General Chemistry
91.2K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved