Étalon interne
Vue d'ensemble
Source : Laboratoire du Dr B. Jill Venton - University of Virginia
L’objectif de nombreuses analyses chimiques est une analyse quantitative, où la quantité d’une substance dans un échantillon est déterminée. Afin de calculer avec précision la concentration d’un inconnu dans un échantillon, la préparation minutieuse est clé. Chaque fois qu’un échantillon est manipulé ou transféré, certains de l’échantillon peuvent être perdus. Il y a cependant, stratégies pour minimiser la perte de l’échantillon. Il y a aussi des stratégies pour faire face à la perte de l’échantillon et toujours en faisant des mesures précises de concentration.
Pour minimiser la perte de l’échantillon, l’idéal est de réduire au minimum le nombre d’étapes de manutention et de transfert échantillon. Par exemple, sa masse d’un échantillon solide directement dans une fiole qu’une solution se fera en réduit une étape de transfert. S’il est nécessaire de transférer d’un ballon à l’autre et une dilution est faite, puis triple rincer la verrerie permet de garantir que tout l’échantillon est transféré. Autres stratégies sont plus spécifiques à l’échantillon. Par exemple, les échantillons qui s’adsorber sur verre, comme les protéines, pourraient mieux être manipulés dans des tubes jetables en polypropylène. Les tubes ne sont pas hydrophiles, donc si une petite quantité d’échantillon doit être reversé dans l’eau, il est préférable d’avoir déjà ajouté l’eau dans le tube, donc l’échantillon peut être distribué directement dans le solvant. Il peut être préférable de se concentrer, plutôt que de les sécher complètement un échantillon, en raison de pertes d’insolubilities après réhydratation.
Une autre source de perte d’échantillon est par des manipulations échantillon incomplet. Par exemple, si une procédure de dérivation est utilisée et la dérivation est incomplète, alors la totalité de l’échantillon n'est pas observée. Les erreurs comme celle-ci sont des erreurs systématiques et peuvent être résolus en corrigeant le problème, comme la modification de la procédure de dérivation. Une autre cause de l’erreur systématique des mesures est des effets de matrice. Ceux-ci peuvent interférer avec la mesure de certaines substances et étalonnages performants dans la même matrice que l’échantillon peut réduire cet effet.
L’analyse quantitative est généralement effectuée à l’aide de normes soit externes ou internes. Pour des normes extérieures, une courbe d’étalonnage est faite en mesurant les différentes concentrations connues de l’analyte d’intérêt. Ensuite, l’échantillon est exécutée séparément de la norme. Pour les étalons internes, la norme est dans le même échantillon que l’analyte d’intérêt, ce qui permet la mesure à prendre en même temps. En règle générale, une espèce différente est ajoutée à l’appelé de l’étalon interne et le rapport de la réponse de l’étalon interne et l’analyte est calculé. L’idée est que le ratio de la réponse, appelé le facteur de réponse, est proportionnel à leur concentration. Alors que la méthode doit être en mesure de distinguer entre l’analyte d’intérêt et de l’étalon interne, les pertes d’échantillon qui se produisent après que l’étalon interne est ajouté devraient être similaires pour les deux substances et donc le ratio de la réponse reste la même. Un cas particulier de l’utilisation de normes internes est la méthode des ajouts dosés, où les quantités croissantes de l’analyte sont ajouté à la solution et le montant initial de l’analyte est calculée. Normes internes peuvent être utilisés en chromatographie, électrochimie et la spectroscopie.
Principles
Un étalon interne est une substance ajoutée à un montant constant à un échantillon, vierge et standard dans une analyse. Un étalon interne peut compenser les erreurs systématiques et aléatoires. Par exemple, s’il y a des fluctuations d’instrument qui causent des erreurs aléatoires dans la mesure, ces fluctuations sont censées être les mêmes pour l’étalon interne et l’analyte et donc le rapport entre les signaux ne change pas. Pour les erreurs systématiques, telles que les effets de matrice du solvant, aussi longtemps que l’effet est égal pour la norme et l’analyte, le ratio est à nouveau affecté.
L’inconvénient des étalons internes, c’est qu’il est difficile de trouver un étalon interne approprié. L’étalon interne doit avoir un signal qui est similaire à l’analyte, mais suffisamment différent pour qu’il se distingue par l’instrument. En outre, l’étalon interne ne devrait pas exister dans la matrice de l’échantillon, afin que l’étalon ajouté est la seule source de la norme. Occasionnellement, un constituant majeur d’un échantillon qui est constant dans la concentration peut être utilisé comme étalon interne au lieu d’un étalon ajouté, mais la concentration doit être connue pour ce composant. L’étalon interne ne devrait pas non plus supprimer ou améliorer le signal de l’analyte.
En chromatographie, une des plus importantes sources d’erreur est souvent l’injection. Si les injections manuelles sont utilisés, on peut erreurs dans la seringue de chargement correctement. Les volumes sont généralement petits (~ 1 µL) donc il existe des incertitudes en injectant reproductibles ce petit un volume, souvent un couple de pourcentage écart-type relatif (RSD). En chromatographie en phase gazeuse (GC), l’échantillon est injecté dans un port chauffé et l’évaporation de la pointe de l’aiguille peut entraîner des variations de volume injecté. Auto-échantillonneurs aident avec l’erreur dans le chargement de la seringue et l’erreur en injectant rapidement pour éviter l’évaporation en GC, mais l’erreur peut être encore 1 ou 2 % RSD. Avec la chromatographie, aire du pic est généralement utilisé au lieu de la hauteur des pics, que les sommets obtenir plus large et plus court avec le temps, mais la surface du pic est constante. Ainsi, pour les étalons internes, les ratios de surfaces de pics sont utilisés en chromatographie au lieu de hauteurs des pics.
Pour un étalonnage avec un étalon interne, un facteur de réponse est calculé. Le facteur de réponse (R) est le rapport entre les sommets par rapport au ratio des concentrations où X est l’analyte et IS est l’étalon interne.

Pour chromatographie sur zone (A) est utilisée. Le facteur de réponse peut être calculé à partir d’une parcelle de calibrage d’un /AXIS vs CX/cIS, où le facteur de réponse est la pente et l’ordonnée à l’origine est supposée pour être 0. Une fois le facteur de réponse est connu pour les normes, puis la réponse de l’inconnu peut être calculée à partir le rapport des surfaces mesurées de l’expérience.
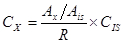
Procédure
1. manipulation des échantillons correct : Faire une Solution
- Prenez un bécher propre et masse la quantité correcte de l’échantillon dedans. Enregistrer le réel masse utilisée. Dans cet exemple, une solution de l’adénine est faite dans une fiole jaugée pour utilisation comme étalon interne pour l’analyse suivante. La masse de l’adénine est de 100 mg. Faire pas directement la masse dans une fiole jaugée parce qu’il a un long cou et l’adénine ne peuvent pas être facilement ajoutée ou supprimée.
- Ajouter environ 25 mL de solvant (en l’occurrence le diméthylsulfoxyde (DMSO)) pour le bécher et laisser il mélanger pour dissoudre. Dans cet exemple, la solution finale est faite dans une fiole jaugée de 50 mL, ainsi qu’ajouter environ 25 mL donc le gobelet peut être rincé et la solution composée au volume final.
- Une fois que le solide est dissout, verser la solution dans la fiole jaugée.
- Rincer le becher et bar avec de petites quantités de solvant, environ 10 mL, remuer et verser le rinçage dans la fiole jaugée. Répéter deux fois plus. Cela aide à assurer le transfert de la solution adéquate.
2. préparation d’une courbe de tarage Standard interne
- Préparer les échantillons standards souhaités pour l’analyse de la chromatographie en phase gazeuse. Dans cet exemple, caféine est extraite du café à l’aide de l’acétonitrile et puis l’adénine est utilisé comme étalon interne pour mesure.
- Pour les échantillons de caféine, peser la quantité d’échantillon nécessaire pour faire l’échantillon de 1 mg/mL. Si vous utilisez une fiole jaugée de 10 mL, qui est de 10 mg.
- Peser l’analyte dans un bécher, ajouter quelques mL de solvant (méthanol ici) se dissoudre, puis transvaser quantitativement dans la fiole jaugée à l’aide de 3 rinçages.
- Faire 3 normes plus de façon similaire avec 0,2, 0,5 et 2 mg/mL de caféine.
- Mettre 1 mL de chaque caféine standard dans un flacon d’échantillonnage.
- Ajouter 0,2 mL de l’étalon interne de 2 mg/mL adénine dans chaque flacon d’échantillon.
- Exécuter l’expérience de la chromatographie en phase gazeuse avec chaque norme de caféine. Pour chaque chromatogramme, calculer le rapport entre la surface des pics de la caféine contre la norme.
- Faire une parcelle de la zone rapport vs le ratio de concentration. La pente de cette courbe est le facteur de réponse.
3. préparation d’un véritable échantillon avec étalon interne pour chromatographie en phase gazeuse
- Préparer l’échantillon souhaité pour l’analyse de chromatographie en phase gazeuse. Dans cet exemple, la caféine est extraite de café à l’aide d’acetrontrile.
- Pour l’échantillon de café, masse avec 2 g de café dans un bécher de 100 mL. Noter le poids exact du café.
- Ajouter 20 mL d’acétonitrile dans le bécher.
- Laisser reposer pendant 20 min, en remuant fréquemment.
- Filtrer le Marc de café à l’aide d’un papier filtre dans un entonnoir.
- Rincer le filtre en papier x 3 avec de petites quantités d’acétonitrile (5 mL).
- Mesurer le volume final du filtrat. Il devrait être d’environ 35 mL.
4. exécuter l’échantillon et calculer la Concentration
- Prélever 1 mL de l’échantillon d’extrait de café et ajouter 0,2 mL de l’étalon interne dans un flacon. Placer la fiole dans support échantillonneur automatique.
- Exécuter une analyse de GC de l’échantillon. S’assurer que les conditions de GC sont tels que la caféine et l’adénine se séparent. Dans cet exemple, isothermes séparations sont effectuées à 200 ° C.
- Après l’analyse, calculer l’aire du pic pour les PIC de l’étalon interne et le pic de l’analyte. En utilisant leurs ratios, calculer la quantité de caféine dans l’échantillon.
5. résultats : Analyse de GC de caféine avec étalon interne
- Analyse de GC de la caféine est illustré à la Figure 1. Adénine est utilisé comme étalon interne. Le rapport entre la surface des pics peut être mesuré et comploté contre le rapport des concentrations. La pente de la courbe est le facteur de réponse (en l’occurrence 1,8).
- La figure 2 illustre un chromatogramme d’un échantillon de café avec étalon interne d’adénine. Le rapport entre la surface du pic est 1,78. En utilisant le facteur de réponse et la concentration de l’adénine (0,33 mg/mL), la concentration de caféine dans l’échantillon inconnu est calculée à 0,33 mg/mL.

Figure 1. Terrain de calibrage à l’aide d’un étalon interne. Une parcelle des ratios de concentration vs zone rapports pour 3 échantillons standards de caféine (1, 0,5 et 0,2 mg/mL) avec étalon interne de 0,33 mg/mL adénine ajouté à chacune. La pente de la droite est de 1,8, qui est le facteur de réponse.
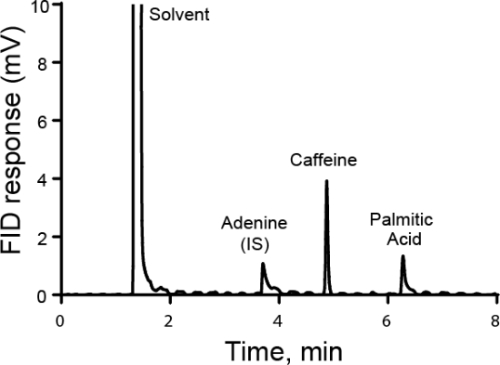
Figure 2. Chromatogramme de café avec étalon interne adénine. Une parcelle de la réponse du détecteur FID aux échantillons. Les trois principaux sommets sont l’adénine (IS), la caféine et l’acide palmitique.
Applications et Résumé
Normes internes sont utilisés dans de nombreux domaines, y compris la spectroscopie et chromatographie. En spectroscopie, normes internes peuvent aider correct pour des erreurs aléatoires en raison de changements dans l’intensité de la source lumineuse. Si une lampe ou autre source lumineuse a une puissance variable, il affectera l’absorption et par conséquent, l’émission d’un échantillon. Toutefois, le ratio d’un étalon interne d’analyte reste constant, même si la source lumineuse n’est pas. Un exemple de ceci est à l’aide de lithium (Li) comme étalon interne pour l’analyse du sodium dans un échantillon de sang par spectrométrie de flamme. Li est chimiquement semblable au sodium, mais ne se trouve pas en mode natif dans le sang.
Pour la chromatographie, les étalons internes sont souvent utilisés en chromatographie en phase gazeuse et en chromatographie en phase liquide. Pour les applications à la spectrométrie de masse comme détecteur, l’étalon interne peut être un analyte isotopiquement étiquetés, afin que le poids moléculaire (MW) sera différent de celle de l’analyte d’intérêt. Normes internes sont couramment utilisés dans les analyses pharmaceutiques ou environnementales.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Étalon interne
Analytical Chemistry
204.6K Vues

Préparation des échantillons pour analyse
Analytical Chemistry
84.6K Vues

Méthode de l'addition standard
Analytical Chemistry
319.8K Vues

Courbes d'étalonnage
Analytical Chemistry
796.1K Vues

Spectroscopie ultraviolet-visible (UV-Vis)
Analytical Chemistry
622.9K Vues

La spectroscopie Raman pour l'analyse chimique
Analytical Chemistry
51.2K Vues

Spectrométrie de fluorescence des rayons X
Analytical Chemistry
25.4K Vues

Chromatographie en phase gazeuse (CG) couplée à un détecteur à ionisation de flamme
Analytical Chemistry
281.8K Vues

La chromatographie en phase liquide à haute performance (CLHP)
Analytical Chemistry
384.1K Vues

Chromatographie par échange d'ions
Analytical Chemistry
264.3K Vues

Électrophorèse capillaire (EC)
Analytical Chemistry
93.7K Vues

Introduction à la spectrométrie de masse
Analytical Chemistry
112.2K Vues

Microscopie électronique à balayage (MEB)
Analytical Chemistry
87.1K Vues

Mesures électrochimiques d'un catalyseur sur support à l'aide d'un potentiostat / galvanostat
Analytical Chemistry
51.3K Vues

Voltammétrie cyclique
Analytical Chemistry
124.9K Vues