Détermination de la loi de vitesse et de l'ordre de la réaction
Vue d'ensemble
Source : Laboratoire du Dr Neal Abrams — SUNY College of Environmental Science and Forestry
Toutes les réactions chimiques ont un taux spécifique définissant l’état d’avancement des réactifs va aux produits. Ce taux peut être influencé par la température, concentration et les propriétés physiques des réactifs. Le tarif comprend également les intermédiaires et les États de transition qui sont forment, mais ne sont ni le réactif ni le produit. La Loi de vitesse qui définit le rôle de chacun des réactifs dans une réaction et peut être utilisée pour modéliser mathématiquement le temps nécessaire à une réaction de procéder. La forme générale d’une équation de taux est illustrée ci-dessous :
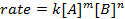
où A et B sont les concentrations des différentes espèces moléculaires, m et n est des ordres de réaction, et k est la constante de vitesse. La vitesse de presque chaque réaction change au fil du temps comme réactifs sont épuisés, rendant les collisions efficaces moins susceptibles de se produire. La constante de vitesse, toutefois, est fixée pour une seule réaction à une température donnée. L’ordre de la réaction illustre le nombre d’espèces moléculaires impliquées dans une réaction. Il est très important de connaître la Loi de vitesse, y compris les taux constants et réaction commande, qui ne peut être déterminée expérimentalement. Dans cette expérience, nous découvrir une méthode de détermination de la Loi de vitesse et il permet de comprendre l’état d’avancement d’une réaction chimique.
Principles
Cinétique et thermodynamique
Toutes les réactions chimiques sont régies par deux facteurs, cinétique et thermodynamique. Le facteur thermodynamique est la différence d’énergie libre au cours d’une réaction chimique. Cette énergie libre, qualifiée de spontanéité, est une valeur complexe résultant de l’enthalpie (chaleur) et l’entropie (désordre) dans une réaction chimique. Cinétique fait référence à la vitesse d’une réaction chimique et à quelle vitesse le système atteint l’équilibre. Alors que la cinétique peut expliquer la vitesse de la réaction, thermodynamique donne des informations sur son bilan énergétique. En termes simples, thermodynamique a trait à la stabilité et la cinétique se rapporte à la réactivité.
Détermination du taux
Taux est une mesure basée sur le temps, ce qui signifie que c’est en constante évolution comme une réaction se produit. Cela peut être représenté à l’aide d’un différentiel de taux droit, exprimant la variation de concentration sur un changement dans le temps. Expérimentalement, le différentiel de taux droit est difficile à utiliser, afin que nous puissions utiliser calcul et représenter la Loi de vitesse comme la Loi de vitesse intégré en intégrant le différentiel de taux droit. La Loi de vitesse intégré représente les concentrations en réaction au début de la réaction et à un intervalle de temps spécifié. Un tableau de l’ordre, Loi de vitesse et Loi de vitesse intégré est indiqué ci-dessous :

Chaque ordre explique la dépendance de la concentration des réactifs sur la vitesse de réaction. Par exemple, une loi de taux ordre zéro, taux = k, indique que le taux est seulement dépendant sur la constante de vitesse, pas sur la concentration des réactifs. Ceci est fréquent dans les réactions catalytiques où le catalyseur est un solide et la surface ne change pas au cours de la réaction. Une loi de vitesse de commandest 1 montre que le taux est dépendant de la concentration d’un réactif, bien que les autres réactifs peuvent être présents. Une loi de vitesse de commande de 2nd indique que le taux dépend de la concentration des deux réactifs dans la réaction. Ces réactifs peuvent être les mêmes, c'est-à-dire taux = k[A]2, ou taux différent, = k[A] [B]. Étant donné que les deux concentrations sont en constante évolution, constantes de taux de deuxième ordre peuvent être difficiles à mesurer en laboratoire. Quel que soit l’ordre, en utilisant la Loi de vitesse intégré simplifie l’analyse des données en tenant compte de données traçant et en appliquant une équation linéaire pour ajuster les données. Depuis la Loi de vitesse intégré qu’une seule s’adapte les données, taux constant et réaction ordre d’une réaction peut être immédiatement identifiée.
Une expérience de cinétique
Détermination de la Loi de vitesse commence par la mise en place d’une expérience de cinétique de la réaction chimique. Une expérience cinétique est soigneusement contrôlée afin que les mesures sont effectuées à intervalles réguliers afin de déterminer la variation de concentration d’une espèce au fil du temps. Que les espèces peuvent soit être réactif (diminution de concentration avec le temps) ou un produit (augmentation de la concentration avec le temps). Si plusieurs réactifs sont impliqués, il est également très important que la concentration du seul réactif change avec le temps. Augmentation de la concentration des autres réactifs beaucoup plus élevés que le réactif à l’étude fait apparaître que la concentration du seul réactif change pendant l’expérience.
Dans cette expérience, la décomposition catalytique du peroxyde d’hydrogène sur un catalyseur platine est explorée. Le platine étant un catalyseur, une seule espèce est impliquée qui se décompose en deux produits selon la réaction ci-dessous :
2 H2O2(aq) → O2(g) + 2 H2O(l)
Parce que l’un des produits, O2, est un gaz, l’augmentation de pression du système au fil du temps peut être mesurée et la Loi des gaz parfaits (PV = nRT) permet d’associer pression moles. Une fois que cela est fait pour plusieurs différentes concentrations du réactif, la Loi de l’ordre et les taux de réaction peut être résolue.
Procédure
1. préparation H2O2 Dilutions
- Peroxyde d’hydrogène 3 % stock a une concentration de dilutions de préparer 5 M. 0,882 allant de 0,882 M à 0,176 M (tableau 1). Préparer ces solutions volumétriquement, mais préparer additivement puisque le soluté est très dilué et volumes d’eau sont additifs.
- Placer les solutions dans un bain d’eau de température constante, ou les laisser sur le comptoir s’équilibrer à température ambiante. Une gamme de température de 20 à 25 ° C (293-298 K) est bonne pour cette réaction.

Le tableau 1. H2O2 solutions utilisées.
2. préparation de la cuve de réaction
- Pour déterminer le volume de la cuve de réaction, remplissez-le d’eau un grand tube vers le haut et insérer un bouchon en caoutchouc 1 trou dans le tube à essai jusqu’au serrage et l’eau pousse sur les côtés et par le haut.
- Retirer le bouchon et verser l’eau dans un cylindre gradué pour déterminer le volume exact de l’eau. C’est le volume total de la cuve de réaction (en éprouvette).
3. mesurer le dégagement d’oxygène
- Remplacer l’eau avec 50 mL de la première solution de peroxyde d’hydrogène et placez-le dans l’eau du bain. Une fois équilibrée, ajouter le disque de platine-enduit réaction et sceller le système avec un bouchon relié à un capteur de pression de gaz. Ces disques sont couramment utilisés dans les systèmes de nettoyage des lentilles de contact.
- Une fois que le capteur de pression est configuré pour acquérir des données à 2 points/s, exécuter l’expérience pour 120 s. Le capteur de pression de gaz Vernier, GPS-BTA, est recommandé pour cette expérience.
- Bulles doivent être observés que le peroxyde est décomposé en eau et en oxygène. Relâcher la pression, jeter la solution, rincer et remplacer la solution avec la prochaine solution de peroxyde d’hydrogène. Répétez la mesure de pression de gaz jusqu'à ce que toutes les solutions sont testées.
4. analyse des données
- Transférer tous les fichiers de données de pression versus le temps vers un tableur.
- Déterminer les vitesses initiales-suppose que la concentration du peroxyde d’hydrogène n’a pas changé beaucoup durant la courte période de l’expérience. Les données représentent la zone linéaire initiale de l’expérience de cinétique.
- Déterminer la pente par traçage de pression par rapport au temps et à l’aide d’une pente de régression linéaire ou de formule. Tracer la pression dans une unité commune.
- La pente est le taux initial en unités de pression/sO2.
- Déterminer l’ordre de la réaction
- Parce que la pression évolué O2 est directement proportionnelle aux moles de décomposé H2O2, traçant le ln (taux initial) vs ln [H2O2]0 donne une pente équivalente à l’ordre de la réaction. La concentration initiale de peroxyde d’hydrogène, [H2O2]0, est ce qui a été utilisé dans chacun des essais.
- L’équation de la Loi de vitesse est
 . Prenant le logarithme népérien (ln) de l’équation produit une équation linéaire
. Prenant le logarithme népérien (ln) de l’équation produit une équation linéaire 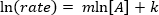 , où m, la pente, est de l’ordre de la réaction.
, où m, la pente, est de l’ordre de la réaction.
- L’équation de la Loi de vitesse est
- Parce que la pression évolué O2 est directement proportionnelle aux moles de décomposé H2O2, traçant le ln (taux initial) vs ln [H2O2]0 donne une pente équivalente à l’ordre de la réaction. La concentration initiale de peroxyde d’hydrogène, [H2O2]0, est ce qui a été utilisé dans chacun des essais.
- Déterminer la vitesse constante, k
- Pour chaque essai, convertir le taux, PO2/s, en unités de atm/s si le taux est dans une unité différente comme torr/s.
- Parce que les bulles ont évolué en solution aqueuse, soustraire la pression de vapeur d’eau à la pression de système pour chaque essai. Le nouveau taux reflète seulement la pression en raison de l’évolution de l’oxygène.
- Appliquer la Loi des gaz parfaits pour convertir le taux d’atm/s en moles/s dans chaque essai.
- Réorganiser les PV = nRT pour n = PV/RT. L’unité de-1 s reste inchangée. Le volume est équivalent au volume de tube à essai moins le volume de solution (50 mL).
- La réaction chimique équilibrée permet de convertir de moles d’oxygène produit moles de peroxyde d’hydrogène que se décompose à chaque essai.
- Diviser les taupes de H2O2 par le volume de la solution, 0,050 L, de céder la molarité de H2O2 décomposé par seconde, [H2O2] / s.
- Car cette expérience suit la cinétique du premier ordre, diviser le taux, [H2O2] / s, par la concentration de la solution originale pour chaque essai, [H2O2]0, pour donner une vitesse constante, k. Cette solution pour la constante de vitesse varie légèrement selon l’ordre de la réaction déterminée précédemment.
- Moyenne des constantes de vitesse pour chaque essai ensemble puisque la température est constante.
Résultats
Oxygène Evolution Data et vitesses initiales
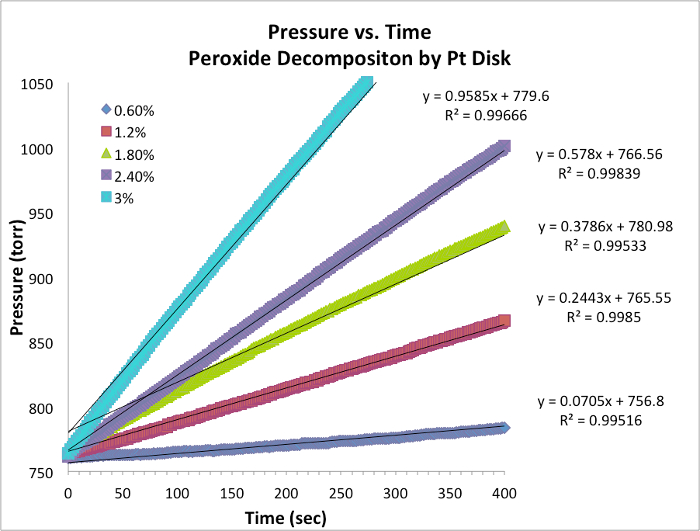
Figure 1. Pression vs chronologiques pour chaque essai à température constante. La pente est équivalente à la vitesse instantanée de la réaction.
Ordre de réaction
- Données pour cinq essais et graphique avec pente sont tabulées ci-dessous (tableau 2, Figure 2). La pente du 0.9353 ≈ 1, est une valeur entière de l’ordre de la réaction.

Le tableau 2. Résultats des 5 H2O2 essais.

Figure 2. Terrain de logarithme naturel de la concentration par rapport taux. La pente équivaut à l’ordre de la réaction.
Constante de vitesse k
- Calculer le taux en mol O2/s en utilisant la Loi des gaz parfaits en soustrayant première sur la pression de vapeur d’eau à 294 K (température de l’expérience de cinétique), 18,7 torr.
- Calculer la constante de vitesse en divisant le taux, [H2O2] / s par la concentration initiale de [H2O2]0.
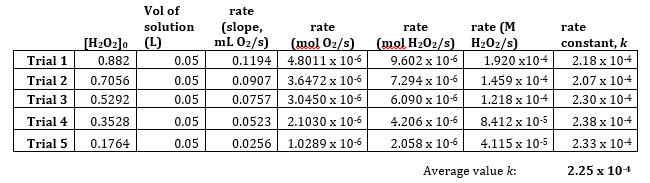
Tableau 3. Calcul de la vitesse constante, k.
- La constante de vitesse moyenne 2,25 x 10-4 s-1 indique la réaction est du premier ordre, basé sur les unités. La Loi de vitesse peut être réécrite sous la forme : taux = 2,25 x 10-4 s-1[H2O2]0
Applications et Résumé
Alors que la détermination des variables de droit taux peut être impliqué mathématiquement, les méthodes sont en fait assez simples. Tant que la disparition d’un réactif ou l’apparence d’un produit peut être mesurée, parcelles de taux permet de calculer la constante de vitesse. Une extension de cette méthode est fréquemment utilisée pour déterminer l’énergie d’activation d’une réaction, Eun, en mesurant le taux et calcul de la constante de vitesse à différentes températures. Cette méthode consiste à utiliser la Loi d’Arrhenius, k = Ae(-Ea/RT). La Loi de vitesse, y compris d’ordre de la réaction, la combinaison avec l’activation énergétique d’une réaction fournit un profil cinétique complète pour une réaction rapide comment (ou lent) progresse et fournit des informations concrètes sur comment des facteurs comme la température et concentration peut affecter cette réaction.
Cinétique chimique trouver des applications dans les industries et de domaines aussi variés que les produits pharmaceutiques, sûreté nucléaire, assainissement de l’environnement et des écrans solaires. Par exemple, un médicament donné peut avoir une constante de vitesse très importantes, ce qui signifie qu'il se décompose très rapidement dans le corps. Cela influe sur son utilisation, le dosage et mode de livraison. En ce qui concerne la science nucléaire, radioactivité suit la cinétique de premier ordre, ce qui signifie que le temps nécessaire pour les matières nucléaires se désintègre jusqu'à un niveau de sécurité est très bien caractérisé. Les mesures seraient très semblables à la méthode présentée ici et pourraient aussi s’appliquer à la désintégration de nombreux polluants de l’environnement. De même, écrans solaires carie également avec des profils cinétiques connus permettant aux fabricants d’informer les consommateurs combien de temps la crème solaire doit être appliqué afin de maintenir un niveau sûr.
References
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).
Passer à...
Vidéos de cette collection:

Now Playing
Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
195.9K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
655.6K Vues

Solutions et Concentrations
General Chemistry
273.9K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
555.8K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.3K Vues

Déterminer la formule empirique
General Chemistry
181.0K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.3K Vues

Utiliser un pH-mètre
General Chemistry
345.3K Vues

Introduction au titrage
General Chemistry
424.0K Vues

Loi des gaz parfaits
General Chemistry
78.3K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.3K Vues

Principe de Le Châtelier
General Chemistry
265.0K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.6K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.5K Vues

Complexes de coordination
General Chemistry
91.4K Vues