Détermination des NOx dans les gaz d'échappement des voitures à l'aide de la spectroscopie UV-VIS
Vue d'ensemble
Source : Laboratoires de Margaret Workman et Kimberly Frye - Depaul University
Dans la troposphère, l’ozone est naturellement formé quand la lumière du soleil divise le dioxyde d’azote (NO2) :
PAS2 + lumière → NO + O
O + O2 → O3
L’ozone (O3) peut aller réagit avec l’oxyde nitrique (NO) pour former de l’oxygène et dioxyde d’azote (NO2) :
NE + O3 → aucune2 + O2
Cela se traduit par aucun gain net de l’ozone (O3). Cependant, avec la production anthropique de l’ozone, formant des précurseurs (NO, NO2et les composés organiques volatils) par le biais de la combustion de combustibles fossiles, ont été trouvés des niveaux élevés d’ozone dans la troposphère. Gaz d’échappement de véhicules automobiles est une source importante de ces ozone formant des précurseurs : NO, NO2et les composés organiques volatils (COV). Par exemple, les sources mobiles représentent près de 60 % des émissions de2 pas + pas.
Aux températures élevées dans la chambre de combustion d’une voiture, l’azote et l’oxygène de l’air réagissent pour former de l’oxyde nitrique (NO) et dioxyde d’azote (NO2) :
N2 g + O2 (g)→ 2 pas(g)
2 pas(g) + O2 (g)→ 2 aucun2 g
L’oxyde nitrique (NO) émis dans le gaz d’échappement de la voiture est peu à peu oxydé en dioxyde d’azote (NO2) dans l’air ambiant. Ce mélange de non et non2 est souvent dénommé NOx. Lorsque aucunx réagit avec les composés organiques volatils dans l’atmosphère en présence de lumière du soleil, des formes de l’ozone troposphérique, comme on le voit dans ce simplifié réaction chimique :
AUCUNx + COV + lumière → O3 autres produits
Ce mélange nocif de la pollution atmosphérique, qui peut inclure des aldéhydes, nitrate de peroxyacétyle, ozone, COV et de NOx, est appelé smog photochimique. L’ozone est la plus importante composante du smog photochimique. Ce smog se trouve dans toutes les villes modernes, mais on le trouve surtout dans les villes avec des climats secs, chauds et ensoleillés et un grand nombre de véhicules à moteur. La couleur jaune-brun de smog dans l’air est due en partie pour le dioxyde d’azote présent, étant donné que ce gaz absorbe la lumière visible près de 400 nm (Figure 1).
À court terme QU'AUCUNE exposition2 (30 min à 1 jour) ne conduit à des effets indésirables respiratoires chez les personnes saines et une augmentation des symptômes respiratoires chez les personnes souffrant d’asthme. AUCUNx réagit avec l’ammoniac et d’autres composés de particules de forme. Ces petites particules peuvent pénétrer dans les poumons et causer des problèmes respiratoires, y compris l’emphysème et la bronchite. Les personnes qui passent beaucoup de temps sur la route ou qui vivent près de la chaussée d’expérience exposition considérablement plus élevée à NO2.
En raison de son impact sur la santé humaine et l’environnement, la U.S. Environmental Protection Agency (EPA) a classé N°2 comme un polluant de critères et a fixé la norme primaire à 100 ppb (98e centile de concentrations maximales quotidiennes de 1 h, en moyenne sur 3 ans) et 53 ppb (moyenne annuelle). Considérant que les véhicules routiers représentent environ 1/3 d’aucune émissionx aux États-Unis, automobiles sont donc régis par la Loi sur l’assainissement de l’Air. L’EPA a établi des normes d’émission que les constructeurs automobiles doivent respecter lors de la production de voitures. Actuellement, les normes d’émissions Tier 2 valeur que les fabricants ne doivent avoir moyenne du parc aucune émissionx ne dépassant pas 0,07 g/mille.
Fabricants aller rencontrer ce standard est à l’aide de convertisseurs catalytiques sur leurs voitures. Ce dispositif est placé entre le moteur et le tuyau d’échappement. Le flux d’échappement passe par le convertisseur catalytique et est exposé à un rôle de catalyseur. Un catalyseur de réduction de la platine et le rhodium est utilisé pour réduire la concentration de NOx dans le gaz d’échappement. Quand une molécule2 aucun ou aucune dans le gaz d’échappement entre en contact avec le catalyseur, l’atome d’azote est attrapé au large de la molécule et s’agrippent à par le catalyseur. L’oxygène est libéré et formules O2. L’atome d’azote sur le catalyseur se lie avec un autre atome d’azote qui s’est tenu sur le catalyseur pour le formulaire N°2.
Convertisseurs catalytiques ont considérablement réduit les émissions de NOx de voiture d’échappement – jusqu'à à réduction de 80 %, lorsque vous effectuez correctement. Toutefois, ils ne fonctionnent que lorsqu’ils ont atteint une température assez élevée. Par conséquent, lorsque vous effectuez un démarrage à froid d’une voiture, le convertisseur catalytique est la suppression quasiment aucune NOx. Il n’est pas jusqu'à ce que les convertisseur catalytique atteint des températures plus élevées qu’il supprime efficacement le N°x du flux de gaz d’échappement. Convertisseurs catalytiques ne fonctionnent pas sur les voitures particulières diesel en raison des conditions maigres dans lesquelles elles opèrent. En outre, le soufre dans le carburant diesel désactive également le catalyseur. Le n °x dans les moteurs diesel sont réduites principalement par le biais de la soupape de recirculation des gaz d’échappement, qui refroidit la température des gaz de combustion. Ainsi, les voitures à moteur diesel émettent généralement plus aucunx que les voitures essence.

Figure 1. La coloration caractéristique de smog en Californie dans le nuage beige Banque derrière le Golden Gate Bridge. La coloration brune est due à la NOx dans le smog photochimique.
Principles
Dans cette expérience, la concentration de NOx dans le flux d’échappement de diverses marques d’automobiles sont mesurées deux fois (au démarrage et après 10 min) pour étudier la capacité du convertisseur catalytique de la voiture pour enlever le gaz d’échappement NOx . Le convertisseur catalytique nécessite une température élevée pour être efficace. Par conséquent, la mesure des gaz d’échappement au démarrage de la voiture représente la quantité de NOx dans le gaz d’échappement sans le travail du convertisseur catalytique. La mesure des gaz d’échappement après que 10 min représente la quantité de NOx dans le gaz d’échappement après le convertisseur catalytique est en vigueur.
La concentration de NOx est déterminée par colorimétrie par diazotation de l’acide sulfanilique et ultérieures réagissant avec N-(1-naphthyl)-éthylènediamine et de mesurer l’intensité de la couleur de la molécule de colorant azoïque résultante à l’aide d’un spectrophotomètre UV-VIS fixée à 550 nm.
En solution, non et non2 subissent les réactions suivantes pour former aucune2–:
2 N°2 (g) + H2O(l) → 2 H+(aq) + N°2–(aq) + N°3–(aq)
4Pas(g) + O2 g + 2 H2O(l) → 4 N°2–(aq) + 4 H+(aq)
Bien que le rapport attendu entre NO2 et NO2– est 2:1, basé sur la première équation énumérée précédemment, il a été empiriquement déterminer à être 1.39:1.
Lorsque l’acide sulfanilique et N-(1-naphthyl)-éthylènediamine sont ajoutés à la solution, une molécule de couleur rose développe (Figure 2).
La concentration de cette molécule de couleur rose est directement proportionnelle à la concentration du NOx dans la solution. La concentration de la molécule de colorant azoïque est mesurée à l’aide d’un spectrophotomètre UV-VIS, fixée à 550 nm.
Spectroscopie ultraviolet-visible est basée sur la mesure de l’absorbance (A) des solutions qui s’est tenue dans un récipient transparent de largeur b (en cm). La concentration des espèces absorbantes est directement proportionnelle à l’absorption, comme le montre l’équation suivante :
A =  b c
b c
où  est l’absorptivité molaire. Cette équation est connue comme la Loi de Beer. L’absorptivité molaire est une mesure de combien fortement une substance absorbe la lumière à une longueur d’onde donnée et est une constante pour une substance donnée.
est l’absorptivité molaire. Cette équation est connue comme la Loi de Beer. L’absorptivité molaire est une mesure de combien fortement une substance absorbe la lumière à une longueur d’onde donnée et est une constante pour une substance donnée.
Pour mesurer l’absorbance d’une solution, un faisceau de lumière avec une intensité j’aio a pour but la solution dans une cuvette (Figure 3). L’intensité du faisceau entrant (j’aio) et le faisceau émergent (I) sont mesurés et l’absorbance est calculée par :


La figure 2. Une molécule de couleur rose qui se développe lorsque l’acide sulfanilique et N-(1-naphthyl)-éthylènediamine sont ajoutés à la solution.

La figure 3. Un faisceau de lumière avec une intensité Io visant à la solution dans une cuvette.
Procédure
1. préparation de la Solution mère de Nitrite (pas2–)
- Peser avec 1,500 g NaNO2 et ajouter dans une fiole jaugée de 1 L.
- Compléter au trait avec de l’eau nanopure. (Vérifier l’eau distillée, de l’eau du robinet, et il peut contenir suffisamment de nitrite pour interférer avec les mesures.) Il en résulte un 1 000 µg aucune solution-mère2–/ml.
- Pour ne faire un 5,0 µg aucun2–/ml de solution, ne prélever 1 mL de la 1 000 µg aucune solution2-/ ml et diluer jusqu'à 200 mL dans une fiole jaugée.
2. Elaboration d’aucune Solution d’indicateur dex
- Peser avec 5,0 g d’acide sulfanilique anhydre et ajouter dans une fiole jaugée de 1 L.
- Ajouter 500 mL d’eau nanopure.
- Ajouter 140 mL d’acide acétique glacial.
- À l’aide d’une barre de remuer, agiter la solution jusqu'à dissolution de l’acide sulfanilique. Cela prend environ 30 min.
- Peser 0,020 g de N-(1-naphthyl)-éthylènediamine dichlorhydrate et verser dans la fiole jaugée.
- Compléter au trait avec de l’eau nanopure.
- Transvaser dans un flacon sombre (pour éviter la photodécomposition) et boucher hermétiquement (pour éviter la réaction avec l’air).
3. préparation des étalons
- Ne mettre à 1,0 mL de la 5,0 µg aucun2–/ml de solution dans une fiole jaugée de 25 mL et diluer avec la solution d’indicateur de NOx de la marque. Cela ne fait un 0,2 µg aucune solution étalon de2–/ml.
- Ne mettre 2,0 mL de la 5,0 µg aucun2–/ml de solution dans une fiole jaugée de 25 mL et diluer avec la solution d’indicateur de NOx de la marque. Cela ne fait un 0,4 µg aucune solution étalon de2–/ml.
- Ne mettre 3,0 mL de la 5,0 µg aucun2–/ml de solution dans une fiole jaugée de 25 mL et diluer avec la solution d’indicateur de NOx de la marque. Cela ne fait un 0,6 µg aucune solution étalon de2–/ml.
- Ne mettez 4,0 mL de la 5,0 µg aucun2–/ml de solution dans une fiole jaugée de 25 mL et diluer avec la solution d’indicateur de NOx de la marque. Cela ne rend une 0,8 µg aucune solution étalon de2–/ml.
- Ne mettre 5,0 mL de la 5,0 µg aucun2–/ml de solution dans une fiole jaugée de 25 mL et diluer avec la solution d’indicateur de NOx de la marque. Cela ne fait un 1,0 µg aucune solution étalon de2–/ml.
4. création de la courbe d’étalonnage
- À l’aide d’un spectrophotomètre UV-VIS, régler l’appareil pour lire l’Absorbance.
- Sélectionner la longueur d’onde de 550 nm sur le spectrophotomètre.
- À l’aide de la solution d’indicateur de NOx , zéro du spectrophotomètre.
- Mesurer l’absorbance des solutions standards 5. Valeurs Records sur le tableau de données (tableau 1).
5. mesure de l’échantillon d’échappement automobile
- Démarrer la voiture à moteur diesel.
- À l’aide d’une seringue de 60 mL étanche aux gaz, insérer quelques pouces dans le tuyau d’échappement. Éviter les brûlures et ne pas respirer fumées. Aspirer et expulser le gaz d’échappement deux fois pour conditionner la seringue.
- Tirer 25 mL de la solution d’indicateur de NOx dans la seringue. Expulser tout l’air de la seringue sans répandre la solution d’indicateur.
- Tirer 35 mL de gaz d’échappement dans la seringue, tirant sur le piston jusqu'à la marque de 60 mL.
- Capuchon de la seringue. Agiter la solution dans la seringue pendant 2 min. de la couverture de la seringue avec du papier aluminium.
- Mesurer la température de l’air à l’échappement lors de la collecte des échantillons.
- Répétez les étapes 5.1 – 5,6 à l’aide d’une voiture fonctionnant à l’essence. Ces étapes peuvent être répétées autant de fois que désiré, à l’aide de différents modèles d’automobiles.
- Répétez les étapes 5.1 – 5,6 après les automobiles ont été diffusées au moins 10 min.
- Attendre 45 min pour laisser la couleur se développer, avant de mesurer l’absorbance de la solution.
- Après le 45 mn sont en hausse, expulser les gaz de la seringue, mettre la solution dans une cuvette et mesurer l’absorbance à l’aide du spectrophotomètre fixé à 550 nm. Valeurs Records sur le tableau de données (tableau 1).
| Échantillon | Absorbance |
| 0,2 µg N°2–/ml norme | |
| 0,4 µg N°2–/ml norme | |
| 0,6 µg N°2–/ml norme | |
| 0,8 µg N°2–/ml norme | |
| 1,0 µg N°2–/ml norme | |
| Diesel gaz d’échappement (au démarrage) | |
| Diesel gaz d’échappement (après l’exécution de 10 min) | |
| Essence d’échappement (au démarrage) | |
| Essence d’échappement (après l’exécution de 10 min) |
Le tableau 1. Tableau de données vides aux valeurs Records d’absorption.
Résultats
Le tableau 2 fournit un exemple des résultats corrects. En utilisant les mesures d’absorbance des solutions étalons, une parcelle de l’Absorbance par rapport à la Concentration de NO2– est possible (Figure 4). Ensuite, la meilleure ligne d’ajustement des données peut être déterminée. À l’aide de la ligne optimale de la courbe d’étalonnage, la concentration de NO2– dans chaque solution inconnue (µg/mL) peut être calculée. Cette valeur peut être convertie à la concentration de NO2 dans l’échantillon de gaz d’échappement selon l’équation suivante :
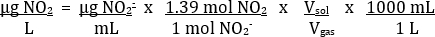
Basée sur l’équation équilibrée pas2 H2O vu précédemment, un mol 2 N°21 mol QU'AUCUN ratio2– n’est attendu. Dans les expériences empiriques, il s’est avéré pour être plus proche d’un ratio de 1.39:1. Le volume de solution utilisée était de 25 mL. Le volume de l’échantillon de gaz était de 35 mL.
La concentration de NO2 calculée représente en réalité tous les NOX dans l’échantillon de gaz d’échappement (tableau 3). L’équation pour la conversion entre ppmV et µg/L dépend de la température et la pression à laquelle les échantillons ont été prélevés. L’équation de conversion est :

Où R = constante universelle des gaz = 0.08206 atm· L/mol· K, P = pression atmosphérique en atm, T = température en K et MW = poids moléculaire de NOx (comme NO2) = 46.01 g/mol. Par conséquent,
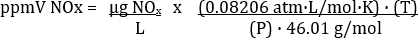
Il est important pour l’entrée T en K et P ATM.
| Échantillon | Absorbance |
| 0,2 µg N°2–/ml norme | 0,22 |
| 0,4 µg N°2–/ml norme | 0,43 |
| 0,6 µg N°2–/ml norme | 0,60 |
| 0,8 µg N°2–/ml norme | 0,79 |
| 1,0 µg N°2–/ml norme | 1.05 |
| Diesel gaz d’échappement (au démarrage) | 1.03 |
| Diesel gaz d’échappement (après l’exécution de 10 min) | 1.03 |
| Essence d’échappement (au démarrage) | 0,10 |
| Essence d’échappement (après l’exécution de 10 min) | 0,04 |
Le tableau 2. Table de données avec des résultats représentatifs de l’absorption.

La figure 4. Une parcelle de courbe d’étalonnage de l’Absorbance par rapport à la Concentration de NO2–.
| Véhicule | Aucune Concentration dex (ppm) |
| Voiture diesel (au démarrage) | 500 |
| Voiture diesel (après l’exécution de 10 minutes) | 500 |
| Voiture essence (au démarrage) | 48 |
| Voiture essence (après l’exécution de 10 minutes) | 21 |
Tableau 3. AUCUNx concentration (ppm) par véhicule.
Applications et Résumé
La mesure des nitrites en utilisant la réaction de Saltzman modifiée est très commune et très utile dans de nombreux domaines. Comme indiqué, la méthode peut servir à ne mesurer aucunsx de concentrations dans les échantillons d’air – voiture d’échappement, salles de laboratoire, qualité de l’air des villes, etc.. En outre, cette méthode peut servir à surveiller NOx dans la fumée de cigarette. La procédure serait très semblable à cette expérience, sauf au lieu de dessiner voiture d’échappement dans la seringue, la fumée de cigarette seront tirée. Il y a souvent une concentration plus élevée de NOx cigarette fumée que sortant de l’échappement des automobiles, qui tend à être surprenant pour beaucoup. Valeurs typiques pour NOx vont de la fumée de cigarette de 500 à 800 ppm.
Cette méthode peut également être utilisée pour tester les niveaux de nitrate produit en présence de bactéries de nitrification. Les bactéries de nitrification sont trouvent dans le sol et l’eau et jouent un rôle important dans le cycle de l’azote – oxydation de l’ammoniac en nitrite et nitrate alors. Les nitrates dans l’échantillon est d’abord converti en nitrite par l’enzyme réductase de nitrate. Puis le nitrite est mesuré à l’aide de la réaction de Saltzman modifiée. Enfin, cette méthode peut être utilisée pour déterminer la concentration de nitrates et de nitrites dans les produits alimentaires. Nitrites et nitrates sont ajoutés aux aliments principalement pour préserver des viandes et produits carnés. Une valeur typique pour les nitrites en charcuterie est environ 125 µg/mL.
Passer à...
Vidéos de cette collection:

Now Playing
Détermination des NOx dans les gaz d'échappement des voitures à l'aide de la spectroscopie UV-VIS
Environmental Science
30.3K Vues

Identification d'arbre : comment utiliser une clé dichotomique
Environmental Science
81.4K Vues

Enquête sur les arbres : méthode d'échantillonnage du quadrant centré sur un point
Environmental Science
49.5K Vues

Utilisation du SIG pour enquêter sur la foresterie urbaine
Environmental Science
12.7K Vues

Piles à combustible à membrane d'échange de protons
Environmental Science
22.2K Vues

Biocarburants : produire de l'éthanol à partir de matière cellulosique
Environmental Science
53.4K Vues

Tests pour identifier les aliments génétiquement modifiés
Environmental Science
90.1K Vues

Turbidité et solides totaux dans les eaux de surface
Environmental Science
35.9K Vues

Oxygène dissous dans les eaux de surface
Environmental Science
56.0K Vues

Nutriments dans les écosystèmes aquatiques
Environmental Science
39.0K Vues

Mesurer l'ozone troposphérique
Environmental Science
26.5K Vues

Analyse du plomb provenant du sol à l'aide de la spectroscopie d'absorption atomique
Environmental Science
125.8K Vues

Analyse du carbone et de l'azote des échantillons environnementaux
Environmental Science
29.6K Vues

Analyse des éléments nutritifs du sol : azote, phosphore et potassium
Environmental Science
216.2K Vues

Analyse des populations de vers de terre du sol
Environmental Science
16.6K Vues