Determinación de NOx en los gases de escape de los automóviles mediante espectroscopia UV-VIS
Visión general
Fuente: Laboratorios de Margaret obrero y Kimberly Frye - Universidad de Depaul
En la troposfera, ozono se forma naturalmente cuando la luz del sol divide el dióxido de nitrógeno (NO2):
NO2 + luz solar → NO + O
Oh + O2 → O3
Ozono (O3) puede pasar al reaccionar con el óxido nítrico (NO) para formar dióxido de nitrógeno (NO2) y oxígeno:
NO + O3 → NO2 + O2
El resultado no hay ganancia neta de ozono (O3). Sin embargo, con la producción antropogénica de ozono formando precursores (NO, NO2y compuestos orgánicos volátiles) a través de la combustión de combustibles fósiles, se han encontrado niveles elevados de ozono en la troposfera. Escape del vehículo de motor es una fuente significativa de estos precursores de formación de ozono: NO, NO2y compuestos orgánicos volátiles (COV). Por ejemplo, fuentes móviles constituyen casi el 60% de las emisiones de NO + NO2 .
En las altas temperaturas encontradas la cámara de combustión de un automóvil, nitrógeno y oxígeno del aire reaccionan para formar óxido nítrico (NO) y dióxido de nitrógeno (NO2):
N2.g + O2 (g)→ 2 NO(g)
2 NO(g) + O2.g→ 2 NO2.g
El óxido nítrico (NO) emitido en los gases de escape del coche poco a poco se oxida a dióxido de nitrógeno (NO2) en el aire ambiente. Esta mezcla de NO y NO2 se refiere a menudo como NOx. Cuando NOx reacciona con compuestos orgánicos volátiles en la atmósfera en presencia de luz solar, formas de ozono troposférico, como se ve en este habían simplificado de reacción química:
NOx + COV + luz solar → oh3 + otros productos
Esta mezcla nociva de la contaminación atmosférica, que puede incluir aldehídos, peroxyacetyl nitratos, ozono, compuestos orgánicos volátiles y NOx, se llama smog fotoquímico. El ozono es el mayor componente del smog fotoquímico. Esta contaminación se encuentra en todas las ciudades modernas, pero se encuentra sobre todo en ciudades con climas soleados, calientes, seco y gran cantidad de vehículos de motor. El color amarillo-marrón de smog en el aire es debido en parte al dióxido de nitrógeno presente, ya que este gas absorbe luz visible cerca de 400 nm (figura 1).
A corto plazo que no2 exposición (30 minutos a 1 día) conduce a efectos respiratorios adversos en personas sanas y el aumento de los síntomas respiratorios en las personas con asma. NOx reacciona con el amoníaco y otros compuestos a las partículas de la forma. Estas pequeñas partículas pueden penetrar en los pulmones y causar problemas respiratorios, incluyendo bronquitis y el enfisema. Personas que pasan mucho tiempo en la carretera o que viven cerca de un camino de experiencia exposición considerablemente mayor a2.
Debido al impacto que tiene sobre la salud humana y el medio ambiente, la Agencia de protección ambiental de Estados Unidos (EPA) ha clasificado NO2 como un contaminante criterio y ha establecido el estándar primario a 100 ppb (percentil 98 de las concentraciones máximas diarias 1-h, un promedio de más de 3 años) y 53 ppb (media anual). Teniendo en cuenta que en carretera vehículos representan aproximadamente 1/3 de ninguna emisión dex en los Estados Unidos, las emisiones de automóviles se regulan por lo tanto a través de la ley de aire limpio. La EPA establece normas de emisión que fabricantes de automóviles deben seguir cuando se producen los coches. En la actualidad, normas de emisiones Tier 2 establece que los fabricantes no deben tener media flotax las emisiones de no más de 0,07 g/milla.
Fabricantes de una manera de cumplir con esta norma es mediante el uso de convertidores catalíticos en sus coches. Este dispositivo se coloca entre el motor y el tubo de escape. La corriente de escape pasa por el convertidor catalítico y se expone a un catalizador. Un catalizador de reducción de platino y el rodio se usa para reducir la concentración dex NO en el escape. Cuando una molécula de2 NO o NO en los gases de escape en contacto con el catalizador, el átomo del nitrógeno se agarró de la molécula y mantuvieron por el catalizador. El oxígeno se libera y forma O2. El átomo del nitrógeno en el catalizador se une con otro átomo de nitrógeno en el catalizador a forma N2.
Convertidores catalíticos han reducido grandemente las emisiones de NOx de escape coche – hasta 80% de reducción, cuando se realiza correctamente. Sin embargo, sólo funcionan cuando han alcanzado una temperatura bastante alta. Por lo tanto, al realizar un arranque en frío de un vehículo, del convertidor catalítico está quitando prácticamente no NOx. No es hasta el convertidor catalítico alcanza mayores temperaturas que elimina eficazmente el NOx de la corriente de escape. Convertidores catalíticos no funcionan en los coches de pasajeros diesel debido a las magras condiciones bajo las cuales operan. Además, el sulfuro en combustible diesel también desactiva el catalizador. NOx en motores diesel se reducen principalmente a través de la válvula de recirculación (EGR) de gas de escape que enfría la temperatura de los gases de combustión. Como resultado, los coches diesel emiten generalmente más NOx que los coches de gasolina.

Figura 1. Coloración característica de smog en California en la nube beige banco detrás del puente Golden Gate. La coloración marrón es debido al NOx en el smog fotoquímico.
Principios
En este experimento, la concentración de NOx en la corriente de escape de varias marcas de automóviles se miden dos veces (al inicio y después de 10 min) para estudiar la capacidad del catalizador del vehículo NOx sacar los gases de escape. El catalizador requiere una alta temperatura para ser eficaz. Por lo tanto, la medición de los gases de escape sobre la puesta en marcha del coche representa la cantidad de NOx en el escape sin el funcionamiento del convertidor catalítico. La medición de los gases de escape después de 10 minutos representa la cantidad de NOx en los gases de escape después del convertidor catalítico está en efecto.
La concentración dex NO se determina colorimétricamente por diazotizacíon de ácido sulfanílico y posterior reaccionando con N-(1-naphthyl)-etilendiamina y medir la intensidad del color de la molécula del tinte de azo resultante usando un espectrofotómetro UV-VIS fijado en 550 nm.
En la solución, NO y NO2 experimentan las siguientes reacciones para formar2–:
2 NO2.g + H2O(l) → 2 H+(aq) + NO2–(aq) + NO3–(aq)
4No(g) + O2.g + 2 H2O(l) → 4 NO2–(aq) + 4 H+(aq)
Aunque la relación esperada entre NO2 y NO2– es 2:1 basado en la primera ecuación enumerada anteriormente, ha sido determinar empíricamente para ser 1.39:1.
Cuando se agregan a la solución de ácido sulfanílico y N-(1-naphthyl)-etilendiamina, una molécula de color rosa desarrolla (figura 2).
La concentración de esta molécula de color rosa es directamente proporcional a la concentración de NOx en la solución. La concentración de la molécula del tinte de azo se mide mediante un espectrofotómetro UV-VIS a 550 nm.
Espectroscopía UV-VIS se basa en la medición de la absorbancia (A) de soluciones en un contenedor transparente de b ancho (en cm). La concentración de la especie absorbente es directamente proporcional a la absorbancia, como se ve en la siguiente ecuación:
A =  b c
b c
donde  es la absortividad molar. Esta ecuación se conoce como ley de Beer. La absortividad molar es una medida de cómo fuertemente una sustancia absorbe luz a una determinada longitud de onda y es una constante para una sustancia dada.
es la absortividad molar. Esta ecuación se conoce como ley de Beer. La absortividad molar es una medida de cómo fuertemente una sustancia absorbe luz a una determinada longitud de onda y es una constante para una sustancia dada.
Para medir la absorbancia de una solución, un haz de luz con intensidad Io está dirigido a la solución en una cubeta (figura 3). La intensidad de la viga de entrada (Io) y el rayo emergente (I) se miden, y se calcula la absorbancia:


Figura 2. Una molécula de color rosa que se presenta cuando el ácido sulfanílico y N-(1-naphthyl)-etilendiamina se agregan a la solución.

Figura 3. Un haz de luz con intensidad Io encaminadas a la solución en una cubeta.
Procedimiento
1. preparación de solución madre de nitrito (NO2–)
- Pesa 1,500 g NaNO2 y agregar a un matraz aforado de 1 L.
- Diluir hasta la marca usando el nanopure agua. (Compruebe el agua destilada del grifo – puede contener suficiente nitrito para interferir con las mediciones). Esto no produce una 1.000 μg solución2–/ml.
- Para hacer un 5.0 μg2–/ml solución, no tomar 1 mL de los 1.000 μg2 -/mL solución y diluir a 200 mL en un matraz aforado.
2. preparación de ninguna solución de indicadorx
- Pesar 5,0 g de ácido sulfanílico anhidro y agregar a un matraz aforado de 1 L.
- Añadir 500 mL de agua nanopure.
- Añadir 140 mL de ácido acético glacial.
- Utilizando una barra de agitación, agitar la solución hasta que se disuelva el ácido sulfanílico. Esto toma aproximadamente 30 minutos.
- Pesar 0,020 g de N-(1-naphthyl)-etilendiamina diclorhidrato y añadir al matraz volumétrico.
- Diluir hasta la marca usando el nanopure agua.
- Transferir a una botella oscura (para evitar la fotodescomposición) y el tapón firmemente (para evitar la reacción con el aire).
3. preparación de patrones de calibración
- Colocar 1.0 mL de la 5.0 μg2–/ml solución en un matraz aforado de 25 mL y diluir con la solución de indicador de NOx a la marca. Esto no hace un 0,2 μg solución patrón de2–/ml.
- Colocar 2.0 mL de la 5.0 μg2–/ml solución en un matraz aforado de 25 mL y diluir con la solución de indicador de NOx a la marca. Esto no hace un 0,4 μg solución patrón de2–/ml.
- Poner 3,0 mL de la 5.0 μg solución2–/ml en un matraz aforado de 25 mL y diluir con la solución de indicador de NOx a la marca. Esto no hace un 0,6 μg solución patrón de2–/ml.
- Poner 4,0 mL de la 5.0 μg solución2–/ml en un matraz aforado de 25 mL y diluir con la solución de indicador de NOx a la marca. Esto no hace un 0,8 μg solución patrón de2–/ml.
- Poner 5,0 mL de la 5.0 μg solución2–/ml en un matraz aforado de 25 mL y diluir con la solución de indicador de NOx a la marca. Esto no hace un 1,0 μg solución patrón de2–/ml.
4. creación de la curva estándar
- Utilizando un espectrofotómetro UV-VIS, configurar el instrumento para leer absorbancia.
- Establecer la longitud de onda de 550 nm en el espectrofotómetro.
- Usando la solución de indicador de NOx , a cero el espectrofotómetro.
- Medir la absorbancia de las soluciones estándar 5. Valores de registros en la tabla de datos (tabla 1).
5. automóvil escape muestra medida
- Empiece el automóvil de motor diesel.
- Utilizando una jeringa de 60 mL estanqueidad, insértela de unas cuantas pulgadas en el tubo de escape. Evitar quemaduras y no respirar los humos. Atraer y expulsar los gases de escape dos veces para la jeringa de la condición.
- Extraer 25 mL de la solución de indicador de NOx en la jeringa. Expulsar todo el aire de la jeringa sin derramar la solución indicadora.
- Dibujar 35 mL de escape dentro de la jeringa, tirando el émbolo hasta la marca de 60 mL.
- Tapa de la jeringa. Agite la solución en la jeringa por 2 minutos tapa la jeringa con papel de aluminio.
- Medir la temperatura del aire en el tubo de escape al recoger las muestras.
- Repita los pasos 5.1-5.6 utilizando un automóvil con motor de gasolina. Estos pasos pueden repetirse tantas veces como se desee, utilizando varios modelos de automóviles.
- Repita los pasos 5.1-5.6 después de que los automóviles han sido funcionando por lo menos 10 minutos.
- Esperar 45 minutos para permitir que el color se desarrolle, antes de medir la absorbancia de la solución.
- Después de 45 min para arriba, expulsar el gas de la jeringa, colocar la solución en una cubeta y medir la absorbancia con el espectrofotómetro a 550 nm. Valores de registros en la tabla de datos (tabla 1).
| Muestra | Absorbancia |
| 0,2 μg NO2–/ml estándar | |
| 0.4 μg NO2–/ml estándar | |
| 0,6 μg NO2–/ml estándar | |
| 0,8 μg NO2–/ml estándar | |
| 1,0 μg NO2–/ml estándar | |
| Diesel coche escape (al inicio) | |
| Diesel coche escape (después de correr 10 min) | |
| Gasolina coche escape (al inicio) | |
| Gasolina coche escape (después de correr 10 min) |
Tabla 1. Tabla de datos en blanco para grabamos valores de absorción.
Resultados
La tabla 2 proporciona un ejemplo de resultados adecuados. Utilizando las mediciones de absorbancia de las soluciones estándar, una parcela de absorbancia vs concentración de NO2– es posible (figura 4). Entonces, se puede determinar la mejor línea de ajuste de los datos. Utilizando la línea de mejor ajuste de la curva estándar, se puede calcular la concentración de NO2– en cada solución desconocida (μg/mL). Este valor puede ser convertido a la concentración de NO2 en la muestra de gases de escape mediante la siguiente ecuación:
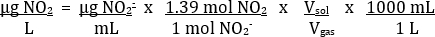
No basado en la ecuación balanceada de NO2 en H2O visto previamente, un mol 2 mol21 no se prevé que ninguna relación2– . En experimentos empíricos, se ha encontrado para ser más cerca de una relación de 1.39:1. El volumen de solución utilizado fue de 25 mL. El volumen de la muestra de gas fue de 35 mL.
La concentración de NO2 calculado realmente representa todo de NOX en la muestra de escape (tabla 3). La ecuación para la conversión entre ppmV y μg/L depende de la temperatura y la presión a la que se recolectaron las muestras. La ecuación de conversión es:

Donde R = constante de gas universal = 0.08206 atm· L/mol· K, P = presión atmosférica en atm, T = temperatura en K y MW = peso molecular de NOx (como2) = 46.01 g/mol. Por lo tanto,
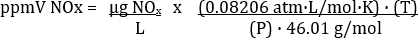
Es importante a la entrada T en K y P en atm.
| Muestra | Absorbancia |
| 0,2 μg NO2–/ml estándar | 0.22 |
| 0.4 μg NO2–/ml estándar | 0.43 |
| 0,6 μg NO2–/ml estándar | 0.60 |
| 0,8 μg NO2–/ml estándar | 0,79 |
| 1,0 μg NO2–/ml estándar | 1.05 |
| Diesel coche escape (al inicio) | 1.03 |
| Diesel coche escape (después de correr 10 min) | 1.03 |
| Gasolina coche escape (al inicio) | 0.10 |
| Gasolina coche escape (después de correr 10 min) | 0.04 |
Tabla 2. Tabla de datos con resultados representativos de absorción.

Figura 4. Una parcela estándar de la curva de absorbancia vs concentración de NO2–.
| Vehículo | Concentración de NOx (ppm) |
| Coche diesel (al inicio) | 500 |
| Coche diesel (después de correr 10 minutos) | 500 |
| Coche de gasolina (al inicio) | 48 |
| Coche de gasolina (después de correr 10 minutos) | 21 |
Tabla 3. NOx la concentración (ppm) por vehículo.
Aplicación y resumen
La medición de nitrito utilizando la reacción de Saltzman modificada es muy común y útil en muchos campos diferentes. Como se ha descrito, el método puede utilizarse para no medir las concentraciones dex en muestras de aire, escape de coches, salas de laboratorio, la calidad del aire de las ciudades, etcetera. Además, este método puede utilizarse para supervisar ningunax en el humo del cigarrillo. El procedimiento sería muy similar a este experimento, excepto en el lugar de escape de coche de dibujo en la jeringa, se elaborará el humo del cigarrillo. Suele haber una mayor concentración de NOx en cigarrillo humo que saliendo del tubo de escape de automóviles, que tiende a ser sorprendente para muchos. Valores típicos de NOx en humo del cigarrillo entre 500-800 ppm.
Este método también puede utilizarse para probar los niveles de nitrato producido en presencia de bacterias de nitrificación. Bacterias de nitrificación se encuentran en el suelo y el agua y juegan un papel importante en el ciclo del nitrógeno: oxidan el amoníaco a nitrito y luego nitrato. El nitrato en la muestra primero se convierte en nitrito por la enzima reductasa de nitrato. Luego el nitrito se mide mediante la reacción de Saltzman modificada. Por último, este método puede ser usado para determinar la concentración de nitratos y nitritos en los productos alimenticios. Nitritos y nitratos se agregan a la alimentación principalmente para conservar carnes y productos cárnicos. Un valor típico para nitritos en carnes curadas es aproximadamente 125 μg/mL.
Saltar a...
Vídeos de esta colección:

Now Playing
Determinación de NOx en los gases de escape de los automóviles mediante espectroscopia UV-VIS
Environmental Science
30.1K Vistas

Identificación del árbol: Cómo utilizar una clave dicotómica
Environmental Science
81.3K Vistas

Encuesta sobre árboles: Método de muestreo de cuartos centrados en puntos
Environmental Science
49.4K Vistas

Uso de SIG para investigar silvicultura urbana
Environmental Science
12.6K Vistas

Pilas de combustible de membrana de intercambio protónico
Environmental Science
22.1K Vistas

Biocombustibles: Producción etanol a partir de material celulósico
Environmental Science
53.3K Vistas

Pruebas para alimentos modificados genéticamente
Environmental Science
89.8K Vistas

Turbidez y sólidos totales en aguas superficiales
Environmental Science
35.9K Vistas

Oxígeno disuelto en aguas superficiales
Environmental Science
55.8K Vistas

Nutrientes en ecosistemas acuáticos
Environmental Science
38.9K Vistas

Medición de ozono troposférico
Environmental Science
26.5K Vistas

Análisis de plomo en el suelo mediante espectroscopia de absorción atómica
Environmental Science
125.5K Vistas

Análisis de carbono y nitrógeno en muestras ambientales
Environmental Science
29.5K Vistas

Análisis de nutrientes del suelo: Nitrógeno, fósforo y potasio
Environmental Science
216.0K Vistas

Análisis de poblaciones de lombrices en el suelo
Environmental Science
16.5K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados