Oxygène dissous dans les eaux de surface
Vue d'ensemble
Source : Laboratoires de Margaret Workman et Kimberly Frye - Depaul University
Oxygène dissous (DO) mesures de calculer la quantité d’oxygène gazeux dissous dans les eaux de surface, ce qui est important pour toute la vie respirant de l’oxygène dans les écosystèmes du fleuve, y compris les espèces de poisson préférées pour la consommation humaine (p. ex. crapet arlequin et basse), ainsi que des espèces de décomposeurs critiques pour le recyclage de matériaux biogéochimiques dans le système.
L’oxygène dissous dans les lacs, rivières et Océans est cruciale pour les organismes et les créatures qui vivent dedans. Que la quantité d’oxygène dissous tombe au-dessous des niveaux normaux en plans d’eau, la qualité de l’eau est bafouée et créatures commencent à mourir. Dans un processus appelé eutrophisation, un plan d’eau peut devenir hypoxique et ne sera plus en mesure d’appuyer les organismes vivants, essentiellement devenir une « zone morte ».
L’eutrophisation se produit lorsque les nutriments en excès provoquent des populations d’algues à croître rapidement dans une prolifération des algues. Les efflorescences algales forme des tapis denses à la surface de l’eau en bloquant deux intrants essentiels de l’oxygène de l’eau : gaz change de l’atmosphère et la photosynthèse dans l’eau en raison du manque de lumière en dessous du tapis. Comme l’oxygène dissous niveaux diminuent au-dessous de la mortalité des organismes surface, respirant de l’oxygène en grande quantité, créant une augmentation en matière organique. Les causes de l’excès de matière organique une augmentation dans les populations de décomposeurs respirant de l’oxygène dans la zone benthique, qui outre épuise l’oxygène dissous restant niveaux durant l’activité métabolique de la décomposition. Dès que les niveaux d’oxygène devient cette espèce de respiration d’oxygène faible et mobile (p. ex. poissons) va s’éloigner, laissant sans vie aérobie dans l’eau et la création d’une zone morte.
La méthode de titration de l’azoture-Winkler utilise titrage pour déterminer la concentration d’un inconnu dans un échantillon. Plus précisément, du thiosulfate de sodium est utilisé pour titrer l’iode, qui peut être stoechiométriquement reliée à la quantité d’oxygène dissous dans un échantillon.
Principles
La méthode de Winkler-Azide sert à mesurer le sur le site, où est recueillie les eaux de surface. Hydroxyde de potassium et de sulfate de manganèse (II) sont ajoutés à l’échantillon, et l’oxygène dissous dans l’échantillon s’oxyde du manganèse et forme un précipité brun. Azoture est ajouté sous la forme d’un réactif acheté iodure alcalin-azide pour corriger la présence de nitrites, qui se retrouvent dans les échantillons d’eaux usées et peuvent interférer avec la procédure d’oxydation de Winkler.
MnSO4 + 2 KOH  Mn(OH)2 + K2SO4
Mn(OH)2 + K2SO4
4 Mn(OH)2 + O2 + 2 H2O  4 Mn(OH)3
4 Mn(OH)3
L’acide sulfurique est ensuite ajouté pour acidifier la solution, et le précipité se dissout. Dans ces conditions, l’iodure de réactif dans la solution alcaline iodure-azoture est converti en iode.
2 Mn(OH)3 + 3 H2SO4  Mn2(SO4)3 + 6 H2O
Mn2(SO4)3 + 6 H2O
Mn2(SO4)3 + 2 KI  2 MnSO4 + K2SO4 + 2 J’ai2
2 MnSO4 + K2SO4 + 2 J’ai2
Le thiosulfate est ensuite utilisé pour titrer l’iode en présence d’un indicateur à l’amidon ajouté.
4 Na2S2O3 + 2 J’ai2  2 Na2S4O6 + 4 NaI
2 Na2S4O6 + 4 NaI
4 moles de S2O32 -  1 mole d’O2
1 mole d’O2
Au point de terminaison de ce titrage, la solution bleue deviendra claire. La quantité d’oxygène dissous dans l’échantillon est quantifiée en proportion directe de la quantité de thiosulfate nécessaire pour atteindre le point de terminaison.
X mL S2O3  X mg/L o :
X mg/L o :
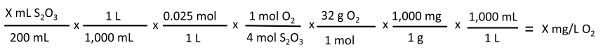
Procédure
1. échantillon dissous à mesure de l’oxygène
- Sur le site de collecte de l’eau, utilisez une pipette calibrée pour ajouter le sulfate de manganèse 2 mL pour une bouteille BOD clair 300 mL rempli avec l’échantillon d’eau. Veillez à ne pas introduire d’oxygène dans l’échantillon en insérant l’embout de la pipette sous la surface de l’échantillon et de distribution soigneusement sulfate de manganèse. Ceci évitera de créer des bulles jusqu'à ce que l’échantillon est « fixée » et empêche le changement de la concentration en oxygène dissous.
- En utilisant la même technique, ajouter 2 mL de réactif d’iodure alcalin-azoture.
- Immédiatement, insérer le bouchon, en inclinant la bouteille légèrement et rapidement poussant le bouchon en place donc aucuns bulles d’air ne sont emprisonnées dans la bouteille.
- Soigneusement inverser plusieurs fois (sans créer de bulles d’air) pour mélanger. Un floccule (floc) formeront une agrégation précipité du matériau avec un aspect nuageux (Figure 1).
- Attendez que le floc dans la solution a réglé. Encore une fois, retourner le flacon plusieurs fois et attendre que le floc est retombée. L’échantillon est fixé maintenant pour empêcher un changement dans la teneur en oxygène dissous et peut être transporté vers le laboratoire et stockée pendant 8 h, si nécessaire, dans un état de frais et sombre.
- Si Ranger, échantillons devraient être scellés à l’aide d’une petite quantité d’eau désionisée jeté autour du bouchon, et le bouchon doit être enroulé dans du papier d’aluminium, fixé avec un élastique.
- Pipeter 2 mL d’acide sulfurique concentré dans l’échantillon en tenant l’extrémité de la pipette juste au-dessus de la surface de l’échantillon. Il faut inverser soigneusement plusieurs fois de dissoudre le floc (Figure 2).
- Dans une fiole de verre et à l’aide d’une pipette calibrée, titrer 200 mL d’échantillon d’eau avec 0,025 que n standardisé de thiosulfate de sodium, tourbillonnant et mélanger en continu jusqu'à une forme de couleur paille pâle (Figure 3).
- Ajouter 2 mL de solution indicatrice d’amidon avec un compte-gouttes et agiter pour mélanger. Une fois la fécule indicateur est ajouté, la solution sera vire au bleue (Figure 4).
- Poursuivre le titrage, en ajoutant une goutte à la fois jusqu'à ce qu’une goutte se dissipe le bleu, causant le point de terminaison incolore. N’oubliez pas d’ajouter chaque goutte de solution titrante soigneusement et mélanger uniformément chaque goutte avant d’ajouter le suivant. Maintenant l’échantillon contre une feuille blanche de papier peut aider à améliorer la visualisation du point de terminaison.
- La concentration de DO est équivalente au volume (mL) de solution titrante utilisé. Chaque millilitre de thiosulfate de sodium ajouté à l’eau échantillon est égal à 1 mg/L dissous d’oxygène.

La figure 1. Un échantillon après que le réactif iodure alcalin-azide a été ajouté et mélangé, montrant la formation floc dans la partie supérieure de l’échantillon avant de s’installer.

La figure 2. Un échantillon avec floc dissous après addition d’acide sulfurique.

La figure 3. Un échantillon après addition de thiosulfate de sodium affichant une couleur paille pâle.

La figure 4. Un exemple montrant la couleur bleue après l’indicateur à l’amidon est ajouté et mélangé.
Résultats
Une teneur en oxygène dissous de 6 mg/L est suffisant pour les espèces plus aquatiques. Teneurs en oxygène dissous inférieures à 4 mg/L sont stressantes pour la plupart des animaux aquatiques. Teneurs en oxygène dissous inférieures à 2 mg/L ne prendra pas en charge la vie aquatique aérobie (Figure 5).
La quantité maximale d’oxygène qui peut être dissous dans l’eau varie selon la température (tableau 1).
Mesures d’en mg/L sont converties en % de saturation à l’aide de la température de l’eau et le tableau de conversion ci-dessous (Figure 6).
DISSOUT LES TENEURS EN OXYGÈNE (SATURATION %)
Excellent : 91 – 110
Bon : 71-90
Foire/salon : 51 à 70
Médiocre : < 50
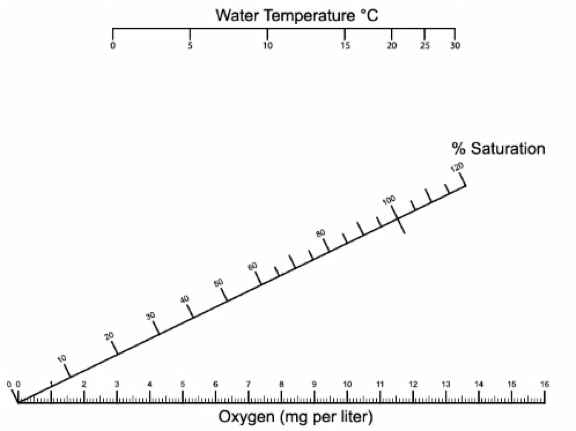
Figure 5. FAIRE les mesures sont converties en % de saturation à l’aide de la température de l’eau. Température de l’eau sur l’axe horizontal supérieur et la valeur mesurée sur l’axe horizontal du fond. Utilisez une règle pour tracer une ligne entre les deux valeurs et enregistrer où la ligne rejoint le milieu axe diagonal pour % de saturation.

Figure 6. Une teneur en oxygène dissous de 6 mg/L est suffisant pour la plupart des espèces aquatiques. Teneurs en oxygène dissous inférieures à 4 mg/L sont stressantes pour la plupart des animaux aquatiques. Teneurs en oxygène dissous inférieures à 2 mg/L ne soutiendra pas de poisson et moins de 1 mg/L ne soutiendra pas la plupart des espèces.
| Temp. (° C) | (Mg/L) | Temp. (° C) | (Mg/L) | Temp. (° C) | (Mg/L) | Temp. (° C) | (Mg/L) |
| 0 | 14.60 | 11 | 11.01 | 22 | 8.72 | 33 | 7.16 |
| 1 | 14.19 | 12 | 10.76 | 23 | 8.56 | 34 | 7.16 |
| 2 | 13.81 | 13 | 10.52 | 24 | 8.40 | 35 | 6.93 |
| 3 | 13.44 | 14 | 10.29 | 25 | 8.24 | 36 | 6.82 |
| 4 | 13.09 | 15 | 10.07 | 26 | 8.09 | 37 | 6.71 |
| 5 | 12,75 | 16 | 9.85 | 27 | 7,95 | 38 | 6.61 |
| 6 | 12.43 | 17 | 9,65 | 28 | 7,81 | 39 | 6.51 |
| 7 | 12.12 | 18 | 9 h 45 | 29 | 7,67 | 40 | 6.41 |
| 8 | 11,83 | 19 | 9.26 | 30 | 7.54 | 41 | 6.41 |
| 9 | 11 h 55 | 20 | 9.07 | 31 | 7.41 | 42 | 6.22 |
| 10 | 11.27 | 21 | 8,90 | 32 | 7.28 | 43 | 6.13 |
Le tableau 1. Montants maximaux de l’oxygène qui peut être dissous dans l’eau par la température.
Applications et Résumé
Cours d’eau lents sont particulièrement vulnérables à de faibles concentrations, et dans des cas extrêmes, ces niveaux peut conduire à des conditions d’hypoxie, création de « zones mortes » où la vie aérobie n’est plus supportée par un plan d’eau (Figure 7). Une fois les plantes et les animaux Herxheimer, l’accumulation de sédiments qui se produit peut également déclencher le lit de la rivière, permettant aux plantes de coloniser au fil de l’eau et pourrait conduire à la perte de la rivière tous ensemble (Figure 8). Eaux de surface à des altitudes plus élevées sont également plus vulnérables à de faibles concentrations, comme la pression atmosphérique diminue avec l’altitude et moins l’oxygène gazeux est suspendue dans l’eau.
Niveaux bas faire appuyer les formes de vie considérée comme désagréables ou impropres à l’usage humain, y compris les sangsues et les vers aquatiques (Oligochaeta).
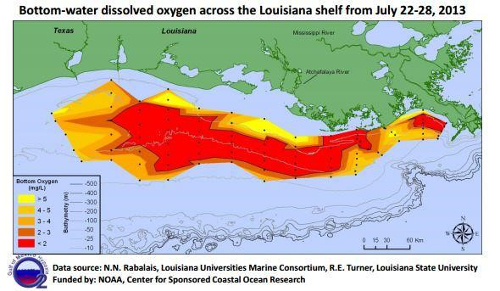
La figure 7. Carte des concentrations d’oxygène dissous dans l’ensemble de la plate-forme de la Louisiane montrant la région zone morte.

La figure 8. Photographie de la mer Caspienne, montrant l’eutrophisation sévère dans l’extrémité nord.
Passer à...
Vidéos de cette collection:

Now Playing
Oxygène dissous dans les eaux de surface
Environmental Science
56.0K Vues

Identification d'arbre : comment utiliser une clé dichotomique
Environmental Science
81.4K Vues

Enquête sur les arbres : méthode d'échantillonnage du quadrant centré sur un point
Environmental Science
49.5K Vues

Utilisation du SIG pour enquêter sur la foresterie urbaine
Environmental Science
12.7K Vues

Piles à combustible à membrane d'échange de protons
Environmental Science
22.2K Vues

Biocarburants : produire de l'éthanol à partir de matière cellulosique
Environmental Science
53.5K Vues

Tests pour identifier les aliments génétiquement modifiés
Environmental Science
90.1K Vues

Turbidité et solides totaux dans les eaux de surface
Environmental Science
35.9K Vues

Nutriments dans les écosystèmes aquatiques
Environmental Science
39.0K Vues

Mesurer l'ozone troposphérique
Environmental Science
26.5K Vues

Détermination des NOx dans les gaz d'échappement des voitures à l'aide de la spectroscopie UV-VIS
Environmental Science
30.3K Vues

Analyse du plomb provenant du sol à l'aide de la spectroscopie d'absorption atomique
Environmental Science
126.1K Vues

Analyse du carbone et de l'azote des échantillons environnementaux
Environmental Science
29.6K Vues

Analyse des éléments nutritifs du sol : azote, phosphore et potassium
Environmental Science
216.2K Vues

Analyse des populations de vers de terre du sol
Environmental Science
16.6K Vues