Oxigênio dissolvido em Águas Superficiais
Visão Geral
Fonte: Laboratórios de Margaret Workman e Kimberly Frye - Universidade Depaul
As medições de oxigênio dissolvido (DO) calculam a quantidade de oxigênio gasoso dissolvido em águas superficiais, o que é importante para toda a vida respiratória de oxigênio nos ecossistemas fluviais, incluindo espécies de peixes preferidas para consumo humano (por exemplo, bluegill e baixo), bem como espécies decompor críticas à reciclagem de materiais biogeoquímicos no sistema.
O oxigênio dissolvido em lagos, rios e oceanos é crucial para os organismos e criaturas que vivem nele. À medida que a quantidade de oxigênio dissolvido cai abaixo dos níveis normais nos corpos d'água, a qualidade da água é prejudicada e as criaturas começam a morrer. Em um processo chamado eutrofização, um corpo de água pode se tornar hipóxico e não será mais capaz de suportar organismos vivos, tornando-se essencialmente uma "zona morta".
A eutrofização ocorre quando o excesso de nutrientes faz com que as populações de algas cresçam rapidamente em uma flor de algas. A flor de algas forma tapetes densos na superfície da água bloqueando duas entradas essenciais de oxigênio para a água: troca de gás da atmosfera e fotossíntese na água devido à falta de luz abaixo dos tapetes. À medida que os níveis de oxigênio dissolvidos diminuem abaixo da superfície, organismos respiradores de oxigênio morrem em grandes quantidades, criando um aumento na matéria orgânica. O excesso de matéria orgânica causa um aumento nas populações de decomposição respiratória de oxigênio na zona benthic, o que esgota ainda mais os níveis de oxigênio dissolvidos restantes durante a atividade de decomposição metabólica. Uma vez que os níveis de oxigênio se tornem tão baixos, as espécies móveis de respiração de oxigênio (por exemplo, peixes) se afastarão, não deixando vida aeróbica na água e criando uma zona morta.
O método de titulação Azide-Winkler usa titulação para determinar a concentração de um desconhecido em uma amostra. Especificamente, o tiossulfato de sódio é usado para titular iodo, que pode estar estequiometricamente relacionado com a quantidade de oxigênio dissolvido em uma amostra.
Princípios
O método Azide-Winkler é usado para medir o DO no local, onde a água superficial é coletada. Sulfato de manganês(II) e hidróxido de potássio são adicionados à amostra, e o oxigênio dissolvido na amostra oxida o manganês e forma um precipitado marrom. Azide é adicionado na forma de um reagente alcalino-azide comprado para corrigir a presença de nitritos, que são encontrados em amostras de águas residuais e podem interferir com o procedimento de oxidação winkler.
MnSO4 + 2 KOH  Mn(OH)2 + K2SO4
Mn(OH)2 + K2SO4
4 Mn(OH)2 + O2 + 2 H2O  4 Mn(OH)3
4 Mn(OH)3
O ácido sulfúrico é então adicionado para acidificar a solução, e o precipitado se dissolve. Nessas condições, o iodeto do reagente alcalino iodida-azide na solução é convertido em iodo.
2 Mn(OH)3 + 3 H2SO4  Mn2(SO4)3 + 6 H2O
Mn2(SO4)3 + 6 H2O
Mn2(SO4)3 + 2 KI  2 MnSO4 + K2SO4 + 2 I2
2 MnSO4 + K2SO4 + 2 I2
O tiossulfato é então usado para titular o iodo na presença de um indicador de amido adicionado.
4 Na2S2O3 + 2 I2  2 na2S4o6 + 4 Nai
2 na2S4o6 + 4 Nai
4 mols de S2O32-1  mole de O2
mole de O2
No ponto final desta titulação, a solução azul ficará clara. A quantidade de oxigênio dissolvido na amostra é quantificada em proporção direta à quantidade de tiosulfato necessária para chegar ao ponto final.
X mL S2O3  X mg/L O:
X mg/L O:
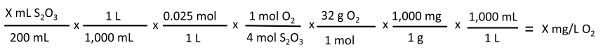
Procedimento
1. Medição de oxigênio dissolvido da amostra
- No local de coleta de água, use uma pipeta calibrada para adicionar sulfato de 2 mL manganous a uma garrafa de BOD de 300 mL clara cheia com a água da amostra. Tenha cuidado para não introduzir oxigênio na amostra inserindo a ponta da pipeta sob a superfície da amostra e distribuindo cuidadosamente sulfato manganous. Isso evitará criar bolhas até que a amostra seja "fixada" e evitará mudanças na concentração de oxigênio dissolvida.
- Usando a mesma técnica, adicione 2 mL de reagente de iodeto alcalino-azide.
- Insira imediatamente a rolha, inclinando a garrafa ligeiramente e empurrando rapidamente a rolha no lugar para que nenhuma bolha de ar fique presa na garrafa.
- Inverta cuidadosamente várias vezes (sem criar bolhas de ar) para misturar. Um flocule (floc) se formará a partir de uma agregação precipitada de material com aparência nublada(Figura 1).
- Espere até que o floc na solução tenha resolvido. Novamente, inverta a garrafa várias vezes e espere até que o floc tenha se estabelecido. A amostra agora é fixada para evitar alterações no teor de oxigênio dissolvido, e pode ser transportada de volta para o laboratório e armazenada por até 8h, se necessário, em uma condição fria e escura.
- Se armazenar, as amostras devem ser seladas usando uma pequena quantidade de água deionizada esguichada ao redor da rolha, e a rolha deve ser enrolada em papel alumínio, presa com um elástico.
- Pipeta 2 mL de ácido sulfúrico concentrado na amostra, segurando a ponta da pipeta logo acima da superfície da amostra. Inverter cuidadosamente várias vezes para dissolver o floco(Figura 2).
- Em um frasco de vidro, e usando uma pipeta calibrada, titular 200 mL de água de amostra com tiossulfato de sódio padronizado de 0,025 N, girando e misturando continuamente até formar uma cor de palha pálida(Figura 3).
- Adicione 2 mL de solução indicadora de amido com um retirador e redemoinho para misturar. Uma vez adicionado o indicador de amido, a solução ficará azul(Figura 4).
- Continue a titulação, adicionando uma gota de cada vez até que uma gota dissipa o azul, causando o ponto final incolor. Certifique-se de adicionar cada gota de titrant cuidadosamente e misturar uniformemente cada gota antes de adicionar a próxima. Segurar a amostra contra um pedaço de papel branco pode ajudar a melhorar a visualização do ponto final.
- A concentração de DO é equivalente ao volume (mL) do titulante utilizado. Cada mililitro de tiossulfato de sódio adicionado à amostra de água equivale a 1 mg/L de oxigênio dissolvido.

Figura 1. Uma amostra após o reagente alcalino iodida-azide foi adicionada e misturada, mostrando a formação de floco no topo da amostra antes de se estabelecer.

Figura 2. Uma amostra com floco dissolvido após a adição de ácido sulfúrico.

Figura 3. Uma amostra após a adição de tiossulfato de sódio exibindo uma cor de palha pálida.

Figura 4. Uma amostra mostrando a cor azul após o indicador de amido é adicionada e misturada.
Resultados
Um nível de oxigênio dissolvido de 6 mg/L é suficiente para a maioria das espécies aquáticas. Níveis de oxigênio dissolvidos abaixo de 4 mg/L são estressantes para a maioria dos animais aquáticos. Níveis de oxigênio dissolvidos abaixo de 2 mg/L não suportarão vida aquática aeróbica(Figura 5).
A quantidade máxima de oxigênio que pode ser dissolvida na água varia de acordo com a temperatura(Tabela 1).
As medidas do em mg/L são convertidas em % saturação utilizando a temperatura da água e o gráfico de conversão abaixo (Figura 6).
NÍVEIS DE OXIGÊNIO DISSOLVIDOS (% SATURAÇÃO)
Excelente: 91 – 110
Bom: 71 – 90
Feira: 51 – 70
Pobre: < 50
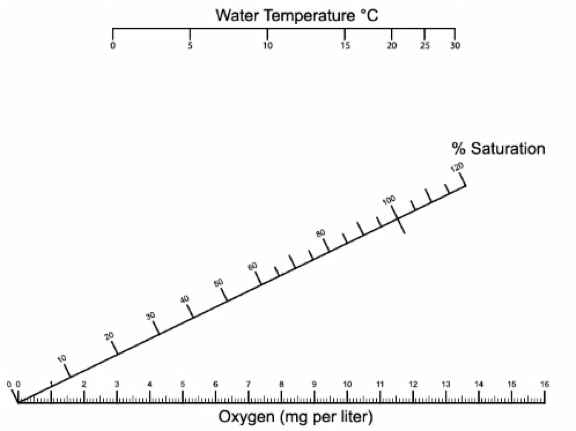
Figura 5. As medidas do são convertidas em % saturação usando a temperatura da água. A temperatura da água no eixo horizontal superior e o valor DO medido no eixo horizontal inferior. Use uma régua para desenhar uma linha entre os dois valores e registrar onde a linha encontra o eixo diagonal médio para % de saturação.

Figura 6. Um nível de oxigênio dissolvido de 6 mg/L é suficiente para a maioria das espécies aquáticas. Níveis de oxigênio dissolvidos abaixo de 4 mg/L são estressantes para a maioria dos animais aquáticos. Níveis de oxigênio dissolvidos abaixo de 2 mg/L não suportarão peixes e abaixo de 1 mg/L não suportarão a maioria das espécies.
| Temperatura(°C) | DO (mg/L) | Temperatura(°C) | DO (mg/L) | Temperatura(°C) | DO (mg/L) | Temperatura(°C) | DO (mg/L) |
| 0 | 14.60 | 11 | 11.01 | 22 | 8.72 | 33 | 7.16 |
| 1 | 14.19 | 12 | 10.76 | 23 | 8.56 | 34 | 7.16 |
| 2 | 13.81 | 13 | 10.52 | 24 | 8.40 | 35 | 6.93 |
| 3 | 13.44 | 14 | 10.29 | 25 | 8.24 | 36 | 6.82 |
| 4 | 13.09 | 15 | 10.07 | 26 | 8.09 | 37 | 6.71 |
| 5 | 12.75 | 16 | 9.85 | 27 | 7.95 | 38 | 6.61 |
| 6 | 12.43 | 17 | 9.65 | 28 | 7.81 | 39 | 6.51 |
| 7 | 12.12 | 18 | 9.45 | 29 | 7.67 | 40 | 6.41 |
| 8 | 11.83 | 19 | 9.26 | 30 | 7.54 | 41 | 6.41 |
| 9 | 11.55 | 20 | 9.07 | 31 | 7.41 | 42 | 6.22 |
| 10 | 11.27 | 21 | 8.90 | 32 | 7.28 | 43 | 6.13 |
Mesa 1. Quantidades máximas de oxigênio que podem ser dissolvidas na água pela temperatura.
Aplicação e Resumo
Rios em movimento lento são particularmente vulneráveis a baixos níveis de DO, e em casos extremos, esses níveis de DO podem levar a condições hipóxiis, criando "zonas mortas" onde a vida aeróbica não é mais suportada por um corpo d'água(Figura 7). Uma vez que plantas e animais morrem, o acúmulo de sedimentos que ocorre também pode elevar o leito do rio, permitindo que as plantas colonizem sobre a água e possam levar à perda do rio todos juntos(Figura 8). As águas superficiais em altitudes mais altas também são mais vulneráveis a baixos níveis de DO, à medida que a pressão atmosférica diminui com o aumento da altitude, e menos gás oxigênio é suspenso na água.
Baixos níveis de DO suportam formas de vida consideradas desagradáveis ou impróprias para uso humano, incluindo sanguessugas e vermes aquáticos(Oligochaeta).
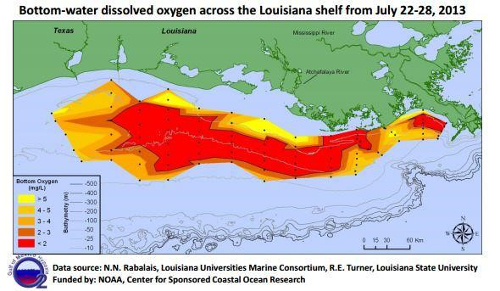
Figura 7. Mapa de concentrações de oxigênio dissolvidas através da prateleira da Louisiana mostrando a região da zona morta.

Figura 8. Fotografia do Mar Cáspio mostrando severa eutrofização no extremo norte.
Pular para...
Vídeos desta coleção:

Now Playing
Oxigênio dissolvido em Águas Superficiais
Environmental Science
55.7K Visualizações

Identificação de árvores: como usar uma chave dicotômica
Environmental Science
81.1K Visualizações

Levantamento de Árvores: Método de Amostragem Trimestral Centrada em Pontos
Environmental Science
49.4K Visualizações

Uso de SIG para Investigar Florestas Urbanas
Environmental Science
12.6K Visualizações

Células de combustível de membrana de troca de prótons
Environmental Science
22.0K Visualizações

Biocombustíveis: Produzindo Etanol a partir de Material Celulósico
Environmental Science
53.1K Visualizações

Testes para alimentos geneticamente modificados
Environmental Science
89.7K Visualizações

Turbidez e Sólidos Totais em Águas Superficiais
Environmental Science
35.8K Visualizações

Nutrientes em Ecossistemas Aquáticos
Environmental Science
38.8K Visualizações

Medição de Ozônio Troposférico
Environmental Science
26.4K Visualizações

Determinação de NOx no escapamento do automóvel usando espectroscopia UV-VIS
Environmental Science
30.0K Visualizações

Análise de chumbo do solo usando espectroscopia de absorção atômica
Environmental Science
125.4K Visualizações

Análise de Carbono e Nitrogênio de Amostras Ambientais
Environmental Science
29.4K Visualizações

Análise de Nutrientes do Solo: Nitrogênio, Fósforo e Potássio
Environmental Science
215.7K Visualizações

Análise de Populações de Minhocas no Solo
Environmental Science
16.5K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados