Method Article
Utilisation de la microscopie d’expansion pour agrandir physiquement des embryons de drosophile entiers pour l’imagerie à super-résolution
Dans cet article
Résumé
Ici, un protocole pour la mise en œuvre de la microscopie d’expansion dans les embryons précoces de drosophile afin d’obtenir une imagerie à super-résolution à l’aide d’un microscope confocal conventionnel à balayage laser est présenté.
Résumé
Le cheval de bataille de la biologie du développement est le microscope confocal, qui permet aux chercheurs de déterminer la localisation tridimensionnelle des molécules marquées dans des échantillons biologiques complexes. Alors que les microscopes confocaux traditionnels permettent de résoudre deux sources ponctuelles fluorescentes adjacentes situées à quelques centaines de nanomètres l’une de l’autre, l’observation des détails les plus fins de la biologie subcellulaire nécessite la capacité de résoudre des signaux de l’ordre de quelques dizaines de nanomètres. De nombreuses méthodes matérielles de microscopie à super-résolution ont été mises au point pour permettre aux chercheurs de contourner ces limites de résolution, bien que ces méthodes nécessitent des microscopes spécialisés qui ne sont pas disponibles pour tous les chercheurs. Une méthode alternative pour augmenter le pouvoir de résolution consiste à agrandir isotropement l’échantillon lui-même par un processus connu sous le nom de microscopie à expansion (ExM), qui a été décrit pour la première fois par le groupe de Boyden en 2015. L’ExM n’est pas un type de microscopie en soi, mais plutôt une méthode de gonflement d’un échantillon tout en préservant l’organisation spatiale relative de ses molécules constitutives. L’échantillon élargi peut ensuite être observé à une résolution effectivement augmentée à l’aide d’un microscope confocal traditionnel. Ici, nous décrivons un protocole pour la mise en œuvre de l’ExM dans les embryons de drosophile montés entiers, qui est utilisé pour examiner la localisation de Par-3, de la myosine II et des mitochondries dans les cellules épithéliales de surface. Ce protocole permet de multiplier par quatre la taille de l’échantillon, ce qui permet de détecter des détails subcellulaires qui ne sont pas visibles avec la microscopie confocale conventionnelle. Comme preuve de principe, un anticorps anti-GFP est utilisé pour distinguer des pools distincts de myosine-GFP entre les cortex cellulaires adjacents, et la streptavidine marquée par fluorescence est utilisée pour détecter les molécules biotinylées endogènes afin de révéler les détails fins de l’architecture du réseau mitochondrial. Ce protocole utilise des anticorps et des réactifs courants pour le marquage par fluorescence, et il devrait être compatible avec de nombreux protocoles d’immunofluorescence existants.
Introduction
En biologie cellulaire et du développement, il faut le voir pour le croire, et la capacité de déterminer avec précision les modèles de localisation des protéines est fondamentale pour de nombreux types d’expériences. La microscopie confocale à balayage laser est l’outil standard pour l’imagerie de protéines marquées par fluorescence en trois dimensions dans des échantillons intacts. Les microscopes confocaux conventionnels sont incapables de distinguer (résoudre) les signaux fluorescents adjacents qui sont séparés par moins de la moitié de la longueur d’onde de la lumière qu’ils émettent1. En d’autres termes, deux sources ponctuelles doivent être séparées d’au moins 200 à 300 nm dans la direction latérale (500 à 700 nm dans la direction axiale) pour les résoudre comme deux signaux distincts. Cette barrière technique est connue sous le nom de limite de diffraction, et c’est un obstacle fondamental à l’étude des structures subcellulaires complexes (par exemple, les réseaux cytosquelettiques ou mitochondriaux de l’actomyosine) avec des caractéristiques spatiales inférieures à la limite de diffraction. Par conséquent, les techniques permettant d’augmenter le pouvoir de résolution des microscopes confocaux conventionnels présentent un intérêt général pour la communauté biologique.
Pour contourner la limite de diffraction, un certain nombre de technologies de microscopie à super-résolution ont été développées qui permettent une résolution de l’ordre de quelques dizaines de nanomètres ou moins 1,2,3, révélant un monde de complexité biologique qui n’était auparavant accessible que par microscopie électronique. Malgré les avantages évidents de ces méthodes matérielles, les microscopes à super-résolution ont souvent des exigences spécifiques en matière d’étiquetage des échantillons et de longs temps d’acquisition, ce qui limite leur flexibilité, ou ils peuvent tout simplement être trop coûteux pour certains laboratoires. Une alternative à la super-résolution au microscope est la microscopie d’expansion (ExM), qui n’est pas un type de microscopie en soi, mais plutôt une méthode de gonflement d’un échantillon tout en préservant l’organisation spatiale relative de ses molécules constitutives4. Les échantillons élargis isotropement peuvent ensuite être observés à une résolution effectivement augmentée à l’aide d’un microscope confocal à fluorescence traditionnel. L’ExM a été décrite pour la première fois par le groupe de Boyden en 20155, et la technique de base a depuis été adaptée pour être utilisée dans une variété d’expériences 6,7,8. ExM a également été adapté pour être utilisé dans des embryons entiers, notamment chez la drosophile9, 10, 11, C. elegans12 et le poisson-zèbre 13, ce qui en fait un outil puissant pour les biologistes du développement.
ExM est basé sur deux chimies d’hydrogel différentes : 1) les hydrogels polyélectrolytiques gonflables, qui augmentent considérablement en taille lorsqu’ils sont trempés dans l’eau14, et 2) les hydrogels de polyacrylamide, qui ont un espacement extrêmement faible entre les polymères pour permettre une expansion isotrope de l’échantillon15. Bien qu’il existe de nombreux protocoles ExM publiés, ils partagent généralement les étapes suivantes : fixation de l’échantillon, étiquetage, activation, gélification, digestion et expansion4. Les conditions de fixation et les stratégies de marquage par fluorescence varient bien sûr en fonction des besoins de l’expérience et du système, et dans certains protocoles, le marquage se produit après l’expansion. Les molécules cibles de l’échantillon doivent être amorcées (activées) pour se lier à l’hydrogel, ce qui peut être réalisé en utilisant différentes chimies4. Au cours des étapes de gélification, l’échantillon est saturé de monomères du futur hydrogel (acrylate de sodium, acrylamide et bisacrylamide, réticulant), et l’hydrogel est ensuite formé par polymérisation radicalaire catalysée par un initiateur, tel que le persulfate d’ammonium (APS), et un accélérateur, tel que la tétraméthylènediamine (TEMED)4. Après gélification, l’échantillon est digéré enzymatiquement pour homogénéiser la résistance de l’échantillon au gonflement et assurer l’expansion isotrope de l’hydrogel4. Enfin, l’hydrogel digéré est placé dans l’eau, ce qui le fait se dilater jusqu’à environ quatre fois sa taille linéaire d’origine4.

Figure 1 : Vue d’ensemble de la microscopie d’expansion chez les embryons de drosophile. ExM est un protocole en plusieurs étapes qui prend au moins 4 jours à compléter. Le prélèvement, la fixation et la désensilinisation des embryons prennent 1 jour ou plus selon que les embryons provenant de plusieurs collections sont mis en commun ou non. Le marquage par immunofluorescence prend 1 jour ou 2 jours selon que les embryons sont incubés pendant la nuit avec les anticorps primaires. L’activation, la gélification, la digestion et l’expansion de l’embryon peuvent être effectuées en une seule journée. Les gels peuvent être montés et imagés immédiatement après l’expansion, bien que pour des raisons pratiques, il soit souvent souhaitable de commencer l’imagerie le lendemain. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ce protocole décrit comment effectuer l’ExM sur des embryons de drosophile à un stade précoce ou intermédiaire16 afin de visualiser les modèles de localisation des protéines subcellulaires à super-résolution (Figure 1). Cette méthode utilise la chimie de l’ester N-hydroxysuccinimidyle de l’acide méthylacrylique (MA-NHS) pour activer et ancrer les molécules de protéines à l’hydrogel17, et il s’agit d’une modification d’un protocole ExM précédemment publié pour une utilisation dans les embryons et les tissus de drosophile à un stade avancé11. Ce protocole utilise des puits de polydiméthylsiloxane (PDMS) pour mouler les hydrogels et faciliter l’échange de solutions lors de l’activation et de la gélification. Une autre méthode qui ne nécessite pas la création de puits PDMS consiste à abaisser les embryons attachés à des lamelles dans des gouttes de solution monomère posées sur un morceau de film d’étanchéité de laboratoire22. De plus, ce protocole décrit une méthode permettant d’enlever manuellement la membrane vittelline imperméable qui entoure les embryons de drosophile , ce qui est une condition préalable à la coloration par immunofluorescence. Il est important de noter que cette méthode d’épluchage manuel des embryons peut être utilisée pour sélectionner uniquement les embryons de drosophile correctement stadifiés avant l’étiquetage des échantillons, ce qui augmente considérablement la probabilité de se retrouver avec des échantillons élargis du stade et de l’orientation corrects et, par conséquent, rend la collecte de données en aval beaucoup plus efficace.
Protocole
Ce protocole suit les directives de l’Université de l’Arkansas (UARK) pour la recherche sur les animaux invertébrés, tels que Drosophila melanogaster, et a été approuvé par le Comité institutionnel de biosécurité de l’UARK (protocole #20001).
1. Fixation et désensilinisation de l’embryon de drosophile
REMARQUE : L’étape 1 décrit une procédure (peeling à la main) pour l’ablation manuelle de la membrane vitelline, une membrane imperméable transparente qui entoure l’embryon. Il est important de noter que l’épluchage à la main permet de sélectionner des embryons correctement stadifiés au début du protocole ExM, ce qui augmente considérablement la probabilité d’obtenir des embryons dans une orientation utilisable à la fin du protocole ExM. Cependant, ce protocole ExM est tout à fait compatible avec le prélèvement d’embryons en vrac et les procédures standard pour l’ablation de la membrane vitelline à base de méthanol, auquel cas on peut passer directement à l’étape 2 (marquage par immunofluorescence).
- Préparez ou achetez un certain nombre d’aiguilles de verre fines. Les dimensions réelles de la pointe de l’aiguille ne sont pas critiques, mais garantissent que les aiguilles sont suffisamment rigides et tranchantes pour percer les membranes vitellines des embryons fixés. Fabriquer des aiguilles à partir de tubes capillaires en verre (1 mm de diamètre extérieur, 0,75 mm de diamètre intérieur) à l’aide d’un extracteur de micropipettes, comme on préparerait des aiguilles pour des micro-injections d’embryons18 ; Vous pouvez également acheter des aiguilles pré-tirées.
- Prélever des embryons à l’aide des techniques standard de drosophile19 en plaçant >100 drosophiles adultes dans un gobelet en plastique ventilé scellé avec une plaque de jus de fruits/gélose20. Utilisez des fenêtres de collecte chronométrées pour enrichir les embryons du stade16 approprié. Par exemple, pour enrichir en vue des stades de gastrulation (stade 6) et d’extension convergente (stade 7), changer la plaque de jus de fruits, recueillir les embryons pendant 2 h à 25 °C, puis retirer la plaque et la faire vieillir encore 2 h à 25 °C pour obtenir des embryons âgés de ~2 à 4 h.
- Pour retirer le chorion en forme de coquille d’œuf des embryons, couvrez la surface des plaques de jus de fruits avec de l’eau de Javel à 50 % (tableau 1), libérez les embryons de la surface de la gélose en les agitant avec un petit pinceau et attendez 3 min que le chorion se dissolve.
- Transférer les embryons déchorionnés à l’aide d’un pinceau dans un flacon à scintillation de 30 mL contenant 4 mL d’heptane (phase supérieure organique) et 4 mL de tampon de fixation (phase inférieure aqueuse ; Tableau 1). Diluez fraîchement le formaldéhyde d’un bouillon fraîchement préparé ou récemment ouvert, et mélangez-le avec 10x PBS et de l’eau déminéralisée immédiatement avant d’ajouter les embryons.
REMARQUE : Préparez le formaldéhyde à partir de la puissance du paraformaldéhyde ou du formaldéhyde de qualité EM à 16% dans des ampoules en verre. Des stocks de formaldéhyde concentré (p. ex., 37 % de formaldéhyde) peuvent être utilisés, bien que les résultats puissent être moins uniformes. - Les embryons vont s’accumuler à l’interface entre les phases organique et aqueuse. Ajoutez autant d’embryons que vous formerez une seule couche à l’interface. Si trop d’embryons sont ajoutés à un flacon, ils ne se fixeront pas aussi bien.
- À l’aide d’un ruban adhésif solide, immobiliser les flacons de scintillation sur le côté sur un shaker de table et les agiter pendant 20 min à 220 tr/min. Pour une fixation optimale, maintenir une émulsion vigoureuse entre les phases organique et aqueuse pendant toute la fixation.
- Pendant le temps de fixation, préparez l’un des éléments suivants pour chacun des échantillons.
- Prenez un fond de boîte de Pétri en plastique de 6 cm rempli à moitié de gélose à 3 % et marquez un rectangle de ~5 cm x 3 cm dans l’agar avec une lame de rasoir ou un scalpel. Des plaques de jus de fruits/gélose peuvent également être utilisées à cette fin.
- À l’aide d’une petite spatule de laboratoire, retirez la plaque de gélose. Retournez la base de la boîte de Pétri et posez-la sur le banc. Placez la plaque d’agar-agar sur le dessus de la boîte inversée (Figure 2A).
- Prenez le couvercle de la boîte de Pétri et assurez-vous qu’il est sec. En portant des gants, placez un morceau de ruban adhésif double face à l’intérieur du couvercle (le morceau de ruban adhésif doit être légèrement plus grand que la dalle de gélose ; Graphique 2B).
- Retirez les flacons du shaker, placez-les à la verticale sur la paillasse et laissez les phases organique et aqueuse se séparer. Les embryons correctement fixés resteront à l’interface entre les deux phases.
- Transférer les embryons fixés sur la plaque de gélose à l’aide d’une pipette Pasteur en verre munie d’une poire en latex. Pour éviter que les embryons n’adhèrent à l’intérieur de la pipette, essayez de garder les embryons dans le col étroit de la pipette et transférez les embryons en plusieurs petits lots plutôt qu’en une seule fois. Une fois que tous les embryons sont sur la plaque de gélose, retirez la majeure partie de l’heptane résiduel autour des embryons à l’aide d’une pipette P200. Effectuez cette étape le plus rapidement possible (<3 min) pour éviter de dessécher les embryons fixés, ce qui peut affecter négativement la morphologie.
- À partir d’une hauteur de ~2 cm, déposez le couvercle avec le ruban adhésif double face sur la plaque de gélose pour faire adhérer les embryons au ruban (Figure 2C). Retirez délicatement le couvercle de la plaque de gélose, placez-le à l’envers sur la paillasse, puis ajoutez suffisamment de PBS-Tween (tableau 1) pour couvrir les embryons dans le couvercle.
- À l’aide d’un microscope à dissection stéréoscopique à un grossissement d’environ 100x avec un éclairage indirect, identifiez les embryons correctement stadifiés à l’aide de marqueurs morphologiques. Pour les embryons de stade 6, utilisez des marqueurs tels qu’un sillon céphalique visible et un mésoderme invaginé ; pour les embryons de stade 7, utilisez des marqueurs comme une bande germinale étendue ; Pour les embryons de stade 11, utilisez des marqueurs tels qu’une bande germinale complètement étendue et une segmentation visible le long de l’axe tête-queue16.
- Pour recueillir les embryons souhaités, piquez d’abord la membrane vitelline (une membrane ovale transparente autour de l’embryon) près de l’extrémité antérieure ou postérieure de l’embryon avec une fine aiguille de verre ; La membrane se dégonflera un peu au fur et à mesure que la pression se relâchera. Ensuite, à l’aide d’une pince fine ou d’une sonde métallique, poussez doucement l’embryon à l’autre extrémité à travers le trou ; La membrane vitelline restera collée au ruban adhésif double face. Laissez les embryons non désirés adhérer à la bande.
- Prélever périodiquement les embryons devitellinisés flottants à l’aide d’une pipette Pasteur en verre et les déplacer dans un tube microfuge de 1,5 ml.
- À ce stade, effectuez l’une des opérations suivantes.
- Passez directement aux étapes de marquage par immunofluorescence. Les embryons dévitellinés peuvent passer directement dans la solution bloquante (étape 2.2). Ne laissez pas les embryons rester dans PBS-Tween ou dans une solution bloquante (tableau 1) pendant plus de 16 h avant de passer à l’étape suivante.
- Déplacez les embryons dans le méthanol pour les stocker. Retirez autant de PBS-Tween que possible, puis ajoutez 1 mL de méthanol. Une fois que les embryons se sont installés, retirez autant de méthanol que possible et ajoutez 1 mL de méthanol frais. Conservez indéfiniment les embryons à −20 °C. Le stockage au méthanol permet également la mise en commun d’embryons provenant de plusieurs collections.
2. Marquage par immunofluorescence
REMARQUE : Mis à part les étapes d’incubation des anticorps, les quantités et les temps exacts de liquide ne sont pas critiques dans cette section. Pour effectuer un rinçage ou un lavage, laissez les embryons se déposer au fond du tube, retirez autant de liquide que possible sans aspirer les embryons, puis ajoutez ~1 mL de nouveau liquide ; utiliser une pipette Pasteur en verre munie d’une poire en latex pour une clarté et un contrôle optimaux. Pour l’étape de rinçage, les embryons ne sont pas bercés, on les laisse juste s’installer ; Pour l’étape de lavage, les embryons sont bercés sur un nutateur pendant la durée indiquée, puis laissés se déposer.
- Si les embryons n’ont pas été conservés dans du méthanol, passez à l’étape 2.2. Si les embryons ont été conservés dans du méthanol, rincez-les deux fois avec PBS-Tween, puis lavez-les deux fois pendant 20 minutes avec PBS-Tween.
- Lavez les embryons pendant 30 à 60 minutes dans 1 mL de solution bloquante.
- Incuber les embryons avec des anticorps primaires dilués dans une solution d’anticorps (tableau 1) pendant 2 h à température ambiante ou de préférence toute la nuit à 4 °C. Effectuer cette étape dans un volume aussi petit que possible (50-300 μL) pour conserver les anticorps primaires ; Il n’est pas strictement nécessaire de se balancer sur un nutateur.
- Augmenter la quantité d’anticorps primaires utilisée dans une expérience d’immunofluorescence typique d’au moins 50 % pour l’ExM. Utiliser les concentrations d’anticorps primaires suivantes : 1 :200 pour le polyclonal anti-cobayePar-3 21 et 1 :100 pour le polyclonal anti-GFP chez le lapin.
- Retirez la solution primaire d’anticorps (à conserver à 4 °C si vous le souhaitez), rincez deux fois avec PBS-Tween, puis lavez pendant 15 minutes quatre fois avec PBS-Tween.
- Incuber les embryons avec des anticorps secondaires fluorescents dans un volume final de 300 μL (dilué dans une solution d’anticorps) pendant 1 h à température ambiante sur un nutateur. De la streptavidine marquée par fluorescence peut être ajoutée au cours de cette étape. À partir de cette étape, protégez les embryons d’une exposition excessive et prolongée à la lumière lorsque cela est possible, par exemple en recouvrant les tubes d’un couvercle opaque ou en conservant les échantillons dans un tiroir.
- Utiliser les concentrations suivantes : 1 :500 pour les IgG anti-lapin de chèvre polyclonale fusionnées à Alexa Fluor 488 ; 1 :500 pour les IgG de chèvre polyclonale anti-cobaye fusionnées à Alexa Fluor 568 ; et 1 :1000 pour streptavidine-Alexa Fluor 488.
- Retirez et éliminez la solution d’anticorps secondaire. Rincez les embryons deux fois avec PBS-Tween et lavez-les quatre fois pendant 15 minutes avec PBS-Tween.
- À ce stade, les embryons peuvent être conservés à 4 °C dans l’obscurité, mais traitent les échantillons le plus rapidement possible (<24 h).
3. Préparation des puits PDMS
REMARQUE : Les puits PDMS peuvent être réalisés jusqu’à 2 semaines à l’avance.
- Réglez un incubateur ou une plaque chauffante à 55 °C et réglez une centrifugeuse capable de faire tourner des tubes coniques à 15 °C.
- Pour préparer la solution PDMS (tableau 1), placer un tube conique de 50 mL dans un récipient secondaire sur une balance et ajouter 10 g de base d’élastomère de silicone dans le tube à l’aide d’une seringue. Ensuite, ajoutez 1 g d’agent de durcissement en élastomère de silicone et retournez le tube plusieurs fois pour mélanger.
- Créez un tube d’équilibre en ajoutant une quantité appropriée d’eau à un deuxième tube conique de 50 ml. Centrifuger la solution PDMS à 500 x g pendant 3 min à 15 °C, puis la verser dans une boîte de Pétri de 10 cm à une profondeur de ~1 mm. Si nécessaire, éliminez les bulles en soufflant doucement sur la solution à l’aide d’un tuyau d’air. Laissez la solution PDMS se solidifier pendant la nuit à 55 °C.
- Une fois la dalle PDMS solidifiée, à l’aide d’un scalpel, marquez des zones carrées légèrement plus petites qu’une lamelle de 22 mm x 22 mm. À l’intérieur de chaque carré, marquez et retirez un puits carré de ~8 mm de large.
- Transférez chaque puits PDMS carré sur une lamelle de 22 mm x 22 mm et collez-la fermement (Figure 2D). La préparation de six lamelles ou plus devrait permettre d’obtenir un bon nombre d’embryons expansés à imager.
4. Collage des embryons sur les lamelles
- Appliquez suffisamment de poly-L-lysine à 0,1 % pour couvrir la surface de la lamelle à l’intérieur de chaque puits (~50 μL) et placez-les dans un incubateur à 55 °C pour les faire sécher à l’air libre. Répétez cette étape pour augmenter l’adhérence.
- Rincez brièvement les embryons une fois dans 1x PBS pour éliminer le détergent pour préadolescents, puis transférez >10 embryons dans chacun des puits enrobés de poly-L-lysine.
- Laissez les embryons s’installer au fond des puits. Prélever l’excédent de liquide des embryons collés à l’aide d’une pipette Pasteur. Passez immédiatement à l’étape suivante.
5. Activation et gélification
REMARQUE : L’activation fait référence à l’ajout de MA-NHS aux embryons, ce qui modifiera les protéines et les anticorps de l’échantillon afin qu’ils puissent se lier à l’hydrogel. La gélification fait référence à la génération d’un hydrogel dans et autour des embryons dans chaque puits. Pendant la gélification, les embryons sont imprégnés d’une solution de monomère, puis traités avec une solution gélifiante pour former l’hydrogel.
- Activer les embryons pendant 1 h à température ambiante en remplissant les puits avec une solution d’activation (1 mM MA-NHS fraîchement dilué dans 1x PBS ; Tableau 1). Changez cette solution environ toutes les 10 minutes pendant 1 h.
- Rincez les embryons avec 1x PBS trois fois. Incuber les embryons dans une solution de monomère (tableau 1) pendant 45 min à 4 °C.
- Pendant que les embryons sont assis dans la solution de monomère, préparez la solution gélifiante (tableau 1). La préparation de ~2 mL de solution gélifiante est suffisante pour couvrir les puits PDMS d’une boîte de Pétri entière de 10 cm. Assurez-vous d’ajouter l’APS en dernier, car il initiera la polymérisation et commencera la gélification.
- Diluer l’oxydant catalytique fraîchement extrait de la poudre (par exemple, 1 % de TEMPO p/v dans de l’eau). Combiner 1 960 μL de solution monomère avec 30 μL de TEMED à 10 % et 10 μL de TEMPO à 1 %.
- Pour éviter de polymériser l’ensemble du lot de solution gélifiante en une seule fois, travaillez par petits lots. Diviser la solution gélifiante (sans APS) en aliquotes de 125 μL entre les huit tubes d’une bandelette PCR.
- Retirer la solution de monomère des trois puits PDMS à l’aide d’un aspirateur en veillant à ne pas perturber les embryons. Ajouter 5 μL d’APS à l’un des tubes PCR contenant une solution gélifiante pour initier la polymérisation. Répartir rapidement la solution gélifiante polymérisante entre les puits (~40 μL par puits). Répétez cette opération jusqu’à ce que tous les puits et les embryons soient couverts.
- Laisser les échantillons se gélimer pendant 1,5 à 2,5 h à 37 °C. Agitez les hydrogels de temps en temps pour surveiller la polymérisation. Les hydrogels solidifiés ne bougent pas. Les hydrogels plus épais mettront plus de temps à terminer la polymérisation et à se solidifier.
6. Digestion et expansion
REMARQUE : Les gels plus épais et plus gros mettront plus de temps à se dilater, et le centre des gels peut prendre plusieurs heures pour se dilater complètement ; Cela peut être accéléré en coupant les bords du gel. Au fur et à mesure que les gels se dilatent, leur indice de réfraction deviendra presque identique à celui de l’eau et ils deviendront très difficiles à voir.
- Une fois la gélification terminée, décollez les puits PDMS de la lamelle tout en essayant de ne pas perturber les hydrogels. Coupez l’excédent de matériau hydrogel, si vous le souhaitez.
- Transférez les hydrogels (toujours attachés aux lamelles) individuellement dans les puits d’une plaque à six puits (figure 2E). Notez que les hydrogels peuvent se dilater légèrement lors de la digestion.
- Couvrir complètement les gels avec un tampon de digestion (tableau 1) pendant 1 h à 37 °C. En général, 30 mL de tampon de digestion suffisent pour recouvrir les gels dans une plaque à 6 puits.
- Après la digestion, transférez chaque hydrogel individuellement dans une boîte de Pétri de 6 cm en les faisant glisser hors de la lamelle. Il peut être nécessaire d’utiliser une deuxième lamelle pour déloger le gel. Remplissez chaque boîte de Pétri avec de l’eau déminéralisée pour dilater le gel. Changez l’eau trois à quatre fois sur une période de 1 à 2 h jusqu’à ce que les gels soient complètement dilatés (attendez-vous à une augmentation d’environ quatre fois de la largeur).
7. Montage et imagerie
REMARQUE : Les hydrogels expansés sont composés presque entièrement d’eau, ce qui les rend presque transparents et extrêmement fragiles. Les gels peuvent être manipulés à l’aide de longues lamelles pour les déplacer et les ramasser. Ne montez et n’imagez qu’un ou deux gels à la fois, car les gels libèrent progressivement de l’eau et commencent à glisser autour de la lamelle.
- À l’aide d’une pipette Pasteur, retirez autant d’eau que possible de la boîte de Pétri afin de minimiser les gels qui se déplacent lorsqu’ils sont manipulés.
- Manœuvrez chaque gel expansé, avec les embryons sur la surface inférieure, sur une grande lamelle (p. ex., 24 mm x 40 mm) pour l’imagerie.
- Montez chaque lamelle avec du gel sur l’objectif d’un microscope confocal inversé à balayage laser. Localisez les échantillons correctement mis en scène et orientés à l’aide des modes de microscopie à épifluorescence ou à fond clair du microscope avec des objectifs à air à faible grossissement (5x ou 10x) ou à grossissement moyen (20x).
- Pour obtenir des images à haute résolution, passez à un objectif à fort grossissement (60x, 63x ou 100x) à immersion dans l’huile ou l’eau. La surface des embryons doit se trouver dans la plage de mise au point de l’objectif (<300 μm de la lamelle pour un objectif 63x) afin d’être imagée.
- Collectez des données à partir d’échantillons à l’aide du mode confocal à balayage laser du microscope. Assurez-vous de collecter des images non saturées avec une bonne plage dynamique et d’utiliser un nombre approprié de pixels par image pour capturer le maximum d’informations possibles sur l’échantillon23.

Figure 2 : Désensilinisation manuelle et travail avec des hydrogels. (A) Découpe d’une plaque d’agar-agar dans une assiette d’agar-agar/jus de fruits. (B) Placer du ruban adhésif double face à l’intérieur du couvercle d’une boîte de Pétri de 6 cm. (C) Adhérence des embryons à la paupière scellée. (D) Une dalle PDMS avec un puits carré collé à une lamelle de 22 mm x 22 mm. (E) Lamelle avec un puits PDMS à l’intérieur d’une plaque à 6 puits. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Pour caractériser l’efficacité générale de l’ExM chez les embryons de drosophiles montés entiers, la longueur de l’embryon le long de l’axe tête-queue a été mesurée chez des embryons témoins non expansés par rapport à des embryons expansés (Figure 3A-C). Les embryons témoins non expansés ont été soumis aux mêmes conditions de fixation et aux mêmes étapes de marquage par immunofluorescence que les embryons expansés, sauf qu’ils ont été montés à l’aide d’un milieu de montage solidifié avant l’imagerie. Les embryons individuels non expansés couvraient environ la moitié d’un champ de vision lors de l’utilisation d’un objectif 10x (Figure 3A). En revanche, les embryons élargis couvraient environ deux champs de vision complets lorsqu’ils utilisaient le même objectif 10x (Figure 3B). Pour évaluer comment le degré d’expansion variait à la fois à l’intérieur et entre les expériences, le même protocole ExM a été effectué à trois occasions distinctes, et la longueur de l’embryon a été mesurée dans trois gels différents dans chaque expérience individuelle. La longueur moyenne de la tête à la queue des embryons témoins non expansés était de 398,8 μm (écart-type [ET] = 22,93 μm ; n = 74 ; Graphique 3C). Pour l’expérience 1, l’expérience 2 et l’expérience 3, les longueurs moyennes des embryons étaient respectivement de 1 596 μm (écart-type = 159,9 μm ; n = 57), 1 868 μm (écart-type = 150,5 μm ; n = 51) et 1 954 μm (écart-type = 120,3 μm ; n = 44), respectivement, ce qui représente des facteurs d’expansion de 4,0 fois, 4,7 fois et 4,9 fois, respectivement (Figure 3C). La variation intra-expérimentale entre les gels était beaucoup moins perceptible que la variation inter-expérimentale, qui était d’environ 20 % (Figure 3C). Pour évaluer les effets de l’ExM sur la morphologie des cellules et des embryons, un anticorps dirigé contre le composant de la jonction adhérente Par-3 (Bazooka)21 a été utilisé pour marquer les membranes cellulaires apicales, et nous avons imagé les segments buccaux en développement d’embryons de drosophile de stade 11, un stade avec une structure segmentée complexe (Figure 3D-F). Dans l’échantillon témoin, les cellules du segment maxillaire avaient une largeur moyenne de 4,76 μm (ET = 1,053 μm, n = 25 ; Graphique 3D, F). Dans les échantillons élargis imagés à l’aide du même objectif 40x et du même facteur de zoom (1x), les cellules du segment maxillaire avaient une largeur moyenne de 19,10 μm (ET = 3,966 μm, n = 18 ; Figure 3E, F), représentant une expansion de 4,0 fois. Par conséquent, conformément aux rapports précédents11, nous avons été en mesure d’agrandir les embryons de drosophile montés en entier d’environ quatre fois en dimensions linéaires en utilisant ExM sans déchirure de l’échantillon ni distorsion évidente de la morphologie cellulaire ou tissulaire.
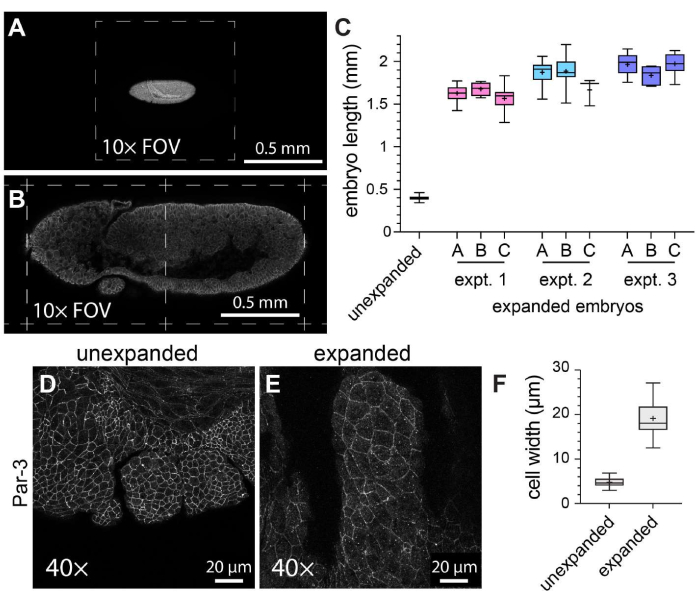
Figure 3 : Quadruplement de l’expansion des embryons de drosophile. (A) Embryons de drosophile non expansés et (B) expansés imagés à l’aide d’un objectif 10x (0,3 NA) avec un zoom 1x. Les champs de vision individuels (FOV) sont indiqués par des lignes pointillées. Les embryons exprimaient une version de la chaîne légère de myosine marquée par la GFP et étaient colorés avec un anticorps anti-GFP. (C) Quantification de la longueur de l’embryon (le long de l’axe tête-queue) dans trois hydrogels par expérience et à partir de trois expériences ExM distinctes par rapport à des témoins non étendus. (D,E) Segments maxillaires d’embryons de drosophile de stade 11 (D) non expansés et (E) élargis imagés à l’aide d’un objectif 40x (1,3 NA) avec un zoom 1x. Les contours des cellules (jonctions adhérentes) ont été détectés avec un anticorps anti Par-3/Bazooka (blanc). (F) Quantification de la largeur de cellule (grand axe) à partir de groupes équivalents de cellules de (D) et (E). Les boîtes à moustaches des paragraphes (C) et (F) montrent les fourchettes des 25e, 50e et 75e percentiles ; les moustaches indiquent les valeurs minimales et maximales ; Les symboles « + » indiquent la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Pour démontrer que l’ExM peut être utilisé pour résoudre des détails subcellulaires en dessous de la limite de diffraction typique, le cytosquelette de l’actomyosine a été imagé chez des embryons témoins non expansés par rapport à des embryons expansés subissant une extension convergente (stade 7). Les événements de remodelage tissulaire de la gastrulation et de l’extension convergente sont largement contrôlés par des changements dans la localisation de la protéine motrice myosine II24. Cependant, dans l’épithélium colonnaire densément emballé de l’ectoderme précoce de la drosophile , il est difficile d’observer de nombreux détails fins du modèle de localisation de la myosine II, même lorsqu’il est imagé à un grossissement de 158x (objectif 63x avec un zoom optique 2,5x) – un pouvoir de résolution maximal typique pour un microscope confocal à balayage laser. Par exemple, parce que la myosine II est une protéine corticale (située directement sous la membrane plasmique), les pools de myosine II25 situés de part et d’autre des contacts cellule-cellule n’étaient pas solubles dans les embryons de stade 7, et ils apparaissaient comme une seule ligne où les cellules voisines se rencontraient (Figure 4A). En revanche, dans les embryons de stade 7 élargi, des lignées parallèles de myosine II ont pu être observées au niveau des jonctions cellule-cellule, représentant des pools de protéines corticales dans les cellules adjacentes (Figure 4B). La distance entre les raies parallèles de myosine II dans les échantillons élargis était de 892,7 nm (ET = 0,171 nm, n = 12) ; lorsqu’il est divisé par quatre, cela donne une distance prédite de ~220 nm entre les raies de myosine dans les cellules adjacentes dans les embryons non développés, ce qui est en effet juste en dessous de la limite de diffraction pour un signal détecté avec Alexa 488 (émission maximale de ~520 nm/2 = 260 nm).
De plus, nous avons également testé si ExM pouvait être utilisé pour résoudre l’architecture du réseau mitochondrial dans des cellules densément emballées d’embryons de drosophile en gastrulation (stade 6). La fonction mitochondriale est étroitement liée à la structure du réseau (c’est-à-dire les organites fusionnés ou fragmentés), mais les détails de l’organisation du réseau mitochondrial sont difficiles à visualiser à l’aide de la microscopie confocale conventionnelle dans les types de cellules qui ne sont pas plats et/ou minces. Les mitochondries sont naturellement riches en molécules biotinylées et, par conséquent, les mitochondries peuvent être marquées dans l’embryon précoce de la drosophile à l’aide de streptavidine26 marquée par fluorescence. Dans les embryons de stade 6 non expansés marqués avec la streptavidine-Alexa 488, le signal est apparu sous forme de ponctuations cytoplasmiques qui se chevauchaient souvent et étaient difficiles à résoudre (Figure 4C). En revanche, dans les embryons de stade 6 élargi, beaucoup plus de détails fins du réseau mitochondrial étaient visibles et les puncta étaient plus faciles à résoudre (Figure 4D)26,27. Ces résultats indiquent que l’ExM peut être utilisé pour étudier l’organisation du réseau mitochondrial dans des types cellulaires qui ne sont pas traditionnellement adaptés à l’analyse mitochondriale.

Figure 4 : Détails du cytosquelette et des mitochondries de l’actomyosine révélés par microscopie d’expansion. (A,B) Localisation de la myosine II dans des cellules neuroectodermiques (germane) imagées avec un objectif 63x (1,4 NA) à un zoom de 2,5x dans les embryons de stade 7 (A) non expansés et (B) expansés. La myosine II a été détectée dans les embryons exprimant une version transgénique marquée à la GFP de la chaîne légère régulatrice de la myosine II (SQH-GGP), qui a été détectée avec un anticorps anti-GFP (rouge). Des pools distincts de myosine corticale situés dans les cellules adjacentes peuvent être résolus dans l’embryon expansé (flèches blanches). (C,D) Réseaux mitochondriaux dans des cellules neuroectodermiques imagées avec un objectif de 63× (1,4 NA) à un zoom de 2,5x dans des embryons non expansés (C) et expansés (D) de stade 6. Les mitochondries ont été détectées avec la streptavidine-Alexa 488 (vert), et les contours des cellules ont été détectés avec un anticorps anti-Par-3/Bazooka (magenta). Les expériences ont été réalisées à l’aide d’un microscope confocal à balayage laser. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Recettes de solutions. Composition des solutions utilisées dans ce protocole par ordre d’apparition. Tous les stocks sont liquides, sauf indication contraire. Les produits chimiques ont été remis en suspension ou dilués dans de l’eau filtrée autoclave, sauf indication contraire. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Dévitellinisation manuelle
La plupart des protocoles de fixation d’embryons de drosophile impliquent l’ablation de la membrane vitelline en agitant les embryons fixés dans une émulsion de méthanol et d’heptane, ce qui provoque l’éclatement des membranes par rupture osmotique26. Alors que la désensitinisation à base de méthanol (éclatement du méthanol) est efficace et appropriée pour de nombreuses applications, la dédésensilinisation manuelle (épluchage à la main) offre des avantages significatifs. Tout d’abord, l’épluchage à la main permet de choisir des embryons au stade précis de la devitellinisation et de la collecte, ce qui augmente considérablement la probabilité d’obtenir des embryons élargis dans une orientation utilisable à la fin de l’expérience. Cet enrichissement est essentiel lors de l’étude d’aspects spécifiques des processus de développement rapide (par exemple, l’invagination du mésoderme ou l’extension convergente), pour lesquels les embryons stadifiés de manière appropriée peuvent ne représenter que quelques pour cent de tous les embryons, même dans une fenêtre de collecte très serrée. Bien sûr, pour de nombreuses applications, l’éclatement plus traditionnel au méthanol d’embryons à partir d’une fenêtre de collecte chronométrée sera suffisant, et l’épluchage à la main peut ne pas valoir l’effort supplémentaire. Deuxièmement, la liaison de certains anticorps primaires et colorants est affectée négativement par l’exposition antérieure de l’échantillon au méthanol. Pour cette raison, le peeling à la main peut entraîner des augmentations significatives de la qualité du signal d’immunofluorescence par rapport aux échantillons de méthanol, ce qui en fait une technique générale utile pour les biologistes du développement de la drosophile .
Microscopie confocale à haute résolution dans des embryons de drosophile à montage entier expansé
Bien que l’exécution de la microscopie confocale à haute résolution sur des échantillons élargis soit conceptuellement la même que sur des échantillons non étendus, ExM présente certains obstacles techniques. Notamment, l’orientation de l’embryon, qui est aléatoire, devient encore plus importante à mesure que la taille de l’échantillon augmente, car les objectifs à fort grossissement et à NA élevé ne sont capables de focaliser la lumière qu’à partir de régions d’échantillon très proches de la lamelle27. Par conséquent, il n’est généralement possible de se concentrer que sur les cellules situées à la surface ou près de la surface de l’embryon qui se sont retrouvées adjacentes à la lamelle lors de la formation du gel. La meilleure façon de s’assurer qu’il y a des spécimens de la bonne orientation à la fin est de commencer le protocole ExM avec une collection d’embryons fixes par étapes serrées (par exemple, en utilisant l’épluchage à la main) et d’ensemencer de nombreux embryons dans chaque puits (>10). Pour visualiser les cellules situées profondément à l’intérieur de l’embryon, il peut être nécessaire d’utiliser des dispositifs d’imagerie plus spécialisés, tels que la microscopie à feuille de lumière28. De plus, nous constatons que la qualité de l’image peut être améliorée en ouvrant le sténopé confocal à une taille supérieure à une unité aérée. Bien sûr, une augmentation de la taille du sténopé se fera au prix d’une diminution de la résolution maximale, mais dans la pratique, même de petites augmentations de la taille du sténopé peuvent augmenter considérablement l’intensité du signal (données non présentées). Les études futures devraient systématiquement porter sur la taille des trous d’épingle et la résolution effective dans les échantillons ExM.
Variations sur ExM de base
Le protocole décrit ici est un exemple relativement simple d’ExM qui devrait fonctionner pour de nombreuses applications et être facile à mettre en œuvre dans la plupart des laboratoires de biologie du développement. Cependant, il existe de nombreuses variantes du concept de base d’ExM 4,5,7 qui peuvent être utilisées pour augmenter l’intensité du signal, atteindre des degrés d’expansion encore plus élevés et détecter des molécules d’acide nucléique ainsi que des protéines. Dans ce protocole, les embryons sont incubés avec des anticorps avant la gélification et l’expansion. Alternativement, les échantillons peuvent être traités avec des anticorps après leur expansion 6,30, ce qui peut augmenter l’intensité du signal en raison de l’accessibilité accrue des épitopes et de la diminution de la perte d’anticorps liés pendant les étapes d’expansion. De plus, des molécules de réticulation spécifiques peuvent être utilisées pour attacher des molécules d’ARN à l’hydrogel afin de permettre la détection de l’ARN dans les gels expansés en utilisant la méthode de réaction en chaîne d’hybridation30. Enfin, les échantillons peuvent être soumis à plusieurs cycles d’expansion, comme dans la microscopie d’expansion itérative (iExM)31, la microscopie pan-ExM32 et la révélatrice d’expansion (ExR)31, pour atteindre des degrés encore plus élevés de résolution accrue.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous tenons à remercier la Dre Jennifer Zallen d’avoir fourni l’anticorps primaire anti-Par-3 du cobaye. Ces travaux ont été soutenus par un généreux financement (1R15GM143729-01 et 1P20GM139768-01 5743) de l’Institut national des sciences médicales générales (NIGMS), l’un des membres des National Institutes of Health (NIH), ainsi que de l’Arkansas Biosciences Institute (ABI), qui a fourni un financement partiel pour l’achat de notre microscope confocal.
matériels
| Name | Company | Catalog Number | Comments |
| acrylamide | Milipore Sigma | 1490-100ML | |
| ammonium persulfate | VWR | BDH9214-500G | |
| anti-GFP rabbit polyclonal antibody | Torrey Pines BioLabs | TP-401 | |
| anti-guinea pig IgG goat polyclonal antibody, Alexa Fluor 568 | Thermo Fisher Scientific | A-11075 | |
| anti-rabbit IgG goat polyclonal antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-11008 | |
| bisacrylamide | Research Products International | A11275 | |
| bovine serum albumin (30% solution) | Millipore Sigma | A7284 | |
| conical tubes, 50 mL | fisherscientific | 21008-940 | |
| coverlip glass, square 22 mm | VWR | 48366-227 | |
| coverslip glass, rectangular 40 mm x 24 mm | VWR | 48393-230 | |
| glass capillaries for pulling needles | World Precision Instruments | TW100F-4 | |
| glass microinjection needles (pre-pulled) | World Precision Instruments | TIP10LT | |
| guanidine HCl | VWR | 101970-606 | |
| heptane | VWR | EM-HX0078-1 | |
| latex pipet bulbs | VWR | 82024-554 | |
| methanol | VWR | BDH1135-4LP | |
| methylacylic acid N-hydroxysuccinimidyl ester | VWR | 730300-1G | |
| microfuge tube, 1.5 mL | VWR | 20170-038 | |
| multi-well plate, 6-well | Genesee | 25-100 | |
| paraformaldehyde (16%, EM-grade, methanol-free) | Electron Microscopy Sciences | 509804487 (Fisher) | |
| Pasteur pipet (2 mL, short tip) | VWR | 14673-010 | |
| PDMS kit (Sylgard 184 Kit, base and curing agent) | VWR | 102092-312 | |
| Petri plates | Genesee | 32-107 | |
| phosphate-buffered saline (10x solution) | VWR | 97063-660 | |
| Poly-L-lysine solution (0.1% solution) | VWR | P8920-1ooML | |
| Proteinase K | Thermo Fisher Scientific | E00491 | |
| scintillation vials (30 mL) | VWR | 66022-128 | |
| sodium acrylate | VWR | 101181-226 | |
| sodium azide (powder) | Millipore Sigma | 71289 | make a 1% w/v working stock; acute POISON at this concentration! |
| Streptavidin, Alexa Fluor 488 | Thermo Fisher Scientific | S32354 | |
| TAE (50x) | VWR | 97063-692 | |
| tape (double-sided, 1 inch wide) | Scotch 3M | 665 Scotch double sided 1inch/1296 inches Boxed | |
| TEMED | Thermo Fisher Scientific | PI17919 | |
| TEMPO | VWR | EM8.14681.0005 | catalytic oxidant |
| Tween-20 | VWR | 97063-872 | extremely viscous when pure; make a 10% working stock with water |
| Zeiss LSM 900 | Zeiss | Laser scanning microscope used without AiryScan |
Références
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proceedings of the National Academy of Sciences of the United States of America. 97 (15), 8206-8210 (2000).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-796 (2006).
- Betzig, E. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Chen, F., Tillberg, P. W., Boyden, E. S. Optical imaging. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Chang, J. -. B. Iterative expansion microscopy. Nature Methods. 14 (6), 593-599 (2017).
- Cahoon, C. K., et al. Superresolution expansion microscopy reveals the three-dimensional organization of the Drosophila synaptonemal complex. Proceedings of the National Academy of Sciences of the United States of America. 114 (33), 6857-6866 (2017).
- Mosca, T. J., Luginbuhl, D. J., Wang, I. E., Luo, L. Presynaptic LRP4 promotes synapse number and function of excitatory CNS neurons. eLife. 6, e27347 (2017).
- Jiang, N., et al. Superresolution imaging of Drosophila tissues using expansion microscopy. Molecular Biology of the Cell. 29 (12), 1413-1421 (2018).
- Yu, C. -. C. J., et al. Expansion microscopy of C. elegans. eLife. 9, e46249 (2020).
- Freifeld, L., et al. Expansion microscopy of zebrafish for neuroscience and developmental biology studies. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), E10799-E10808 (2017).
- Tanaka, T., et al. Phase transitions in ionic gels. Physical Review Letters. 45 (20), 1636-1639 (1980).
- Hausen, P., Dreyer, C. The use of polyacrylamide as an embedding medium for immunohistochemical studies of embryonic tissues. Stain Technology. 56 (5), 287-293 (1981).
- Campos-Ortega, J. A., Hartenstein, V. . The Embryonic Development of Drosophila melanogaster. , (2013).
- Chozinski, T. J., et al. Expansion microscopy with conventional antibodies and fluorescent proteins. Nature Methods. 13 (6), 485-488 (2016).
- Miller, D. F. B., Holtzman, S. L., Kaufman, T. C. Customized microinjection glass capillary needles for P-element transformations in Drosophila melanogaster. BioTechniques. 33 (2), 366-367 (2002).
- Rothwell, W. F., Sullivan, W. Drosophila embryo dechorionation. CSH Protocols. 2007, (2007).
- Cold Spring Harbor Protocols. . Drosophila apple juice-agar plates. , (2011).
- de Matos Simões, S., et al. Rho-kinase directs bazooka/Par-3 planar polarity during drosophila axis elongation. Developmental Cell. 19 (3), 377-388 (2010).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Paré, A. C., Zallen, J. A. Cellular, molecular, and biophysical control of epithelial cell intercalation. Current Topics in Developmental Biology. 136, 167-193 (2020).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Molecular Biology of the Cell. 15 (2), 838-850 (2004).
- Chowdhary, S., Tomer, D., Dubal, D., Sambre, D., Rikhy, R. Analysis of mitochondrial organization and function in the Drosophila blastoderm embryo. Scientific Reports. 7 (1), 5502 (2017).
- Chowdhary, S., Madan, S., Tomer, D., Mavrakis, M., Rikhy, R. Mitochondrial morphology and activity regulate furrow ingression and contractile ring dynamics in Drosophila cellularization. Molecular Biology of the Cell. 31 (21), 2331-2347 (2020).
- Stelzer, E. H. K., et al. Light sheet fluorescence microscopy. Nature Reviews Methods Primers. 1, 73 (2021).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Wen, G., et al. A Universal labeling strategy for nucleic acids in expansion microscopy. Journal of the American Chemical Society. 143 (34), 13782-13789 (2021).
- M'Saad, O., Bewersdorf, J. Light microscopy of proteins in their ultrastructural context. Nature Communications. 11 (1), 3850 (2020).
- Sarkar, D. Expansion revealing: Decrowding proteins to unmask invisible brain nanostructures. bioRxiv. , (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon