Method Article
使用扩增显微镜物理放大 整个果蝇 胚胎以进行超分辨率成像
摘要
在这里,提出了在早期 果蝇 胚胎中实施扩展显微镜以实现使用常规激光扫描共聚焦显微镜实现超分辨率成像的方案。
摘要
发育生物学的主力是共聚焦显微镜,它使研究人员能够确定复杂生物样品中标记分子的三维定位。虽然传统的共聚焦显微镜可以分辨相距几百纳米的两个相邻荧光点源,但观察亚细胞生物学的更精细细节需要能够分辨数十纳米量级的信号。已经开发了许多基于硬件的超分辨率显微镜方法,使研究人员能够规避这种分辨率限制,尽管这些方法需要专门的显微镜,而并非所有研究人员都可以使用。提高分辨能力的另一种方法是通过称为膨胀显微镜(ExM)的过程各向同性地扩大样品本身,该过程由Boyden小组于2015年首次描述。ExM 本身 不是一种显微镜,而是一种使样品膨胀,同时保持其组成分子的相对空间组织的方法。然后,可以使用传统的共聚焦显微镜以有效提高的分辨率观察扩展的样品。在这里,我们描述了一种在全装 果蝇 胚胎中实施ExM的方案,该方案用于检查Par-3,肌球蛋白II和线粒体在表面上皮细胞内的定位。该协议使样品量增加约四倍,从而可以检测传统共聚焦显微镜不可见的亚细胞细节。作为原理证明,抗GFP抗体用于区分相邻细胞皮层之间的不同肌球蛋白-GFP池,荧光标记的链霉亲和素用于检测内源性生物素化分子,以揭示线粒体网络结构的细节。该协议使用常见的抗体和试剂进行荧光标记,并且它应该与许多现有的免疫荧光协议兼容。
引言
在细胞和发育生物学中,眼见为实,准确确定蛋白质定位模式的能力是许多类型实验的基础。激光扫描共聚焦显微镜是在完整样品中以三维方式对荧光标记蛋白质进行成像的标准工具。传统的共聚焦显微镜无法区分(分辨)相邻的荧光信号,这些信号的间隔不到它们发出的光波长的一半1。换言之,两个点源必须在横向(轴向500-700 nm)上至少相隔200-300 nm,才能将它们解析为两个不同的信号。这种技术障碍被称为衍射极限,它是研究空间特征低于衍射极限的复杂亚细胞结构(例如肌动球蛋白细胞骨架或线粒体网络)的基本障碍。因此,提高传统共聚焦显微镜分辨率的技术是生物学界普遍感兴趣的。
为了避开衍射极限,已经开发了许多不同的超分辨率显微镜技术,这些技术允许分辨率达到数十纳米或更小的1,2,3,,这揭示了以前只能通过电子显微镜才能获得的生物复杂性世界。尽管这些基于硬件的方法具有明显的优势,但超分辨率显微镜通常具有特定的样品标记要求和较长的采集时间,限制了它们的灵活性,或者对于某些实验室来说可能过于昂贵。基于显微镜的超分辨率的替代方案是膨胀显微镜 (ExM),它本身不是一种显微镜,而是一种在保持其组成分子的相对空间组织的同时使样品膨胀的方法4。然后,可以使用传统的荧光共聚焦显微镜以有效提高的分辨率观察各向同性膨胀的样品。20155 年,Boyden 小组首次描述了 ExM,此后该基本技术已被改编用于各种实验 6,7,8。ExM 还被改编用于整个胚胎,特别是在果蝇9、10、11、秀丽隐杆线虫12 和斑马鱼13 中,使其成为发育生物学家的有力工具。
ExM基于两种不同的水凝胶化学成分:1)可溶胀的聚电解质水凝胶,浸泡在水中时尺寸大大增加14,以及2)聚丙烯酰胺水凝胶,其聚合物间距极小,允许各向同性样品膨胀15。虽然有许多已发表的 ExM 方案,但它们通常共享以下步骤:样品固定、标记、活化、凝胶化、酶切和扩增4.当然,固定条件和荧光标记策略会根据实验和系统的需要而变化,在某些方案中,标记发生在扩增之后。样品中的靶分子必须被引发(活化)才能与水凝胶结合,这可以使用不同的化学成分来实现4.在凝胶化步骤中,样品被未来水凝胶的单体(丙烯酸钠、丙烯酰胺和交联剂双丙烯酰胺)饱和,然后通过引发剂(如过硫酸铵 (APS))和促进剂(如四亚甲基二胺 (TEMED))催化的自由基聚合形成水凝胶4。凝胶化后,对样品进行酶消化,使样品抗溶胀性均匀化,并确保水凝胶4的各向同性膨胀。最后,将消化的水凝胶置于水中,使其膨胀到其原始线性尺寸的大约四倍4.

图1: 果蝇 胚胎扩增显微镜概述。 ExM 是一个多步骤协议,至少需要 4 天才能完成。胚胎收集、固定和脱髓化需要 1 天或更长时间,具体取决于来自多个集合的胚胎是否合并。免疫荧光标记需要 1 天或 2 天,具体取决于胚胎是否与一抗一起孵育过夜。胚胎活化、凝胶化、消化和扩增可以在一天内完成。凝胶可以在扩增后立即安装并成像,但出于实际原因,通常希望在第二天开始成像。 请点击这里查看此图的较大版本.
该协议描述了如何在全安装的早期至中期 果蝇 胚胎16 上进行ExM,以超分辨率可视化亚细胞蛋白定位模式(图1)。该方法使用甲基丙烯酸 N-羟基琥珀酰亚胺酯 (MA-NHS) 化学来激活蛋白质分子并将其锚定到水凝胶17 上,它是对先前发表的用于晚期 果蝇 胚胎和组织的 ExM 方案的修改11。该方案使用聚二甲基硅氧烷(PDMS)孔来模制水凝胶并促进活化和凝胶化过程中的溶液交换。一种不需要创建PDMS孔的替代方法涉及将附着在盖玻片上的胚胎降低到位于一块实验室密封膜22上的单体溶液滴中。此外,该方案描述了一种手动去除 果蝇 胚胎周围的不可渗透的卵黄膜的方法,这是免疫荧光染色的先决条件。重要的是,这种手工剥离胚胎的方法可用于在样品标记之前仅选择正确分期的 果蝇 胚胎,这大大增加了最终获得正确阶段和方向的扩展样品的可能性,从而使下游数据收集更加高效。
研究方案
该协议遵循阿肯色大学(UARK)关于无脊椎动物(如 果蝇黑腹果蝇)研究的指南,并得到了UARK机构生物安全委员会(协议#20001)的批准。
1. 果蝇 胚胎固定和脱膜化
注意:步骤1描述了手动去除卵黄膜的程序(手工剥离),卵黄膜是围绕胚胎的透明不透水膜。重要的是,手工剥离允许在ExM方案开始时选择适当分期的胚胎,从而大大提高了在ExM方案结束时以可用方向获得胚胎的可能性。然而,该ExM方案与批量胚胎收集和基于甲醇去除卵黄膜的标准程序完全兼容,在这种情况下,可以直接跳到步骤2(免疫荧光标记)。
- 准备或购买一些细玻璃针。针尖的实际尺寸并不重要,但要确保针头足够坚硬和锋利,足以刺穿固定胚胎的卵黄膜。使用微量移液管拉拔器从玻璃毛细管(外径1毫米,内径0.75毫米)制作针头,就像准备用于胚胎显微注射的针头一样18;或者,购买预拔针头。
- 使用标准 果蝇 技术19 收集胚胎,将>100成年 果蝇 放入用果汁/琼脂板20密封的通风塑料杯中。使用定时收集窗口富集适当阶段的胚胎16.例如,为了富集原肠胚形成(第6阶段)和收敛延伸(第7阶段)阶段,更换果汁平板,在25°C下收集胚胎2小时,然后取出平板,并在25°C下再老化2小时以获得~2-4小时大的胚胎。
- 为了从胚胎中除去蛋壳状绒毛膜,用50%漂白剂覆盖果汁板的表面(表1),用小画笔搅拌它们,将胚胎从琼脂表面释放出来,并等待3分钟使绒毛膜溶解。
- 使用画笔将去绒毛胚胎转移到含有 4 mL 庚烷(有机顶相)和 4 mL 固定缓冲液(水性底相; 表1)。从新鲜制备或最近打开的原液中新鲜稀释甲醛,并在添加胚胎之前立即与10x PBS和去离子水混合。
注意:从多聚甲醛或玻璃安瓿中的16%EM级甲醛中制备甲醛。可以使用浓甲醛(例如,37%甲醛)的储备,尽管结果可能不太一致。 - 胚胎将积聚在有机相和水相之间的界面处。添加尽可能多的胚胎,以在界面处形成单层。如果将太多胚胎添加到小瓶中,它们也不会固定。
- 使用强力胶带,将闪烁瓶固定在桌面振荡器上,并以220rpm搅拌20分钟。为了获得最佳固定效果,在整个固定过程中,在有机相和水相之间保持强烈的乳液。
- 在固定期间,为每个样品准备以下其中一项。
- 取一个塑料 6 厘米培养皿底座,其中一半装满 3% 琼脂,用剃须刀片或手术刀在琼脂中划出 ~5 cm x 3 cm 矩形。果汁/琼脂平板也可用于此目的。
- 使用小实验室刮刀,取出琼脂板。倒置培养皿的底部,并将其放在工作台上。将琼脂板放在倒置培养皿的顶部(图2A)。
- 取上培养皿的盖子,确保它是干燥的。戴上手套,在盖子内放一块双面胶带(胶带应略大于琼脂板; 图2B)。
- 从振荡器中取出小瓶,将它们直立放在工作台上,并让有机相和水相分离。正确固定的胚胎将保留在两个阶段之间的界面上。
- 使用装有乳胶灯泡的玻璃巴斯德移液管将固定的胚胎转移到琼脂板上。为防止胚胎粘附在移液管内部,请尽量将胚胎保持在移液管的窄颈内,并分多个小批量移植胚胎,而不是一次全部移植。一旦所有胚胎都在琼脂板上,使用P200移液器从胚胎周围除去大部分残留的庚烷。尽快(<3分钟)执行此步骤,以避免固定胚胎变干,这会对形态产生负面影响。
- 从~2cm的高度,用双面胶带将盖子放到琼脂板上,将胚胎粘附在胶带上(图2C)。轻轻地从琼脂板上取下盖子,将其倒置在工作台上,然后加入足够的PBS-吐温(表1)以覆盖盖子中的胚胎。
- 使用约100倍放大倍率和间接照明的立体解剖显微镜,使用形态学标记物识别正确分期的胚胎。对于第 6 阶段胚胎,使用可见的头沟和内陷的中胚层等标记物;对于第 7 阶段的胚胎,使用标记物,如延长的种带;对于第 11 阶段的胚胎,使用标记物,如完全延伸的胚芽和沿头尾轴16 的可见分割。
- 为了收集所需的胚胎,首先用细玻璃针刺破胚胎前端或后端附近的卵黄膜(胚胎周围的透明椭圆形膜);随着压力的释放,膜会稍微放气。然后,使用细镊子或金属探针,轻轻地将另一端的胚胎推入孔中;卵黄膜将保持粘附在双面胶带上。将不需要的胚胎粘附在胶带上。
- 定期用玻璃巴斯德移液管收集漂浮的脱皮脱脂化胚胎,并将它们移动到1.5mL微量离心管中。
- 此时,请执行以下步骤之一。
- 直接进行免疫荧光标记步骤。脱膜的胚胎可以直接进入封闭溶液(步骤2.2)。在进行下一步之前,不要让胚胎在PBS-吐温或封闭溶液(表1)中停留超过16小时。
- 将胚胎移入甲醇中储存。尽可能多地去除 PBS-吐温,然后加入 1 mL 甲醇。胚胎沉淀后,尽可能多地去除甲醇,并加入 1 mL 新鲜甲醇。将胚胎无限期地储存在-20°C。甲醇储存还允许从多个集合中汇集胚胎。
2. 免疫荧光标记
注意:除了抗体孵育步骤外,确切的液体量和时间在本节中并不重要。要进行冲洗或洗涤,让胚胎沉淀到管底部,在不吸吮胚胎的情况下尽可能多地去除液体,然后加入 ~1 mL 新液体;使用装有乳胶灯泡的玻璃巴斯德移液管,以获得最佳的清晰度和控制效果。对于冲洗步骤,胚胎不会摇晃,只是让它们沉淀;对于洗涤步骤,将胚胎在章动器上摇动指定的时间,然后让其沉淀。
- 如果胚胎未储存在甲醇中,请继续执行步骤2.2。如果胚胎储存在甲醇中,则用PBS-Tween冲洗两次,然后用PBS-Tween洗涤两次20分钟。
- 在 1 mL 封闭溶液中洗涤胚胎 30-60 分钟。
- 将胚胎与在抗体溶液(表1)中稀释的一抗在室温下孵育2小时,或优选在4°C下孵育过夜。 以尽可能小的体积(50-300μL)执行此步骤以保存一抗;在章动器上摇摆不是严格要求的。
- 将典型免疫荧光实验中使用的一抗量增加至少 50% 用于 ExM。使用以下一抗浓度:抗Par-3豚鼠多克隆21 :1:200,抗GFP兔多克隆1:100。
- 除去一抗溶液(如果需要,在4°C保存),用PBS-Tween冲洗两次,然后用PBS-Tween洗涤15分钟四次。
- 将胚胎与荧光二抗一起孵育,最终体积为300μL(在抗体溶液中稀释),在室温下在章动器上孵育1小时。在此步骤中可以添加荧光标记的链霉亲和素。从这一步开始,尽可能保护胚胎免受过度和长时间的光照,例如用不透明的盒盖盖住试管或将样品放在抽屉中。
- 使用以下浓度:1:500 用于与 Alexa Fluor 488 融合的抗兔 IgG 山羊多克隆抗体;1:500 用于与 Alexa Fluor 568 融合的抗豚鼠 IgG 山羊多克隆抗体;链霉亲和素-Alexa Fluor 488 的比例为 1:1000。
- 取出并处理二抗溶液。用PBS-Tween冲洗胚胎两次,并用PBS-Tween洗涤15分钟四次。
- 此时,胚胎可以在黑暗中储存在4°C,但尽快处理样品(<24小时)。
3. 制备PDMS孔
注意:PDMS 孔最多可以提前 2 周制作。
- 将培养箱或热板设置为55°C,并将可以将锥形管旋转至15°C的离心机设置为15°C。
- 要制备PDMS溶液(表1),请将50 mL锥形管放入刻度的二级容器中,并使用注射器向管中加入10 g有机硅弹性体基质。然后,加入1g有机硅弹性体固化剂,将管子倒置数次混合。
- 通过向第二个 50 mL 锥形管中加入适量的水来创建平衡管。将PDMS溶液在15°C下以500× g 离心3分钟,然后将其倒入10cm培养皿中至~1mm的深度。如有必要,用空气软管轻轻吹在溶液上去除气泡。让PDMS溶液在55°C下凝固过夜。
- PDMS板固化后,使用手术刀在略小于22 mm x 22 mm盖玻片的方形区域划痕。在每个正方形内,划痕并取出一个 ~8 毫米宽的正方形孔。
- 将每个方形PDMS孔转移到22 mm x 22 mm盖玻片上,并牢固地粘附(图2D)。准备六个或更多的盖玻片应该产生大量扩增的胚胎进行成像。
4.将胚胎粘附在盖玻片上
- 施加足够的0.1%聚-L-赖氨酸以覆盖每个孔(~50μL)内的盖玻片表面,并将它们置于55°C培养箱中风干。重复此步骤以增加粘附性。
- 在1x PBS中短暂冲洗胚胎一次以除去吐温洗涤剂,然后将>10个胚胎转移到每个聚-L-赖氨酸包被的孔中。
- 让胚胎沉降到孔底。使用巴斯德移液管从粘附的胚胎中去除多余的液体。立即继续执行下一步。
5. 活化和凝胶化
注意:活化是指将MA-NHS添加到胚胎中,这将修饰样品蛋白质和抗体,使它们能够与水凝胶结合。凝胶化是指在每个孔的胚胎内部和周围产生水凝胶。在凝胶化过程中,胚胎被单体溶液渗透,然后用凝胶溶液处理以形成水凝胶。
- 通过用活化溶液填充孔(1mM MA-NHS,在1x PBS中新鲜稀释; 表1)。在1小时内大约每10分钟改变一次该溶液。
- 用1x PBS冲洗胚胎三次。将胚胎在单体溶液(表1)中在4°C下孵育45分钟。
- 当胚胎位于单体溶液中时,制备凝胶溶液(表1)。制备 ~2 mL 凝胶溶液足以覆盖整个 10 cm 培养皿的 PDMS 孔。请务必最后添加 APS,因为它将启动聚合并开始凝胶化。
- 从粉末中稀释催化氧化剂(例如,1% TEMPO w/v 在水中)。将 1,960 μL 单体溶液与 30 μL 10% TEMED 和 10 μL 1% TEMPO 混合。
- 为避免一次聚合整批凝胶溶液,请小批量工作。将凝胶溶液(不含APS)在PCR条带的八个管之间分成125μL等分试样。
- 使用真空从三个PDMS孔中取出单体溶液,同时注意不要破坏胚胎。将 5 μL APS 加入到其中一个含有凝胶溶液的 PCR 管中以引发聚合。在孔中快速分配聚合凝胶溶液(每孔~40μL)。重复此操作,直到覆盖所有孔和胚胎。
- 让样品在37°C下凝胶1.5-2.5小时。 每隔一段时间搅拌一次水凝胶以监测聚合。固化的水凝胶不会摆动。较厚的水凝胶需要更长的时间才能完成聚合和固化。
6.消化和膨胀
注意:较厚和较大的凝胶需要更长的时间才能膨胀,凝胶的中心可能需要几个小时才能完全膨胀;这可以通过修剪凝胶的边缘来加快速度。随着凝胶的膨胀,它们的折射率将变得几乎与水的折射率相同,并且它们将变得非常难以看到。
- 凝胶化完成后,从盖玻片上剥离PDMS孔,同时尽量不要干扰水凝胶。如果需要,切掉多余的水凝胶材料。
- 将水凝胶(仍附着在盖玻片上)单独转移到六孔板的孔中(图2E)。请注意,水凝胶在消化过程中可能会略微膨胀。
- 在37°C下用消化缓冲液(表1)完全覆盖凝胶1小时。 通常,30 mL 消化缓冲液足以覆盖 6 孔板中的凝胶。
- 消化后,将每种水凝胶从盖玻片上滑下来,将它们单独转移到6厘米的培养皿中。可能需要使用第二个盖玻片来去除凝胶。用去离子水填充每个培养皿以扩增凝胶。在1-2小时内更换水3至4次,直到凝胶完全膨胀(预计宽度增加约4倍)。
7. 安装和成像
注意:膨胀水凝胶几乎完全由水组成,使其几乎透明且极其脆弱。可以使用长盖玻片操纵凝胶,以移动它们并将它们拾取。一次只能安装和成像一两块凝胶,因为凝胶会逐渐释放水分并开始在盖玻片周围滑动。
- 使用巴斯德移液管,尽可能多地从培养皿中去除多余的水,以尽量减少凝胶在处理时四处移动。
- 将每个扩增的凝胶(胚胎在底面上)操纵到大盖玻片(例如,24 mm x 40 mm)上进行成像。
- 用凝胶将每个盖玻片安装在倒置激光扫描共聚焦显微镜的物镜上。使用显微镜上的落射荧光或明场显微镜模式,使用低放大倍率(5倍或10倍)或中放大倍率(20倍)空气物镜定位正确分位和定向的标本。
- 要以高分辨率成像,请切换到高放大倍率(60倍、63倍或100倍)油浸物镜或水浸物镜。胚胎的表面必须在物镜的聚焦范围内(63倍物镜距离盖玻片<300μm)才能成像。
- 使用显微镜上的激光扫描共聚焦模式从样品中收集数据。确保收集具有良好动态范围的非饱和图像,并在每张图像中使用适当数量的像素来捕获有关样本23的最大可能信息。

图 2:手动脱膜和使用水凝胶 。 (A) 从琼脂/果汁平板上切下琼脂板。(B) 将双面胶带放在 6 厘米培养皿的盖子内。(C) 将胚胎粘附在胶带盖上。(D) 带有方形孔的 PDMS 板粘附在 22 mm x 22 mm 的盖玻片上。(E) 盖玻片,在 6 孔板内带有 PDMS 孔。 请点击这里查看此图的较大版本.
结果
为了表征ExM在整座果蝇胚胎中的一般功效,在未扩增的对照胚胎与扩增的胚胎中测量沿头尾轴的胚胎长度(图3A-C)。未扩增的对照胚胎经受与扩增胚胎相同的固定条件和免疫荧光标记步骤,只是在成像前使用固化的封固剂进行封片。当使用10倍物镜时,单个未扩增的胚胎跨越了大约一半的视野(图3A)。相比之下,当使用相同的10倍物镜时,扩增的胚胎跨越了大约两个完整的视野(图3B)。为了评估实验内和实验之间的扩增程度如何变化,在三个不同的场合执行相同的ExM方案,并在每个单独的实验中用三种不同的凝胶测量胚胎长度。未扩增的对照胚胎的平均头尾长度为398.8μm(标准差[SD]=22.93μm;n=74;图3C)。对于实验 1、实验 2 和实验 3,平均胚胎长度分别为 1,596 μm (SD = 159.9 μm; n = 57)、1,868 μm (SD = 150.5 μm; n = 51) 和 1,954 μm (SD = 120.3 μm; n = 44),分别代表 4.0 倍、4.7 倍和 4.9 倍的膨胀因子(图 3C)。凝胶之间的实验内差异远不如实验间差异明显,后者约为20%(图3C)。为了评估ExM对细胞和胚胎形态的影响,使用针对粘附连接成分Par-3(火箭筒)21的抗体来标记顶端细胞膜,我们对第11阶段果蝇胚胎的发育口段进行了成像 - 一个具有复杂分段结构的阶段(图3D-F)。在对照样品中,上颌节的细胞平均宽度为4.76μm(SD = 1.053 μm,n = 25;图3D,F)。在使用相同的 40 倍物镜和缩放因子 (1x) 成像的扩展样品中,上颌节段的细胞平均宽度为 19.10 μm (SD = 3.966 μm,n = 18;图 3E,F),表示 4.0 倍的扩展。因此,与之前的报告11 一致,我们能够使用 ExM 将整个果蝇胚胎的线性尺寸扩增约四倍,而不会出现样品撕裂或细胞或组织形态的明显扭曲。
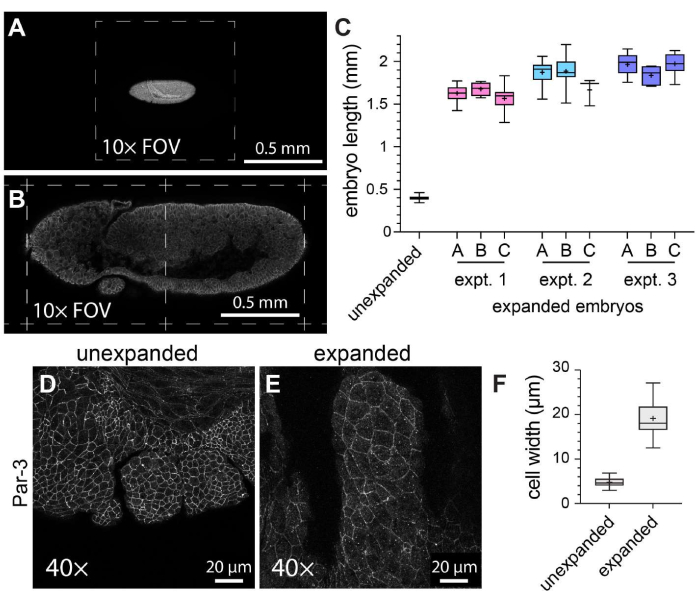
图3:果蝇胚胎的四倍扩增。 (A)未扩增和(B)扩增的果蝇胚胎使用10倍物镜(0.3 NA)在1倍变焦下成像。各个视场 (FOV) 用虚线表示。胚胎表达GFP标记的肌球蛋白轻链,并用抗GFP抗体染色。(C)与未扩增的对照相比,每个实验和三个单独的ExM实验中三个水凝胶的胚胎长度(沿头尾轴)的定量。(D,E)使用 40 倍物镜 (1.3 NA) 在 1 倍变焦下成像的 (D) 未扩张和 (E) 扩张的 11 期果蝇胚胎的上颌节段。用抗Par-3/火箭筒抗体(白色)检测细胞轮廓(粘附连接)。(F)从(D)和(E)的等效细胞组中量化细胞宽度(长轴)。(C) 和 (F) 中的箱形图显示了第 25、50 和 75 个百分位数范围;晶须表示最小值和最大值;"+"符号表示平均值。请点击这里查看此图的较大版本.
为了证明ExM可用于解析低于典型衍射极限的亚细胞细节,在未扩增的对照组与经历收敛延伸(第7期)的扩增胚胎中对肌动球蛋白细胞骨架进行了成像。原肠胚形成和收敛延伸的组织重塑事件在很大程度上受运动蛋白肌球蛋白 II24 定位变化的控制。然而,在早期 果蝇 外胚层密集的柱状上皮中,即使以 158 倍放大倍率(63 倍物镜,2.5 倍光学变焦)成像,也很难观察到肌球蛋白 II 定位模式的许多精细细节——这是激光扫描共聚焦显微镜的典型最大分辨率。例如,由于肌球蛋白II是一种皮质蛋白(位于质膜正下方),因此位于细胞间接触两侧的肌球蛋白II25 池在7期胚胎中是不可分离的,它们表现为相邻细胞相遇的单线(图4A)。相比之下,在扩展的第 7 阶段胚胎中,可以在细胞-细胞连接处观察到肌球蛋白 II 的平行线,代表相邻细胞中的皮质蛋白池(图 4B)。扩增样品中平行肌球蛋白II线之间的距离为892.7 nm(SD = 0.171 nm,n = 12);当除以 4 时,这会产生未扩增胚胎中相邻细胞中肌球蛋白线之间的预测距离为 ~220 nm,这确实略低于 Alexa 488 检测到的信号的衍射极限(峰值发射为 ~520 nm/2 = 260 nm)。
此外,我们还测试了 ExM 是否可用于解析胃部果蝇胚胎(第 6 阶段)密集堆积细胞中的线粒体网络结构。线粒体功能与网络结构密切相关(即融合与碎片化的细胞器),但在不平坦和/或薄的细胞类型中使用传统的共聚焦显微镜很难可视化线粒体网络组织的细节。线粒体天然富含生物素化分子,因此,可以使用荧光标记的链霉亲和素26 在早期果蝇胚胎中标记线粒体。在用链霉亲和素-Alexa 488标记的未扩增的6期胚胎中,信号显示为细胞质点,通常重叠且难以解析(图4C)。相比之下,在扩展的 6 期胚胎中,可以看到线粒体网络的更多精细细节,并且点状更容易解析(图 4D)26,27。这些结果表明,ExM可用于研究传统上不适合线粒体分析的细胞类型的线粒体网络组织。

图 4:通过扩增显微镜显示的肌动球蛋白细胞骨架和线粒体的详细信息。 (A,B) 肌球蛋白 II 在神经外胚层(生殖带)细胞中的定位,在第 7 阶段 (A) 未扩增和 (B) 扩增胚胎中以 2.5 倍放大的 2.5 倍成像。在表达转基因GFP标记的肌球蛋白II调节轻链(sqh-GFP)的胚胎中检测到肌球蛋白II,该蛋白用抗GFP抗体(红色)检测。位于相邻细胞中的不同皮质肌球蛋白池可以在扩展的胚胎中分解(白色箭头)。(C,D)在6期未扩增(C)和扩增(D)胚胎中,用63×物镜(1.4 NA)以2.5倍放大对神经外胚层细胞中的线粒体网络进行成像。用链霉亲和素-Alexa 488(绿色)检测线粒体,用抗Par-3/火箭筒抗体(品红色)检测细胞轮廓。实验采用激光扫描共聚焦显微镜进行。请点击这里查看此图的较大版本.
表1:溶液配方。 本协议中使用的溶液的组成按外观顺序排列。除非另有说明,否则所有股票均为液体。除非另有说明,否则将化学品重悬或稀释在高压灭菌的过滤水中。 请按此下载此表格。
讨论
手动脱膜
大多数 果蝇 胚胎固定方案涉及通过在甲醇和庚烷乳液中摇晃固定胚胎来去除卵黄膜,这导致膜 通过 渗透破裂破裂26。虽然基于甲醇的脱膜(甲醇爆裂)是有效且适用于许多应用的,但手动脱膜(手工剥离)具有一些显着的优势。首先,手工剥离允许人们选择精确分期的胚胎进行脱膜和收集,大大增加了在实验结束时以可用方向获得扩增胚胎的可能性。在研究快速发育过程的特定方面(例如,中胚层内陷或收敛延伸)时,这种富集至关重要,对于这些方面,适当分期的胚胎可能只占所有胚胎的百分之几,即使在时间紧迫的收集窗口内也是如此。当然,对于许多应用来说,从定时收集窗口对胚胎进行更传统的散装甲醇爆裂就足够了,手工剥离可能不值得付出额外的努力。其次,某些一抗和染料的结合会受到先前样品暴露于甲醇的负面影响。因此,与甲醇爆破样品相比,手工剥离可以显着提高免疫荧光信号质量,使其成为 果蝇 发育生物学家有用的通用技术。
扩增的全装果蝇胚胎中的高分辨率共聚焦显微镜
虽然对扩增样品进行高分辨率共聚焦显微镜在概念上与未扩增样品相同,但ExM确实引入了一些技术障碍。值得注意的是,随着样本量的增加,随机的胚胎取向变得更加重要,因为高放大倍率、高数值孔径物镜只能聚焦来自非常接近盖玻片的样品区域的光27。因此,通常只能聚焦在胚胎表面或附近的细胞上,这些细胞在凝胶形成时最终与盖玻片相邻。确保最后有正确方向的标本的最佳方法是以紧密分阶段的固定胚胎集合(例如,通过使用手工剥离)开始ExM方案,并在每个孔中播种许多胚胎(>10)。为了可视化胚胎内部深处的细胞,可能需要使用更专业的成像装置,例如光片显微镜28。此外,我们发现可以通过将共聚焦针孔打开到大于一个通风单元的尺寸来提高图像质量。当然,增加针孔尺寸会以降低最大分辨率为代价,但在实践中,即使针孔尺寸的小幅增加也会显著提高信号强度(数据未显示)。未来的研究应系统地解决ExM样品中的针孔尺寸和有效分辨率。
基本 ExM 的变化
这里描述的协议是一个相对简单的ExM示例,它应该适用于许多应用,并且在大多数发育生物学实验室中易于实施。然而,ExM 4,5,7 的基本概念有许多变化,可用于增加信号强度、实现更进一步的扩增程度以及检测核酸分子和蛋白质。在该方案中,胚胎在凝胶化和扩增之前与抗体一起孵育。或者,样品在扩增后可以用抗体处理 6,30,这可以增加信号强度,因为在扩增步骤中增加表位可及性和减少结合抗体的损失。此外,特定的交联剂分子可用于将RNA分子附着在水凝胶上,以允许使用杂交链式反应方法30检测扩增凝胶中的RNA。最后,样品可以进行多轮扩增,如迭代膨胀显微镜 (iExM)31、泛 ExM32 和扩增揭示 (ExR)31,以实现更高程度的分辨率提高。
披露声明
作者没有利益冲突需要声明。
致谢
我们要感谢 Jennifer Zallen 博士提供豚鼠抗 Par-3 一抗。这项工作得到了美国国立卫生研究院(NIH)成员之一美国国家普通医学科学研究所(NIGMS)以及阿肯色州生物科学研究所(ABI)的慷慨资助(1R15GM143729-01和1P20GM139768-01 5743)的支持,该研究所为购买我们的共聚焦显微镜提供了部分资金。
材料
| Name | Company | Catalog Number | Comments |
| acrylamide | Milipore Sigma | 1490-100ML | |
| ammonium persulfate | VWR | BDH9214-500G | |
| anti-GFP rabbit polyclonal antibody | Torrey Pines BioLabs | TP-401 | |
| anti-guinea pig IgG goat polyclonal antibody, Alexa Fluor 568 | Thermo Fisher Scientific | A-11075 | |
| anti-rabbit IgG goat polyclonal antibody, Alexa Fluor 488 | Thermo Fisher Scientific | A-11008 | |
| bisacrylamide | Research Products International | A11275 | |
| bovine serum albumin (30% solution) | Millipore Sigma | A7284 | |
| conical tubes, 50 mL | fisherscientific | 21008-940 | |
| coverlip glass, square 22 mm | VWR | 48366-227 | |
| coverslip glass, rectangular 40 mm x 24 mm | VWR | 48393-230 | |
| glass capillaries for pulling needles | World Precision Instruments | TW100F-4 | |
| glass microinjection needles (pre-pulled) | World Precision Instruments | TIP10LT | |
| guanidine HCl | VWR | 101970-606 | |
| heptane | VWR | EM-HX0078-1 | |
| latex pipet bulbs | VWR | 82024-554 | |
| methanol | VWR | BDH1135-4LP | |
| methylacylic acid N-hydroxysuccinimidyl ester | VWR | 730300-1G | |
| microfuge tube, 1.5 mL | VWR | 20170-038 | |
| multi-well plate, 6-well | Genesee | 25-100 | |
| paraformaldehyde (16%, EM-grade, methanol-free) | Electron Microscopy Sciences | 509804487 (Fisher) | |
| Pasteur pipet (2 mL, short tip) | VWR | 14673-010 | |
| PDMS kit (Sylgard 184 Kit, base and curing agent) | VWR | 102092-312 | |
| Petri plates | Genesee | 32-107 | |
| phosphate-buffered saline (10x solution) | VWR | 97063-660 | |
| Poly-L-lysine solution (0.1% solution) | VWR | P8920-1ooML | |
| Proteinase K | Thermo Fisher Scientific | E00491 | |
| scintillation vials (30 mL) | VWR | 66022-128 | |
| sodium acrylate | VWR | 101181-226 | |
| sodium azide (powder) | Millipore Sigma | 71289 | make a 1% w/v working stock; acute POISON at this concentration! |
| Streptavidin, Alexa Fluor 488 | Thermo Fisher Scientific | S32354 | |
| TAE (50x) | VWR | 97063-692 | |
| tape (double-sided, 1 inch wide) | Scotch 3M | 665 Scotch double sided 1inch/1296 inches Boxed | |
| TEMED | Thermo Fisher Scientific | PI17919 | |
| TEMPO | VWR | EM8.14681.0005 | catalytic oxidant |
| Tween-20 | VWR | 97063-872 | extremely viscous when pure; make a 10% working stock with water |
| Zeiss LSM 900 | Zeiss | Laser scanning microscope used without AiryScan |
参考文献
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proceedings of the National Academy of Sciences of the United States of America. 97 (15), 8206-8210 (2000).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-796 (2006).
- Betzig, E. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Wassie, A. T., Zhao, Y., Boyden, E. S. Expansion microscopy: principles and uses in biological research. Nature Methods. 16 (1), 33-41 (2019).
- Chen, F., Tillberg, P. W., Boyden, E. S. Optical imaging. Expansion microscopy. Science. 347 (6221), 543-548 (2015).
- Chen, F., et al. Nanoscale imaging of RNA with expansion microscopy. Nature Methods. 13 (8), 679-684 (2016).
- Tillberg, P. W., et al. Protein-retention expansion microscopy of cells and tissues labeled using standard fluorescent proteins and antibodies. Nature Biotechnology. 34 (9), 987-992 (2016).
- Chang, J. -. B. Iterative expansion microscopy. Nature Methods. 14 (6), 593-599 (2017).
- Cahoon, C. K., et al. Superresolution expansion microscopy reveals the three-dimensional organization of the Drosophila synaptonemal complex. Proceedings of the National Academy of Sciences of the United States of America. 114 (33), 6857-6866 (2017).
- Mosca, T. J., Luginbuhl, D. J., Wang, I. E., Luo, L. Presynaptic LRP4 promotes synapse number and function of excitatory CNS neurons. eLife. 6, e27347 (2017).
- Jiang, N., et al. Superresolution imaging of Drosophila tissues using expansion microscopy. Molecular Biology of the Cell. 29 (12), 1413-1421 (2018).
- Yu, C. -. C. J., et al. Expansion microscopy of C. elegans. eLife. 9, e46249 (2020).
- Freifeld, L., et al. Expansion microscopy of zebrafish for neuroscience and developmental biology studies. Proceedings of the National Academy of Sciences of the United States of America. 114 (50), E10799-E10808 (2017).
- Tanaka, T., et al. Phase transitions in ionic gels. Physical Review Letters. 45 (20), 1636-1639 (1980).
- Hausen, P., Dreyer, C. The use of polyacrylamide as an embedding medium for immunohistochemical studies of embryonic tissues. Stain Technology. 56 (5), 287-293 (1981).
- Campos-Ortega, J. A., Hartenstein, V. . The Embryonic Development of Drosophila melanogaster. , (2013).
- Chozinski, T. J., et al. Expansion microscopy with conventional antibodies and fluorescent proteins. Nature Methods. 13 (6), 485-488 (2016).
- Miller, D. F. B., Holtzman, S. L., Kaufman, T. C. Customized microinjection glass capillary needles for P-element transformations in Drosophila melanogaster. BioTechniques. 33 (2), 366-367 (2002).
- Rothwell, W. F., Sullivan, W. Drosophila embryo dechorionation. CSH Protocols. 2007, (2007).
- Cold Spring Harbor Protocols. . Drosophila apple juice-agar plates. , (2011).
- de Matos Simões, S., et al. Rho-kinase directs bazooka/Par-3 planar polarity during drosophila axis elongation. Developmental Cell. 19 (3), 377-388 (2010).
- Gambarotto, D., et al. Imaging cellular ultrastructures using expansion microscopy (U-ExM). Nature Methods. 16 (1), 71-74 (2019).
- Paré, A. C., Zallen, J. A. Cellular, molecular, and biophysical control of epithelial cell intercalation. Current Topics in Developmental Biology. 136, 167-193 (2020).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Molecular Biology of the Cell. 15 (2), 838-850 (2004).
- Chowdhary, S., Tomer, D., Dubal, D., Sambre, D., Rikhy, R. Analysis of mitochondrial organization and function in the Drosophila blastoderm embryo. Scientific Reports. 7 (1), 5502 (2017).
- Chowdhary, S., Madan, S., Tomer, D., Mavrakis, M., Rikhy, R. Mitochondrial morphology and activity regulate furrow ingression and contractile ring dynamics in Drosophila cellularization. Molecular Biology of the Cell. 31 (21), 2331-2347 (2020).
- Stelzer, E. H. K., et al. Light sheet fluorescence microscopy. Nature Reviews Methods Primers. 1, 73 (2021).
- Ku, T., et al. Multiplexed and scalable super-resolution imaging of three-dimensional protein localization in size-adjustable tissues. Nature Biotechnology. 34 (9), 973-981 (2016).
- Wen, G., et al. A Universal labeling strategy for nucleic acids in expansion microscopy. Journal of the American Chemical Society. 143 (34), 13782-13789 (2021).
- M'Saad, O., Bewersdorf, J. Light microscopy of proteins in their ultrastructural context. Nature Communications. 11 (1), 3850 (2020).
- Sarkar, D. Expansion revealing: Decrowding proteins to unmask invisible brain nanostructures. bioRxiv. , (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。