Method Article
Détermination de la cinétique d’activation in vitro et cellulaire pour les aptamères d’ARN fluorogéniques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le protocole présente deux méthodes pour déterminer la cinétique des aptamères d’ARN fluorogéniques Spinach2 et Brocoli. La première méthode décrit comment mesurer la cinétique des aptamères fluorogéniques in vitro avec un lecteur de plaques, tandis que la deuxième méthode détaille la mesure de la cinétique des aptamères fluorogéniques dans les cellules par cytométrie en flux.
Résumé
Des aptamères d’ARN fluorogéniques ont été appliqués dans des cellules vivantes pour marquer et visualiser les ARN, rendre compte de l’expression des gènes et activer des biocapteurs fluorescents qui détectent les niveaux de métabolites et de molécules de signalisation. Afin d’étudier les changements dynamiques dans chacun de ces systèmes, il est souhaitable d’obtenir des mesures en temps réel, mais la précision des mesures dépend de la cinétique de la réaction fluorogénique plus rapide que la fréquence d’échantillonnage. Ici, nous décrivons des méthodes pour déterminer la cinétique d’activation in vitro et cellulaire pour les aptamères d’ARN fluorogénique à l’aide d’un lecteur de plaques équipé respectivement d’un injecteur d’échantillon et d’un cytomètre en flux. Nous montrons que la cinétique in vitro pour l’activation de fluorescence des aptamères Spinach2 et Brocoli peut être modélisée comme des réactions d’association à deux phases et ont différentes constantes de vitesse de phase rapide de 0,56 s-1 et 0,35 s-1, respectivement. De plus, nous montrons que la cinétique cellulaire pour l’activation de fluorescence des épinards2 chez Escherichia coli, qui est encore limitée par la diffusion du colorant dans les bactéries à Gram négatif, est encore suffisamment rapide pour permettre une fréquence d’échantillonnage précise sur l’échelle de temps infime. Ces méthodes d’analyse de la cinétique d’activation de fluorescence sont applicables à d’autres aptamères d’ARN fluorogéniques qui ont été développés.
Introduction
Les réactions fluorogéniques sont des réactions chimiques qui génèrent un signal de fluorescence. Les aptamères d’ARN fluorogénique remplissent généralement cette fonction en liant un colorant à petite molécule pour améliorer son rendement quantique de fluorescence (Figure 1A)1. Différents systèmes d’aptamères d’ARN fluorogéniques ont été développés et se composent de séquences d’aptamères d’ARN spécifiques et des ligands colorants correspondants1. Des aptamères d’ARN fluorogéniques ont été ajoutés aux transcrits d’ARN sous forme de marqueurs fluorescents qui permettent l’imagerie de cellules vivantes d’ARNm et d’ARN non codants 2,3,4. Ils ont également été placés après des séquences promotrices en tant que rapporteurs fluorescents de l’expression génique, similaire à l’utilisation de la protéine fluorescente verte (GFP) comme rapporteur, sauf que la fonction de déclaration est au niveau de l’ARN 5,6. Enfin, des aptamères d’ARN fluorogéniques ont été incorporés dans des biocapteurs fluorescents à base d’ARN, conçus pour déclencher la réaction fluorogénique en réponse à une petite molécule spécifique. Des biocapteurs fluorescents à base d’ARN ont été développés pour l’imagerie de cellules vivantes de divers métabolites non fluorescents et molécules de signalisation 7,8,9,10,11.
Il y a un intérêt croissant pour le développement d’aptamères d’ARN fluorogéniques pour visualiser les changements dynamiques dans la localisation de l’ARN, l’expression des gènes et les signaux de petites molécules. Pour chacune de ces applications, il est souhaitable d’obtenir des mesures en temps réel, mais la précision des mesures dépend de la cinétique de la réaction fluorogénique plus rapide que la fréquence d’échantillonnage. Ici, nous décrivons des méthodes pour déterminer la cinétique in vitro des aptamères d’ARN fluorogéniques Spinach2 12 et Brocoli13 à l’aide d’un lecteur de plaques équipé d’un injecteur d’échantillon et pour déterminer la cinétique d’activation cellulaire pourSpinach2 exprimée dans Escherichia coli à l’aide d’un cytomètre en flux. Ces deux aptamères d’ARN ont été choisis parce qu’ils ont été appliqués pour étudier la localisation de l’ARN 2,3,4, ils ont été utilisés dans les rapporteurs5,6 et les biocapteurs 7,8,9,10,11, et les ligands colorants correspondants (DFHBI ou DFHBI-1T) sont disponibles dans le commerce. Un résumé de leurs propriétés in vitro déterminées dans la littérature est présenté dans le tableau 1 4,13,14, qui a éclairé l’élaboration du protocole (p. ex., les longueurs d’onde et les concentrations de colorant utilisées). Ces résultats démontrent que les réactions fluorogéniques affectées par les aptamères d’ARN sont rapides et ne devraient pas empêcher des mesures précises pour les applications biologiques cellulaires souhaitées.
Protocole
1. Expérience de cinétique in vitro
- Préparation de modèles d’ADN par PCR
- Configurer la ou les réactions PCR : Pour préparer les réactions PCR, combinez les réactifs suivants dans un tube PCR à paroi mince :
33 μL d’eau bidistillée (ddH2O)
10 μL de tampon 5x pour ADN polymérase haute fidélité
5 μL de 2 mM de désoxyribonucléoside triphosphate (dNTP)
0,5 μL d’amorce avant de 40 μM
0,5 μL d’amorce inverse 40 μM
0,5 μL (10-100 ng) de matrice d’ADN (pour la PCR Spinach2 seulement; Les apprêts pour le brocoli se chevauchent)
0,5 μL d’ADN polymérase haute fidélité (ajouter en dernier)
REMARQUE: Les oligonucléotides synthétiques sont souvent expédiés à sec. Pour préparer des solutions mères, ajoutez un volume connu (100 μL recommandé) de ddH2O et mesurez le A260 de cette solution pour déterminer la concentration par la loi de Beer, où le coefficient d’extinction peut être calculé par les règles du plus proche voisin en ligne. Cette solution mère peut ensuite être utilisée pour rendre les dilutions appropriées pour une utilisation en PCR. - Exécutez le protocole thermocycleur.
- Utilisez le protocole thermocycleur suivant pour amplifier les modèles d’ADN d’épinards2 et de brocoli sur toute la longueur :
Dénaturation initiale :98 °C pendant 2 min
35 cycles :
Dénaturation:98 °C dénaturation pendant 15 s
Recuit :72 °C pendant 30 s
Extension : 72 °C pendant 30 s
Extension finale : 72 °C pendant 5 min. - Après la réaction, analyser une petite partie aliquote du produit par un gel d’agarose à 2% avec une échelle de faible poids moléculaire (gamme de taille: 25-766 nucléotides) pour confirmer la présence du produit d’ADN désiré.
- Purifier le produit par extraction de gel disponible dans le commerce ou kits de nettoyage PCR et éluer avec ddH2O ou le tampon fourni par le fabricant.
REMARQUE: Assurez-vous lors du choix d’un kit de nettoyage PCR que le seuil de poids moléculaire de la colonne est suffisamment bas pour retenir T7-Brocoli (81 nucléotides), sinon le produit PCR sera perdu.
REMARQUE: Point de pause facultatif: stockez l’ADN à -20 ° C.
- Utilisez le protocole thermocycleur suivant pour amplifier les modèles d’ADN d’épinards2 et de brocoli sur toute la longueur :
- Configurer la ou les réactions PCR : Pour préparer les réactions PCR, combinez les réactifs suivants dans un tube PCR à paroi mince :
- Préparation d’épinards2 et d’ARN de brocoli par transcription in vitro (IVT)
- Configurez la ou les réactions de transcription.
- Pour préparer une réaction de transcription de 100 μL, combiner les réactifs suivants dans un tube microcentrifuge de 1,5 mL : 10 μL de tampon de transcription 10x + 20 μL de ribonucléosides triphosphates 10 mM (rNTP) + 1-64 μL de matrice d’ADN (total de 1 μg) + 2 μL de pyrophosphatase inorganique +ddH2Oà 98 μL + 2 μL d’ARN polymérase T7 (ajouter en dernier).
- Incuber cette réaction pendant 4 h à 37 °C. Éteignez la réaction en ajoutant 100 μL de 2x tampon de charge de gel d’urée (2x ULB), composé de 20% de saccharose, 0,1% de dodécylsulfate de sodium (SDS), 1x tampon Tris-Borate-EDTA (1x TBE) et ~18 M d’urée.
REMARQUE : Point de pause facultatif : stocker la réaction éteinte à −20 °C.
- Configurez la ou les réactions de transcription.
- Purification de l’ARN par électrophorèse sur gel polyacrylamide (PAGE)
- Purification PAGE des épinards2 et de l’ARN du brocoli
ATTENTION : L’acrylamide non polymérisé (liquide ou en poudre) est extrêmement toxique. Si vous pesez de l’acrylamide en poudre, faites-le dans une hotte. Portez toujours l’équipement de protection approprié et retirez immédiatement les gants contaminés par de la poudre ou de la solution d’acrylamide, en vous lavant soigneusement les mains. Si l’acrylamide entre en contact direct avec la peau, laver la zone exposée pendant au moins 15 minutes avec de l’eau et du savon. Si l’acrylamide entre en contact direct avec les yeux, rincez-les à l’eau pendant 15 min.- Préparez le gel PAGE : Pour éliminer les transcrits abortifs indésirables et les rNTP n’ayant pas réagi du produit complet, préparez un gel d’urée-polyacrylamide à 6 %. En général, des gels de 28 cm x 16,5 cm x 1,5 mm peuvent être utilisés avec un peigne à 8 puits. Installez l’équipement de gel et d’électrophorèse, en utilisant 1x tampon TBE pour remplir les réservoirs.
- Charger le(s) échantillon(s) d’ARN dans le gel PAGE : Charger le gel avec une réaction trempée de 200 μL par voie. Dans une voie séparée, charger 2x ULB avec des colorants trackers xylène cyanol et bleu de bromophénol, qui migrent dans le gel à 106 nucléotides et 26 nucléotides, respectivement15. Laissez une voie vide entre chaque échantillon pour éviter toute contamination potentielle aux étapes suivantes.
- Pour séparer les épinards 95-nt2 et 49-nt Brocoli de leurs produits tronqués respectifs, faites fonctionner le gel pendant 1,5-2 h à 25 W, après quoi le colorant bleu de bromophénol aura migré ~5/6 de la longueur du gel.
- Visualisez le(s) échantillon(s) d’ARN dans le gel PAGE : Démontez les plaques de verre autour du gel et couvrez le gel d’une pellicule plastique des deux côtés, en étiquetant les voies sur l’enveloppe. Visualisez les bandes d’ARN dans une pièce sombre par ombrage UV en plaçant le gel enveloppé sur une plaque TLC fluorescente sous lumière UV. Délimitez rapidement le bord des bandes d’ARN correspondant au produit à l’aide d’un marqueur et éteignez la lampe UV pour minimiser les dommages causés par l’exposition aux UV.
- Extraire le(s) échantillon(s) d’ARN du gel PAGE : Avec une lame de rasoir fraîche pour chaque échantillon, exciser les bandes de produit souhaitées, couper en dés en cubes de ~1 mm et ajouter les morceaux de gel dans un tube microcentrifuge de 2 ml avec 500 μL de tampon de trempage d’écrasement pour extraire l’ARN sur un rotateur pendant 2 h à température ambiante (RT) ou toute la nuit à 4 °C.
NOTE: Point de pause facultatif: l’échantillon peut être conservé à −20 °C. - Précipiter l’ARN
- Pour séparer les morceaux de gel de l’ARN extrait dans un tampon, centrifuger l’échantillon à 13 000 x g pendant 20 minutes à 4 °C, puis utiliser une pipette à pointe étroite pour extraire le surnageant et le charger dans un nouveau tube microcentrifuge de 2 mL.
- Pour précipiter l’ARN, ajouter 1,5 mL d’éthanol glacé et 1 μL de glycogène 20 mg/mL, vortex, et conserver pendant au moins 1 h à -20 °C ou -80 °C.
NOTE: Point de pause facultatif: l’ARN peut être stocké à -20 ° C pendant quelques mois.
- Collecte du précipité d’ARN : Enduit l’ARN précipité par centrifugation à 13 000 x g pendant 20 min à 4 °C. Retirer le surnageant et laisser l’éthanol restant s’évaporer à l’air libre (~1 h) avant de remettre la pastille en suspension dans 30 μL de tamponddH2Oou 1x TE.
REMARQUE: Ce processus entraîne généralement une concentration finale d’ARN de ~ 10 μM.
NOTE: Point de pause facultatif: l’échantillon d’ARN peut être conservé à -20 ° C pendant quelques mois.
- Déterminer les concentrations du stock d’ARN.
- Préparer une aliquote d’ARN pour la réaction d’hydrolyse.
- Pour effectuer ce test, utilisez d’abord un nanospectrophotomètre UV / Vis pour déterminer le A260 de l’échantillon d’ARN stock et faites une partie aliquote diluée de l’échantillon à ~10 unités d’absorbance (UA) dans ddH2O.
- Préparer la réaction suivante dans un tube de PCR de 0,5 mL : 16 μL deddH2O+ 2 μL de tampon 10xNa2CO3+ 2 μL d’ARN aliquote dilué à ~10 UA. Incuber la réaction pendant 90 min à 95 °C, puis laisser refroidir à TA.
- Déterminer la concentration d’ARN à l’aide d’absorbances nucléotidiques : Mesurer l’A260 de cet échantillon à l’aide d’un nanospectrophotomètre UV/Vis et calculer la concentration d’ARN à l’aide de la formule suivante :

où c est la concentration d’ARN, b est la longueur du trajet, i est le nucléotide spécifique (A, C, G ou U), n i est la fréquence du nucléotide i dans la séquence d’ARN et ε i est le coefficient d’extinction molaire du nucléotide i. Pour déterminer la concentration initiale d’ARN stock, multiplier c par le facteur de dilution.
REMARQUE: Point de pause facultatif: L’ARN peut être stocké à -20 ° C pendant quelques mois.
- Préparer une aliquote d’ARN pour la réaction d’hydrolyse.
- Purification PAGE des épinards2 et de l’ARN du brocoli
- Exécution d’une in vitro Test de cinétique du lecteur de plaques
- Configurer le programme de renaturation de l’ARN : Créez le protocole thermocycleur suivant en sélectionnant Créer un nouveau programme > Ajouter une nouvelle phase > Ajouter une nouvelle étape plusieurs fois pour ajouter chacune des étapes suivantes avant d’appuyer sur Enregistrer :
70 °C pendant 3 min
65 °C pendant 45 s
60 °C pendant 45 s
55 °C pendant 45 s
50 °C pendant 45 s
45 °C pendant 45 s
40 °C pendant 45 s
35 °C pendant 45 s
30 °C pendant 45 s - Renaturer l’ARN : Pour renaturer les ARN d’épinards2 et de brocoli, préparer 2 μM de chaque ARN dans ddH2O dans un tube de PCR à paroi mince de 0,5 mL, puis ajouter un volume égal de tampon de renaturation 2x (80 mM HEPES, pH 7,5 [KOH], 250 mM KCl, 6 mM MgCl2) pour faire des solutions d’ARN 1 μM. Ajoutez les tubes au thermocycleur, ouvrez le programme de renaturation enregistré et appuyez sur Exécuter.
REMARQUE: Si un thermocycleur n’est pas disponible, les ARN peuvent plutôt être incubés sur un bloc de chaleur à 70 ° C pendant 3 minutes, puis laissés refroidir lentement à TA sur le banc. - Préparer le tampon de réaction de liaison: Pour préparer le tampon pour une réaction de liaison aptamère-colorant, faire un mélange maître contenant des composants tampons (69,5 μL de ddH2O+ 4 μL de 1 M HEPES, pH 7,5 [KOH] + 6,2 μL de 2 M KCl + 0,3 μL de 1 M MgCl2). Selon le nombre d’échantillons et de répétitions nécessaires, multipliez ces valeurs par le nombre d’échantillons plus un. En général, trois répétitions par échantillon d’ARN sont satisfaisantes.
- Préparez le lecteur de plaques.
- Configurer le programme d’injecteur du lecteur de plaques : Sur le lecteur de plaques de fluorescence, sélectionnez Temp et réglez la température souhaitée à 37 °C, en vous assurant que la température s’est équilibrée à cette valeur bien avant de commencer les expériences de cinétique. Ouvrez le logiciel de lecture de plaques, sélectionnez Paramètres > vue d’acquisition et entrez le programme suivant pour les mesures cinétiques :
Boucle : Pour chaque puits
Paramètre de référence : 60 lectures de ligne de base
Paramètres SmartInject : injection de 10 μL (qui se produira après les lectures de la ligne de base)
La fluorescence (ou FL) se lit comme suit :
Excitation: 448 nm (bande passante: 9 nm)
Émission: 506 nm (bande passante: 15 nm)
Cartouche : MONO (s/n 3297)
Timing:
Temps de lecture total : 10 min
Intervalle de lecture: 0.5 s
PMT et optique : 6 flashs par lecture
Boucle : Puits suivant - Préparer l’injecteur
- Lavez et aspirez l’injecteur : Pour préparer l’injecteur de lecteur de plaques, sélectionnez d’abord Injecter sur le lecteur de plaques, fournissez une plaque de collecte des déchets au lecteur de plaques lorsqu’il est dirigé, puis sélectionnez Lavage et nettoyez le tube d’injection en suivant les instructions sur le lecteur de plaques avec 1 mL de volumes de ddH2O, éthanol à 75 % dans ddH2O, puis ddH2O. Ensuite, sélectionnez Aspirate, permettant à l’injecteur d’éjecter l’excès de liquide.
- Amorcer l’injecteur : Après avoir quitté l’écran précédent, sélectionnez Prime pour amorcer l’injecteur avec deux volumes de 260 μL de ligand à injecter pour s’assurer que le ligand pur et concentré est ajouté aux échantillons pendant les expériences - dans ce cas, amorcer avec 100 μM DFHBI dans ddH2O.
- Configurer le programme d’injecteur du lecteur de plaques : Sur le lecteur de plaques de fluorescence, sélectionnez Temp et réglez la température souhaitée à 37 °C, en vous assurant que la température s’est équilibrée à cette valeur bien avant de commencer les expériences de cinétique. Ouvrez le logiciel de lecture de plaques, sélectionnez Paramètres > vue d’acquisition et entrez le programme suivant pour les mesures cinétiques :
- Effectuer des expériences de cinétique in vitro : Pour effectuer une expérience cinétique, ajoutez d’abord 80 μL de mélange principal tampon de liaison préalablement préparé à un puits d’une plaque à fond clair de 96 puits, suivi de 10 μL d’ARN renaturé. Laisser cette plaque et la solution DFHBI dans l’injecteur s’équilibrer à 37 °C pendant 15 min dans le lecteur de plaques.
- Dans Paramètres du logiciel de lecture de plaques sous Zone de lecture, sélectionnez le puits à analyser, puis, sous l’onglet Accueil , sélectionnez Exécuter pour exécuter le programme cinétique décrit précédemment. Répétez ce processus jusqu’à ce que toutes les expériences soient terminées.
REMARQUE : De façon critique, les expériences de cinétique doivent être effectuées un puits à la fois pour s’assurer que la cinétique de l’ARN est mesurée dans des conditions identiques entre les répétitions et les échantillons. - Laver l’injecteur : Pour retirer la solution DFHBI restante du tube d’injection, laver le tube d’injection comme décrit à l’étape 1.4.4.2.1 avec 1 mL de volumes de ddH2O, d’éthanol à 75 % dans du ddH2O, puis duddH2O.
REMARQUE : Point de pause facultatif.
- Configurer le programme de renaturation de l’ARN : Créez le protocole thermocycleur suivant en sélectionnant Créer un nouveau programme > Ajouter une nouvelle phase > Ajouter une nouvelle étape plusieurs fois pour ajouter chacune des étapes suivantes avant d’appuyer sur Enregistrer :
- Analyse de la cinétique in vitro des aptamères d’ARN fluorogéniques.
- Entrée de données dans le logiciel d’analyse : exportez les données expérimentales sous forme de feuille de calcul pour les copier facilement en vue de leur traitement. Dans le logiciel d’analyse, créez une nouvelle table de données au format XY. Dans la colonne X, entrez chaque point de temps de lecture, t = 0 étant le moment de l’injection de DFHBI. Dans la colonne Y, entrez les valeurs de fluorescence moyennes entre les répétitions à ce point de temps respectif en commençant par t = 0.
- Normaliser et représenter graphiquement les données : Pour normaliser les valeurs de fluorescence, cliquez sur Analyser > Traitement des données > Normaliser, puis cliquez sur OK. Choisissez d’utiliser les valeurs les plus petites et les plus grandes du jeu de données pour la normalisation, de présenter les résultats sous forme de fractions et de représenter graphiquement les résultats, puis cliquez sur OK. Pour créer un graphique de la fluorescence moyenne normalisée au fil du temps, cliquez sur l’icône Normaliser de [Nom du jeu de données] et sélectionnez Famille de graphes : XY avec points uniquement.
Remarque : Les barres d’erreur peuvent être utiles à voir dans les cas où un petit nombre de points temporels sont représentés graphiquement. Si vous le souhaitez, lorsque vous choisissez une table de données au format XY, sélectionnez l’option sous « Y » pour entrer des valeurs répliquées dans des colonnes côte à côte. L’représentation graphique du tableau résultant avec les options par défaut sélectionnées produira un graphique avec des barres d’erreur. - Effectuer l’ajustement de courbe pour obtenir des paramètres cinétiques : Pour ajuster une courbe aux données cinétiques, cliquez sur Analyser > Analyser les données et sélectionnez Régression non linéaire (ajustement de la courbe) sous l’onglet Analyses XY . Sous l’onglet Modèle , cliquez sur Association exponentielle > deux phases pour ajuster les données cinétiques à l’équation d’association à deux phases suivante :
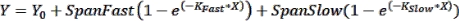
où Y est la fluorescence au temps X, Y 0 est la fluorescence à t = 0, K Fast et K Slow sont respectivement des constantes de vitesse rapide et lente, et SpanFast et SpanSlow sont les plages d’activation de la fluorescence expliquées respectivement par les vitesses rapides et lentes (voir les résultats représentatifs, Figure 1). Cliquez sur l’onglet Nonlin Fit pour afficher les constantes de taux, les valeurs t1/2 et les valeurs PercentFast.
REMARQUE : Pour obtenir un écart-type pour toutes ces valeurs, les répétitions expérimentales individuelles de lecteurs de plaques peuvent être traitées de la même manière que celle décrite ci-dessus.
2. Expérience de cinétique cellulaire
- Préparation des souches d’E. coli
- Transformez les cellules d’E. coli BL21 Star (DE3) avec ~100 ng de construction d’ARNt-épinards pET31b en suivant le protocole du fabricant.
REMARQUE: La construction plasmidique est disponible dans le commerce (Plasmide #79783). - Plaquer les cellules sur des plaques de gélose LB contenant de la carbénicilline (Carb : 50 mg/mL) et incuber à 37 °C pendant 12-16 h. Les cellules contenant des plasmides se développeront sous forme de colonies sur la plaque.
REMARQUE: Point de pause facultatif: Les cellules BL21 Star transformées sur les plaques peuvent être stockées à 4 ° C enveloppées dans un parafilm pendant 1 semaine.
- Transformez les cellules d’E. coli BL21 Star (DE3) avec ~100 ng de construction d’ARNt-épinards pET31b en suivant le protocole du fabricant.
- Croissance de cellules et induction de l’expression d’aptamères d’ARN fluorogénique
- Inoculer une culture de 2 mL de milieux non inducteurs (NI) contenant de la carbénicilline (Carb : 50 mg/mL) avec une seule colonie de cellules BL21 Star transformées. Répétez cette opération pour au moins trois réplications biologiques. Incuber les cultures à 37 °C dans un incubateur/agitateur à 250 rpm pendant 22-24 h.
REMARQUE : Point de pause facultatif : Les cellules cultivées dans des milieux NI retiennent le plasmide et peuvent être conservées à 4 °C pendant 1 semaine. - Après croissance dans un milieu NI, diluer la culture 100x dans un nouveau 3 mL de média d’autoinduction (AI) ZYP-5052 contenant de la carbénicilline (Carb : 50 mg/mL). Faire pousser les cellules à 37 °C dans un incubateur/agitateur à 250 rpm pendant 16-18 h pour induire l’expression.
NOTE: Le OD600 typique pour les cultures variera de 2,0 à 3,3 après 18 heures de croissance. La plage de densité cellulaire optimale se situe entre 2,5 et 3,0.
- Inoculer une culture de 2 mL de milieux non inducteurs (NI) contenant de la carbénicilline (Carb : 50 mg/mL) avec une seule colonie de cellules BL21 Star transformées. Répétez cette opération pour au moins trois réplications biologiques. Incuber les cultures à 37 °C dans un incubateur/agitateur à 250 rpm pendant 22-24 h.
- Réalisation de l’expérience de cinétique cellulaire
- Configurez le cytomètre en flux.
- Allumez le cytomètre en flux et l’ordinateur connecté à l’instrument. Une fois connecté au logiciel pour le cytomètre en flux, sous l’onglet Instrument , cliquez sur l’icône Démarrage . Suivez les étapes indiquées sur l’écran du logiciel pour assurer une initialisation correcte de l’instrumentation.
REMARQUE: Certains cytomètres en flux appellent la séquence de démarrage de l’instrument Amorçage. Assurez-vous de suivre le protocole du fabricant pour le cytomètre en flux qui sera utilisé pour l’expérience. - Exécutez un test de performance (le cas échéant). Sous l’onglet Menu principal , cliquez sur Test de performance. Dans un tube de culture, ajouter trois gouttes de billes de suivi du rendement du fabricant dans 3 ml de liquide de focalisation.
- Placez le tube de culture dans le tube de levage du tube d’échantillon et soulevez-le. Avant de cliquer sur Exécuter le test de performance, assurez-vous que le # de lot du tube des perles de suivi est identique à ce qui est indiqué sur l’écran Configuration du test de performance. Cliquez sur Test de performances pour exécuter le test.
- Configurez le logiciel de cytomètre en flux pour cette expérience avec les paramètres d’acquisition suivants pour la fluorescence unicellulaire :
Laser d’excitation: 488 nm
Canal d’émission: GFP (également appelé FITC)
Volume d’acquisition : 40 μL (avec un volume total de tirage de 90 μL)
Débit: 200 μL / min
Nombre de cellules pour chaque mesure : 30 000
Paramètres de l’instrument :
Tension:
FSC : 480 V
SSC : 400 V
BL1 : 540 V
BL2 : 392 V
BL3 : 422 V
- Allumez le cytomètre en flux et l’ordinateur connecté à l’instrument. Une fois connecté au logiciel pour le cytomètre en flux, sous l’onglet Instrument , cliquez sur l’icône Démarrage . Suivez les étapes indiquées sur l’écran du logiciel pour assurer une initialisation correcte de l’instrumentation.
- Configurez les fichiers expérimentaux.
- Créez un nouveau fichier d’expérience dans l’onglet Explorateur d’expériences en cliquant avec le bouton droit sur le nom d’utilisateur du cytomètre en flux. Sélectionnez Nouvelle expérience dans la fenêtre déroulante. Lorsqu’une nouvelle fenêtre s’affiche sur l’écran de l’ordinateur, sélectionnez OK.
- Dans le nouveau fichier d’expérience, cliquez avec le bouton droit de la souris sur le dossier « Group » et sélectionnez Ajouter un nouveau tube d’échantillonnage. Étiquetez les tubes d’échantillon pour chaque point de temps spécifique et répliquez-les en cliquant avec le bouton droit de la souris sur Échantillon et en sélectionnant Renommer dans le menu déroulant. Répétez cette étape pour le nombre total de répétitions et les points temporels pour le cours prévu de l’étude.
- Préparer une solution cellulaire diluée : Dans un nouveau tube de culture, ajouter 1,5 mL de 1x solution de PBS. Ensuite, ajoutez 3 μL de cellules induites dans un milieu d’IA dans la solution PBS 1x pour obtenir une solution cellulaire diluée. Répétez cette étape pour chaque réplication biologique dans différents tubes de culture.
- Mesurer la fluorescence de fond des cellules: Avant d’ajouter un colorant, prenez des lectures de chaque tube de culture de réplication biologique contenant des cellules dans 1x solution de PBS. C’est ainsi que le fond fluorescent des cellules est mesuré pour observer le pli s’allumer au fil du temps une fois le colorant ajouté.
- Pour prendre une lecture, placez le tube de culture dans le tube de levage du tube d’échantillon et soulevez le tube de levage à la main jusqu’à l’aiguille d’injection de l’échantillon. Sélectionnez l’exemple de fichier approprié dans l’onglet Panneau de collecte , puis cliquez sur Enregistrer.
- Lorsque l’exécution est terminée, abaissez le tube de levage du tube d’échantillon avec le tube de culture à la main. Cela déclenchera une étape de rinçage qui rincera le système fluidique et minimisera le transfert entre chaque échantillon de réplication biologique. Les données seront automatiquement enregistrées sur l’ordinateur une fois l’exécution terminée.
- Répéter les étapes décrites au point 2.3.4 pour mesurer le fond fluorescent cellulaire pour au moins trois réplicats biologiques. Pour passer au fichier d’exemple suivant, sélectionnez le fichier d’exemple suivant en cliquant sur l’icône en forme de flèche droite près du nom du tube d’échantillon sous l’icône Enregistrement .
- Mesurer la fluorescence aux points temporels des cellules avec colorant.
- Ajouter 1,4 μL d’un stock de colorant concentré (50 mM DFHBI-1T dans DMSO) dans 1x solution PBS avec des cellules pour obtenir une concentration finale de 50 μM DFBHI-1T. Ensuite, fixez le couvercle du tube de culture, puis inversez les tubes de culture 3x-5x pour mélanger la solution uniformément avant de prendre la première lecture de point temporel.
REMARQUE : Le pourcentage total de DMSO dans les tubes de culture pour E. coli ne doit pas dépasser 10 %, car cela peut affecter la viabilité cellulaire16. - Retirez le couvercle et placez le tube de culture dans le tube de levage du tube à échantillon. Soulevez le support à la main jusqu’à l’aiguille d’injection de l’échantillon et, sous le fichier d’échantillon approprié, cliquez sur l’icône Enregistrer . En outre, démarrez une minuterie en appuyant sur Démarrer pour l’expérience.
- Abaissez le tube de levage à la main une fois la course terminée et répétez les étapes 2.3.5.1-2.3.5.2. (avec la minuterie en marche) en ajoutant 1,4 μL de DFHBI-1T concentré, en inversant les tubes de culture et en prenant des lectures pour toutes les répétitions biologiques restantes. Ces premiers enregistrements seront les lectures obtenues à 0 min pour toutes les répliques biologiques. Faites-le un à la fois pour chaque répétition biologique.
REMARQUE: Notez l’heure à laquelle l’acquisition de la cytométrie de flux d’enregistrement est pressée. Respectez ce temps en échelonnant pour les points temporels au cours de l’expérience. - Continuez à prendre des lectures en soulevant les tubes de culture dans le tube de levage du tube d’échantillon jusqu’à l’aiguille d’injection de l’échantillon, en sélectionnant le fichier d’échantillon approprié, en cliquant sur Enregistrer et en abaissant le leveur à la main après chaque passage. Faites-le pour tous les points temporels supplémentaires et les réplications biologiques testées. Répétez les étapes jusqu’à ce que l’expérience soit terminée.
REMARQUE: Gardez les échantillons à l’abri de la lumière pour éviter le photoblanchiment du DFHBI-1T en solution en recouvrant les échantillons de papier d’aluminium.
- Ajouter 1,4 μL d’un stock de colorant concentré (50 mM DFHBI-1T dans DMSO) dans 1x solution PBS avec des cellules pour obtenir une concentration finale de 50 μM DFBHI-1T. Ensuite, fixez le couvercle du tube de culture, puis inversez les tubes de culture 3x-5x pour mélanger la solution uniformément avant de prendre la première lecture de point temporel.
- Mesurer la fluorescence à des points temporels pour les cellules sans colorant (contrôle).
- Exécutez les protocoles de nettoyage appropriés pour le cytomètre en flux avant de répéter l’expérience avec des contrôles négatifs en suivant le protocole du fabricant. Ceci est fait pour minimiser tout transfert de l’expérience précédente dans l’expérience d’analyse du point de temps de contrôle. Voici les étapes suivies pour le cytomètre en flux entre les expériences:
- Placez un tube de culture vide dans le tube élévateur à la main, soulevez le porte-tube et cliquez sur l’icône Déboucher dans l’onglet Instrument . Cela exécutera un rinçage à contre-courant dans le système fluidique pour nettoyer les échantillons collants. Abaissez le support du tube à la main et retirez le tube une fois la séquence de débouchage terminée.
- Avec un nouveau tube de culture, ajouter 3 mL d’une solution d’eau de Javel à 10 %, placer le tube de culture dans le porte-tube et soulever le support à la main jusqu’à l’aiguille d’injection de l’échantillon. De plus, placez une plaque propre de 96 puits dans l’échantillonneur automatique, le cas échéant, sur le cytomètre en flux.
- Cliquez sur l’icône SIP Sanitize / Sanitize Autosampler SIP pour exécuter une séquence de nettoyage avec 10% d’eau de Javel dans tout le système fluidique. Abaissez le porte-tube pour terminer la séquence de nettoyage.
- Définissez les fichiers d’exemple pour l’analyse du point temporel de contrôle exécutée en suivant les instructions de l’étape 2.3.3.
- Dans un nouveau tube de culture, préparer une solution cellulaire diluée dans 1,5 mL de 1x solution PBS. Ajouter 3 μL de cellules induites dans les milieux d’IA dans la solution 1x PBS pour obtenir une solution cellulaire diluée. Répétez cette étape pour chaque répétition biologique.
- Ajoutez 1,4 μL de DMSO dans le tube de culture un à la fois à la solution 1x PBS avec des cellules et testez les mêmes points temporels. Fixez le couvercle du tube de culture, puis inversez les tubes de culture 3x-5x pour mélanger la solution uniformément avant de prendre la première lecture de point temporel. Faites-le un à la fois pour chaque répétition biologique.
- Suivez le même protocole pour l’analyse des cellules témoins que pour les cellules avec colorant, en utilisant les étapes 2.3.5.2-2.3.5.4.
- Exécutez les protocoles de nettoyage appropriés pour le cytomètre en flux avant de répéter l’expérience avec des contrôles négatifs en suivant le protocole du fabricant. Ceci est fait pour minimiser tout transfert de l’expérience précédente dans l’expérience d’analyse du point de temps de contrôle. Voici les étapes suivies pour le cytomètre en flux entre les expériences:
- Arrêtez le cytomètre en flux : Suivez le protocole du fabricant pour l’arrêt correct de l’instrumentation. Pour le cytomètre en flux, l’instrument est préparé pour l’arrêt de la manière suivante:
- Effectuer le protocole de nettoyage initial du cytomètre en flux en suivant les étapes 2.3.6.1.1-2.3.6.1.3.
- Remplacer le tube de culture par une solution d’eau de Javel à 10 % par un tube de culture contenant 3 mL de liquide de focalisation. Soulevez le porte-tube à la main et, sous l’icône Arrêter , cliquez sur le menu déroulant et sélectionnez Complet.
REMARQUE : Point de pause facultatif.
- Configurez le cytomètre en flux.
- Analyse des données de cytométrie en flux
- Exportez tous les fichiers FCS pour analyse. Ouvrez les fichiers FCS avec un logiciel d’analyse de cytométrie en flux.
- À l’aide de l’un des fichiers FCS Cell only, générez une porte à partir du diagramme de points à diffusion avant (FSC) et à diffusion latérale (SSC) (FSC-Area/SSC-Area), en utilisant les deux axes logarithmiques pour exclure tout signal des débris. Pour créer cette porte, cliquez sur l’icône AutoGate sur le logiciel d’analyse de cytométrie en flux et nommez-la Gate 1. Appliquez cette même porte à tous les échantillons testés sous l’onglet Tous les échantillons de l’espace de travail pour le traitement des données. Cela se traduira par le traitement de la porte 1 sous tous les fichiers FCS.
- Créez un nouveau fichier de sous-ensemble avec le fichier FCS Cellule uniquement utilisé à l’étape 2.4.2 en double-cliquant dessus. Modifiez les paramètres de l’axe en FSC-Area/FSC-Height, les deux utilisant des axes logarithmiques. Cliquez sur l’icône AutoGate sur le logiciel d’analyse de cytométrie en flux pour générer une porte ovale, en la nommant Gate 2. Appliquer cette porte en tant que sous-ensemble sous la porte définie à l’étape 2.4.2 à tous les échantillons testés. Ainsi, tous les échantillons auront la porte 1 > la porte 2 associées à chaque fichier FCS.
- Créez un autre fichier de sous-ensemble avec les deux portes définies à l’étape 2.4.2 et à l’étape 2.4.3 appliquées en double-cliquant sur Porte 2. Définissez les paramètres de l’axe sur FSC-Area/Histogram. Appliquez cette porte d’histogramme en tant que sous-ensemble à tous les échantillons testés, ce qui permet à tous les échantillons d’avoir la porte 1 > la porte 2 > la porte 2 associées à chaque fichier FCS.
REMARQUE: Les histogrammes peuvent être renommés de la porte 2 à l’histogramme pour aider à déplacer les histogrammes dans la fenêtre de mise en page, ainsi que pour créer plus d’organisation avec le traitement des données. - Pour analyser les valeurs d’intensité de fluorescence moyenne (MFI), ouvrez la fenêtre de mise en page. Cliquez et faites glisser les portes de l’histogramme pour chaque point temporel dans la fenêtre de mise en page.
- Effectuez une analyse statistique pour « ∑ Mean: BL1-A » (GFP) pour chaque échantillon testé afin d’afficher les résultats de l’IMF dans la fenêtre de mise en page.
- Calculer l’écart type pour les valeurs de l’IMF par analyse ponctuelle pour au moins trois réplicas biologiques indépendants.
- Enregistrez les histogrammes et les valeurs MFI pour chaque point temporel en exportant la fenêtre de mise en page sous forme de fichier PDF.
REMARQUE : Point de pause facultatif.
- Données de cytométrie en flux graphique
- Ouvrez le fichier PDF contenant les histogrammes et les valeurs MFI pour chaque point de temps. Les valeurs de l’IMF seront copiées dans un logiciel d’analyse de données. Dans un logiciel de graphiques de données, créez une nouvelle table de données au format XY.
- Sélectionnez cette option pour créer une table XY avec les éléments suivants :
Table de données : entrez ou importez des données dans une nouvelle table
Options:
X : Temps écoulés
Y : entrez (trois à quatre) répliquer les valeurs dans des sous-colonnes côte à côte - Étiquetez sur l’axe X tous les points temporels de l’expérience et du contrôle.
- Dans le groupe A, entrez les valeurs d’IMF pour toutes les réplications biologiques dans chaque point temporel pour l’analyse de fluorescence des cellules avec le colorant ajouté.
- Dans le groupe B, entrez les valeurs d’IMF pour toutes les réplications biologiques dans chaque point temporel pour l’analyse des cellules sans colorant (DMSO) ajouté.
- Pour observer les résultats, cliquez sur [Insérer le nom de l’ensemble de données] sous l’onglet Graphiques . Cela affichera les points de données sous forme de moyennes, avec des barres d’erreur représentant l’écart type (s.d.) à chaque point de temps. L’axe des X représente le temps écoulé et l’axe des Y représente les valeurs de l’IMF.
- Sélectionnez cette option pour créer une table XY avec les éléments suivants :
- Ouvrez le fichier PDF contenant les histogrammes et les valeurs MFI pour chaque point de temps. Les valeurs de l’IMF seront copiées dans un logiciel d’analyse de données. Dans un logiciel de graphiques de données, créez une nouvelle table de données au format XY.
Résultats
Cinétique in vitro
Les séquences des matrices et des amorces d’ADN, qui sont achetées comme oligonucléotides synthétiques, sont présentées dans le tableau 2, et les recettes de réactifs sont présentées dans le fichier supplémentaire 1. L’amplification par PCR est utilisée pour augmenter la quantité de matrice d’ADN avec le promoteur T7, ce qui est nécessaire pour la réaction ultérieure de transcription in vitro (IVT). En outre, l’amplification par PCR peut être utilisée à deux fins dans la même réaction: générer le modèle d’ADN du brocoli complet par extension d’amorce, ainsi que pour mettre à l’échelle le modèle d’ADN.
Après la réaction IVT pour synthétiser l’ARN, la purification PAGE éliminera tous les transcrits tronqués indésirables, les produits dégradés et les rNTP n’ayant pas réagi du produit d’ARN complet. Ce type de purification est préféré parce que les ARN tronqués ou dégradés entraîneront la détermination inexacte des concentrations d’ARN. Étant donné que les bases nucléotidiques absorbent la lumière UV, les bandes d’ARN et les rNTP sur le gel peuvent être visualisés sous UV sous forme d’ombres contre une plaque TLC fluorescente. Ainsi, les bandes correspondant à la taille correcte du produit peuvent être extraites de manière sélective.
La méthode du plus proche voisin surestime les coefficients d’extinction et, par conséquent, les concentrations d’ARN structurés puisqu’elle ne tient pas compte de l’hypochromicité due à l’appariement des bases17. Par conséquent, pour déterminer des concentrations précises d’ARN, des tests d’hydrolyse thermique à pH neutre ont été effectués pour hydrolyser l’ARN en NMPindividuels 18. Le coefficient d’extinction précis a été calculé comme la somme des coefficients d’extinction des NMP dans la séquence d’ARN.
La cinétique de la liaison DFHBI aux épinards2 et au brocoli a été déterminée à l’aide d’un test de lecture de plaques. L’ARN a d’abord été renaturé pour s’assurer qu’il serait dans la bonne conformation pour la liaison au colorant. Les conditions de réaction pour le test cinétique du lecteur de plaque étaient de 40 mM HEPES, pH 7,5 (KOH), 125 mM KCl, 3 mM MgCl2, 100 nM d’ARN renaturé et 10 μM DFHBI, et la réaction a été mesurée à 37 °C. Cette température et cette concentration de MgCl 2 ont été choisies pour imiter les conditions physiologiques19, bien que des conditions de 28 °C et 10 mM MgCl2 puissent également être utilisées pour améliorer le repliement des aptamères.
Les deux aptamères fluorogéniques Spinach2 et Brocoli présentent une cinétique d’association à deux phases pour se lier au colorant DFHBI (Figure 2). Les données cinétiques étaient mieux ajustées par association à deux phases qu’à une association en une phase pour les deux aptamères (figure supplémentaire 1). Les constantes de vitesse et les valeurs t1/2 pour les associations rapide et lente ont été déterminées par la courbe de meilleur ajustement (tableau 3). PercentFast, qui décrit le pourcentage de l’amplitude d’activation de la fluorescence représenté par la population d’ARN de liaison DFHBI plus rapide, a également été déterminé.
Les épinards2 à l’état de liaison montrent une activation plus rapide que le brocoli (t 1/2 = 1,2 s contre2,0 s). La cinétique de la deuxième phase pour les deux aptamères est similaire (t1/2 = 180 s) et correspond probablement à une étape commune limitant le taux pour une sous-population de l’échantillon (PercentFast = 68% et 60% pour les épinards2 et le brocoli, respectivement). Dans l’ensemble, ces résultats montrent que les aptamères d’épinards2 et de brocoli bien pliés présentent une cinétique d’activation très rapide, avec la demi-activation initiale maximale dans les 1-2 s suivant l’ajout de colorant.
Cinétique cellulaire
Les séquences des constructions d’ADN, qui sont clonées dans le plasmide pET31b, sont présentées dans le tableau 2, et les recettes de réactifs sont présentées dans le fichier supplémentaire 1. Les constructions d’ADN des aptamères d’ARN fluorogéniques sont généralement contenues dans un échafaudage d’ARNt pour les expériences cellulaires. La souche E. coli BL21 Star (DE3) est une souche d’expression avec une mutation de la RNase E qui augmente la stabilité de l’ARN.
Les mesures de points temporels de fluorescence ont été enregistrées toutes les 5 minutes pendant les 45 premières minutes, suivies de lectures à 1 h, 1,5 h et 2 h, ce qui donne un total de 12 points temporels plus la lecture de la cellule uniquement. Le fait que l’intervalle de temps le plus court soit de 5 minutes a permis de mesurer plusieurs répétitions biologiques à chaque point temporel, avec un espacement régulier entre les mesures de répétition de 30 s à 1 min. Le volume total de cellules diluées dans 1x solution de PBS utilisée pour l’expérience sur le parcours temporel était de 1,5 mL.
Les cellules ont été fermées avant de déterminer l’intensité de fluorescence moyenne (ICM) de la population de cellules individuelles. Gating sélectionne une zone sur le nuage de points pour déterminer la population cellulaire qui sera analysée. Ce processus empêche toute lecture de débris ou de multiplets d’être inclus dans l’analyse. Pour l’analyse de cytométrie de flux montrée, 30 000 événements ont été enregistrés, ce qui a entraîné l’analyse de 10 000 à 20 000 événements après le contrôle.
La cinétique de fluorescence cellulaire est fonction à la fois de la diffusion du colorant dans E. coli et de la cinétique de liaison du colorant à l’aptamère d’ARN dans l’environnement cellulaire (Figure 1B). Pour les cellules exprimant l’ARNt Spinach2, il a été observé que l’intensité moyenne de fluorescence (ICM) augmente immédiatement au point de temps « 0 », en raison du court délai (en secondes) entre l’ajout de colorant et l’analyse de l’échantillon (Figure 3A). De plus, la fluorescence cellulaire a déjà atteint sa valeur d’ICM équilibrée maximale (40 441 ± 990) au premier point temporel de 5 min. En revanche, les cellules témoins présentent une faible fluorescence de fond (416) et aucun changement de la valeur de l’IMF avec l’ajout de DMSO (Figure 3B). Une comparaison entre les cellules avec colorant et les cellules sans colorant révèle que l’activation de la fluorescence est 98 fois ± 2 dans les cellules. Dans l’ensemble, ces résultats montrent que l’ARNt Spinach2-exprimé dans les cellules E. coli présente une cinétique d’activation rapide, avec une activation maximale en moins de 5 minutes après l’ajout du colorant.
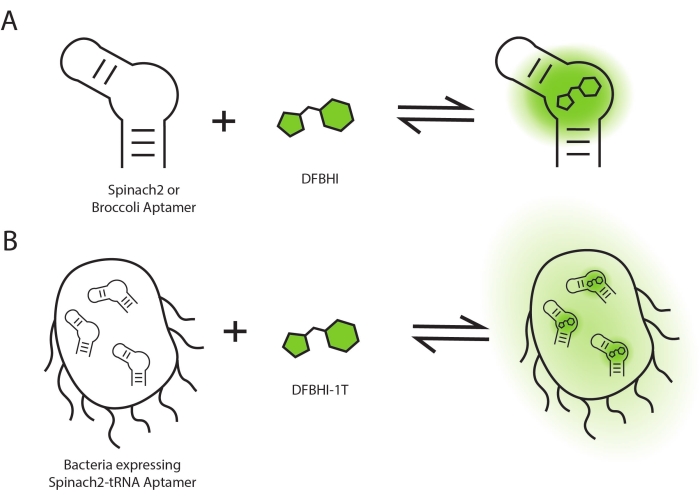
Figure 1 : Schéma de l’activation de la fluorescence. L’activation de fluorescence se produit lorsque les aptamères d’ARN se lient aux molécules de colorant (A) in vitro et (B) dans les cellules. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Cinétique in vitro des aptamères fluorogéniques. Cinétique in vitro représentative des aptamères fluorogéniques (A,B) Épinards2 ou (C,D) Brocoli modélisée par association biphasique, t = 0 s étant le point temporel de l’addition DFHBI (concentration finale de DFHBI : 10 μM). Les expériences ont été réalisées en trois exemplaires. Toutes les barres d’erreur représentent des écarts-types par rapport à la moyenne. À partir de l’ajustement, des valeurs t1/2 ont été obtenues pour les composants de réaction d’association rapide et lente. Veuillez cliquer ici pour voir une version agrandie de cette figure.
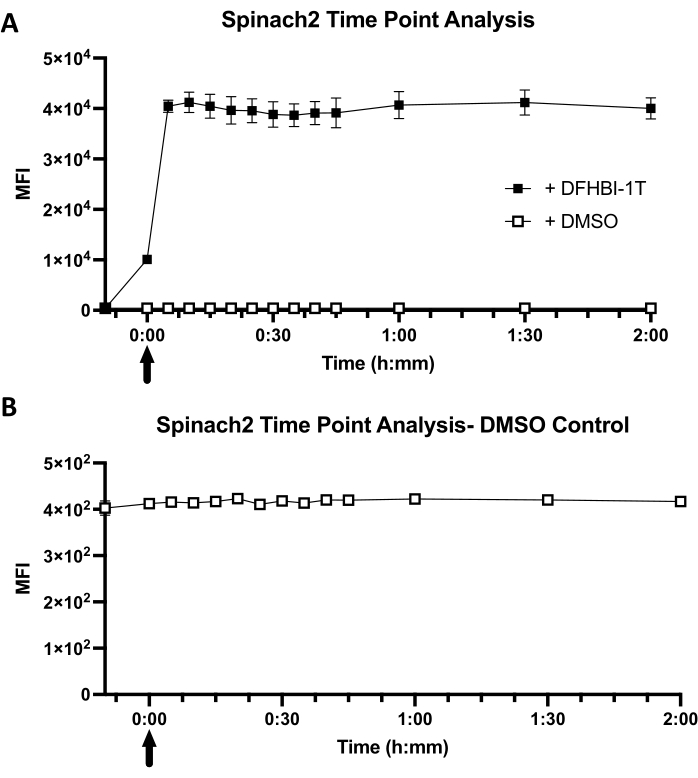
Figure 3 : Cinétique cellulaire représentative des épinards2 dans un échafaudage d’ARNt. (A) Analyse temporelle de l’absorption du colorant ARNt-Épinards2 au cours de 2 heures. Une base de référence uniquement cellulaire a été prise avant l’ajout de DFHIB-1T ou de DMSO. Les points de temps ont été pris toutes les 5 minutes pendant les 45 premières minutes, suivis d’un point de temps à 1 h, 1,5 h et 2 h. La flèche représente le moment où le DFHBI-1T ou le DMSO a été ajouté dans une solution PBS 1x avec des cellules étoiles BL21. La concentration finale de DFHBI-1T pour l’analyse est de 50 μM. Pour le contrôle DMSO, l’ajout de DMSO était à un volume égal (1,4 μL) utilisé pour l’ajout de colorant DFHBI-1T. (B) Un gros plan de l’analyse ponctuelle du contrôle du DMSO avec des cellules E. coli BL21 Star. L’intensité moyenne de fluorescence (MFI) indique la lecture fluorescente globale des cellules étoiles BL21 avec colorant ou DMSO. Les données représentent l’écart type moyen ± de trois répétitions biologiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Paire aptamère-colorant | Longueur (nt) | Abs max. (nm) | Max em (nm) | Coefficient d’extinction (M-1· cm-1) | Rendement quantique | Luminosité | Kd (nm) | Tm (°C) | Référence |
| Épinards2-IFDHB | 95 | 445 | 501 | 26100 | 0.7 | 63 | 1450 | 37 | 4 |
| Épinards2-DFHBI-1T | 95 | 482 | 505 | 31000 | 0.94 | 100 | 560 | 37 | 13, 14 |
| Brocoli-DFHBI-1T | 49 | 472 | 507 | 29600 | 0.94 | 96 | 360 | 48 | 13 |
Tableau 1 : Propriétés photophysiques et biochimiques publiées précédemment de Spinach2-DFHBI4, Spinach2-DFHBI-1T 13,14 et Broccoli-DFHBI-1T 13.
| Promoteur Épinards2 + T7 | 5'-CGATCCCGCGAAATTAATACGACTCACTATAGGATGTAACTGAATGAAATGGTGAA GGACGGGTCCAGTAGGCTGCTTCGGCAGCCTACTTGTTGAGTAGAGTGTGAGCTCC GTAACTAGTTACATC-3' | ||
| Brocoli + promoteur T7 | 5'-CGATCCCGCGAAATTAATACGACTCACTATAGgagacggtcgg gtccagatattcgtatctgtcgagtagagtgtgggctc-3' | ||
| Construction ARNt-Épinard2 (dans le plasmide pET31b) | 5'-CGATCCCGCGAAATTAATACGACTCACTATAGGGGCCCGGATAGCTCAGTCGGT AGAGCAGCGGCCGGATGTAACTGAATGAAATGGTGAAGGACGGGTCCAGTAGGCT GCTTCGGCAGCCTACTTGTTGAGTAGAGTGTGAGCTCCGTAACTAGTTACATCCGG CCGCGGGTCCAGGGTTCAAGTCCCTGTTCGGGCGCCA TAGCATAACCCCTTGGGGCCTCTAAACGGGTCTTGAGGGGTTTTTTG-3' | ||
| Épinard2 Amorce avant | 5'-CGATCCCGCGAAATTAATACGACTCACTATAG-3' | ||
| Épinard2 Amorce inversée | 5'-GATGTAACTAGTTACGGAGC-3' | ||
| Brocoli Forward Primer | 5'-CGATCCCGCGAAATTAATACGACTCACTATAGgagacggtcgggtccagatattcgtatctg-3' | ||
| Brocoli Reverse Primer | 5'-gagcccacactctactcgacagatacgaatatctggacccgaccgtctc-3' | ||
Tableau 2 : Tableau des séquences d’ADN contenant les séquences d’ADN et les amorces utilisées pour les études in vitro et de cinétique cellulaire. Gras = promoteur T7; Souligné = échafaudage d’ARNt; Capuchons = épinards2; minuscules = Brocoli; Italique gras = terminateur T7.
| Aptamère | Rapide t1/2 (s) | Lent t1/2 (s) | KRapide (s-1) | KLent (s-1) | Pourcentage rapide |
| Épinards2 | 1,2 ± 0,2 | 180 ± 10 | 0,56 ± 0,07 | 0,0039 ± 0,0002 | 68 ± 5 |
| Brocoli | 2,0 ± 0,2 | 180 ± 30 | 0,35 ± 0,05 | 0,0039 ± 0,0006 | 60 ± 3 |
Tableau 3 : Valeurs cinétiques in vitro des aptamères Spinach2 et Brocoli dérivées de données ajustées. Les données sont présentées comme la moyenne ± l’écart-type de trois répétitions.
Figure supplémentaire 1 : Cinétique in vitro représentative des aptamères fluorogéniques. Cinétique in vitro représentative des aptamères fluorogéniques (A,C) Épinards2 ou (B,D) Brocoli modélisée par association monophasée à des temps de mesure (A,B) 600 s ou (C,D) 20 s, avec des flèches indiquant le point temporel d’addition DFHBI (concentration finale de DFHBI : 10 μM). Les expériences ont été réalisées en trois exemplaires. Dans l’ensemble, ces données sont moins bien adaptées par un modèle d’association à une phase qu’à un modèle d’association à deux phases lorsque le signal de fluorescence est surveillé pendant une plus longue durée. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 1 : Recettes pour l’expérience de cinétique in vitro. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Pour l’expérience de cinétique in vitro, le même protocole général peut être modifié pour mesurer la cinétique in vitro d’un biocapteur fluorescent à base d’ARN contenant à la fois un domaine de liaison au ligand et un domaine de liaison au fluorophore 8. Dans ce cas, l’ARN doit être incubé avec le fluorophore avant les mesures lors de l’injection du ligand afin d’obtenir la cinétique de réponse du ligand. Si une grande variabilité est observée entre les répétitions, on peut résoudre le problème en vérifiant que chaque échantillon est autorisé à s’équilibrer pendant la même durée dans la plaque de 96 puits avant la mesure. Chaque échantillon ou répétition doit être préparé individuellement dans un puits et mesuré juste après l’étape d’équilibrage de 15 minutes, plutôt que de préparer tous les échantillons en même temps.
Pour l’expérience de cinétique cellulaire, le protocole peut être modifié pour des cycles de temps plus ou moins longs, mais il est essentiel de planifier le nombre de répétitions biologiques et d’ajuster le volume de solution cellulaire nécessaire. Il est recommandé d’espacer chaque lecture de répétition biologique entre 30 s et 1 min pour avoir suffisamment de temps pour effectuer les étapes avec soin. Une autre modification consiste à tester un colorant fluorogénique différent qui ne lie pas l’aptamère d’ARN comme témoin négatif alternatif, qui ne devrait pas montrer d’activation de fluorescence sur le fond. Si des résultats incohérents sont observés, on peut résoudre le problème en vérifiant que le cytomètre en flux est correctement nettoyé en suivant le protocole du fabricant entre les différents essais expérimentaux pour éviter tout saignement de cellules ou de colorants de l’exécution précédente à la suivante.
Bien que la méthode in vitro présentée soit utile pour comparer la cinétique entre les aptamères fluorogéniques ou les biocapteurs fluorogéniques à base d’ARN, les valeurs cinétiques obtenues peuvent changer en fonction de la température, de la concentration en magnésium ou d’autres composants tampons utilisés. De plus, bien que cette méthode fournisse des conditions bien définies qui ont été utilisées précédemment pour caractériser différents systèmes d’ARN fluorogéniques, l’environnement intracellulaire ne peut pas être parfaitement représenté en raison de la présence d’autres macromolécules biologiques.
Alors que le lecteur de plaque de fluorescence équipé d’un injecteur programmable n’a pas de temps mort pour l’acquisition de données, l’instrument de cytomètre en flux a une précision temporelle limitée en raison du temps mort observable. Il y a un décalage de ~5 s entre le moment où le bouton « Enregistrer » est cliqué et le moment où l’acquisition de données commence. Un décalage supplémentaire de ~5 s se produit pour que l’instrument mesure 30 000 événements; ce temps d’acquisition de l’échantillon variera légèrement en fonction de la dilution des cellules dans 1x PBS.
Une autre limitation potentielle des expériences cellulaires est la viabilité cellulaire dans 1x PBS. Pour les analyses temporelles prolongées, la viabilité cellulaire peut être vérifiée à l’aide d’iodure de propidium pour colorer les cellules mortes20. L’agrégation de colorants peut également limiter la précision des mesures de fluorescence effectuées par le cytomètre en flux. Les colorants ayant une solubilité très limitée dans les solutions aqueuses peuvent s’agréger et apparaître sous forme de particules suffisamment grosses pour être comptées comme des cellules sur le cytomètre en flux. Par conséquent, il est important d’effectuer des contrôles expérimentaux uniquement sur colorant pour vérifier la présence d’agrégats dans la région fermée.
Auparavant, il a été démontré que le brocoli a une luminosité comparable à celle des épinards2 à 1 mM Mg2+ in vitro, mais que Broccoli-ARNt présente ~ deux fois plus d’intensité de fluorescence dans E. coli vivant par rapport à Spinach2-ARNt13. À notre connaissance, la cinétique de liaison aux colorants pour les aptamères fluorogéniques Spinach2 et Brocoli n’a pas été comparée auparavant et modélisée par une association à deux phases. Les constantes de vitesse rapide initiales pour les deux aptamères d’ARN soutiennent que la poche de liaison du colorant est pré-pliée et qu’aucun changement structurel n’est nécessaire pour que le colorant se lie, ce qui est cohérent avec la cristallographie aux rayons X et les expériences de fusion UV21,22. La deuxième phase avec une constante de vitesse plus lente n’a pas été rapportée auparavant parce que d’autres expériences telles que les mesures de durée de vie à écoulement arrêté et de fluorescence ont analysé l’aptamère d’épinards pour une durée plus courte (20 s et 300 s)23,24. La deuxième phase, beaucoup plus lente, entraîne une augmentation biexponentielle de la fluorescence lorsque les données sont analysées pendant 600 s. Cette étape lente peut être attribuée soit à une étape de repliement limitant la vitesse d’un état d’ARN incompétent à un état d’ARN compétent en liant, soit à une étape de photoconversion limitant la vitesse des formes trans à cis du colorant lié. Ce dernier mécanisme a déjà été modélisé pour donner un profil de fluorescence biexponentiel24 et est soutenu par une analyse récente de la différence entre les spectres d’absorption et d’excitation sur l’aptamère apparenté, Baby Spinach25.
L’importance globale des résultats in vitro est qu’ils montrent que l’association du colorant à l’aptamère d’ARN fluorogénique ne limite pas la localisation de l’ARN en temps réel et les études d’expression génique. Pour les biocapteurs fluorescents à base d’ARN qui utilisent des épinards2, la cinétique d’activation mesurée est similaire à la cinétique de deuxième phase mesurée ici10 parce que les biocapteurs nécessitent une étape de repliement et, par conséquent, devraient être suffisamment rapides pour permettre des études de signalisation en temps quasi réel.
On s’attendait à ce que la cinétique cellulaire soit différente de la cinétique in vitro observée pour les épinards2. Une différence clé est qu’il y a une étape supplémentaire de diffusion du colorant dans les cellules E. coli, qui implique de traverser les membranes externe et interne . En outre, l’environnement cellulaire pose des conditions différentes pour l’association colorant-aptamère en termes d’encombrement moléculaire, de composition ionique et de concentrations, ainsi que de concentrations d’ARN et de colorant.
La signification globale des résultats est que la fluorescence cellulaire atteint le signal maximal en moins de 5 minutes et reste stable pendant au moins 2 heures, ce qui permet la localisation de l’ARN en temps réel et les études d’expression génique dans cette plage de temps. Pour un biocapteur à base d’ARN qui utilise des épinards2, nous avons précédemment montré qu’une réponse de fluorescence significative pouvait être observée dans les 4-5 minutes suivant l’ajout du ligand, mais qu’atteindre le signal maximal prend plus de temps (15-30 min)8. Pris ensemble, ces résultats indiquent que la diffusion de colorants dans les cellules n’est pas l’étape pratique limitant le débit pour les expériences in vivo avec des biocapteurs à base d’ARN. Enfin, ce protocole expérimental peut être appliqué pour analyser d’autres systèmes d’ARN fluorogéniques dans les cellules.
Les protocoles expérimentaux présentés ici peuvent être appliqués pour analyser d’autres systèmes d’ARN fluorogéniques. Au-delà des deux aptamères analysés dans cette étude, les épinards2 et le brocoli, d’autres systèmes d’ARN fluorogéniques ont été développés qui fournissent différents profils d’émission, une photostabilité améliorée, des affinités de liaison plus étroites et la capacité de changer les fluorophores (récemment examiné1). En plus de leurs propriétés de fluorescence, il est important d’évaluer la cinétique d’activation de ces systèmes in vitro et dans les cellules pour évaluer leur adéquation à différentes applications biologiques cellulaires. Les résultats peuvent également soutenir le prépliage structurel ou le réarrangement de l’aptamère. Comme nous l’avons vu, avec quelques modifications, ces protocoles ont également été appliqués pour analyser les biocapteurs à base d’ARN8.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par les subventions suivantes à MCH: NSF-BSF 1815508 et NIH R01 GM124589. MRM a été partiellement soutenu par la subvention de formation NIH T32 GM122740.
matériels
| Name | Company | Catalog Number | Comments |
| Agarose | Thermo Fischer Scientific | BP160500 | |
| Agarose gel electrophoresis equipment | Thermo Fischer Scientific | B1A-BP | |
| Alpha D-(+)-lactose monohydrate | Thermo Fischer Scientific | 18-600-440 | |
| Amber 1.5 mL microcentrifuge tubes | Thermo Fischer Scientific | 22431021 | |
| Ammonium persulfate (APS) | Sigma-Aldrich | A3678 | |
| Ammonium sulfate ((NH4)2SO4) | Sigma-Aldrich | A4418 | |
| Attune NxT Flow cytometer | Thermo Fischer Scientific | A24861 | |
| Attune 1x Focusing Fluid | Thermo Fischer Scientific | A24904 | |
| Attune Shutdown Solution | Thermo Fischer Scientific | A24975 | |
| Attune Performance Tracking Beads | Thermo Fischer Scientific | 4449754 | |
| Attune Wash Solution | Thermo Fischer Scientific | J24974 | |
| Boric acid | Sigma-Aldrich | B6768 | |
| Bromophenol blue | Sigma-Aldrich | B0126 | |
| Carbenicillin disodium salt | Sigma-Aldrich | C3416 | |
| Chlorine Bleach | Amazon | B07J6FJR8D | |
| Corning Costar 96-well plate | Daigger Scientific | EF86610A | |
| Culture Tubes, 12 mm x 75 mm, 5 mL with attached dual position cap | Globe Scientific | 05-402-31 | |
| DFHBI | Sigma-Aldrich | SML1627 | |
| DFHBI-1T | Sigma-Aldrich | SML2697 | |
| D-Glucose (anhydrous) | Acros Organics | AC410955000 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D8418 | |
| Dithiothreitol (DTT) | Sigma-Aldrich | DTT-RO | |
| DNA loading dye | New England Biolabs | B7025S | |
| DNA LoBind Tubes (2.0 mL) | Eppendorf | 22431048 | |
| dNTPs: dATP, dCTP, dGTP, dTTP | New England Biolabs | N0446S | |
| EDTA, pH 8.0 | Gibco, Life Technologies | AM9260G | |
| Ethanol (EtOH) | Sigma-Aldrich | E7023 | |
| Filter-tip micropipettor tips | Thermo Fischer Scientific | AM12635, AM12648, AM12655, AM12665 | |
| FlowJo Software | BD Biosciences | N/A | FlowJo v10 Software |
| Fluorescent plate reader with heating control | VWR | 10014-924 | |
| Gel electrophoresis power supply | Thermo Fischer Scientific | EC3000XL2 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Glycogen AM95010 | Thermo Fischer Scientific | AM95010 | |
| GraphPad Prism | Dotmatics | N/A | Analysis software from Academic Group License |
| Heat block | Thomas Scientific | 1159Z11 | |
| HEPES | Sigma-Aldrich | H-4034 | |
| Inorganic pyrophosphatase | Sigma-Aldrich | I1643-500UN | |
| Low Molecular Weight DNA Ladder | New England Biolabs | N3233L | Supplied with free vial of Gel Loading Dye, Purple (6x), no SDS (NEB #B7025). |
| Magnesium chloride hexahydrate (MgCl2) | Sigma-Aldrich | M2670 | |
| Magnesium sulfate (MgSO4) | Fisher Scientific | MFCD00011110 | |
| Microcentrifuge tubes (1.5 mL) | Eppendorf | 22363204 | |
| Microcentrifuge with temperature control | Marshall Scientific | EP-5415R | |
| Micropipettors | Gilson | FA10001M, FA10003M, FA10005M, FA10006M | |
| Micropipettor tips | Sigma-Aldrich | Z369004, AXYT200CR, AXYT1000CR | |
| Millipore water filter with BioPak unit | Sigma-Aldrich | CDUFBI001, ZRQSVR3WW | |
| Narrow micropipettor pipette tips | DOT Scientific | RN005R-LRS | |
| PBS, 10x | Thermo Fischer Scientific | BP39920 | |
| PCR clean-up kit | Qiagen | 28181 | |
| PCR primers and templates | Integrated DNA technologies | ||
| PCR thermocycler for thin-walled PCR tubes | Bio-Rad | 1851148 | |
| PCR thermocycler for 0.5 mL tubes | Techne | 5PRIME/C | |
| pET31b-T7-Spinach2 Plasmid | Addgene | Plasmid #79783 | |
| Phusion High-Fidelity DNA polymerase | New England Biolabs | M0530L | Purchase of Phusion High-Fideldity Enzyme is supplied with 5x Phusion HF Buffer, 5x Phusion GC Buffer, and MgCl2 and DMSO solutions. |
| Polyacrylamide gel electrophoresis gel comb, C.B.S. Scientific | C.B.S. Scientific | VGC-1508 | |
| Polyacrylamide gel electrophoresis equipment | C.B.S. Scientific | ASG-250 | |
| Potassium chloride (KCl) | Sigma-Aldrich | P9333 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Razor blades | Genesee Scientific | 38-101 | |
| rNTPs: ATP, CTP, GTP, UTP | New England Biolabs | N0450L | |
| SDS | Sigma-Aldrich | L3771 | |
| Short wave UV light source | Thermo Fischer Scientific | 11758221 | |
| Sodium carbonate (Na2CO3) | Sigma-Aldrich | S7795 | |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S8045 | |
| Sodium phosphate dibasic, anhydrous | Thermo Fischer Scientific | S375-500 | |
| SoftMax Pro | Molecular Devices | N/A | SoftMax Pro 6.5.1 (platereader software) obtained through Academic Group License |
| Sterile filter units | Thermo Fischer Scientific | 09-741-88 | |
| Sucrose | Sigma-Aldrich | S0389 | |
| SYBR Safe DNA gel stain | Thermo Fischer Scientific | S33102 | |
| TAE buffer for agarose gel electrophoresis | Thermo Fischer Scientific | AM9869 | |
| Tetramethylethylenediamine (TEMED) | Sigma-Aldrich | T9281 | |
| Tris base | Sigma-Aldrich | TRIS-RO | |
| Tryptone (granulated) | Thermo Fischer Scientific | M0251S | |
| T7 RNA polymerase | New England Biolabs | M0251S | |
| Urea-PAGE Gel system | National Diagnostics | EC-833 | |
| UV fluorescent TLC plate | Sigma-Aldrich | 1.05789.0001 | |
| UV/Vis spectrophotometer | Thermo Fischer Scientific | ND-8000-GL | |
| Vortex mixer | Thermo Fischer Scientific | 2215415 | |
| Xylene cyanol | Sigma-Aldrich | X4126 | |
| Yeast Extract (Granulated) | Thermo Fischer Scientific | BP9727-2 |
Références
- Su, Y., Hammond, M. C. RNA-based fluorescent biosensors for live cell imaging of small molecules and RNAs. Current Opinion in Biotechnology. 63, 157-166 (2020).
- Zhang, J., et al. Tandem spinach array for mRNA Imaging in living bacterial cells. Scientific Reports. 5, 17295(2015).
- Wang, Z., et al. In spatial complementation of aptamer-mediated recognition enables live-cell imaging of native RNA transcripts in real time. Angewandte Chemie. 57 (4), 972-976 (2018).
- Strack, R. L., Disney, M. D., Jaffrey, S. R. A superfolding Spinach2 reveals the dynamic nature of trinucleotide repeat-containing RNA. Nature Methods. 10 (12), 1219-1224 (2013).
- Thavarajah, W., et al. Point-of-use detection of environmental fluoride via a cell-free riboswitch-based biosensor. ACS Synthetic Biology. 9 (1), 10-18 (2020).
- You, M., Litke, J. L., Jaffrey, S. R. Imaging metabolite dynamics in living cells using a Spinach-based riboswitch. Proceedings of the National Academy of Sciences of the United States of America. 112 (21), 2756-2765 (2015).
- Kellenberger, C. A., Wilson, S. C., Sales-Lee, J., Hammond, M. C. RNA-based fluorescent biosensors for live cell imaging of second messengers cyclic di-GMP and cyclic AMP-GMP. Journal of the American Chemical Society. 135 (13), 4906-4909 (2013).
- Manna, S., Truong, J., Hammond, M. C. Guanidine biosensors enable comparison of cellular turn-on kinetics of riboswitch-based biosensor and reporter. ACS Synthetic Biology. 10 (3), 566-578 (2021).
- Bose, D., Su, Y., Marcus, A., Raulet, D. H., Hammond, M. C. An RNA-based fluorescent biosensor for high-throughput analysis of the cGAS-cGAMP-STING pathway. Cell Chemical Biology. 23 (12), 1539-1549 (2016).
- Wang, X. C., Wilson, S. C., Hammond, M. C. Next-generation RNA-based fluorescent biosensors enable anaerobic detection of cyclic di-GMP. Nucleic Acids Research. 44 (17), 139(2016).
- Paige, J. S., Thinh, N. -D., Wenjiao, S., Jaffrey, S. R. Fluorescence imaging of cellular metabolites with RNA. Science. 335 (6073), 1194(2012).
- Paige, J. S., Wu, K. Y., Jaffrey, S. R. RNA mimics of green fluorescent protein. Science. 333 (6042), 642-646 (2011).
- Filonov, G. S., Moon, J. D., Svensen, N., Jaffrey, S. R. Broccoli: Rapid selection of an RNA mimic of green fluorescent protein by fluorescence-based selection and directed evolution. Journal of the American Chemical Society. 136 (46), 16299-16308 (2014).
- Song, W., Strack, R. L., Svensen, N., Jaffrey, S. R. Plug-and-play fluorophores extend the spectral properties of spinach. Journal of the American Chemical Society. 136 (4), 1198-1201 (2014).
- Sambrook, J., Fritsch, E., Maniatis, T. Molecular Cloning: A Laboratory Manual. , Cold Spring Harbor Laboratory Press. Cold Spring Harbor, NY. (1989).
- Basch, H., Gadebusch, H. H. In vitro antimicrobial activity of dimethylsulfoxide. Applied Microbiology. 16 (12), 1953-1954 (1968).
- Kallansrud, G., Ward, B. A comparison of measured and calculated single- and double-stranded oligodeoxynucleotide extinction coefficients. Analytical Biochemistry. 236 (1), 134-138 (1996).
- Wilson, S. C., Cohen, D. T., Wang, X. C., Hammond, M. C. A neutral pH thermal hydrolysis method for quantification of structured RNAs. RNA. 20 (7), 1153-1160 (2014).
- Szatmári, D., et al. Intracellular ion concentrations and cation-dependent remodelling of bacterial MreB assemblies. Scientific Reports. 10, 12002(2020).
- Boulos, L., Prévost, M., Barbeau, B., Coallier, J., Desjardins, R. LIVE/DEAD® BacLightTM: Application of a new rapid staining method for direct enumeration of viable and total bacteria in drinking water. Journal of Microbiological Methods. 37 (1), 77-86 (1999).
- Huang, H., et al. A G-quadruplex-containing RNA activates fluorescence in a GFP-like fluorophore. Nature Chemical Biology. 10 (8), 686-691 (2014).
- Jeng, S. C. Y., Chan, H. H. Y., Booy, E. P., McKenna, S. A., Unrau, P. J. Fluorophore ligand binding and complex stabilization of the RNA Mango and RNA Spinach aptamers. RNA. 22 (12), 1884-1892 (2016).
- Han, K. Y., Leslie, B. J., Fei, J., Zhang, J., Ha, T. Understanding the photophysics of the Spinach-DFHBI RNA aptamer-fluorogen complex to improve live-cell RNA imaging. Journal of the American Chemical Society. 135 (50), 19033-19038 (2013).
- Wang, P., et al. Photochemical properties of Spinach and its use in selective imaging. Chemical Science. 4 (7), 2865-2873 (2013).
- Dao, N. T., et al. Photophysics of DFHBI bound to RNA aptamer Baby Spinach. Scientific Reports. 11, 7356(2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon