Method Article
Induction de choc hémorragique normalisée guidée par l'oxymétrie cérébrale et la surveillance hémodynamique prolongée chez les porcs
Dans cet article
Résumé
Le choc hémorragique est une complication grave dans les patients grièvement blessés, qui mène à l'insuffisance d'oxygène représentant un danger pour la vie. Nous présentons une méthode normalisée pour induire le choc hémorragique par le retrait de sang chez les porcs qui est guidé par l'hémodynamique et l'oxygénation cérébrale microcirculatoire.
Résumé
Le choc hémorragique compte parmi les principales raisons de la mort grave liée aux blessures. La perte de volume circulatoire et de porteurs d'oxygène peut conduire à un approvisionnement insuffisant en oxygène et à une défaillance irréversible des organes. Le cerveau n'exerce que des capacités d'indemnisation limitées et est particulièrement à haut risque de dommages hypoxiques graves. Cet article démontre l'induction reproductible du choc hémorragique représentant un danger pour la vie dans un modèle porcin au moyen du retrait sanguin calculé. Nous attifions l'induction de choc guidée par la spectroscopie proche infrarouge et la surveillance hémodynamique prolongée pour montrer l'échec circulatoire systémique, aussi bien que l'épuisement microcirculatoire cérébral d'oxygène. Par rapport à des modèles similaires qui se concentrent principalement sur les volumes d'élimination prédéfinis pour l'induction du choc, cette approche met en évidence une titration au moyen de l'échec résultant de la macro- et la microcirculation.
Introduction
La perte de sang massive est l'une des principales causes de décès liés aux blessures1,2,3. La perte de liquide circulatoire et de porteurs d'oxygène conduit à une défaillance hémodynamique et à une grave sous-alimentation en oxygène et peut causer une défaillance irréversible des organes et la mort. Le niveau de gravité du choc est influencé par d'autres facteurs comme l'hypothermie, la coagulopathie et l'acidose4. Particulièrement le cerveau, mais aussi les reins manquent de capacité de compensation en raison de la forte demande d'oxygène et de l'incapacité de la production d'énergie anaérobie adéquate5,6. À des fins thérapeutiques, une action rapide et immédiate est essentielle. Dans la pratique clinique, la réanimation liquide avec une solution équilibrée d'électrolyte est la première option pour le traitement, suivie par l'administration des concentrés de globules rouges et du plasma congelé frais. Les concentrés de Thrombocyte, les catécholamines, et l'optimisation de la coagulation et du statut acide-base soutiennent la thérapie pour regagner des conditions physiologiques normales après trauma soutenu. Ce concept se concentre sur la restauration de l'hémodynamique et de la macrocirculation. Plusieurs études, cependant, montrent que la perfusion microcirculatoire ne se rétablit pas simultanément avec la macrocirculation. Particulièrement, la perfusion cérébrale reste altérée et davantage de sous-approvisionnement en oxygène peut se produire7,8.
L'utilisation de modèles animaux permet aux scientifiques d'établir des stratégies nouvelles ou expérimentales. L'anatomie, l'homologie et la physiologie comparables des porcs et des humains permettent de tirer des conclusions sur des facteurs pathologiques spécifiques. Les deux espèces ont un système métabolique similaire et la réponse aux traitements pharmacologiques. C'est un grand avantage par rapport aux modèles de petits animaux où les différences dans le volume sanguin, l'hémodynamique, et la physiologie globale font qu'il est presque impossible d'imiter un scénario clinique9. En outre, l'équipement médical et les consommables autorisés peuvent être facilement utilisés dans les modèles porcins. En outre, il est facilement possible d'obtenir des porcs auprès de fournisseurs commerciaux, ce qui permet une grande diversité de la génétique et des phénotypes et est la réduction des coûts10. Le modèle de sevrage sanguin par l'intermédiaire du vaisseau cannulation est assez commun11,12,13,14,15.
Dans cette étude, nous prolongeons le concept de l'induction hémorragique de choc par le retrait de sang artériel avec une titration exacte de l'échec hémodynamique et de l'affaiblissement cérébral d'oxygénation. Le choc hémorragique est réalisé si l'index cardiaque et la pression artérielle moyenne tombe en dessous de 40%de la valeur de base, qui a été montrée pour causer la détérioration considérable de la saturation régionale cérébrale d'oxygénation 8. La mesure du rendement cardiaque du contour des impulsions (PiCCO) est utilisée pour la surveillance hémodynamique continue. Tout d'abord, le système doit être calibré par thermodilution transpulmonaire, qui permet le calcul de l'indice cardiaque de la teneur en eau pulmonaire extravasculaire et du volume global de l'extrémité diastolique. Par la suite, l'indice cardiaque continu est calculé par l'analyse du contour de l'impulsion et fournit également des paramètres de précharge dynamiques comme la pression d'impulsion et la variation du volume des accidents vasculaires cérébraux.
Cette technique est bien établie dans les milieux cliniques et expérimentaux. La spectroscopie proche infrarouge (NIRS) est une méthode cliniquement et expérimentalement établie pour surveiller les changements dans l'approvisionnement en oxygène cérébral en temps réel. Des capteurs auto-adhérents sont attachés au front gauche et droit et calculent l'oxygénation cérébrale de façon non invasive dans le cortex frontal cérébral. Deux longueurs d'onde de la lumière infrarouge (700 et 900 nm) sont émises et détectées par les capteurs après avoir été réfléchies par le tissu du cortex. Pour évaluer la teneur en oxygène cérébrale, les contributions du sang artériel et veineux sont calculées dans les relations 1:3 et mises à jour dans 5 intervalles de s. La sensibilité en profondeur de 1-4 cm est exponentielle décroissante et influencée par le tissu pénétré (par exemple, la peau et l'os), bien que le crâne soit translucide à la lumière infrarouge. La technique facilite des actions thérapeutiques rapides pour empêcher des patients des résultats défavorables comme le délire ou les dommages cérébraux hypoxiques et sert de paramètre cible en cas de sortie cardiaque altérée16,17. La combinaison des deux techniques pendant le choc expérimental permet une titration exacte de la macrocirculation, aussi bien que l'affaiblissement microcirculatoire cérébral, pour étudier cet événement représentant un danger pour la vie.
Protocole
Les expériences de ce protocole ont été approuvées par le Comité d'État et de soins aux animaux institutionnels (Landesuntersuchungsamt Rheinland-Pfalz, Koblenz, Allemagne; Présidente: Dre Silvia Eisch-Wolf; numéro de référence: 23 177-07/G 14-1-084; 02.02.2015). Les expériences ont été menées conformément aux lignes directrices sur les rapports de recherche sur les animaux des expériences in vivo (ARRIVE). L'étude a été planifiée et menée entre novembre 2015 et mars 2016. Après une recherche documentaire approfondie, le modèle porcin a été choisi comme modèle bien établi pour le choc hémorragique. Sept porcs mâles anesthésiés (Sus scrofa domestica) avec un poids moyen de 28 à 2 kg et un âge de 2-3 mois ont été inclus dans le protocole. Les animaux ont été pris en charge par un éleveur local qui a été recommandé par l'État et le Comité institutionnel de soins aux animaux. Les animaux ont été gardés dans leur environnement connu aussi longtemps que possible pour minimiser le stress. La nourriture, mais pas l'eau a été refusée 6 h avant l'expérience a été prévue, pour réduire le risque d'aspiration. Le cours de temps représentatif est affiché à la figure 1.
1. Anesthésie, intubation et ventilation mécanique
- Porcs sédentaires avec une injection combinée de kétamine (4 mg-kg-1) et d'azaperone (8 mg-kg-1) dans le cou ou le muscle fessier avec une aiguille pour l'injection intramusculaire (1,2 mm). Assurez-vous que les animaux restent stables jusqu'à ce que la sédation s'installe.
MISE EN GARDE: Les gants sont absolument nécessaires lors de la manipulation des animaux. - Transportez les animaux sous sédatifs au laboratoire.
REMARQUE: Les animaux s'endorment profondément et ne se réveillent pas pendant la manipulation normale, comme quand ils sont soulevés dans la cage de transport. Dans ce cadre, le temps de transport était d'environ 20 min avec une fourgonnette spéciale pour le transport des animaux. - Surveillez la saturation périphérique en oxygène (SpO2) avec un capteur fixé à la queue ou à l'oreille du porc directement après l'arrivée.
- Désinfecter la peau avec une teinture de désinfection incolore et attendre 3 min avant d'insérer un cathéter véinisme périphérique (1,2 mm) dans une veine de l'oreille. Ensuite, induire l'anesthésie par une injection intraveineuse de fentanyl (4 kg-1) et de propofol (3 mgkg-1).
- Lorsque tous les réflexes sont absents et que la respiration spontanée expire, placez les porcs en position de supine sur une civière et fixez-les avec des bandages.
REMARQUE: Des niveaux adéquats d'anesthésie doivent être confirmés par un chercheur expérimenté par l'absence d'un réflexe de paupière et d'autres réactions aux stimuli externes. - Commencez immédiatement la ventilation non invasive avec un masque de ventilation pour chien (taille 2). Utilisez les paramètres de ventilation suivants : fraction d'oxygène inspiratoire (FiO2) 1,0; fréquence respiratoire 14-16 min-1; pression inspiratoire maximale 'lt;20 cm H2O, pression positive d'expiration de fin (PEEP) '5 cm H2O.
- Maintenir l'anesthésie par une infusion continue de fentanyl (0,1 à 0,2 kg -1 kg-1h-1) et de propofol (8-12 mg-kg-1h-1) et commencer une infusion de solution d'électrolyte équilibrée (5 mL-kg-1h-1).
- Faciliter l'intubation endotrachéale par l'application d'un relaxant musculaire (atracurium 0,5 mg-kg-1).
- Sécurisez les voies respiratoires par intubation avec un tube endotrachéal commun (ID 6-7) et un introducteur. Utilisez un laryngoscope commun avec une lame Macintosh (taille 4). Deux personnes facilitent la procédure.
- Personne 1 : Fixez la langue à l'extérieur avec un morceau de tissu et ouvrez le museau avec l'autre main.
- Personne 2 : Effectuer une laryngoscopie.
- Personne 2 : Lorsque l'épiglotte est visible, déplacez le laryngoscope ventralement. Soulevez l'épiglotte et assurez-vous que les cordes vocales sont visibles.
REMARQUE: Si l'épiglotte ne bouge pas dorsally, il colle à la palatine molle et peut être mobilisé par la pointe du tube. Alternativement, une lame d'une autre taille (3 ou 5) ou d'un type (lame Miller) peut être utilisée.
- Déplacez le tube soigneusement à travers les cordes vocales.
REMARQUE: Le point le plus étroit de la trachée n'est pas au niveau des cordes vocales, mais subglottique. Si l'insertion du tube n'est pas possible, essayez de faire pivoter le tube ou utilisez un tube plus petit. - Sortez l'introducteur du tube, utilisez une seringue de 10 ml pour bloquer le brassard avec 10 ml d'air et contrôlez la pression du brassard à l'intérieur d'un gestionnaire de manchette (30 cm H2O).
- Démarrer la ventilation mécanique après que le tube est relié à un ventilateur (PEEP 5 cm H2O; volume de marée ' 8 mL-kg-1; FiO2 à 0,4; ratio inspiration-expiration 1:2; fréquence respiratoire - variable pour atteindre un CO 2 de maréefinale de 6 kPa).
REMARQUE: Évitez la fluctuation du CO2 pour minimiser les effets respiratoires sur la perfusion cérébrale. - Assurez-vous que la position du tube est correcte par expiration régulière et périodique du CO2 par capnographie, et vérifiez la ventilation recto-verso par auscultation.
REMARQUE: Si le tube est placé incorrectement, l'inflation de l'air dans l'estomac forme rapidement un renflement visible dans la paroi abdominale, avant même que la capnographie soit installée. Dans ce cas, le remplacement du tube et l'insertion d'un tube gastrique sont absolument nécessaires. - Avec deux personnes, placez un tube gastrique dans l'estomac pour éviter le reflux et les vomissements.
- Personne 1 : Fixez la langue à l'extérieur avec un morceau de tissu et ouvrez le museau avec l'autre main.
- Personne 2 : Effectuer une laryngoscopie du larynx porcin.
- Personne 2 : Visualisez l'œsophage.
- Personne 2 : Poussez le tube gastrique à l'intérieur de l'œsophage avec une paire de forceps magill jusqu'à ce que le liquide gastrique soit drainé.
REMARQUE: Parfois, la visualisation n'est pas facile. Dans ce cas, déplacez le laryngoscope dorsally au tube et poussez ventralement pour ouvrir l'oesophage. Pendant la procédure, le corps de l'animal est recouvert de couvertures pour éviter l'hypothermie. Si la température corporelle de l'animal diminue, utilisez un système de chauffage pour stabiliser la température à un niveau physiologique (voir le Tableau des matériaux). La température corporelle est affichée sur l'écran du PiCCO.
2. Instrumentation
- Utilisez des bandages pour tirer les pattes postérieures pour lisser les plis dans la zone fémorale pour le cathétérisation du navire.
- Préparer les matériaux suivants : une seringue de 5 ml, une seringue de 10 ml, une seringue de 50 ml, une aiguille Seldinger, des gaines d'introduction (2 mm, 2,7 mm, 2,7 mm), des fils-guides pour les gaines, un cathéter veineux central avec trois ports (2,3 mm, 30 cm) avec fil de guidage, et un PiCCO cathéter (1,67 mm, 20 cm).
- Désinfecter la zone inguinale avec la désinfection colorée, attendre 2 min, et essuyer la désinfection avec un tissu stérile. Répétez cette procédure 3x. Après la troisième fois, n'enlevez pas la désinfection.
- Remplissez tous les cathéters de solutions saline.
- Appliquer du gel à ultrasons sur la sonde à ultrasons. Couvrir la zone inguinale d'un drapé fenestré stérile et numériser les bons vaisseaux fémoraux à l'échographie. Utilisez la technique Doppler pour distinguer entre l'artère et la veine18.
- Le sang pulsant rouge vif confirme la position aspirée d'aiguille. Débranchez la seringue et insérez le fil-guide dans l'artère fémorale droite.
- Visualisez l'axe longitudinal de la veine fémorale droite et insérez l'aiguille Seldinger sous aspiration permanente avec la seringue de 5 ml.
- Aspirez le sang veineux rouge foncé non pulsant.
- Visualisez l'artère fémorale droite axialement et passez à une vue longitudinale de l'artère en faisant pivoter la sonde à 90 degrés.
-
Perforez l'artère fémorale droite sous la visualisation d'ultrason avec l'aiguille de Seldinger sous l'aspiration permanente avec la seringue de 5 ml.
REMARQUE : La technique de Seldinger ultrason-guidée est associée à la perte de sang sensiblement inférieure, au trauma de tissu, et à la consommation de temps que d'autres méthodes d'accès vasculaire19,20.- Si la position correcte de l'aiguille dans les différents vaisseaux ne peut pas être établie avec certitude, prenez les sondes sanguines et analysez la teneur en gaz sanguin avec un analyseur de gaz sanguin (voir le Tableau des matériaux). Un niveau élevé d'oxygène est un bon signe de sang artériel, et un faible niveau d'oxygène est un signe de sang veineux.
- Insérez le fil de guidage pour le cathéter veineux central dans la veine fémorale droite après avoir débranché la seringue et rétracté l'aiguille Deldinger.
- Visualisez les deux vaisseaux droits avec l'ultrason pour commander la position correcte de fil.
- Poussez la gaine artériel d'introduction (2 mm) au-dessus du fil de guidage dans l'artère droite et fixez la position avec l'aspiration de sang.
- Utilisez la technique Seldinger pour positionner la ligne veineuse centrale dans la veine fémorale droite. Aspirez tous les ports et rincez-les avec une solution saline.
- Effectuer la même procédure sur le côté inguinal gauche pour insérer les autres gaines d'introduction dans la technique Seldinger dans l'artère fémorale gauche (2,7 mm) et la veine fémorale (2,7 mm).
- Connectez la gaine d'introduction artérielle droite et le cathéter veineux central avec deux systèmes de transducteur pour la mesure de l'hémodynamique invasive, et positionnez les deux transducteurs au niveau du coeur pour obtenir des valeurs appropriées.
- Passer les trois voies-stopcocks des deux transducteurs ouverts à l'atmosphère pour calibrer les systèmes à 0 comme prescrit dans les instructions de fonctionnement.
REMARQUE: Il est absolument nécessaire d'éviter les bulles d'air et les taches de sang dans les systèmes pour générer des valeurs plausibles. - Passer toutes les perfusions pour maintenir l'anesthésie de la veine périphérique à la ligne veineuse centrale.
- Prenez les valeurs de base (hémodynamique, spirométrie, NIRS (voir section 4) et PiCCO (voir la section 3) après 15 min de récupération.
- Initier un choc hémorragique (voir la section 5).
3. Mesure PiCCO
REMARQUE: Pour l'équipement PiCCO, voir la Table des Matériaux.
- Insérer le cathéter PiCCO dans la gaine de l'introduction artérielle droite.
REMARQUE: En médecine clinique, les cathéters PiCCO sont directement placés par la technique Seldinger. Cependant, le placement par l'intermédiaire d'une gaine d'introduction est également faisable. - Connectez le cathéter avec le fil artériel du système PiCCO et le transducteur artériel directement avec le port PiCCO. Ensuite, recalibrez comme décrit à l'étape 2.17.
- Connectez l'unité de mesure veineuse du système PiCCO avec la gaine d'introduction veineuse gauche.
REMARQUE: Il est nécessaire de relier les sondes veineuses et artérielles à une certaine distance les unes des autres. Sinon, la mesure sera perturbée, car l'application d'une solution saline froide dans le système veineux influencera la mesure artérielle. Pour plus de détails sur PiCCO, voir Mayer et Suttner21. - Allumez le système PiCCO et confirmez qu'un nouveau patient est mesuré.
- Entrez la taille et le poids de l'animal et passez la catégorie aux adultes.
- Entrez le nom et l'ID du protocole et entrez Exit.
- Définir le volume d'injection à 10 ml.
REMARQUE: Le volume de la solution d'injection choisie peut être varié. Un volume plus élevé rend les valeurs mesurées plus valides. Choisissez un petit volume pour éviter tout effet d'hémodilution par application répétitive. - Entrez la pression veineuse centrale.
- Ouvrez le stopcock à trois voies à l'atmosphère, cliquez sur Zéro pour l'étalonnage du système, et cliquez sur Exit.
- Calibrer la mesure continue de la sortie cardiaque telle que décrite ci-contre et cliquer sur La TD (Thermodilution). Préparer une solution saline physiologique avec une température de 4 oC dans une seringue de 10 ml et cliquer sur Démarrer.
- Injectez 10 ml de la solution saline froide rapidement et régulièrement dans l'unité de mesure veineuse et attendez que la mesure soit terminée et que le système demande une répétition.
- Répétez cette procédure jusqu'à ce que trois mesures soient effectuées.
- Laissez le système calculer la moyenne de tous les paramètres et cliquez sur Exit.
- Après l'étalonnage complet, commencez immédiatement la mesure. Pour surveiller l'induction du choc, concentrez-vous sur l'indice cardiaque du paramètre dérivé de PiCCO.
4. Saturation régionale cérébrale d'oxygénation
REMARQUE: Pour l'équipement de surveillance de l'oxygénation régionale cérébrale, voir le Tableau des matériaux.
- Raser le front du porc avec un rasoir jetable et de l'eau et coller deux capteurs auto-adhérents (voir la Table des Matériaux) pour NIRS sur le front du porc.
- Connectez le préamplificateur au moniteur et connectez les connecteurs de câbles de capteur codés en couleur au préamplificateur.
- Fermez le mécanisme de verrouillage préampli et attachez les capteurs aux câbles du capteur.
REMARQUE: Afin d'enregistrer des données en temps réel, une clé USB doit être connectée au moniteur NIRS. - Allumez le moniteur, cliquez sur New Patient, entrez le nom de l'étude, et cliquez sur Fait.
- Vérifiez le signal entrant. Lorsque le signal est stable, cliquez sur Menu baseline et cliquez sur Définir Baselines. Si la ligne de base a déjà été saisie, confirmez la nouvelle ligne de base en cliquant sur Oui et cliquez sur La marque d'événement.
- Choisissez l'événement avec les boutons fléchés sur le clavier et avec NextEvent; sélectionnez l'événement 3 Induction et appuyez sur Select Event.
REMARQUE: Si de plus amples renseignements sont nécessaires, consultez le manuel d'exploitation du système NIRS22.
5. Induction de choc hémorragique
- Connectez la gaine de l'introducteur gauche avec un stopcock à l'arbre. Connectez un port du stopcock à trois voies avec une seringue de 50 ml et un avec une bouteille d'infusion vide.
REMARQUE: Alternativement, le sang retiré peut être recueilli dans des sacs citrated pour l'autotransfusion ultérieure. C'est un avantage majeur du sevrage sanguin contrôlé. - Mesurer et documenter les paramètres hémodynamiques exacts et calculer 40% de l'indice cardiaque et la pression artérielle moyenne comme cibles hémodynamiques. Définir l'événement 93 Perte de sang dans le système NIRS tel que décrit à l'étape 4.6.
REMARQUE: Le choc hémorragique est atteint si l'indice cardiaque et la pression artérielle moyenne tombe en dessous de 40% de la valeur de base. Une saturation régionale considérable d'oxygénation (crSO2) baisse de 20% est préférable pour dépeindre l'affaiblissement microcirculatoire. La perte de sang moyenne pour y parvenir se situe dans une fourchette de 25-35 mL-kg-1. - Aspirez 50 ml de sang dans la seringue et changez le robinet d'arrêt à trois voies. Poussez le sang dans la bouteille vide.
- Notez le volume sanguin enlevé.
- Surveillez de près la pression artérielle, l'indice cardiaque et le CRSO2. Répétez le sevrage sanguin jusqu'à ce que la pression artérielle cible et l'indice cardiaque soient atteints (après 20-30 min).
- Définir l'événement 97 Hypotension dans le dispositif NIRS tel que décrit à l'étape 4.6.
REMARQUE: Ne retirez pas le sang trop rapidement, car cela comporte le risque d'une défaillance cardio-circulatoire immédiate. Après avoir terminé la procédure d'induction de choc, les animaux peuvent être utilisés pour diverses interventions thérapeutiques.
6. Fin de l'expérience et de l'euthanasie
- Injecter 0,5 mg de fentanyl dans la ligne veineuse centrale et attendre 5 min.
- Injecter 200 mg de propofol dans la ligne veineuse centrale et euthanasier l'animal avec 40 chlorure de potassium de mmol.
Résultats
Après le début de l'induction du choc, un court délai d'indemnisation peut être enregistré. Avec l'ablation continue du sang, la décompensation cardio-circulatoire susmentionnée, surveillée par une diminution significative de CRSO2, l'indice cardiaque, l'indice intrathoracique du volume sanguin, et l'indice global de volume de fin-diastolique (figure2 , Figure 3, et Figure 4), se produit. En outre, une tachycardie significative et une diminution de la pression artérielle artérielle sont observées comme manifestations courantes de choc hémorragique (Figure 2). La variation du volume des accidents vasculaires cérébraux augmente considérablement (figure 3). La teneur en eau extravasculaire des poumons et la résistance vasculaire systémique ne sont généralement pas affectées (figure 3). Après avoir mis fin au prélèvement sanguin (28 à 2 mLkg-1),les valeurs hémodynamiques restent à un niveau critiquement bas. Parallèlement, crSO2 baisse également de manière significative. Ces capteurs ne démarrent pas régulièrement au même niveau, mais le débaissement cental est comparable. La figure 4 montre un enregistrement représentatif d'un animal. La teneur en hémoglobine et l'hématocrit ne diminuent pas directement dans le processus, mais les niveaux de lactate augmentent et la saturation centrale en oxygène veineux diminue (figure 5).

Figure 1: Graphique expérimental de flow. La ligne de base est fixée après la préparation et une stabilisation de 30 min. Le choc est induit pendant 30 min. Les paramètres de sortie cardiaque du contour d'impulsion et l'oxygénation régionale cérébrale sont mesurés pendant toute l'expérience. Les temps de mesure sont appelés préparation, Baseline, et Shock.
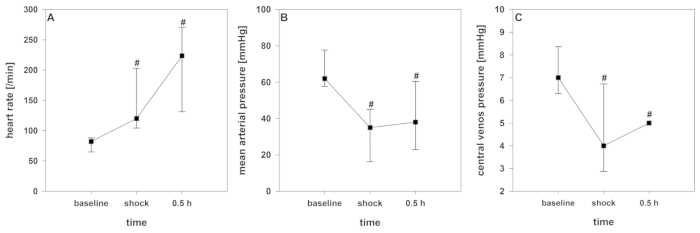
Figure 2 : Développement de l'hémodynamique pendant le choc hémorragique. Les effets au fil du temps sont analysés par ANOVA et la méthode post hoc Student-Newman-Keuls. # p lt; 0,05 à la ligne de base. Les données sont présentées comme une déviation moyenne et standard. (A) La fréquence cardiaque (B) signifie la pression artérielle, et (C) la pression veineuse centrale sont considérablement influencées dans ce modèle. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
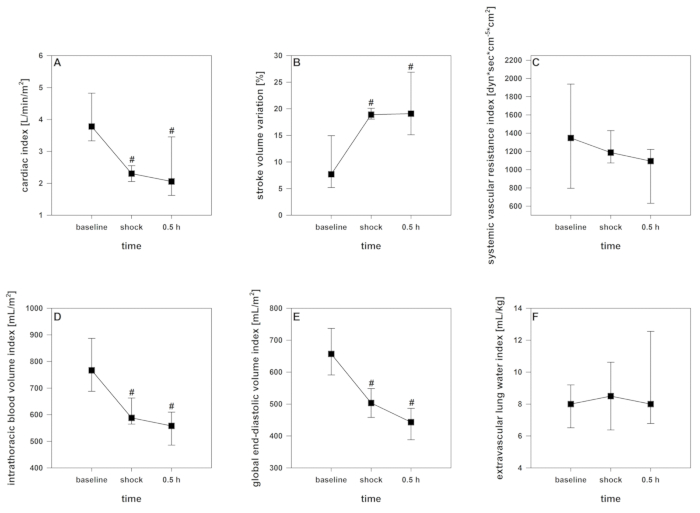
Figure 3 : Développement de la sortie cardiaque du contour du pouls et des paramètres dérivés de la thermodilution pendant le choc hémorragique. Les effets au fil du temps sont analysés par ANOVA et la méthode post hoc Student-Newman-Keuls. # p lt; 0,05 à la ligne de base. Les données sont présentées comme une déviation moyenne et standard. (A) L'indice cardiaque diminue, (B) La variation du volume des accidents vasculaires cérébraux augmente, (D) l'indice intrathoracique du volume sanguin et (E) la diminution globale de l'indice de volume de fin diastolique, (C) l'indice de résistance vasculaire systémique et (F) ) l'indice extravasculaire d'eau pulmonaire restent intacts. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
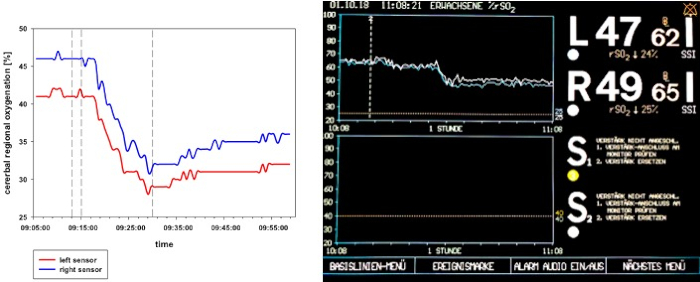
Figure 4 : CRSO2 graphique de flux pendant le choc hémorragique chez un animal représentatif. Le panneau gauche montre une présentation schématique du crSO2 pendant le choc hémorragique. Le panneau droit affiche l'affichage du système NIRS. crSO2 se décompose de manière significative par induction de choc et reste à un bas niveau après le retrait de sang est terminé.

Figure 5 : Développement des paramètres hématologiques pendant le choc hémorragique. Les effets au fil du temps sont analysés par ANOVA et la méthode post hoc Student-Newman-Keuls. # p lt; 0,05 à la ligne de base. Les données sont présentées comme une déviation moyenne et standard. (A) L'hémoglobine et (D) l'excès de base ne sont pas affectés, (C) le niveau de lactate augmente de façon significative, (B) la saturation centrale en oxygène veineux diminue. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Le protocole décrit une méthode d'induire le choc hémorragique par l'intermédiaire du saignement artériel commandé chez les porcs qui est guidé par l'hémodynamique systémique, aussi bien que par l'affaiblissement microcirculatoire cérébral. Les conditions de choc ont été atteintes par un retrait sanguin calculé de 25-35 mL kg-1 et confirmés par le composite mentionné des paramètres de substitution indiquant l'échec cardio-circulatoire considérable. Si elle n'est pas traitée, cette procédure était mortelle dans un rayon de 2 h chez 66 % des animaux, ce qui souligne la sévérité et la reproductibilité du modèle. La réanimation adéquate des fluides, d'autre part, a restabilisé la circulation et approuvé la patency pour imiter un scénario clinique8. Cependant, moins de perte de sang peut ne pas conduire à l'instabilité hémodynamique qui a également affecté CRSO2 menant à l'échec expérimental. La quantité de sang enlevé doit être adaptée au poids corporel de l'animal, ce qui correspond au volume sanguin total8.
Cette méthode permet aux scientifiques d'examiner différents aspects de cette condition potentiellement mortelle et ouvre la possibilité d'étudier un large éventail d'interventions thérapeutiques dans un scénario pseudoclinique. Dans ce contexte, il est important de noter que lors d'un choc hémorragique manifeste, la macrocirculation seule indique à peine une microcirculation intacte ou altérée et l'apport en oxygène des organes7. L'avantage de la procédure réside dans sa conception simple et sa facilité d'utilisation. Le transfert à d'autres mammifères de taille moyenne semble simple, bien que différentes espèces puissent présenter des défis spécifiques. La conception offre une grande flexibilité que différents niveaux de déficience cardio-circulatoire peut être facilement choisi en titrant les variables d'effet. La combinaison avec NIRS fournit des informations sur l'approvisionnement en oxygène microcirculatoire autrement non reconnu pendant le choc hémorragique.
Certaines des étapes critiques du modèle doivent être mises en évidence et nécessitent une attention particulière. Une sédation adéquate avant le transport est essentielle pour éviter le stress qui pourrait compliquer la manipulation des animaux et falsifier les résultats par la libération de catécholamine endogénique. Le museau porcin, avec sa longue cavité oropharyngée, complique l'intubation et rend l'assistance d'une deuxième personne raisonnable. Régulièrement, l'épiglotte colle au palais et doit être mobilisée avec la pointe du tube. La partie la plus étroite des voies respiratoires n'est pas au niveau des cordes vocales, mais subglottique, comme chez les patients pédiatriques23. Ces aspects rendent la relaxation musculaire adéquate essentielle parce que l'intubation est facilitée. Le cathétérisation guidée par ultrasons est préférable, bien que l'accès chirurgical puisse également être utilisé de façon reproductible. La technique mini-invasive a besoin d'une formation et d'une expérience spéciales, mais elle peut minimiser les saignements incontrôlés, les lésions tissulaires, les taux de complications, le temps d'accès et la douleur24. L'induction du choc hémorragique lui-même semble être très simple, mais l'utilisateur doit être conscient de plusieurs pièges. Il est important de réduire la vitesse d'enlèvement du sang pour reconnaître l'instabilité hémodynamique. L'enlèvement des artères est efficace, mais lorsqu'il est effectué trop rapidement, il peut conduire à une défaillance cardio-circulatoire et expérimentale imprévue. Le calcul du volume d'extraction approximatif aide à gérer l'enlèvement et évite les niveaux cardio-circulatoires extrêmement bas25,26,27. D'autres protocoles publiés varient en termes d'échec hémodynamique ciblé, la quantité de volume sanguin enlevé, et la période de sevrage sanguin. Le navire ponctué peut différer ainsi27,28.
NIRS permet des mesures en temps réel du CRSO2 (en). Dans plusieurs milieux cliniques, cette méthode a été utilisée pour reconnaître une altération de l'apport en oxygène cérébral : en particulier pendant la chirurgie cardiaque et vasculaire majeure, le NIRS représente un outil précieux. Les paramètres dérivés du NIRS peuvent prédire des résultats neurologiques pires et la survie du patient causées par une oxygénation insuffisante des tissus29 Ans et plus. Fait intéressant, le niveau de lactate intracérébrale diminue en corrélation avec les valeurs Du NIRS. Des études ont montré que pendant le stress oxydatif lactate peut être utilisé comme une source de pyruvate, et le niveau de lactate intracrânienne diminue10 Ans et plus. Ces résultats et mesures ne sont pas pris en compte dans cette description de modèle de base. Changements de pression artérielle moyenne qui influencent la perfusion cérébrale, PaO2 (en)Paco2 (en), ou l'hémoglobine affectent directement le CRSO dérivé du NIRS2 (en)30 Ans, états-unis (,31 Ans, états-unis (. NIRS a une valeur pronostique dans les patients souffrant de choc hémorragique et d'instabilité hémodynamique aussi bien32 Ans, états-unis (,33 Ans, états-unis (,34 Ans, états-unis (,35 Annonces,36 Annonces,37 Ans, états-unis (,38 Annonces,39 Ans et plus qu'ils. Cependant, plusieurs limitations et inconvénients doivent être notés. Les tissus extracrâniens sous les capteurs, comme la peau, les muscles et la graisse, peuvent influencer les mesures et peuvent conduire à de faux résultats négatifs. La résolution spatiale est faible, et la profondeur de pénétration est limitée32 Ans, états-unis (,33 Ans, états-unis (,34 Ans, états-unis (,40 ans, états-unis (,41 Ans, états-unis (,42 Ans, états-unis (,43 Ans, états-unis (. La méthode ne fait pas la distinction entre le sang artériel et le sang veineux ni entre la livraison d'oxygène et la demande41 Ans, états-unis (,44 Ans, en est à qui,45 Annonces. L'appareil est principalement approuvé pour l'application humaine. Les capteurs utilisés sont conçus pour les adultes humains. Il existe de plus petits capteurs pour les enfants et les nouveau-nés, mais ceux-ci n'étaient pas disponibles pour ce protocole. Chez les porcs, la technique est largement acceptée, et crSO2 (en)corrèle avec une pression partielle de l'oxygène, l'électroencéphalographie quantitative, et la saturation veineuse cérébrale d'oxygène46 Annonces,47 Annonces. Plusieurs dispositifs mesurent directement la pression partielle d'oxygène dans le tissu cérébral. À cette fin, les sondes doivent être insérées chirurgicalement dans le cerveau. Cela permet des mesures inchangées dans la région d'intérêt respective et évite les perturbations par les tissus non cérébraux environnants. Cette approche est très invasive et convient plutôt à des scénarios spéciaux comme les procédures neurochirurgicales48 Annonces,49 ans, en plus,50 Annonces,51 Annonces. L'utilisation de modèles porcins pour simuler les pathomécanismes humains est une approche très courante11 Ans, états-unis (,12 Ans, états-unis,13 (en),15 Annonces. L'avantage réside dans la comparabilité physiologique entre les deux espèces. Les expériences qui simulent des conditions cliniques potentiellement mortelles exigent une expertise fondamentale en médecine de soins intensifs et en anesthésie, mais aussi dans des caractéristiques spécifiques liées aux espèces. Cela permet d'imiter les scénarios cliniques de manière réaliste pour l'essai translationnel de nouveaux dispositifs ou régimes thérapeutiques sur le seuil de l'application clinique8 Annonces,52 Annonces. Cependant, nous devons être conscients que des conclusions directes ou immédiates concernant l'application clinique peuvent difficilement être tirées de modèles expérimentaux. Certaines différences et limitations pertinentes doivent être notées : en ce qui concerne le choc ou l'hémorragie, le système de coagulation porcine semble être plus efficace et la teneur en hémoglobine est significativement plus faible. En outre, les niveaux de plasma de lactate et de succinate diffèrent53 Annonces. Le sang porcin se compose d'un système de groupe sanguin "A0", par rapport au système humain "AB0"54 Annonces. Quelques études discutent si la splenectomy devrait être exécutée pour exclure l'occurrence de l'autotransfusion intrinsèque dans les modèles de choc porcins. D'autre part, pendant la splenectomy, le stress oxydatif, la douleur, et la stimulation sympathique se produisent, et la procédure est associée aux réactions d'autotransfusion par elle-même. Pour ces raisons, la splenectomy n'est pas recommandée55 Annonces,56 Annonces. L'utilisation d'appareils approuvés cliniquement a certaines sources systémiques d'erreur. Le système PiCCO nécessite le calcul de la surface du corps, qui diffère entre les porcs et les humains. Cela peut provoquer une erreur systémique, mais la capacité de tendance de l'appareil ne sera pas affectée. D'autres méthodes de mesure de sortie cardiaque, comme l'échocardiographie ou un cathéter artériel pulmonaire, peuvent être discutées dans ce cadre.
En conclusion, ce protocole présente un modèle de choc hémorragique normalisé initié par le retrait du sangartériel et contrôlé par la surveillance hémodynamique prolongée, aussi bien que CRSO 2. Par rapport à des modèles similaires qui se concentrent principalement sur les volumes d'élimination prédéfinis pour l'induction du choc, cette approche met en évidence une titration au moyen de l'échec résultant de la macro- et la microcirculation.
Déclarations de divulgation
Le dispositif NIRS a été fourni sans condition par Medtronic PLC, Usa, à des fins de recherche expérimentale. Alexander Ziebart, Andreas Garcia-Bardon et Erik K. Hartmann ont reçu des honoraires d'instructeur pour des cours de formation médicale de Medtronic PLC. Aucun des auteurs ne fait état de conflits d'intérêts financiers ou autres.
Remerciements
Les auteurs veulent remercier Dagmar Dirvonskis pour son excellent soutien technique.
matériels
| Name | Company | Catalog Number | Comments |
| 3-way-stopcock blue | Becton Dickinson Infusion Therapy AB Helsingborg, Sweden | 394602 | Drug administration |
| 3-way-stopcock red | Becton Dickinson Infusion Therapy AB Helsingborg, Sweden | 394605 | Drug administration/Shock induction |
| Atracurium | Hikma Pharma GmbH , Martinsried | AM03AC04* | Anesthesia |
| Canula 20 G | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 301300 | Vascular access |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | - | Hemodynamic monitor |
| Desinfection | Schülke & Mayr GmbH, Germany | 104802 | Desinfection |
| Heidelberger Verlängerung 75CM | Fresenius Kabi Deutschland GmbH | 2873112 | Drug administration/Shock induction |
| INVOS 5100C Cerebral | Medtronic PLC, USA | - | Monitore for cerebral regional oxygenation |
| INVOS Cerebral/Somatic Oximetry Adult Sensors | Medtronic PLC, USA | 20884521211152 | Monitoring of the cerebral regional oxygenation |
| Endotracheal tube | Teleflex Medical Sdn. Bhd, Malaysia | 112482 | Intubation |
| Endotracheal tube introducer | Wirutec GmbH, Sulzbach, Germany | 5033062 | Intubation |
| Engström Carestation | GE Heathcare, Madison USA | - | Ventilator |
| Fentanyl | Janssen-Cilag GmbH, Neuss | AA0014* | Anesthesia |
| Gloves | Paul Hartmann, Heidenheim, Germany | 9422131 | Self-protection |
| Incetomat-line 150 cm | Fresenius, Kabi GmbH, Bad Homburg, Germany | 9004112 | Drug administration |
| Ketamine | Hameln Pharmaceuticals GmbH, Zofingen, Schweiz | AN01AX03* | Sedation |
| Laryngoscope | Teleflex Medical Sdn. Bhd, Malaysia | 671067-000020 | Intubation |
| Logical pressure monitoring system | Smith- Medical GmbH, Minneapolis, USA | MX9606 | Hemodynamic monitor |
| Logicath 7 Fr 3-lumen 30 cm | Smith- Medical GmbH, Minneapolis, USA | MXA233x30x70-E | Vascular access/Drug administration |
| Masimo Radical 7 | Masimo Corporation, Irvine, USA | - | Hemodynamic monitor |
| Mask for ventilating dogs | Henry Schein, Melville, USA | 730-246 | Ventilation |
| Original Perfusor syringe 50 mL Luer Lock | B.Braun Melsungen AG, Melsungen, Germany | 8728810F | Drug administration |
| PICCO Thermodilution. F5/20CM EW | MAQUET Cardiovascular GmbH, Rastatt, Germany | PV2015L20-A | Hemodynamic monitor |
| Percutaneous sheath introducer set 8,5 und 9 Fr, 10 cm with integral haemostasis valve/sideport | Arrow international inc., Reading, USA | AK-07903 | Vascular access/Shock induction |
| Perfusor FM Braun | B.Braun Melsungen AG, Melsungen, Germany | 8713820 | Drug administration |
| Potassium chloride | Fresenius, Kabi GmbH, Bad Homburg, Germany | 6178549 | Euthanasia |
| Propofol 2% | Fresenius, Kabi GmbH, Bad Homburg, Germany | AN01AX10* | Anesthesia |
| Pulse Contour Cardiac Output (PiCCO2) | Pulsion Medical Systems, Feldkirchen, Germany | - | Hemodynamic monitor |
| Sonosite Micromaxx Ultrasoundsystem | Fujifilm, Sonosite Bothell, Bothell, USA | - | Vascular access |
| Stainless Macintosh Size 4 | Teleflex Medical Sdn. Bhd, Perak, Malaysia | 670000 | Intubation |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | AB05BB01* | balanced electrolyte infusion |
| Stresnil 40 mg/mL | Lilly Germany GmbH, Wiesbaden, Germany | QN05AD90 | Sedation |
| Syringe 10 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 309110 | Drug administration |
| Syringe 2 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 300928 | Drug administration |
| Syringe 20 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 300296 | Drug administration |
| Syringe 5 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 309050 | Drug administration |
| Venous catheter 22 G | B.Braun Melsungen AG, Melsungen, Germany | 4269110S-01 | Vascular access |
| *ATC: Anatomical Therapeutic Chemical / Defined Daily Dose Classification |
Références
- Kutcher, M. E., et al. A paradigm shift in trauma resuscitation: evaluation of evolving massive transfusion practices. JAMA Surgery. 148 (9), 834-840 (2013).
- Allen, B. S., Ko, Y., Buckberg, G. D., Sakhai, S., Tan, Z. Studies of isolated global brain ischaemia: I. A new large animal model of global brain ischaemia and its baseline perfusion studies. European Journal of Cardio-Thoracic Surgery. 41 (5), 1138-1146 (2012).
- Noll, E., et al. Comparative analysis of resuscitation using human serum albumin and crystalloids or 130/0.4 hydroxyethyl starch and crystalloids on skeletal muscle metabolic profile during experimental haemorrhagic shock in swine: A randomised experimental study. European Journal of Anaesthesiology. 34 (2), 89-97 (2017).
- Tisherman, S. A., Stein, D. M. ICU Management of Trauma Patients. Critical Care Medicine. , (2018).
- Nielsen, T. K., Hvas, C. L., Dobson, G. P., Tonnesen, E., Granfeldt, A. Pulmonary function after hemorrhagic shock and resuscitation in a porcine model. Acta Anaesthesiologica Scandinavica. 58 (8), 1015-1024 (2014).
- Bogert, J. N., Harvin, J. A., Cotton, B. A. Damage Control Resuscitation. Journal of Intensive Care Medicine. 31 (3), 177-186 (2016).
- Gruartmoner, G., Mesquida, J., Ince, C. Fluid therapy and the hypovolemic microcirculation. Current Opinion in Critical Care. 21 (4), 276-284 (2015).
- Ziebart, A., et al. Effect of gelatin-polysuccinat on cerebral oxygenation and microcirculation in a porcine haemorrhagic shock model. Scandinavian Journal Trauma Resuscitation Emergency Medicin. 26 (1), 15 (2018).
- Bassols, A., et al. The pig as an animal model for human pathologies: A proteomics perspective. Proteomics Clinical Applications. 8 (9-10), 715-731 (2014).
- Alosh, H., Ramirez, A., Mink, R. The correlation between brain near-infrared spectroscopy and cerebral blood flow in piglets with intracranial hypertension. Journal of Applied Physiology. 121 (1985), 255-260 (2016).
- Hartmann, E. K., et al. Ventilation/perfusion ratios measured by multiple inert gas elimination during experimental cardiopulmonary resuscitation. Acta Anaesthesiologica Scandinavica. 58 (8), 1032-1039 (2014).
- Hartmann, E. K., Duenges, B., Baumgardner, J. E., Markstaller, K., David, M. Correlation of thermodilution-derived extravascular lung water and ventilation/perfusion-compartments in a porcine model. Intensive Care Medicine. 39 (7), 1313-1317 (2013).
- Hartmann, E. K., et al. An inhaled tumor necrosis factor-alpha-derived TIP peptide improves the pulmonary function in experimental lung injury. Acta Anaesthesiologica Scandinavica. 57 (3), 334-341 (2013).
- Ortiz, A. L., et al. The influence of Ringer's lactate or HES 130/0.4 administration on the integrity of the small intestinal mucosa in a pig hemorrhagic shock model under general anesthesia. Journal of the Veterinary Emergency and Critical. 27 (1), 96-107 (2017).
- Ziebart, A., et al. Low tidal volume pressure support versus controlled ventilation in early experimental sepsis in pigs. Respiratory Research. 15, 101 (2014).
- Hoffman, G. M., et al. Postoperative Cerebral and Somatic Near-Infrared Spectroscopy Saturations and Outcome in Hypoplastic Left Heart Syndrome. The Annals of Thoracic Surgery. 103 (5), 1527-1535 (2017).
- Hickok, R. L., Spaeder, M. C., Berger, J. T., Schuette, J. J., Klugman, D. Postoperative Abdominal NIRS Values Predict Low Cardiac Output Syndrome in Neonates. World Journal for Pediatric and Congenital Heart Surgery. 7 (2), 180-184 (2016).
- Weiner, M. M., Geldard, P., Mittnacht, A. J. Ultrasound-guided vascular access: a comprehensive review. Journal of Cardiothoracic and Vascular Anesthesia. 27 (2), 345-360 (2013).
- Kumar, A., Chuan, A. Ultrasound guided vascular access: efficacy and safety. Best Practice & Research: Clinical Anaesthesiology. 23 (3), 299-311 (2009).
- Lamperti, M., et al. International evidence-based recommendations on ultrasound-guided vascular access. Intensive Care Medicine. 38 (7), 1105-1117 (2012).
- Mayer, J., Suttner, S. Cardiac output derived from arterial pressure waveform. Current Opinion in Anesthesiology. 22 (6), 804-808 (2009).
- Medtronic. . Operations Manual INVOS ® System, Model 5100C. , (2013).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-a computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Tuna Katircibasi, M., Gunes, H., Cagri Aykan, A., Aksu, E., Ozgul, S. Comparison of Ultrasound Guidance and Conventional Method for Common Femoral Artery Cannulation: A Prospective Study of 939 Patients. Acta Cardiologica Sinica. 34 (5), 394-398 (2018).
- Teeter, W. A., et al. Feasibility of basic transesophageal echocardiography in hemorrhagic shock: potential applications during resuscitative endovascular balloon occlusion of the aorta (REBOA). Cardiovascular Ultrasound. 16 (1), 12 (2018).
- Kontouli, Z., et al. Resuscitation with centhaquin and 6% hydroxyethyl starch 130/0.4 improves survival in a swine model of hemorrhagic shock: a randomized experimental study. European Journal of Trauma and Emergency Surgery. , (2018).
- Nikolian, V. C., et al. Improvement of Blood-Brain Barrier Integrity in Traumatic Brain Injury and Hemorrhagic Shock Following Treatment With Valproic Acid and Fresh Frozen Plasma. Critical Care Medicine. 46 (1), e59-e66 (2018).
- Williams, T. K., et al. Endovascular variable aortic control (EVAC) versus resuscitative endovascular balloon occlusion of the aorta (REBOA) in a swine model of hemorrhage and ischemia reperfusion injury. The Journal of Trauma and Acute Care Surgery. 85 (3), 519-526 (2018).
- Aly, S. A., et al. Cerebral tissue oxygenation index and lactate at 24 hours postoperative predict survival and neurodevelopmental outcome after neonatal cardiac surgery. Congenital Heart Disease. 12 (2), 188-195 (2017).
- Sorensen, H. Near infrared spectroscopy evaluated cerebral oxygenation during anesthesia. The Danish Medical Journal. 63 (12), (2016).
- Cem, A., et al. Efficacy of near-infrared spectrometry for monitoring the cerebral effects of severe dilutional anemia. Heart Surgery Forum. 17 (3), E154-E159 (2014).
- Edmonds, H. L., Ganzel, B. L., Austin, E. H. Cerebral oximetry for cardiac and vascular surgery. Seminars in Cardiothoracic and Vascular Anesthesia. 8 (2), 147-166 (2004).
- Murkin, J. M., et al. Monitoring brain oxygen saturation during coronary bypass surgery: a randomized, prospective study. Anesthesia & Analgesia. 104 (1), 51-58 (2007).
- Hong, S. W., et al. Prediction of cognitive dysfunction and patients' outcome following valvular heart surgery and the role of cerebral oximetry. European Journal of Cardio-Thoracic Surgery. 33 (4), 560-565 (2008).
- Al Tayar, A., Abouelela, A., Mohiuddeen, K. Can the cerebral regional oxygen saturation be a perfusion parameter in shock?. Journal of Critical Care. 38, 164-167 (2017).
- Torella, F., Cowley, R. D., Thorniley, M. S., McCollum, C. N. Regional tissue oxygenation during hemorrhage: can near infrared spectroscopy be used to monitor blood loss?. Shock. 18 (5), 440-444 (2002).
- Yao, F. S., Tseng, C. C., Ho, C. Y., Levin, S. K., Illner, P. Cerebral oxygen desaturation is associated with early postoperative neuropsychological dysfunction in patients undergoing cardiac surgery. Journal of Cardiothoracic and Vascular Anesthesia. 18 (5), 552-558 (2004).
- Slater, J. P., et al. Cerebral oxygen desaturation predicts cognitive decline and longer hospital stay after cardiac surgery. The Annals of Thoracic Surgery. 87 (1), 36-44 (2009).
- Brodt, J., Vladinov, G., Castillo-Pedraza, C., Cooper, L., Maratea, E. Changes in cerebral oxygen saturation during transcatheter aortic valve replacement. Journal of Clinical Monitoring and Computing. 30 (5), 649-653 (2016).
- Yoshimura, A., et al. Altered cortical brain activity in end stage liver disease assessed by multi-channel near-infrared spectroscopy: Associations with delirium. Scintific Reports. 7 (1), 9258 (2017).
- Douds, M. T., Straub, E. J., Kent, A. C., Bistrick, C. H., Sistino, J. J. A systematic review of cerebral oxygenation-monitoring devices in cardiac surgery. Perfusion. 29 (6), 545-552 (2014).
- Forman, E., et al. Noninvasive continuous cardiac output and cerebral perfusion monitoring in term infants with neonatal encephalopathy: assessment of feasibility and reliability. Pediatric Research. 82 (5), 789-795 (2017).
- Tweddell, J. S., Ghanayem, N. S., Hoffman, G. M. Pro: NIRS is " standard of care " for postoperative management. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual. 13 (1), 44-50 (2010).
- Lewis, C., Parulkar, S. D., Bebawy, J., Sherwani, S., Hogue, C. W. Cerebral Neuromonitoring During Cardiac Surgery: A Critical Appraisal With an Emphasis on Near-Infrared Spectroscopy. Journal of Cardiothoracic and Vascular Anesthesia. 32 (5), 2313-2322 (2018).
- Thudium, M., Heinze, I., Ellerkmann, R. K., Hilbert, T. Cerebral Function and Perfusion during Cardiopulmonary Bypass: A Plea for a Multimodal Monitoring Approach. Heart Surgery Forum. 2 (1), E028-E035 (2018).
- Putzer, G., et al. Monitoring of brain oxygenation during hypothermic CPR - A prospective porcine study. Resuscitation. 104, 1-5 (2016).
- Weenink, R. P., et al. Detection of cerebral arterial gas embolism using regional cerebral oxygen saturation, quantitative electroencephalography, and brain oxygen tension in the swine. Journal of Neuroscience Methods. 228, 79-85 (2014).
- Mader, M. M., et al. Evaluation of a New Multiparameter Brain Probe for Simultaneous Measurement of Brain Tissue Oxygenation, Cerebral Blood Flow, Intracranial Pressure, and Brain Temperature in a Porcine Model. Neurocritical Care. , (2018).
- Mikkelsen, M. L. G., et al. The influence of norepinephrine and phenylephrine on cerebral perfusion and oxygenation during propofol-remifentanil and propofol-remifentanil-dexmedetomidine anaesthesia in piglets. Acta Veterinaria Scandinavica. 60 (1), 8 (2018).
- Nelskyla, A., et al. The effect of 50% compared to 100% inspired oxygen fraction on brain oxygenation and post cardiac arrest mitochondrial function in experimental cardiac arrest. Resuscitation. 116, 1-7 (2017).
- Klein, K. U., et al. Intraoperative monitoring of cerebral microcirculation and oxygenation--a feasibility study using a novel photo-spectrometric laser-Doppler flowmetry. European Journal of Trauma and Emergency Surgery. 22 (1), 38-45 (2010).
- Ziebart, A., et al. Pulmonary effects of expiratory-assisted small-lumen ventilation during upper airway obstruction in pigs. Anaesthesia. 70 (10), 1171-1179 (2015).
- Reisz, J. A., et al. All animals are equal but some animals are more equal than others: Plasma lactate and succinate in hemorrhagic shock-A comparison in rodents, swine, nonhuman primates, and injured patients. The Journal of Trauma and Acute. 84 (3), 537-541 (2018).
- Smith, D. M., Newhouse, M., Naziruddin, B., Kresie, L. Blood groups and transfusions in pigs. Xenotransplantation. 13 (3), 186-194 (2006).
- Boysen, S. R., Caulkett, N. A., Brookfield, C. E., Warren, A., Pang, J. M. Splenectomy Versus Sham Splenectomy in a Swine Model of Controlled Hemorrhagic. Shock. 46 (4), 439-446 (2016).
- Wade, C. E., Hannon, J. P. Confounding factors in the hemorrhage of conscious swine: a retrospective study of physical restraint, splenectomy, and hyperthermia. Circulatory Shock. 24 (3), 175-182 (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon