Method Article
Inducción de choque hemorrágico estandarizada guiada por oximetría cerebral y monitoreo hemodinámico extendido en cerdos
En este artículo
Resumen
El shock hemorrágico es una complicación grave en pacientes gravemente heridos, lo que conduce a un suboferta de oxígeno potencialmente mortal. Presentamos un método estandarizado para inducir shock hemorrágico a través de la extracción de sangre en cerdos que se guía por la hemodinámica y la oxigenación cerebral microcirculatoria.
Resumen
El shock hemorrágico se encuentra entre las principales razones de la muerte grave relacionada con lesiones. La pérdida de volumen circulatorio y portadores de oxígeno puede conducir a un suministro insuficiente de oxígeno y una falla irreversible de los órganos. El cerebro ejerce sólo capacidades de compensación limitadas y está particularmente en alto riesgo de daño hipoxico grave. Este artículo demuestra la inducción reproducible de shock hemorrágico potencialmente mortal en un modelo porcino por medio de la abstinencia de sangre calculada. Valoramos la inducción de choque guiados por espectroscopia de infrarrojo cercano y monitoreo hemodinámico extendido para mostrar falla scirculatoria sistémica, así como agotamiento cerebral de oxígeno microcirculatorio. En comparación con modelos similares que se centran principalmente en volúmenes de eliminación predefinidos para la inducción por choque, este enfoque destaca una valoración por medio de la falla resultante de la macro y la microcirculación.
Introducción
La pérdida masiva de sangre es una de las principales causas de muertes relacionadas con lesiones1,2,3. La pérdida de líquido circulatorio y portadores de oxígeno conduce a insuficiencia hemodinámica y suboferta grave de oxígeno y puede causar insuficiencia orgánica irreversible y la muerte. El nivel de gravedad del shock está influenciado por factores adicionales como la hipotermia, la coagulopatía y la acidosis4. Particularmente el cerebro, pero también los riñones carecen de capacidad de compensación debido a la alta demanda de oxígeno y la incapacidad de la generación de energía anaeróbica adecuada5,6. Con fines terapéuticos, la acción rápida e inmediata es fundamental. En la práctica clínica, la reanimación de líquidos con una solución electrolito equilibrada es la primera opción para el tratamiento, seguida de la administración de concentrados de glóbulos rojos y plasma fresco congelado. Los concentrados de trombocitos, las catecolaminas y la optimización de la coagulación y el estado ácido-base apoyan la terapia para recuperar las condiciones fisiológicas normales después de un trauma sostenido. Este concepto se centra en la restauración de la hemodinámica y la macrocirculación. Varios estudios, sin embargo, muestran que la perfusión microcirculatoria no se recupera simultáneamente con la macrocirculación. Especialmente, la perfusión cerebral sigue deteriorada y el suministro de oxígeno adicional puede ocurrir7,8.
El uso de modelos animales permite a los científicos establecer estrategias novedosas o experimentales. La anatomía, la homología y la fisiología comparables de los cerdos y los seres humanos permiten conclusiones sobre factores patológicos específicos. Ambas especies tienen un sistema metabólico similar y respuesta a los tratamientos farmacológicos. Esta es una gran ventaja en comparación con los modelos animales pequeños donde las diferencias enel volumen sanguíneo, la hemodinámica y la fisiología general hacen que sea casi imposible imitar un escenario clínico 9. Además, los equipos médicos y consumibles autorizados se pueden utilizar fácilmente en modelos porcinos. Además, es fácilmente posible obtener cerdos de proveedores comerciales, lo que permite una alta diversidad de genéticas y fenotipos y es un coste reduciendo10. El modelo de extracción de sangre a través de la cannulación de los vasos es bastante común11,12,13,14,15.
En este estudio, ampliamos el concepto de inducción de choque hemorrágico a través de la abstinencia arterial de sangre con una valoración exacta de la insuficiencia hemodinámica y deterioro de la oxigenación cerebral. El shock hemorrágico se logra si el índice cardíaco y la presión arterial media caen por debajo del 40% del valor basal, lo que ha demostrado causar un deterioro considerable de la saturación de oxigenación regional cerebral8. La medición de la salida cardíaca de contorno de pulso (PiCCO) se utiliza para la monitorización hemodinámica continua. En primer lugar, el sistema debe calibrarse mediante termodilución transpulmonar, lo que permite calcular el índice cardíaco del contenido de agua pulmonar extravascular y el volumen diastólico final global. Posteriormente, el índice cardíaco continuo se calcula mediante el análisis del contorno del pulso y también proporciona parámetros dinámicos de precarga como la presión del pulso y la variación del volumen de la carrera.
Esta técnica está bien establecida en entornos clínicos y experimentales. La espectroscopia de infrarrojo cercano (NIRS) es un método establecido clínica y experimentalmente para monitorear los cambios en el suministro de oxígeno cerebral en tiempo real. Los sensores autoadherentes están unidos a la frente izquierda y derecha y calculan la oxigenación cerebral de forma no invasiva en la corteza frontal cerebral. Dos longitudes de onda de luz infrarroja (700 y 900 nm) son emitidas y detectadas por los sensores después de ser reflejadas desde el tejido de la corteza. Para evaluar el contenido de oxígeno cerebral, las contribuciones de la sangre arterial y venosa se calculan en relaciones 1:3 y se actualizan en intervalos de 5 s. La sensibilidad en profundidad de 1-4 cm es exponencial decreciente e influenciada por el tejido penetrado (por ejemplo, piel y hueso), aunque el cráneo es translúcido a luz infrarroja. La técnica facilita acciones terapéuticas rápidas para evitar que los pacientes desenlaces adversos como delirio o lesión cerebral hipoxica y sirve como parámetro objetivo en caso de deterioro de la salida cardíaca16,17. La combinación de ambas técnicas durante el choque experimental permite una valoración exacta de la macrocirculación, así como deterioro microcirculatorio cerebral, para estudiar este evento potencialmente mortal.
Protocolo
Los experimentos de este protocolo fueron aprobados por el Comité Estatal e Institucional de Cuidado de Animales (Landesuntersuchungsamt Rheinland-Pfalz, Coblenza, Alemania; Presidenta: Dra. Silvia Eisch-Wolf; número de referencia: 23 177-07/G 14-1-084; 02.02.2015). Los experimentos se llevaron a cabo de acuerdo con las directrices de Informes de Investigación Animal de Experimentos In Vivo (ARRIVE). El estudio se planeó y realizó entre noviembre de 2015 y marzo de 2016. Después de una extensa investigación de la literatura, el modelo de cerdo fue elegido como un modelo bien establecido para el shock hemorrágico. Siete cerdos macho anestesiados (Sus scrofa domestica) con un peso medio de 28 x 2 kg y una edad de 2-3 meses fueron incluidos en el protocolo. Los animales fueron atendidos por un criador local que fue recomendado por el Comité Estatal e Institucional de Cuidado de Animales. Los animales fueron mantenidos en su entorno conocido el mayor tiempo posible para minimizar el estrés. A los alimentos, pero no al agua se le negaron 6 horas antes de que se programara el experimento, para reducir el riesgo de aspiración. El curso de tiempo representativo se muestra en la Figura1.
1. Anestesia, intubación y ventilación mecánica
- Cerdos sedados con una inyección combinada de ketamina (4 mg-kg-1) y azaperona (8 mg-kg-1) en el cuello o el músculo glúteo con una aguja para inyección intramuscular (1,2 mm). Asegúrese de que los animales permanezcan estables hasta que la sedación se ponga en.
PRECAUCION: Los guantes son absolutamente necesarios al manipular animales. - Transportar a los animales sedados al laboratorio.
NOTA: Los animales se duermen profundamente y no despiertan durante el manejo normal, como cuando son levantados en la jaula de transporte. En este entorno, el tiempo de transporte era de unos 20 minutos con una furgoneta especial para el transporte de animales. - Supervise la saturación periférica de oxígeno (SpO2) con un sensor recortado a la cola o la oreja del cerdo directamente después de la llegada.
- Desinfectar la piel con una tintura de desinfección incolora y esperar 3 minutos antes de insertar un catéter de vena periférica (1,2 mm) en una vena del oído. A continuación, inducir la anestesia mediante una inyección intravenosa de fentanilo (4 kg-1) y propofol (3 mg-kg-1).
- Cuando todos los reflejos estén ausentes y la respiración espontánea expire, coloque a los cerdos en posición supina en una camilla y arréglalos con vendas.
NOTA: Los niveles adecuados de anestesia deben ser confirmados por un investigador experimentado por la ausencia de un reflejo del párpado y otras reacciones a los estímulos externos. - Inicie inmediatamente la ventilación no invasiva con una máscara de ventilación para perros (tamaño 2). Utilice los siguientes parámetros de ventilación: fracción inspiratoria de oxígeno (FiO2) a 1,0; frecuencia respiratoria á 14-16 min-1; Presión inspiratoria máxima <20 cm H2O, presión positiva de expiración final (PEEP) a 5 cm H2O.
- Mantener la anestesia a través de una perfusión continua de fentanilo(0,1-0,2 kg-1o 1 ) y propofol (8-12 mg-kg-1-h-1) e iniciar una perfusión de solución de electrolito equilibrada (5 mL-kg-1o 1 -1 ).
- Facilitar la intubación endotraqueal mediante la aplicación de un relajante muscular (atracurium 0,5 mg-kg-1).
- Asegure las vías respiratorias a través de la intubación con un tubo endotraqueal común (ID 6-7) y un introductor. Utilice un laringoscopio común con una hoja Macintosh (tamaño 4). Dos personas facilitan el procedimiento.
- Persona 1: Fije la lengua afuera con un pedazo de tejido y abra el hocico con la otra mano.
- Persona 2: Realizar una laringoscopia.
- Persona 2: Cuando la epiglotis entre en la vista, mueva el laringoscopio ventralmente. Levante la epiglotis y asegúrese de que las cuerdas vocales estén visibles.
NOTA: Si la epiglotis no se mueve dorsalmente, se adhiere a la palatina suave y se puede movilizar por la punta del tubo. Alternativamente, se puede utilizar una cuchilla con otro tamaño (3 o 5) o tipo (hoja de Miller).
- Mueva el tubo con cuidado a través de las cuerdas vocales.
NOTA: El punto más estrecho de la tráquea no está en el nivel de las cuerdas vocales, sino subglottípico. Si la inserción del tubo no es posible, intente girar el tubo o utilice un tubo más pequeño. - Tire del introductor del tubo, utilice una jeringa de 10 ml para bloquear el manguito con 10 ml de aire y controle la presión del manguito con un administrador del manguito (30 cm H2O).
- Inicie la ventilación mecánica después de que el tubo esté conectado a un respirador (PEEP a 5 cm H2O; volumen de marea a 8 ml-kg-1; FiO2 a 0,4; relación entre la inspiración y la expiración: 1:2; frecuencia respiratoria: variable para lograr un CO2 de marea final de <6 kPa).
NOTA: Evite la fluctuación delCO2 para minimizar los efectos respiratorios en la perfusión cerebral. - Asegúrese de que la posición del tubo sea correcta mediante la exhalación regular y periódica de CO2 a través de la capnografía, y compruebe la ventilación de doble cara a través de la auscultación.
NOTA: Si el tubo se coloca incorrectamente, la inflación del aire en el estómago forma rápidamente una protuberancia visible en la pared abdominal, incluso antes de que se instale la capnografía. En este caso, la sustitución del tubo y la inserción de un tubo gástrico son absolutamente necesarias. - Con dos personas, coloque una sonda gástrica en el estómago para evitar el reflujo y los vómitos.
- Persona 1: Fije la lengua afuera con un pedazo de tejido y abra el hocico con la otra mano.
- Persona 2: Realizar una laringoscopia de la laringe porcina.
- Persona 2: Visualice el esófago.
- Persona 2: Empuje el tubo gástrico dentro del esófago con un par de fórceps de Magill hasta que se drene el líquido gástrico.
NOTA: A veces, la visualización no es fácil. En este caso, mueva el laringoscopio dorsalmente al tubo y empújelo ventralmente para abrir el esófago. Durante el procedimiento, el cuerpo animal está cubierto con mantas para evitar la hipotermia. Si la temperatura corporal del animal disminuye, utilice un sistema de calentamiento para estabilizar la temperatura a nivel fisiológico (ver la Tabla de Materiales). La temperatura corporal se muestra en la pantalla del PiCCO.
2. Instrumentación
- Utilice vendas para tirar hacia atrás de las patas traseras para suavizar los pliegues en el área femoral para el cateterismo de los vasos.
- Prepare los siguientes materiales: una jeringa de 5 ml, una jeringa de 10 ml, una jeringa de 50 ml, una aguja Seldinger, vainas de introducción (2 mm, 2,7 mm, 2,7 mm), cables guía para las vainas, un catéter venoso central con tres puertos (2,3 mm, 30 cm) con alambre guía y un PiCCO catéter (1,67 mm, 20 cm).
- Desinfectar el área inguinal con desinfección de color, esperar 2 minutos, y limpiar la desinfección con un tejido estéril. Repita este procedimiento 3x. Después de la tercera vez, no retire la desinfección.
- Llene todos los catéteres con soluciones salinas.
- Aplique gel de ultrasonido a la sonda de ultrasonido. Cubra el área inguinal con una cortina fenestrada estéril y escanee los vasos femorales derecho con ultrasonido. Utilice la técnica Doppler para distinguir entre la arteria y la vena18.
- La sangre brillante y roja que palpita confirma la posición de la aguja aspirada. Desconecte la jeringa e inserte el alambre guía en la arteria femoral derecha.
- Visualice el eje longitudinal de la vena femoral derecha e inserte la aguja Seldinger bajo aspiración permanente con la jeringa de 5 ml.
- Aspirar sangre venosa no pulsante de color rojo oscuro.
- Visualice la arteria femoral derecha axialmente y cambie a una vista longitudinal de la arteria girando la sonda 90o.
-
Perfore la arteria femoral derecha bajo visualización por ultrasonido con la aguja Seldinger bajo aspiración permanente con la jeringa de 5 ml.
NOTA: La técnica Seldinger guiada por ultrasonido se asocia con una pérdida de sangre significativamente menor, traumatismos tisulares y consumo de tiempo que otros métodos de acceso vascular19,20.- Si no se puede establecer la posición correcta de la aguja en los diferentes vasos, tome las sondas de sangre y analice el contenido de gas sanguíneo con un analizador de gas sanguíneo (ver la Tabla de Materiales). Un nivel alto de oxígeno es un buen signo de sangre arterial, y un nivel bajo de oxígeno es un signo de sangre venosa.
- Inserte el cable guía para el catéter venoso central en la vena femoral derecha después de desconectar la jeringa y retraer la aguja Seldinger.
- Visualice ambos vasos derecho con ultrasonido para controlar la posición correcta del cable.
- Empuje la vaina del introductor arterial (2 mm) sobre el alambre guía en la arteria derecha y asegure la posición con la aspiración de sangre.
- Utilice la técnica Seldinger para colocar la línea venosa central en la vena femoral derecha. Aspirar todos los puertos y lavarlos con solución salina.
- Realice el mismo procedimiento en el lado inguinal izquierdo para insertar las otras vainas del introductor en la técnica Seldinger en la arteria femoral izquierda (2,7 mm) y la vena femoral (2,7 mm).
- Conecte la vaina del introductor arterial derecha y el catéter venoso central con dos sistemas de transductores para la medición de la hemodinámica invasiva, y coloque ambos transductores en el nivel del corazón para obtener valores adecuados.
- Cambie los tres topes de ambos transductores abiertos a la atmósfera para calibrar los sistemas a 0 según lo prescrito en las instrucciones de operación.
NOTA: Es absolutamente necesario evitar cualquier burbuja de aire y manchas de sangre en los sistemas para generar valores plausibles. - Cambie todas las perfusiones para mantener la anestesia desde la vena periférica hasta la línea venosa central.
- Tome los valores basales (hemodinámica, espirometría, NIRS (ver sección 4) y PiCCO (ver sección 3) después de 15 minutos de recuperación.
- Iniciar shock hemorrágico (ver sección 5).
3. Medición PiCCO
NOTA: Para el equipo PiCCO, véase la Tabla de Materiales.
- Inserte el catéter PiCCO en la funda del introductor arterial derecho.
NOTA: En la medicina clínica, los catéteres PiCCO se colocan directamente mediante la técnica Seldinger. Sin embargo, la colocación a través de una funda de introducción también es factible. - Conecte el catéter con el cable arterial del sistema PiCCO y el transductor arterial directamente con el puerto PiCCO. A continuación, vuelva a calibrar como se describe en el paso 2.17.
- Conecte la unidad de medición venosa del sistema PiCCO con la funda del introductor de venosa izquierda.
NOTA: Es necesario conectar las sondas venosas y arteriales a cierta distancia entre sí. De lo contrario, la medición se verá perturbada, ya que la aplicación de solución salina fría en el sistema venoso influirá en la medición arterial. Para más detalles sobre PiCCO, véase Mayer y Suttner21. - Encienda el sistema PiCCO y confirme que se mide un nuevo paciente.
- Introduzca el tamaño y el peso del animal y cambie la categoría a adultos.
- Introduzca el nombre y el ID del protocolo y escriba Exit.
- Ajuste el volumen de inyección a 10 ml.
NOTA: El volumen de la solución de inyección elegida puede variar. Un volumen más alto hace que los valores medidos sean más válidos. Elija un pequeño volumen para evitar cualquier efecto de hemodilución a través de la aplicación repetitiva. - Introduzca la presión venosa central.
- Abra la llave de tres vías a la atmósfera, haga clic en Cero para la calibración del sistema y haga clic en Salir.
- Calibre la medición de la salida cardíaca continua como se describe a continuación y haga clic en TD (Thermodilution). Preparar la solución salina fisiológica con una temperatura de 4 oC en una jeringa de 10 ml y hacer clic en Iniciar.
- Inyectar 10 ml de la solución salina fría rápida y constantemente en la unidad de medición venosa y esperar hasta que se complete la medición y el sistema solicite una repetición.
- Repita este procedimiento hasta que se completen tres mediciones.
- Deje que el sistema calcule la media de todos los parámetros y haga clic en Salir.
- Después de la calibración completa, inicie inmediatamente la medición. Para controlar la inducción de choque, concéntrese en el índice cardíaco del parámetro derivado de PiCCO.
4. Saturación de Oxigenación Regional Cerebral
NOTA: Para el equipo para monitorear la oxigenación regional cerebral, véase la Tabla de Materiales.
- Afeitar la frente del cerdo con una maquinilla de afeitar desechable y agua y pegar dos sensores autoadherentes (ver la Tabla de Materiales)para NIRS a la frente del cerdo.
- Conecte el preamplificador al monitor y conecte los conectores del cable del sensor codificados por colores al preamplificador.
- Cierre el mecanismo de bloqueo del preamplificador y conecte los sensores a los cables del sensor.
NOTA: Para grabar datos en tiempo real, una unidad flash USB tiene que estar conectada al monitor NIRS. - Encienda el monitor, haga clic en Nuevopaciente, introduzca el nombre del estudio y haga clic en Hecho.
- Compruebe la señal entrante. Cuando la señal sea estable, haga clic en Menú de línea base y haga clic en Establecer líneas base. Si la línea base ya se ha introducido, confirme la nueva línea base haciendo clic en Sí y haga clic en Marca de evento.
- Elija el evento con los botones de flecha en el teclado y con Next Event; seleccione el evento 3 Inducción y pulse Seleccionar evento.
NOTA: Si es necesario obtener más información, consulte el manual de instrucciones del sistema NIRS22.
5. Inducción de shock hemorrágico
- Conecte la funda del introductor izquierdo con un tope de parada de camino en el árbol. Conecte un puerto de la caja de tres vías con una jeringa de 50 ml y otro con un frasco de perfusión vacío.
NOTA: Alternativamente, la sangre retirada puede ser recogida en bolsas de bolsa para autotransfusión posterior. Esta es una ventaja importante de la abstinencia de sangre controlada. - Mida y documente los parámetros hemodinámicos exactos y calcule el 40% del índice cardíaco y la presión arterial media como dianas hemodinámicas. Establezca el evento 93 Blood Loss en el sistema NIRS como se describe en el paso 4.6.
NOTA: El shock hemorrágico se logra si el índice cardíaco y la presión arterial media caen por debajo del 40% del valor basal. Es preferible una considerable saturación de oxigenación regional cerebral (crSO2) del 20% para representar el deterioro microcirculatorio. La pérdida media de sangre para lograr esto se encuentra dentro de un rango de 25-35 mL-kg-1. - Aspira 50 ml de sangre en la jeringa y cambia el tapón de tres vías. Empuje la sangre en la botella vacía.
- Tenga en cuenta el volumen sanguíneo eliminado.
- Controle de cerca la presión arterial, el índice cardíaco y el crSO 2. Repita la abstinencia sanguínea hasta que se alcance la presión arterial objetivo y el índice cardíaco (después de 20-30 min).
- Establezca el evento 97 Hipotensión en el dispositivo NIRS como se describe en el paso 4.6.
NOTA: No retire la sangre demasiado rápido, porque esto conlleva el riesgo de insuficiencia cardiocirculatoria inmediata. Después de terminar el procedimiento de inducción de choque, los animales se pueden utilizar para diversas intervenciones terapéuticas.
6. Fin del experimento y la eutanasia
- Inyectar 0,5 mg de fentanilo en la línea venosa central y esperar 5 min.
- Inyectar 200 mg de propofol en la línea venosa central y eutanasia al animal con 40 mmol de cloruro de potasio.
Resultados
Después de iniciar la inducción del choque, se puede registrar un corto período de compensación. Con la extracción de sangre en curso, la mencionada descompensación cardiocirculatoria, monitoreada por una disminución significativa de crSO2,el índice cardíaco, el índice de volumen sanguíneo intratorácico y el índice global de volumen diastólico final (Figura2 , se produce la Figura 3y la Figura 4. Además, se observan taquicardia significativa y una disminución de la presión arterial como manifestaciones comunes de shock hemorrágico (Figura2). La variación del volumen del trazo aumenta significativamente (Figura3). El contenido de agua pulmonar extravascular y la resistencia vascular sistémica generalmente no se ven afectados (Figura3). Después de finalizar la abstinencia de sangre (28 x 2 ml de kg-1), los valores hemodinámicos permanecen en un nivel críticamente bajo. Paralelamente, crSO2 también cae significativamente. Estos sensores no se inician regularmente en el mismo nivel, pero el desplegable porcentual es comparable. La Figura 4 muestra una grabación representativa de un animal. El contenido de hemoglobina y el hematocrito no disminuyen directamente en el proceso, pero los niveles de lactato aumentan y la saturación venosa central disminuye (Figura5).

Figura 1: Gráfico experimental de flow. La línea de base se establece después de la preparación y una estabilización de 30 minutos. El shock se induce durante 30 minutos. Parámetros de salida cardíaca del contorno del pulso y oxigenación regional cerebral se miden durante todo el experimento. Los tiempos de medición se denominan Preparación, Línea de basey Choque.
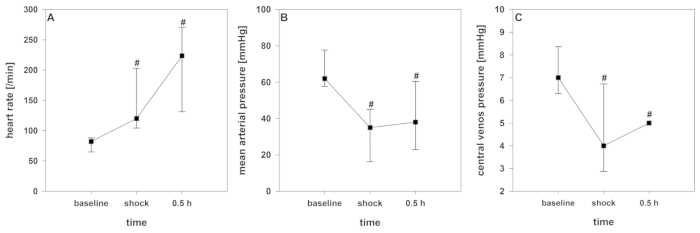
Figura 2 : Desarrollo de la hemodinámica durante el shock hemorrágico. Los efectos a lo largo del tiempo son analizados por ANOVA y el método post hoc Student-Newman-Keuls. # p < 0.05 a la línea de base. Los datos se presentan como media y desviación estándar. (A) Frecuencia cardíaca (B) la presión arterial media, y (C) la presión venosa central se ven considerablemente influenciado en este modelo. Haga clic aquí para ver una versión más grande de esta figura.
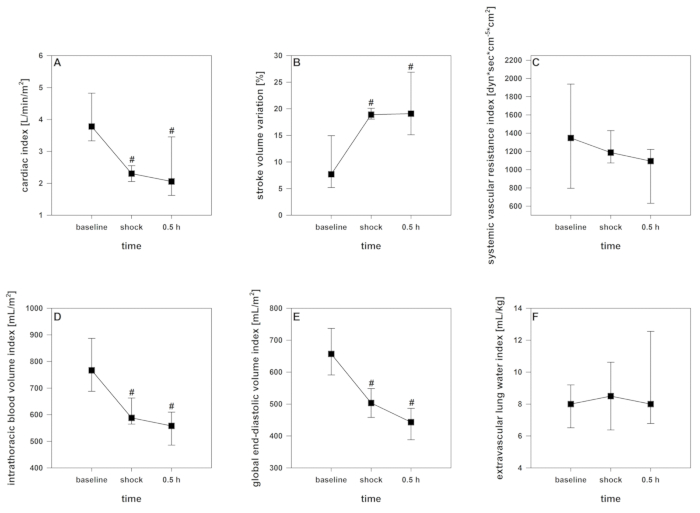
Figura 3 : Desarrollo de la salida cardiaca del contorno del pulso y parámetros derivados de la termodilución durante el shock hemorrágico. Los efectos a lo largo del tiempo son analizados por ANOVA y el método post hoc Student-Newman-Keuls. # p < 0.05 a la línea de base. Los datos se presentan como media y desviación estándar. (A) El índice cardíaco disminuye, (B) La variación del volumen del accidente cerebrovascular aumenta, (D) el índice de volumen sanguíneo intratorácico y (E) la disminución del índice de volumen diastólico final global, (C) el índice de resistencia vascular sistémica y (F) el índice de resistencia vascular sistémica y (F) ) el índice de agua pulmonar extravascular no se ven afectados. Haga clic aquí para ver una versión más grande de esta figura.
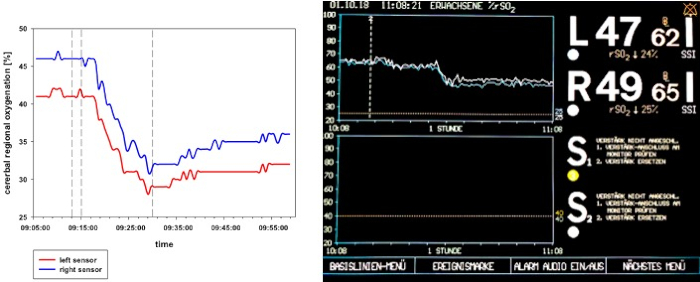
Figura 4 : crSO2 diagrama de flujo durante el shock hemorrágico en un animal representativo. El panel izquierdo muestra una presentación esquemática del crSO2 durante el shock hemorrágico. El panel derecho muestra la visualización del sistema NIRS. crSO2 se descompone significativamente a través de la inducción de choque y permanece en un nivel bajo después de la extracción de sangre se termina.

Figura 5 : Desarrollo de parámetros hematológicos durante el shock hemorrágico. Los efectos a lo largo del tiempo son analizados por ANOVA y el método post hoc Student-Newman-Keuls. # p < 0.05 a la línea de base. Los datos se presentan como media y desviación estándar. (A) El exceso de hemoglobina y (D) de base no se ven afectados, (C) el nivel de lactato aumenta significativamente, (B) disminuye la saturación venosa central de oxígeno. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo describe un método de inducir el shock hemorrágico a través de sangrado arterial controlado en cerdos que se guía por la hemodinámica sistémica, así como por deterioro microcirculatorio cerebral. Las condiciones de choque se lograron mediante una extracción sanguínea calculada de 25-35 ml kg-1 y confirmadas por el compuesto mencionado de parámetros sustitutivos que indican una insuficiencia cardiocirculatoria considerable. Si no se trata, este procedimiento fue letal dentro de 2 h en el 66% de los animales, lo que subraya la gravedad y reproducibilidad del modelo. La reanimación adecuada de fluidos, por otro lado, restabilizó la circulación y aprobó la patencia para imitar un escenario clínico8. Sin embargo, menos pérdida de sangre puede no conducir a la inestabilidad hemodinámica que también afectó crSO2 conduce a la falla experimental. La cantidad de sangre extraída debe adaptarse al peso corporal del animal,que correspondía con el volumen sanguíneo total 8.
Este método permite a los científicos examinar diferentes aspectos de esta condición potencialmente mortal y abre la oportunidad de estudiar una amplia gama de intervenciones terapéuticas en un escenario pseudoclínico. En este contexto, es importante señalar que durante el shock hemorrágico manifiesto la macrocirculación por sí sola apenas indica una microcirculación intacta o deteriorada y el suministro de oxígeno en los órganos7. La ventaja del procedimiento radica en su diseño sencillo y usabilidad. La transferencia a otros mamíferos de tamaño mediano parece poco complicada, aunque diferentes especies pueden presentar desafíos específicos. El diseño proporciona una alta flexibilidad, ya que se pueden elegir fácilmente diferentes niveles de deterioro cardiocirculatorio valorando las variables de efecto. La combinación con NIRS proporciona información sobre el suministro de oxígeno microcirculatorio no reconocido durante el shock hemorrágico.
Algunos de los pasos críticos del modelo tienen que ser resaltados y requieren atención. La sedación adecuada antes del transporte es esencial para evitar el estrés que podría complicar la manipulación de animales y falsificar los resultados por liberación de catecolaminas endogénicas. El hocico porcino, con su larga cavidad orofaríngea, complica la intubación y hace que la asistencia de una segunda persona sea razonable. Regularmente, la epiglotis se adhiere al paladar y tiene que ser movilizada con la punta del tubo. La parte más estrecha de las vías respiratorias no está a nivel de las cuerdas vocales, sino subglotótica, como en pacientes pediátricos23. Estos aspectos hacen que la relajación muscular adecuada sea esencial porque se facilita la intubación. Es preferible el cateterismo de los vasos guiados por ultrasonido, aunque el acceso quirúrgico también se puede utilizar de manera reproducible. La técnica mínimamente invasiva necesita entrenamiento y experiencia especiales, pero puede minimizar el sangrado incontrolado, el daño tisular, las tasas de complicación, el tiempo de acceso y el dolor24. La inducción del choque hemorrágico en sí parece ser muy simple, pero el usuario debe ser consciente de varios escollos. Es importante reducir la velocidad de extracción de sangre para reconocer la inestabilidad hemodinámica. La eliminación arterial es eficiente, pero cuando se realiza demasiado rápido, puede conducir a un fallo cardiocirculatorio y experimental no planificado. El cálculo del volumen aproximado de extracción ayuda a gestionar la extracción y evita niveles cardiocirculatorios críticamente bajos25,26,27. Otros protocolos publicados varían en términos de falla hemodinámica dirigida, cantidad de volumen de sangre eliminado y período de abstinencia de sangre. El recipiente puntuado puede diferir también27,28.
NIRS permite mediciones en tiempo real de la crSO2. En varios entornos clínicos, este método se ha utilizado para reconocer un suministro de oxígeno cerebral deteriorado: particularmente durante la cirugía cardíaca y vascular mayor, NIRS representa una herramienta valiosa. Los parámetros derivados del NIRS pueden predecir un peor resultado neurológico y la supervivencia del paciente causada por la insuficiente oxigenación de los tejidos29. Curiosamente, el nivel de lactato intracerebral disminuye en correlación con los valores NIRS. Los estudios han demostrado que durante el lactato de estrés oxidativo se puede utilizar como una fuente de piruvato, y el nivel de lactato intracraneal disminuye10. Estos hallazgos y mediciones no se tienen en cuenta en esta descripción básica del modelo. Cambios de presión arterial media que influyen en la perfusión cerebral, PaO2Paco2, o la hemoglobina afecta directamente a crSO derivado de NIRS230,31. NIRS tiene un valor pronóstico en pacientes que sufren de shock hemorrágico e inestabilidad hemodinámica, así32,33,34,35,36,37,38,39. Sin embargo, hay que tener en cuenta varias limitaciones y desventajas. El tejido extracraneal debajo de los sensores, como la piel, los músculos y la grasa, puede influir en las mediciones y puede conducir a resultados falsos negativos. La resolución espacial es baja, y la profundidad de penetración es limitada32,33,34,40,41,42,43. El método no diferencia entre sangre arterial y venosa ni entre la administración de oxígeno y la demanda41,44,45. El dispositivo está aprobado principalmente para la aplicación humana. Los sensores utilizados están diseñados para adultos humanos. Existen sensores más pequeños para niños y recién nacidos, pero estos no estaban disponibles para este protocolo. En cerdos, la técnica es ampliamente aceptada, y crSO2se correlaciona con una presión parcial de oxígeno, electroencefalografía cuantitativa y saturación de oxígeno venoso cerebral46,47. Varios dispositivos miden directamente la presión parcial del oxígeno en el tejido cerebral. Para ello, las sondas tienen que insertarse quirúrgicamente en el cerebro. Esto permite mediciones no afectadas en la región respectiva de interés y evita alteraciones por el tejido no cerebral circundante. Este enfoque es altamente invasivo y más bien adecuado para escenarios especiales como procedimientos neuroquirúrgicos48,49,50,51. El uso de modelos porcinos para simular patologías humanas es un enfoque muy común11,12,13,15. La ventaja radica en la comparabilidad fisiológica entre ambas especies. Los experimentos que simulan condiciones clínicas potencialmente mortales requieren experiencia fundamental en medicina y anestesia de cuidados intensivos, pero también en características específicas relacionadas con especies. Esto permite imitar escenarios clínicos de manera realista para las pruebas traslacionales de nuevos dispositivos o regímenes terapéuticos en el umbral de la aplicación clínica8,52. Sin embargo, debemos ser conscientes de que las conclusiones directas o inmediatas relativas a la aplicación clínica difícilmente pueden extraerse de modelos experimentales. Hay que tener en cuenta algunas diferencias y limitaciones relevantes: con respecto a shock o hemorragia, el sistema de coagulación porcina parece ser más eficaz y el contenido de hemoglobina es significativamente menor. Además, los niveles plasmáticos de lactato y succinato difieren53. La sangre porcina consiste en un sistema de grupo sanguíneo "A0", en comparación con el sistema humano "AB0"54. Algunos estudios analizan si se debe realizar la esplenectomía para excluir la aparición de autotransfusión intrínseca en modelos de choque porcino. Por otro lado, durante la esplenectomía, se produce estrés oxidativo, dolor y estimulación simpática, y el procedimiento se asocia con reacciones de autotransfusión por sí mismo. Por estas razones, no se recomienda la esplenectomía55,56. El uso de dispositivos clínicamente aprobados tiene algunas fuentes sistémicas de error. El sistema PiCCO requiere el cálculo de la superficie corporal, que difiere entre cerdos y humanos. Esto puede causar un error sistémico, pero la capacidad de tendencia del dispositivo no se verá afectada. Otros métodos de medición de la salida cardíaca, como la ecocardiografía o un catéter arterial pulmonar, se pueden discutir en este entorno.
En conclusión, este protocolo presenta un modelo de choque hemorrágico estandarizado iniciado por la abstinenciaarterial y controlado por monitoreo hemodinámico extendido, así como crSO 2. En comparación con modelos similares que se centran principalmente en volúmenes de eliminación predefinidos para la inducción por choque, este enfoque destaca una valoración por medio de la falla resultante de la macro y la microcirculación.
Divulgaciones
El dispositivo NIRS fue proporcionado incondicionalmente por Medtronic PLC, EE. UU., con fines de investigación experimental. Alexander Ziebart, Andreas Garcia-Bardon y Erik K. Hartmann recibieron honoraria instructor para cursos de formación médica de Medtronic PLC. Ninguno de los autores reporta conflictos financieros u otros conflictos de intereses.
Agradecimientos
Los autores quieren agradecer a Dagmar Dirvonskis por su excelente apoyo técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-way-stopcock blue | Becton Dickinson Infusion Therapy AB Helsingborg, Sweden | 394602 | Drug administration |
| 3-way-stopcock red | Becton Dickinson Infusion Therapy AB Helsingborg, Sweden | 394605 | Drug administration/Shock induction |
| Atracurium | Hikma Pharma GmbH , Martinsried | AM03AC04* | Anesthesia |
| Canula 20 G | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 301300 | Vascular access |
| Datex Ohmeda S5 | GE Healthcare Finland Oy, Helsinki, Finland | - | Hemodynamic monitor |
| Desinfection | Schülke & Mayr GmbH, Germany | 104802 | Desinfection |
| Heidelberger Verlängerung 75CM | Fresenius Kabi Deutschland GmbH | 2873112 | Drug administration/Shock induction |
| INVOS 5100C Cerebral | Medtronic PLC, USA | - | Monitore for cerebral regional oxygenation |
| INVOS Cerebral/Somatic Oximetry Adult Sensors | Medtronic PLC, USA | 20884521211152 | Monitoring of the cerebral regional oxygenation |
| Endotracheal tube | Teleflex Medical Sdn. Bhd, Malaysia | 112482 | Intubation |
| Endotracheal tube introducer | Wirutec GmbH, Sulzbach, Germany | 5033062 | Intubation |
| Engström Carestation | GE Heathcare, Madison USA | - | Ventilator |
| Fentanyl | Janssen-Cilag GmbH, Neuss | AA0014* | Anesthesia |
| Gloves | Paul Hartmann, Heidenheim, Germany | 9422131 | Self-protection |
| Incetomat-line 150 cm | Fresenius, Kabi GmbH, Bad Homburg, Germany | 9004112 | Drug administration |
| Ketamine | Hameln Pharmaceuticals GmbH, Zofingen, Schweiz | AN01AX03* | Sedation |
| Laryngoscope | Teleflex Medical Sdn. Bhd, Malaysia | 671067-000020 | Intubation |
| Logical pressure monitoring system | Smith- Medical GmbH, Minneapolis, USA | MX9606 | Hemodynamic monitor |
| Logicath 7 Fr 3-lumen 30 cm | Smith- Medical GmbH, Minneapolis, USA | MXA233x30x70-E | Vascular access/Drug administration |
| Masimo Radical 7 | Masimo Corporation, Irvine, USA | - | Hemodynamic monitor |
| Mask for ventilating dogs | Henry Schein, Melville, USA | 730-246 | Ventilation |
| Original Perfusor syringe 50 mL Luer Lock | B.Braun Melsungen AG, Melsungen, Germany | 8728810F | Drug administration |
| PICCO Thermodilution. F5/20CM EW | MAQUET Cardiovascular GmbH, Rastatt, Germany | PV2015L20-A | Hemodynamic monitor |
| Percutaneous sheath introducer set 8,5 und 9 Fr, 10 cm with integral haemostasis valve/sideport | Arrow international inc., Reading, USA | AK-07903 | Vascular access/Shock induction |
| Perfusor FM Braun | B.Braun Melsungen AG, Melsungen, Germany | 8713820 | Drug administration |
| Potassium chloride | Fresenius, Kabi GmbH, Bad Homburg, Germany | 6178549 | Euthanasia |
| Propofol 2% | Fresenius, Kabi GmbH, Bad Homburg, Germany | AN01AX10* | Anesthesia |
| Pulse Contour Cardiac Output (PiCCO2) | Pulsion Medical Systems, Feldkirchen, Germany | - | Hemodynamic monitor |
| Sonosite Micromaxx Ultrasoundsystem | Fujifilm, Sonosite Bothell, Bothell, USA | - | Vascular access |
| Stainless Macintosh Size 4 | Teleflex Medical Sdn. Bhd, Perak, Malaysia | 670000 | Intubation |
| Sterofundin | B.Braun Melsungen AG, Melsungen, Germany | AB05BB01* | balanced electrolyte infusion |
| Stresnil 40 mg/mL | Lilly Germany GmbH, Wiesbaden, Germany | QN05AD90 | Sedation |
| Syringe 10 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 309110 | Drug administration |
| Syringe 2 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 300928 | Drug administration |
| Syringe 20 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 300296 | Drug administration |
| Syringe 5 mL | Becton Dickinson S.A. Carretera Mequinenza Fraga, Spain | 309050 | Drug administration |
| Venous catheter 22 G | B.Braun Melsungen AG, Melsungen, Germany | 4269110S-01 | Vascular access |
| *ATC: Anatomical Therapeutic Chemical / Defined Daily Dose Classification |
Referencias
- Kutcher, M. E., et al. A paradigm shift in trauma resuscitation: evaluation of evolving massive transfusion practices. JAMA Surgery. 148 (9), 834-840 (2013).
- Allen, B. S., Ko, Y., Buckberg, G. D., Sakhai, S., Tan, Z. Studies of isolated global brain ischaemia: I. A new large animal model of global brain ischaemia and its baseline perfusion studies. European Journal of Cardio-Thoracic Surgery. 41 (5), 1138-1146 (2012).
- Noll, E., et al. Comparative analysis of resuscitation using human serum albumin and crystalloids or 130/0.4 hydroxyethyl starch and crystalloids on skeletal muscle metabolic profile during experimental haemorrhagic shock in swine: A randomised experimental study. European Journal of Anaesthesiology. 34 (2), 89-97 (2017).
- Tisherman, S. A., Stein, D. M. ICU Management of Trauma Patients. Critical Care Medicine. , (2018).
- Nielsen, T. K., Hvas, C. L., Dobson, G. P., Tonnesen, E., Granfeldt, A. Pulmonary function after hemorrhagic shock and resuscitation in a porcine model. Acta Anaesthesiologica Scandinavica. 58 (8), 1015-1024 (2014).
- Bogert, J. N., Harvin, J. A., Cotton, B. A. Damage Control Resuscitation. Journal of Intensive Care Medicine. 31 (3), 177-186 (2016).
- Gruartmoner, G., Mesquida, J., Ince, C. Fluid therapy and the hypovolemic microcirculation. Current Opinion in Critical Care. 21 (4), 276-284 (2015).
- Ziebart, A., et al. Effect of gelatin-polysuccinat on cerebral oxygenation and microcirculation in a porcine haemorrhagic shock model. Scandinavian Journal Trauma Resuscitation Emergency Medicin. 26 (1), 15 (2018).
- Bassols, A., et al. The pig as an animal model for human pathologies: A proteomics perspective. Proteomics Clinical Applications. 8 (9-10), 715-731 (2014).
- Alosh, H., Ramirez, A., Mink, R. The correlation between brain near-infrared spectroscopy and cerebral blood flow in piglets with intracranial hypertension. Journal of Applied Physiology. 121 (1985), 255-260 (2016).
- Hartmann, E. K., et al. Ventilation/perfusion ratios measured by multiple inert gas elimination during experimental cardiopulmonary resuscitation. Acta Anaesthesiologica Scandinavica. 58 (8), 1032-1039 (2014).
- Hartmann, E. K., Duenges, B., Baumgardner, J. E., Markstaller, K., David, M. Correlation of thermodilution-derived extravascular lung water and ventilation/perfusion-compartments in a porcine model. Intensive Care Medicine. 39 (7), 1313-1317 (2013).
- Hartmann, E. K., et al. An inhaled tumor necrosis factor-alpha-derived TIP peptide improves the pulmonary function in experimental lung injury. Acta Anaesthesiologica Scandinavica. 57 (3), 334-341 (2013).
- Ortiz, A. L., et al. The influence of Ringer's lactate or HES 130/0.4 administration on the integrity of the small intestinal mucosa in a pig hemorrhagic shock model under general anesthesia. Journal of the Veterinary Emergency and Critical. 27 (1), 96-107 (2017).
- Ziebart, A., et al. Low tidal volume pressure support versus controlled ventilation in early experimental sepsis in pigs. Respiratory Research. 15, 101 (2014).
- Hoffman, G. M., et al. Postoperative Cerebral and Somatic Near-Infrared Spectroscopy Saturations and Outcome in Hypoplastic Left Heart Syndrome. The Annals of Thoracic Surgery. 103 (5), 1527-1535 (2017).
- Hickok, R. L., Spaeder, M. C., Berger, J. T., Schuette, J. J., Klugman, D. Postoperative Abdominal NIRS Values Predict Low Cardiac Output Syndrome in Neonates. World Journal for Pediatric and Congenital Heart Surgery. 7 (2), 180-184 (2016).
- Weiner, M. M., Geldard, P., Mittnacht, A. J. Ultrasound-guided vascular access: a comprehensive review. Journal of Cardiothoracic and Vascular Anesthesia. 27 (2), 345-360 (2013).
- Kumar, A., Chuan, A. Ultrasound guided vascular access: efficacy and safety. Best Practice & Research: Clinical Anaesthesiology. 23 (3), 299-311 (2009).
- Lamperti, M., et al. International evidence-based recommendations on ultrasound-guided vascular access. Intensive Care Medicine. 38 (7), 1105-1117 (2012).
- Mayer, J., Suttner, S. Cardiac output derived from arterial pressure waveform. Current Opinion in Anesthesiology. 22 (6), 804-808 (2009).
- Medtronic. . Operations Manual INVOS ® System, Model 5100C. , (2013).
- Wani, T. M., Rafiq, M., Akhter, N., AlGhamdi, F. S., Tobias, J. D. Upper airway in infants-a computed tomography-based analysis. Paediatric Anaesthesia. 27 (5), 501-505 (2017).
- Tuna Katircibasi, M., Gunes, H., Cagri Aykan, A., Aksu, E., Ozgul, S. Comparison of Ultrasound Guidance and Conventional Method for Common Femoral Artery Cannulation: A Prospective Study of 939 Patients. Acta Cardiologica Sinica. 34 (5), 394-398 (2018).
- Teeter, W. A., et al. Feasibility of basic transesophageal echocardiography in hemorrhagic shock: potential applications during resuscitative endovascular balloon occlusion of the aorta (REBOA). Cardiovascular Ultrasound. 16 (1), 12 (2018).
- Kontouli, Z., et al. Resuscitation with centhaquin and 6% hydroxyethyl starch 130/0.4 improves survival in a swine model of hemorrhagic shock: a randomized experimental study. European Journal of Trauma and Emergency Surgery. , (2018).
- Nikolian, V. C., et al. Improvement of Blood-Brain Barrier Integrity in Traumatic Brain Injury and Hemorrhagic Shock Following Treatment With Valproic Acid and Fresh Frozen Plasma. Critical Care Medicine. 46 (1), e59-e66 (2018).
- Williams, T. K., et al. Endovascular variable aortic control (EVAC) versus resuscitative endovascular balloon occlusion of the aorta (REBOA) in a swine model of hemorrhage and ischemia reperfusion injury. The Journal of Trauma and Acute Care Surgery. 85 (3), 519-526 (2018).
- Aly, S. A., et al. Cerebral tissue oxygenation index and lactate at 24 hours postoperative predict survival and neurodevelopmental outcome after neonatal cardiac surgery. Congenital Heart Disease. 12 (2), 188-195 (2017).
- Sorensen, H. Near infrared spectroscopy evaluated cerebral oxygenation during anesthesia. The Danish Medical Journal. 63 (12), (2016).
- Cem, A., et al. Efficacy of near-infrared spectrometry for monitoring the cerebral effects of severe dilutional anemia. Heart Surgery Forum. 17 (3), E154-E159 (2014).
- Edmonds, H. L., Ganzel, B. L., Austin, E. H. Cerebral oximetry for cardiac and vascular surgery. Seminars in Cardiothoracic and Vascular Anesthesia. 8 (2), 147-166 (2004).
- Murkin, J. M., et al. Monitoring brain oxygen saturation during coronary bypass surgery: a randomized, prospective study. Anesthesia & Analgesia. 104 (1), 51-58 (2007).
- Hong, S. W., et al. Prediction of cognitive dysfunction and patients' outcome following valvular heart surgery and the role of cerebral oximetry. European Journal of Cardio-Thoracic Surgery. 33 (4), 560-565 (2008).
- Al Tayar, A., Abouelela, A., Mohiuddeen, K. Can the cerebral regional oxygen saturation be a perfusion parameter in shock?. Journal of Critical Care. 38, 164-167 (2017).
- Torella, F., Cowley, R. D., Thorniley, M. S., McCollum, C. N. Regional tissue oxygenation during hemorrhage: can near infrared spectroscopy be used to monitor blood loss?. Shock. 18 (5), 440-444 (2002).
- Yao, F. S., Tseng, C. C., Ho, C. Y., Levin, S. K., Illner, P. Cerebral oxygen desaturation is associated with early postoperative neuropsychological dysfunction in patients undergoing cardiac surgery. Journal of Cardiothoracic and Vascular Anesthesia. 18 (5), 552-558 (2004).
- Slater, J. P., et al. Cerebral oxygen desaturation predicts cognitive decline and longer hospital stay after cardiac surgery. The Annals of Thoracic Surgery. 87 (1), 36-44 (2009).
- Brodt, J., Vladinov, G., Castillo-Pedraza, C., Cooper, L., Maratea, E. Changes in cerebral oxygen saturation during transcatheter aortic valve replacement. Journal of Clinical Monitoring and Computing. 30 (5), 649-653 (2016).
- Yoshimura, A., et al. Altered cortical brain activity in end stage liver disease assessed by multi-channel near-infrared spectroscopy: Associations with delirium. Scintific Reports. 7 (1), 9258 (2017).
- Douds, M. T., Straub, E. J., Kent, A. C., Bistrick, C. H., Sistino, J. J. A systematic review of cerebral oxygenation-monitoring devices in cardiac surgery. Perfusion. 29 (6), 545-552 (2014).
- Forman, E., et al. Noninvasive continuous cardiac output and cerebral perfusion monitoring in term infants with neonatal encephalopathy: assessment of feasibility and reliability. Pediatric Research. 82 (5), 789-795 (2017).
- Tweddell, J. S., Ghanayem, N. S., Hoffman, G. M. Pro: NIRS is " standard of care " for postoperative management. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual. 13 (1), 44-50 (2010).
- Lewis, C., Parulkar, S. D., Bebawy, J., Sherwani, S., Hogue, C. W. Cerebral Neuromonitoring During Cardiac Surgery: A Critical Appraisal With an Emphasis on Near-Infrared Spectroscopy. Journal of Cardiothoracic and Vascular Anesthesia. 32 (5), 2313-2322 (2018).
- Thudium, M., Heinze, I., Ellerkmann, R. K., Hilbert, T. Cerebral Function and Perfusion during Cardiopulmonary Bypass: A Plea for a Multimodal Monitoring Approach. Heart Surgery Forum. 2 (1), E028-E035 (2018).
- Putzer, G., et al. Monitoring of brain oxygenation during hypothermic CPR - A prospective porcine study. Resuscitation. 104, 1-5 (2016).
- Weenink, R. P., et al. Detection of cerebral arterial gas embolism using regional cerebral oxygen saturation, quantitative electroencephalography, and brain oxygen tension in the swine. Journal of Neuroscience Methods. 228, 79-85 (2014).
- Mader, M. M., et al. Evaluation of a New Multiparameter Brain Probe for Simultaneous Measurement of Brain Tissue Oxygenation, Cerebral Blood Flow, Intracranial Pressure, and Brain Temperature in a Porcine Model. Neurocritical Care. , (2018).
- Mikkelsen, M. L. G., et al. The influence of norepinephrine and phenylephrine on cerebral perfusion and oxygenation during propofol-remifentanil and propofol-remifentanil-dexmedetomidine anaesthesia in piglets. Acta Veterinaria Scandinavica. 60 (1), 8 (2018).
- Nelskyla, A., et al. The effect of 50% compared to 100% inspired oxygen fraction on brain oxygenation and post cardiac arrest mitochondrial function in experimental cardiac arrest. Resuscitation. 116, 1-7 (2017).
- Klein, K. U., et al. Intraoperative monitoring of cerebral microcirculation and oxygenation--a feasibility study using a novel photo-spectrometric laser-Doppler flowmetry. European Journal of Trauma and Emergency Surgery. 22 (1), 38-45 (2010).
- Ziebart, A., et al. Pulmonary effects of expiratory-assisted small-lumen ventilation during upper airway obstruction in pigs. Anaesthesia. 70 (10), 1171-1179 (2015).
- Reisz, J. A., et al. All animals are equal but some animals are more equal than others: Plasma lactate and succinate in hemorrhagic shock-A comparison in rodents, swine, nonhuman primates, and injured patients. The Journal of Trauma and Acute. 84 (3), 537-541 (2018).
- Smith, D. M., Newhouse, M., Naziruddin, B., Kresie, L. Blood groups and transfusions in pigs. Xenotransplantation. 13 (3), 186-194 (2006).
- Boysen, S. R., Caulkett, N. A., Brookfield, C. E., Warren, A., Pang, J. M. Splenectomy Versus Sham Splenectomy in a Swine Model of Controlled Hemorrhagic. Shock. 46 (4), 439-446 (2016).
- Wade, C. E., Hannon, J. P. Confounding factors in the hemorrhage of conscious swine: a retrospective study of physical restraint, splenectomy, and hyperthermia. Circulatory Shock. 24 (3), 175-182 (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados