Method Article
Isolement chimique, Quantification et séparation des lipides de la peau des Reptiles
Dans cet article
Résumé
Chez les reptiles, les lipides de la peau de leurs congénères sont cruciales pour signalisation sexuelle, avec une utilisation potentielle dans la gestion des espèces envahissantes. Nous décrivons ici les protocoles pour l’extraction des lipides de la peau de peau de hangar ou des animaux entiers, déterminer et analyser la masse de lipides totaux et séparant les lipides à l’aide de fractionnement par chromatographie sur colonne de.
Résumé
Reptiles de signaux à leurs congénères à l’aide de lipides dans leur peau, principalement pour permettre la mate de suivi et évaluation. L’isolement de ces lipides a une utilité dans la recherche axée sur les tendances évolutives et les mécanismes de communication chimique, en plus de comprendre le rôle d’imperméabilisation des lipides dans l’évolution de la vie terrestre. Dans une approche appliquée, ces indices axés sur la peau ont une utilisation potentielle pour les gestionnaires de la faune portant sur les espèces envahissantes. Les principales étapes pour quantifier les lipides de la peau de reptile dans le protocole présenté ici comprennent l’extraction, dosage des lipides totaux et fractionnement par chromatographie sur colonne de, ce dernier procédé entraînant des éluats purifiées de composés qui peuvent ensuite soit d’être analysés pour attribuer des identifications composées (par exemple, chromatographie en phase gazeuse-spectrométrie de masse [GC-MS]) ou utilisés directement dans des essais biologiques plus raffinés. Les lipides de la peau peut être extraite de la peau vivante, hangar animaux peau ou morts ensemble, en utilisant des solvants organiques non polaires (p. ex., hexane, benzène, toluène). Extraction solubilise les lipides et, ensuite, le solvant peut s’évaporer pour obtenir un extrait lipidique uniquement mesurable. Le fractionnement consiste à séparer l’extrait de lipides totaux dans les éluats spécifiques via traditionnel chromatographie sur colonne. L’extrait lipidique total est d’abord lié à une colonne de substrat (par exemple, alumine) et, ensuite, les éluats individuels (« fractions ») de solvant à des volumes spécifiques sont passés séquentiellement par le biais de la colonne pour éluer les ensembles composés d’un mélange de lipides basée sur la polarité commune. Les progrès de fractions en polarité à une séquence normalisée en augmentant la quantité relative de solvant polaire (par exemple, l’éther diéthylique) dans un solvant non polaire. Dans ce manuscrit, nous décrire plusieurs méthodes d’extraction des lipides de la peau des reptiles et, ensuite, fournir un protocole standard utilisé pour isoler les différentes séries de composés basés sur la polarité, chromatographie sur colonne traditionnel. Extrait lipidique entier ou fractions spécifiques, puis, utilisable dans des essais biologiques pour déterminer toute activité biologique induite par les composés qui y sont.
Introduction
Reptiles produisent des lipides dans l’épiderme, directement à partir de cellules de la peau ou des glandes discrètes qui sont utilisés dans la communication sociale, tels que mate évaluation et suivi, territorialité et intra - et interspécifique reconnaissance1,2 ,3,4. L’isolement de ces lipides de la peau a une utilité dans la recherche axée sur les tendances évolutives et les mécanismes de communication chimique, en plus de comprendre le rôle d’imperméabilisation des lipides dans l’évolution de la vie terrestre2,3 ,4. En outre, de nombreux reptiles, en particulier les squamates (lézards, serpents), sont des espèces envahissantes préoccupantes dans les écosystèmes sensibles, et le développement de leurres à base de phéromones afin d’améliorer le piégeage et la suppression est en cours de5,6. L’imperméabilité de la peau de reptile facilite l’extraction des lipides précisées afin d’obtenir des extractions relativement pures d’une source potentiellement robuste de signaux chimiques. Les étapes du principe de quantification des lipides de la peau de reptile dans le protocole décrit comprennent l’extraction, dosage des lipides totaux et fractionnement via la colonne chromatographie1,6,7. Les méthodes ont été utilisées systématiquement car elles donnent des isolats bioactifs qui expliquent beaucoup sur le choix d’un partenaire et de sélection, en particulier dans les serpents2.
Les lipides de la peau peuvent être extrait de peau vivante, peau de hangar, ou reptiles morts ensemble, en utilisant non polaires ou des solvants organiques polaires1,7,8,9. Il est à noter que les spécimens de musée conservés dans des solvants comme l’éthanol ne sont pas optimales pour l’extraction des lipides de la peau, et seulement fraîches ou congelées fraîchement carcasses devraient être considérés comme des sources possibles pour l’extraction. Les lipides de la peau sont inertes, ce qui les rend stables sur la surface de la peau et facile à extraire7. Dans leurs rôles de signalisation en écologie de reptile, peau lipides repères sont souvent déposés dans des environnements difficiles, mais en raison de leurs propriétés chimiques robustes, ces repères peuvent conserver leur valeur informative sur de longues périodes de temps10,11 , 12. le processus d’extraction solubilise les lipides, à l’aide d’un solvant non polaire (par exemple, hexane, benzène, toluène) sur un trempage de longue heures, suivi par l’évaporation du solvant, de quitter une masse mesurable de lipides extrait7 , 8. les lipides de la peau sont très miscibles dans les solvants non polaires, et un large éventail d’hydrocarbures peut être extraites de la même manière une grande diversité de sources.
Le fractionnement est plus laborieux que l’extraction mais sert à séparer l’extrait lipidique total en fractions spécifiques par chromatographie sur colonne, pour aider à l’identification possible et de purification des composés qui y1, 6 , 7 , 8. l’extrait lipidique total est lié à une colonne de substrat, et ensuite, éluats individuels (« fractions ») de solvant à des volumes spécifiques sont passés séquentiellement à travers la colonne pour éluer les ensembles composés d’un mélange de lipides disposant d’un commun polarité6,7,8. En chromatographie de lipide, les progrès de fractions en polarité à certains normalisé séquence en augmentant la quantité relative de solvant polaire (par exemple, l’éther diéthylique) dans un solvant non polaire (généralement exprimée en pourcentage : 0 %, 2 %, 4 % éther, etc.. )6,7,8. Bien que les méthodes comme la chromatographie sur couche mince (TLC) peut être utilisé pour séparer les lipides dans un mélange et sont plus simples, chromatographie sur colonne est préféré parce qu’il utilise un système fermé, est facile à contrôler, peut plus distinct mélanges de concentrés et est compatible avec multiplexage d’efficacité. Dans ce manuscrit, nous décrire plusieurs méthodes d’extraction des lipides de la peau des reptiles et, ensuite, fournir un protocole standard utilisé pour isoler les différentes séries de composés basés sur la polarité, chromatographie sur colonne traditionnel. Dans de nombreux projets de recherche impliquant l’isolement de signaux chimiques, le but ultime est d’apporter des changements dans les récepteurs exposés à ces indices. Extrait lipidique entier ou fractions spécifiques, puis, utilisable dans des essais biologiques pour déterminer que toute activité biologique induites par les composés qui y1,2,6,7. Dans la recherche fondamentale en biologie, par exemple, des essais sur des fractions spécifiques peuvent révéler aux chercheurs que source purifiée de phéromones a été isolée, et puis, les méthodes pour l’identification des composés cibles peuvent être engagées. Dans une perspective de gestion de la faune, d’identification ne peut pas être l’objectif, et au lieu de cela, la fraction active pourrait être utilisée dans le domaine pour attirer leurs congénères dans des pièges ou inhiber mate suivi dans l’habitat non indigènes13,14.
Protocole
Toutes les procédures impliquant l’utilisation de vertébrés ont été approuvées par le Comité utiliser de James Madison University et d’institutionnels animalier.
1. extraction
-
Extraction de peau de hangar
- Recueillir environ 30 cm2 de hangar d’un seul reptile, enlever la tête et les sections cloacales qui peuvent contaminer les échantillons. Chloroprène gants et nettoyer l’abri des débris.
- Tarer la balance avec un sac ou peser bateau et peser le hangar (± 0,01 g).
NOTE : La précision de masse est déterminée par la précision de la balance. Peau de hangar de masse est le facteur de normalisation pour peau extrait lipidique de masse (voir ci-dessous) et varie considérablement avec les lipides extraits masse. - Séparer le hangar en petits morceaux (2de 5 cm) et ajoutez-les à un récipient en verre refermable avec un couvercle d’hexane-compatible (par exemple, un bocal à conserves verre avec un couvercle en métal ou une fiole de laboratoire avec un couvercle PTFE). Décanter assez hexane dans le récipient pour submerger complètement les morceaux de peau de hangar. Sceller le contenant.
Attention : L’Hexane est inflammable, un irritant respiratoire et est associée à plusieurs court et long terme dangers pour la santé. Procédures impliquant l’hexane sont effectuées dans une hotte de laboratoire (laboratoire) ou à l’extérieur (champ) tout en portant l’équipement approprié de protection individuelle (EPI) (p. ex., anti-éclaboussures, chloroprène gants, manches longues, chaussures fermées). - Étiqueter les réservoirs avec un crayon ou un stylo résistant aux solvants. Laissez les réservoirs dans la hotte de laboratoire à température ambiante une nuit ou jusqu'à 24 h.
- Retirer les morceaux de hangar à l’aide de la pince métallique propre ou des pinces. Secouez les morceaux pour conserver toute hexane restant dans le conteneur. Laisser les morceaux de peau sécher sur du papier absorbant ; puis, jetez-les. Si les extractions multiples sont exécutées, nettoyer les pince/pinces entre chaque échantillon. Pour nettoyer la pince/pinces, rincez-les dans environ 50 mL d’hexane dans un bécher.
- Si l’extrait ne doit ne pas être utilisé immédiatement, décanter ou pipeter l’extrait dans un flacon en verre de volume approprié, sceller avec un capuchon doublé PTFE, étiqueter et conserver à-20 ° C.
Attention : Étant donné que l’extrait contient hexane, conserver les flacons dans un congélateur antidéflagrant.
-
Animale morts toute extraction
- La longueur museau-cloaque (SVL ; en centimètres) et la masse (en grammes) de l’animal. Si la production totale de lipides ou de phéromones par unité de surface de la peau doit être déterminé, utilisez le ruban à mesurer un tailleur pour obtenir la circonférence maximale de corps (en centimètres).
- Pour l’extraction, choisissez un conteneur qui a un diamètre qui est 1/3 de la longueur de l’animal. Positionner la carcasse solidement au fond du récipient avec la tête et le cloaque au-dessus. Décanter suffisamment hexane dans le récipient pour maximiser la surface immergée du corps.
Remarque : Si la tête ou le cloaque submergé pour n’importe quel laps de temps dans l’extraction, prendre note. - Fixer le couvercle, étiqueter le contenant et faire tremper dans une hotte de laboratoire à température ambiante une nuit ou jusqu'à 24 h.
- Lors du retrait de la carcasse, utiliser la pince métallique propre ou des pinces. Conserver l’hexane résiduelle sur la carcasse dans le conteneur en lui permettant de s’écouler de l’organisme, pas de la tête ou la queue. Sceller le contenant.
- Si l’extrait ne doit ne pas être utilisé immédiatement, décanter l’extrait ou il pipetter, dans un flacon en verre de volume approprié, sceller avec un capuchon doublé PTFE, étiqueter et conserver à-20 ° C.
2. détermination de la masse lipidique
Remarque : L’extrait lipidique masse peut être déterminé de deux manières : avec un flacon de verre ou avec un ballon à fond rond, à l’aide d’un évaporateur rotatif.
- Déterminer l’extrait lipidique masse via la méthode du flacon verre.
- Utiliser un flacon prépesé de taille suffisante (22 mL, 50 mL, 7 mL, etc.). Inclure le bouchon et l’étiquette dans la masse totale, ou toujours peser le flacon sans bouchon et étiquette (marquages sur l’étiquette également ajoutent la masse). Placer l’étiquette sur le col du matras pour éviter le contact de l’eau.
Remarque : L’évaporation en flacons de verre est efficace si le chercheur a accès à un système de collecteur de gaz où plusieurs flacons peuvent s’évaporer en même temps sous un courant de2 N. - Transvaser l’extrait dans le flacon, à l’aide d’une pipette de verre avec une poire en caoutchouc, ou, pour les extraits de grand volume, un pipeteur électronique avec une pipette de verre jetable 10 mL. Rincer le contenant avec ~ 3 mL d’hexane et le transfert à la fiole aussi bien.
- Évaporer l’échantillon sous un léger courant de2 N. Inclinez le flacon à un angle permettant une surface maximale du solvant. Condensation se forme sur l’extérieur de la cuvette comme l’hexane s’évapore.
NOTE : Anneaux de lipide se formera dans le flacon comme l’hexane s’évapore, donc périodiquement agiter l’extrait. - Évaporer l’échantillon à sec ; puis, repeser. Enregistrer le rendement en lipides totaux.
Remarque : Pour l’analyse dans les différents groupes, normaliser les lipides soit faire la masse de masse (masse lipidique [en grammes] divisée par la masse de hangar [en grammes] x 100 donne la masse du pourcentage de lipides de l’abri) ou de l’animal SVL (lipides masse [en milligrammes] divisée par SVL [dans cm] ; donne la masse lipidique par unité de longueur). Grands animaux produisent plus de lipides, et beaucoup d’espèces est fortement sexuellement dimorphes, qui impose un biais important dans les données.
- Utiliser un flacon prépesé de taille suffisante (22 mL, 50 mL, 7 mL, etc.). Inclure le bouchon et l’étiquette dans la masse totale, ou toujours peser le flacon sans bouchon et étiquette (marquages sur l’étiquette également ajoutent la masse). Placer l’étiquette sur le col du matras pour éviter le contact de l’eau.
- Déterminer l’extrait lipidique massive via l’évaporateur rotatif.
- Pour une évaporation plus rapide par échantillon individuel, transférer l’extrait dans un ballon à fond rond prépesé et s’évaporer à l’aide d’un évaporateur rotatif.
- Si les particules sont perceptibles dans l’extrait, filtrer l’échantillon en plaçant un cône de papier filtre dans le col du matras ; Ensuite, transférer l’extrait dans la fiole et laisser au filtre de la gravité. Jeter le papier filtre suivant l’extrait complet est transférée.
Remarque : Le volume de l’échantillon de transfert (jusqu’au volume de la fiole de ~ 80 %) avant l’évaporateur rotatif. Toute propagation de l’extrait dans le condenseur de l’évaporateur rotatif provoque une contamination et exige le condenseur à nettoyer. Un piège à bosse peut être placé entre le ballon et le cou du condenseur en cas de bulles ou « cogner » dans la plupart des échantillons.
- Si les particules sont perceptibles dans l’extrait, filtrer l’échantillon en plaçant un cône de papier filtre dans le col du matras ; Ensuite, transférer l’extrait dans la fiole et laisser au filtre de la gravité. Jeter le papier filtre suivant l’extrait complet est transférée.
- Mettre en marche pour le bain l’eau et l’évaporateur rotatif (50 ° C ; plus bas que le point d’ébullition solvant). Activer le flux d’eau froide vers le condenseur.
Remarque : Le condenseur de l’évaporateur rotatif est relié à un réfrigérant en circuit fermé ou un robinet d’eau froide, évacuation vers l’égout. Le débit peut être lent si l’eau est plus fraîche que la température ambiante, à condenser les vapeurs de solvant laissant la fiole et entrant dans le condenseur. - Allumez la source de vide (vide d’eau ou pompe). S’assurer que la pression de vide est suffisante pour tenir le ballon au cou du condenseur. Ouvrez l’évent à l’extrémité de ce dernier avant de raccorder le ballon. Faites glisser le ballon sur le cou du condenseur, près de l’évent pour sceller et s’assurer que le ballon ne peut pas déconnecter le condensateur quand le ballon est sorti.
- Abaisser la fiole jusqu'à ce qu’environ 50 % est immergée dans le bain. Actionnez la rotation du ballon à vitesse moyenne. Si le vide, vitesse, débit condenseur et température du bain sont optimales, les vapeurs de solvant laissant le ballon peut se condenser sur la bobine et s’écouler dans le ballon de récupération.
- Si le bout de l’échantillon (par exemple, de grosses bulles, gazage rapide), réduire immédiatement la vitesse de l’évaporateur rotatif sous vide et/ou. Si l’ébullition se poursuit, désactiver la rotation de la fiole, éteindre l’aspirateur, soulever le ballon du bain et libérer le joint de vide. Répétez les étapes 2.2.3 et 2.2.4.
Remarque : Si aucun solvant ne recueille dans le ballon de récupération, mais l’extrait est évidemment s’évaporer, le vide est très probablement non optimales et doit être réajusté.
- Si le bout de l’échantillon (par exemple, de grosses bulles, gazage rapide), réduire immédiatement la vitesse de l’évaporateur rotatif sous vide et/ou. Si l’ébullition se poursuit, désactiver la rotation de la fiole, éteindre l’aspirateur, soulever le ballon du bain et libérer le joint de vide. Répétez les étapes 2.2.3 et 2.2.4.
- Évaporer l’échantillon sous le vide environ 2 mL de solvant reste dans le ballon (extraits de grand volume), ou, si une fiole prépesée est utilisée, s’évaporer jusqu'à ce qu’une perle de liquide avec un < 1 cm de diamètre est visible dans le fond du flacon. Désactiver la rotation et le vide ; Ensuite, soulever le ballon hors de la baignoire.
- Tenir le cou de ballon comme le vide seal est libéré ; puis, tordre le cou pour faire glisser le condenseur. Si on utilise une fiole de grand volume, agiter l’extrait concentré dans la fiole de dissoudre les lipides visibles ; Ensuite, la solution via la pipette de transfert dans une fiole de faible volume, prépesée. Ajouter 3 mL d’hexane, pour rincer le grand ballon, faire tourner, il pipetter dans le plus petit ballon et s’évaporer à nouveau (étapes 2.2.3 - 2.2.5).
- La perle de liquide dans l’extrait consolidera comme l’hexane s’évapore. Une fois sec, laissez-le à température ambiante. Lipides formeront une translucide, blanche ou jaune cire dans la fiole (~ 5 min). Peser la fiole pour obtenir la masse finale.
Remarque : Selon la nature des lipides extraits, ils auront soit solide (par exemple, cire) ou propriétés semi-solide (p. ex., pétrole brut), surtout quand les lipides fractionnés sont évaporés (voir ci-dessous).
- Pour une évaporation plus rapide par échantillon individuel, transférer l’extrait dans un ballon à fond rond prépesé et s’évaporer à l’aide d’un évaporateur rotatif.
- Solubiliser les lipides dans le volume enregistré d’hexane à rendement ≥ 1 mg de lipides par 1 mL d’hexane. Le volume de travail pour progresser à la chromatographie est environ 5 mL. Si vous transférez de la fiole de fiole, conserver les 2 mL du volume total à rincer le ballon après le transfert de la majorité de l’extrait dans le flacon.
- Étiqueter les flacons, sceller avec casquettes bordées de PTFE et les stocker à-20 ° C.
3. chromatographie sur colonne
NOTE : Pour séparer des composés inconnus basées sur la polarité en fractions spécifiques, extrait lipidique masse peut être des colonnes de chromatographie en phase liquide ajouté à préparé et fractionnés en utilisant le standard d’élution.
- Préparation de la colonne
- Selon la masse lipidique dans l’extrait, utilisez une grande ou une colonne chromatographique de verre de petit volume avec un robinet en téflon. La colonne est soit équipée ou fusionnée à un réservoir de volume fixe (500 mL pour une longue colonne ; 250 mL pour une petite colonne). Désormais, ce protocole se réfère seulement à une colonne de chromatographie de grand volume fusionnée à un réservoir. Nettoyer soigneusement toute nouvelle verrerie et les pièces à être utilisés en chromatographie, tel que décrit à l’article 4 ; Ensuite, rincez-les hexane ou un autre solvant non polaire.
- Plier un morceau de laine de fibre de verre (environ 14 cm de longueur [L] x 4 cm de largeur [W]) à plusieurs reprises jusqu'à forme un carré d’environ 4 cm x 4 cm. Utilisez une tige de cheville en bois plus longue que la colonne à la position de la fibre de verre au bas de la colonne.
- Fixer la colonne dans une hotte sur un support de bague standard avec deux pinces (p. ex., pivotant ou modulaire), un au-dessus du robinet d’arrêt et l’autre sous le cou du réservoir. Niveau de la colonne. Position de la colonne à une hauteur pour permettre à une distance suffisante de travail pour le bécher de 500 mL pour s’adapter facilement au titre de la colonne. Ouvrir le robinet.
- Pour lave et faire sécher le sable dans la colonne, jusqu'à ce qu’un ~ 3 cm de sable repose au-dessus de la fibre de verre. Placer un papier noir ou sombre sous la colonne et tapoter doucement. Si le sable tombe dans la colonne de chaque robinet, la barrière de la fibre de verre est insuffisante. Répétez les étapes 3.1.2 - 3.1.4.
Remarque : Utilisez un trombone déplié scotché à l’extrémité d’une tige de goujon d’extraction de la fibre de verre du bas. - Placer le bécher de 500 mL au titre de la colonne. Décanter lentement ~ 25 mL d’hexane d’un bécher de 100 mL ou une éprouvette graduée dans le réservoir de la colonne pour mouiller le sable. Fermer le robinet lorsqu’il y a ~0.5 cm d’hexane au-dessus du sable.
- Peser, alumine neutre. Pour chaque petite colonne, utilisez ~ 50 g ; ~ 175 g pour chaque colonne de la grande. Versez l’alumine dans une fiole d’Erlenmeyer de 1 litre. Limite de 400 g d’alumine par flacon de 1 L.
- Pour activer l’alumine (activité III), pipette d’eau déionisée d’un volume équivalant à 6 % de l’alumine masse (c.-à-d., pour 100 g d’alumine, ajouter 6 mL d’eau). Ajouter l’eau sous forme de gouttes tout au long de l’alumine.
- Couvrir le ballon avec le papier d’aluminium ou un bouchon de Liège. Agiter vigoureusement (ne pas secouer) pour disperser uniformément l’accusation. Continuer jusqu'à ce qu’aucune des touffes visibles.
Remarque : Le ballon chaud que l’eau réagit avec l’alumine, qui est à prévoir. - Ajouter hexane jusqu'à ce que l’alumine est complètement recouverte, ~0.5 cm d’hexane au-dessus de l’alumine. Agiter le ballon pour former une bouillie.
- Placez un entonnoir ventilé dans le réservoir de la colonne et un bécher en verre 500 mL sous la colonne. Ouvrir le robinet. Tourbillonner l’alumine et verser progressivement dans la colonne. S’assurer que l’alumine est régler uniformément dans la colonne et aucune grosses bulles ou fissures sont forment dans la colonne d’alumine. Tapotez doucement le côté de la colonne à régler uniformément l’alumine.
NOTE : Hexane supplémentaire doit être ajouté pour verse supplémentaires, pour maintenir le lisier. L’hexane collecte dans le bécher sous la colonne peut être réutilisée si la carafe en verre était propre au départ. - La colonne se forme lorsque le haut de l’alumine est stable et ~ 4 cm sous le cou de la colonne à la base du réservoir. Utiliser une pipette pour rincer l’intérieur du réservoir avec de l’hexane pour l’alumine résiduelle. À l’aide d’un entonnoir, doucement ajouter une deuxième couche de sable sur le dessus de l’alumine, à environ 1 cm sous le réservoir.
NOTE : Hexane découleront de la colonne que le robinet d’arrêt reste ouverte. Ne laissez pas la colonne sèche. Si la colonne se dessèche, le processus doit commencer encore une fois, en commençant à l’étape 3.1.2. Le protocole peut être arrêté ici si les colonnes sont préparés la veille de fractionnement. Placer un bouchon de Liège dans la partie supérieure du réservoir ou couvrez-le hermétiquement avec du papier fermement. Remplir le réservoir d’environ 100 mL d’hexane. Serrer le robinet d’arrêt.
- Fractionnement de l’extrait lipidique
NOTE : Quelle que soit la taille de colonne, fractions d’extrait lipidique peuvent être recueillies individuellement et regroupées selon leur polarité de fraction ou mis au rebut complètement s’ils ne contiennent pas des composés connus/identifiée cible. Tours d’élution répétée (n = 3 volumes) sont passés à travers la colonne afin d’assurer l’élution suffisante des lipides. Suivre le tableau 1 pour grand-colonne élution (avec un extrait masse > 30 mg) ou petit-colonne élution (avec un extrait masse < 30 mg). Un protocole d’élution sur mesure pour isoler seulement méthyl cétones est dans le tableau 2.- Supprimez l’hexane restant en haut de la colonne, à l’aide d’une pipette de grand volume, ou permettre l’hexane s’écouler dehors dans un bécher propre. Laisser environ 3 mL d’hexane au-dessus du sable en haut de la colonne.
Remarque : L’hexane recueilli est pure si elle seulement contacté verrerie propre et peut être recyclée dans la première fraction. - Transvaser l’extrait lipidique de la colonne, à l’aide d’une pipette de verre long. Pipetter lentement, l’extrait pour ne pas perturber la couche de sable. Rincer le flacon d’extrait ou de la fiole avec environ 5 mL d’hexane et transférez-le vers la colonne.
Remarque : Si l’extrait a été stocké à-20 ° C, les lipides vont être précipités. Réchauffer le flacon jusqu'à ce que plus aucun précipité est visible. - Ouvrir le robinet et laisser l’échantillon charger dans la colonne. Si l’extrait a une masse importante (> 30 mg), une bande jaunâtre peut être visible dans l’alumine, juste en dessous du sable dans la partie supérieure. Recueillir le débit à travers dans un bécher de déchets que ce hexane n’est donc plus propre. Fermer le robinet lorsque ~ 3 mL reste sur le dessus du sable.
Attention : Les lipides dans l’extrait, désormais lié à l’alumine et la colonne, ne peut pas sécher ou l’échantillon seront perdue. - Placer un ballon à fond rond prépesé et étiqueté (100 mL, 250 mL ou 500 mL) sous la colonne avant de verser la première fraction. Fractions de jeter peuvent être collectées dans un conteneur de verre commun.
- Préparer la première fraction (100 % hexane : 0 % éther diéthylique [jusqu’ici, « éther »]) dans une éprouvette graduée. Si vous préparez des fractions à l’avance, couvrir avec une feuille ou bouchon de Liège.
NOTE : Progrès de Fractions polarité ; par conséquent, le cylindre n’a pas besoin être rincée entre les fractions. - Ajouter la première fraction au réservoir par le versant via un entonnoir de verre ventilé dirigé vers un côté du réservoir pour ne pas perturber la couche de sable. Ouvrir le robinet pour commencer l’élution. Fermer le robinet lorsque ~ 3 mL d’hexane reste au-dessus du sable en haut de la colonne.
Remarque : Arrêter jamais une élution dans une fraction individuelle en fermant le robinet d’arrêt avant la majorité de l’éluat ont été collectée. Entre fractions, ne pas laisser le robinet d’arrêt fermé pendant plus de ~ 1 h parce que les retards peuvent altérer la qualité et la reproductibilité de l’élution. - Répétez les étapes 3.2.4 - 3.2.6 pour les fractions 2 et 3. Recueillir les fractions dans des flacons de tailles appropriée permettant à feuillure pour évaporateur rotatif, surtout si les fractions sont étant mis en commun.
- Préparer une quatrième fraction (éther de 2 %) et l’ajouter au réservoir. Placer la fiole prochaine sous la colonne, ouvrir le robinet et recueillir la fraction de quatrième. Préparer une fraction cinquième ; Ensuite, continuer selon les besoins.
Remarque : Il est possible de faire évaporer la première procède par évaporateur rotatif tout en recueillant des fractions successives. - Pour la préparation des fractions à être utilisées dans les analyses GC-MS, obtenir une masse de la fraction à l’aide d’une balance de précision 0,01 ou 0,1 mg. Solubiliser les fractions lipidiques pour produire 1 mg de lipides par 1 mL d’hexane.
- Supprimez l’hexane restant en haut de la colonne, à l’aide d’une pipette de grand volume, ou permettre l’hexane s’écouler dehors dans un bécher propre. Laisser environ 3 mL d’hexane au-dessus du sable en haut de la colonne.
4. nettoyage
- Laisser le robinet ouvert et inverser la colonne dans le bécher de déchets. L’alumine et le sable vont manquer la colonne ; Secouez alternativement, pour accélérer le processus. Utilisez une tige de goujon pour aller chercher de la laine de fibre de verre n’est pas bloqué (éviter de rayer le verre) ou souffler avec un flux de2 N.
- Démontez et nettoyez toute la verrerie, à l’aide de laboratoire-détergent dans l’eau chaude dans une cuve en plastique avec une brosse de verrerie (avec les cheveux ou de poils en plastique). Laver 3 x. Rincez bien avec de l’eau tiède jusqu'à ce que le verre n’est donc plus lisse au toucher.
- Rincer la verrerie et outils x 3 avec de l’eau désionisée. Placez-les sur une grille à sécher à l’air. Pour accélérer le séchage, ajouter une petite quantité d’acétone (3 mL) pour la verrerie, tourbillonner et laissez-le sécher à l’air ou de l’exécuter sous un courant de2 N.
Résultats
Extraction suivante, lipides totaux masse est le premier type de données qui peuvent être acquises via le protocole présenté ici. Toutefois, valeurs de masse lipidique total jamais il faudrait analyser sans quelque tentative de normaliser les valeurs obtenues. Plusieurs approches peuvent être utilisées, mais il est recommandé soit de normaliser la masse de l’extrait lipidique de l’animal SVL (en centimètres) ou à la masse de la peau de hangar qui a été extrait. Les anciens résultats dans une valeur de lipide-masse-par-longueur et ce dernier sera une proportion de source massive. La raison de la normalisation, c’est que les plus grands animaux produisent naturellement les lipides de la peau plus parce qu’ils ont une plus grande surface de peau totale. Figure 1 a illustre bien cette association, où les échelles masse de peau extrait lipidique linéairement avec la masse du hangar extraite de la peau. Une fois normalisé à la masse de peau remise totale, cette relation linéaire est complètement retiré (Figure 1 b).
Après fractionnement, la même approche de normalisation peut être utilisée avec les masses des fractions individuelles (Figure 2). Dans ce jeu de données d’exemple, chaque fraction pas contribue également à lipides extraits totaux masse : lipides neutres (fractions de 1-3) sont l’ensemble dominant des composés de masse proportion par rapport à chaque ensemble de lipides polaires plus (fractions 4-6, 7-9 et 10-12).
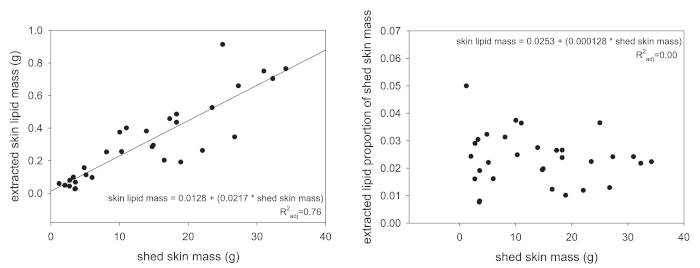
Figure 1 : relations entre extrait lipidique massive et d’entrée matériau. (A) chez les reptiles, la relation entre le hangar total peau de masse et les lipides de la peau extrait masse est corrélé positivement (P < 0,001). (B) lorsque les lipides de la peau extrait masse est standardisé pour le montant total versé en masse (lipide masse divisée par le hangar massive), cette relation n’est plus présente (P = 0,46). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : normalisés des masses de fraction après élution. Chromatographie sur colonne, extraits de lipides de la peau peuvent être éluées en fractions, basées sur la polarité composée. La fraction de masse est, ensuite, exprimée en pourcentage de l’extrait de lipides totaux (fraction masse [en mg] divisée par la masse extrait lipidique total [en milligrammes) pour déterminer les différences entre les fractions ou expérimental regroupe8. Les barres représentent les moyens. L’erreur supérieure est SEM ; l’erreur de fond est IC à 95 %. Points de données individuels sont fournis par souci de clarté. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : représentant chromatographes en phase gazeuse des fractions de méthyl cétone. (A) avec l’élution appropriée, méthyl cétones sont des composés les plus abondants dans la fraction 7 du tableau 2 et peut être considérées comme distiques de pics (temps de rétention = 24-34 min). (B) Fraction 6 du tableau 2, cependant, seulement donne des composés. Ce même résultat peut se produire lorsque le solvant polaire utilisé dans la phase mobile est expiré ou si la colonne est arrêtée pour de longues périodes (> 1 h) entre les fractions. Notez la différence en abondance moléculaire entre les deux traces. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Fraction | Hexane (mL) | Éther diéthylique (mL) |
| 1,2,3 | 100 [30] | 0 [0] |
| 4,5,6 | 98 [29,4] | 2 [0,6] |
| 7,8,9 | 96 [28,8] | 4 [1.2] |
| 10,11,12 | 92 [27,6] | 8 [2.4] |
| 13,14,15 | 84 [25,2] | 16 [4.8] |
Tableau 1 : volume d’élution Standard pour fractionnement de lipides de la peau. Pourcentages et volumes de solvants sont donnés pour les gros volumes (par exemple, 250 mL) et les [petits] (p. ex., 100 mL) colonnes de chromatographie à l’aide d’alumine (activité III). Hexane est le solvant ; l’éther est la phase mobile.
| Fraction | Hexane (mL) | Éther diéthylique (mL) | Notes |
| 1, 2, 3 | 30 | 0 | éluer ; ne pas prélever |
| 4, 5 | 28,8 | 1.2 | éluer ; ne pas prélever |
| 6, 7, 8 | 28,8 | 1.2 | collecter individuellement ; la majorité des méthylcétone masse sera en fraction 7 ; GC-MS de contrôles de qualité doivent être exécutés sur les 6 et 8 pour assurer la correcte d’élution des cétones |
Tableau 2 : régime d’élution mis à jour le thamnophis méthyl cétones. Ces volumes sont à utiliser avec une colonne de chromatographie de petit volume et avec la marque de l’alumine actuellement disponible. La fraction éluée positive pour les méthyl cétones a une bioactivité forte dans des essais de terrain avec wild, courtisant les couleuvres mâle1,7. Pour confirmer la présence de méthyl cétones dans les fractions de la cible, les échantillons peuvent être dilués à 1 mg/mL et analysés par GC-Mme Figure 3 fournit des chromatogrammes représentatifs pour les résultats positifs et négatifs après élution.
Discussion
L’extraction des lipides de la peau chez les reptiles peut être appliquée à la peau vivante ou morte, en plus de la peau de hangar, qui offre la polyvalence dans l’expérience de l’application de cette technique. En outre, extraction des lipides de la peau peut être faite sur le terrain, pour permettre une application dynamique de la méthode à un large éventail de biologistes2,13. Extraction des lipides de la peau est simple ; par conséquent, il est facile intensifier les extractions selon les besoins par l’expérience ou de conception, et praticiens ne doivent pas avoir une expertise appréciable pour exécuter les méthodes. Les seuls facteurs limitants pour amplifier sont la disponibilité de l’espace de hotte des fumées, une abondance de verrerie propre et scellable et espace de stockage de solvants.
Peau lipides extrait de fractionnement peut être adapté aux besoins du chercheur et, a donc la même souplesse à l’extraction des lipides. Par exemple, les lipides neutres peuvent être éluées et ensuite rejetées, pour aboutir à des fractions de cible qui peuvent purifier les composés d’intérêt ou de simplifier les tests biologiques. Le fractionnement peut être effectué à plusieurs échelles au sein et entre les échantillons de lipides. Par exemple, plusieurs colonnes peuvent être exécutés en même temps pour rendre le processus plus efficace. Ou bien, une partie seulement d’un extrait lipidique total peut être fractionnée sur une petite colonne pour, ainsi, de rechange réactifs et temps. Le fractionnement est principalement limité par la masse de l’extrait de lipides totaux et la précision de l’équipement disponible au chercheur. Par exemple, si le chercheur a une balance avec une précision de 10,0 mg, la détermination de la fraction de masse et, par conséquent, la précision de la préparation des échantillons pour l’analyse par CPG-SM est significative, si ce n’est pas complètement, fait obstacle. Il en va de même pour la verrerie. Si le chercheur dispose d’une colonne de grand volume pour le fractionnement, mais a une masse de petites lipides totaux pour séparer l’élution ou la séparation des composés progressera mais nécessitera un gaspillage considérable de solvants, réactifs, temps et potentiellement, la cible les composés eux-mêmes.
Il est conseillé d’effectuer un contrôle de qualité avant de déterminer le régime de l’élution, comme on le voit dans le tableau 2et de décider quelles fractions peuvent être rejetées. Pour confirmer l’élution des lipides désirées, une colonne peut être exécuter où chaque fraction, 1-15, est recueillie individuellement et ensuite analysée en utilisant GC-MS. Dans la Figure 3, représentant chromatographe en phase gazeuse des traces montrent que les méthyl cétones de couleuvres éluer seulement de la colonne dans une fraction spécifique. En effectuant cette étape de contrôle de la qualité, un schéma d’élution modifiés peut être développé pour une espèce donnée afin d’assurer le rendement maximum des composés d’intérêt. Changements dans les matériaux, tels que le fournisseur ou le lot de l’alumine ou l’âge de l’éther diéthylique, entraînera absolument différences d’élution qui doit être contrôlé pour en effectuant un essai de contrôle de la qualité.
Les techniques décrites sont limités principalement par la nature chimique des signaux qui peuvent être obtenus. Principalement, ces méthodes n’autorisent que les chercheurs isoler et séparer la longue chaîne de lipides de la peau des reptiles. De nombreuses espèces de reptiles utilisent des signaux aéroportés ou protéiques comme des signaux chimiques, et les méthodes décrites sont incompatibles avec ladite indices d’isolement. Autres solvants non polaires extraira pas cues aqueux de la surface des reptiles ou sources de dépôts de repère (par exemple, eau de la cage, les matières fécales, substrat aquatique) qui peuvent en effet contenir abondante des signaux chimiques. Les méthodes appropriées pour la capture de ces types de signaux sont accessibles aux chercheurs (p. ex., solid-phase microextraction [SPME] pour repères volatils et la chromatographie liquide à haute performance [HPLC] pour signaux aqueux), bien que, comme les méthodes décrit ci-dessus, il y a une courbe d’apprentissage technique.
Plus important encore, l’utilité de la bouillie chimique finale au chercheur devrait guider les méthodes utilisées. Par exemple, si un chercheur veut savoir si un animal mâle focal peut distinguer entre les repères produites par mâle vs femelle congénères dans un bioessai ciblé, l’extraction est que la seule méthode nécessaires2,3. Si l’identification de composés présente un dimorphisme sexuel est le but, cependant, l’extrait devait être purifiés, afin de permettre une plus grande confiance dans l’attribution des identifications à des molécules spécifiques ou des groupes de molécules par analyse chimique1, 6,9,11. Cependant, pour la même conduite chromatographie avec une source de lipides, une masse importante de démarrage extrait est nécessaire pour que les masses de fraction mesurable peuvent être obtenus ; dans le cas contraire, la mise en commun des échantillons peut être poursuivi, mais n’est pas optimale14.
Les développements futurs de ce protocole comprennent des mesures pour utiliser et adapter la procédure pour les espèces plus reptiliens. Autres méthodes non invasives d’extraction des lipides de la peau sont également développées.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le développement de ces méthodes, surtout hangar de l’extraction de lipides peau, s’est produite lors des accords de coopération (14-7412-1061-CA, 15-7412-1155-CA et 16-7412-1269-CA) entre James Madison University (JMU) et l’US Department of Agriculture Animal et Plant Health Inspection Service (APHIS). M.R.P. reconnaît les contributions des élèves suivants pour le développement des méthodes hangar peau : S. Patel (Washington and Lee University [WLU]), J. Zachry (Université Wilfrid Laurier), R. Flores (JMU), J. Noll (JMU) et S. Ashton (JMU).
matériels
| Name | Company | Catalog Number | Comments |
| Powder-free Chloroprene Gloves | Microflex | NEC-288 | See "1.1 Shed Extraction set-up" (step 1.1.2 "gloves") |
| Ohaus Adventurer Precision Balance | Ohaus | AX622 | See "1.1 Shed Extraction set-up" (step 1.1.3 "balance") |
| Freund Container Ball 16oz Mason Jar & Lid | Ball | NC9661590 | See "1.1 Shed Extraction set-up" (step 1.1.5 "mason jar") |
| Hexane, Mixtures of Isomers | Sigma-Aldrich | 650544 | See "1.1 Shed Extraction set-up" (step 1.1.6 "hexane") |
| Hi/Lo Write-On Temperature Tape | Electron Microscopy Sciences | 5029927 | See "1.1 Shed Extraction set-up" (step 1.1.8 "tape") |
| Single-Neck Round-Bottom Flask, capacity 500 mL | Sigma-Aldrich | Z414514 | See "2. Extraction" (step 2.1.2.4 "500 mL") |
| Single-Neck Round-Bottom Flask, capacity 100 mL | Sigma-Aldrich | Z414492 | See "3.2 Fractionating" (step 3.2.4 "100 mL") |
| Cork Flask Support Ring | Sigma-Aldrich | Z512419 | See "2. Extraction" (step 2.1.2.1 "cork support ring") |
| Accu-jet Pro Pipette Controller | Sigma-Aldrich | Z671533 | See "2. Extraction" (step 2.1.1.3 "electric pipette controller") |
| Disposable Individually Wrapped Glass Serological Pipets, 10 mL | Pyrex | 13-666-7E | See "2. Extraction" (step 2.1.1.3 "10 mL pipette") |
| Rotavapor R II | Buchi | 2422A0 | See "2. Extraction" (step 2.1.2.1 "rotary evaporator") |
| Elliptical Bump Trap | Chemglass Life Science | 501215241 | See "2. Extraction" (step 2.1.2.1 "bump trap") |
| 7 mL Vials, Screw Top, Clear Glass | Supelco | 27151 | See "1.1 Shed Extraction set-up" (step 1.1.11 "7 mL vial") |
| 7 mL Vial Screw Cap, Solid Top with PTFE Liner | Supelco | 27152 | See "1.1 Shed Extraction set-up" (step 1.1.11 "cap") |
| 22 mL Vials, Screw Top, Clear Glass | Supelco | 27173 | See "1.1 Shed Extraction set-up" (step 1.1.11 "22 mL vial") |
| 22 mL Vial Screw Cap, Solid Top with PTFE Liner | Supelco | 27174-U | See "1.1 Shed Extraction set-up" (step 1.1.11 "cap") |
| Excellence XS Analytical Balance | Mettler-Toledo | XS205DU | See "2. Extraction" (step 2.1.2.1 "balance") |
| 5 3/4" Disposable Glass Pipette | Fisherbrand | NC0418555 | See "1.1 Shed Extraction set-up" (step 1.1.11 "pipette") |
| Chromatography column with PTFE Stopcock Assembly | Kimble-Chase | 17810-19300 | See "3.1 Preparing the column" (step 3.1.1 "small glass column") |
| Cast-Iron L-Shaped Base Support Stands | Fischerbrand | 11474207 | See "3.1 Preparing the column" (step 3.1.1 "support stand") |
| 3-Prong Dual Adjust Nickel-Plated Zinc Clamp | Troemner | 2300203 | See "3.1 Preparing the column" (step 3.1.1 "clamps") |
| Clamp Regular Holder | Fischerbrand | 05754Q | See "3.1 Preparing the column" (step 3.1.1 "clamp holder") |
| Sand,Washed and Dried | Macron Fine Chemical | MK-7062-212 | See "3.1 Preparing the column" (step 3.1.5 "sand") |
| Alumina, Neutral | Sorbtech | 15740-5 | See "3.1 Preparing the column" (step 3.1.7 "alumina"); only known manufacturer in the US |
| Narrow-Neck Heavy-Duty Glass Erlenmeyer Flask, 1000mL | Pyrex | 4980-1L | See "3.1 Preparing the column" (step 3.1.6 "Erlenmeyer flask") |
| Single-Neck Round-Bottom Flask, capacity 250 mL | Sigma-Aldrich | Z100684 | See "3.1 Preparing the column" (step 3.2.4 "250 mL round bottom flask") |
| Calibrated Chromatography Column with Solvent Reservoir | Sigma-Aldrich | Z560553 | See "3.2 Preparing the column" (step 3.2.1 "large glass column") |
| Ethyl Ether Anhydrous | Fisher Chemical | E138500 | See "3.2 Fractionating" (step 3.2.5 "ether") |
| Alconox Detergnet | Sigma-Aldrich | 242985 | See "4. Cleaning" (step 4.2 "Alconox") |
| Acetone (Certified ACS) | Fisher Chemical | A18P-4 | See "4. Cleaning" (step 4.4 "acetone") |
Références
- Mason, R. T., et al. Sex pheromones in snakes. Science. 245 (4915), 290-292 (1989).
- Mason, R. T., Parker, M. R. Social behavior and pheromonal communication in reptiles. Journal of Comparative Physiology A. 196 (10), 729-749 (2010).
- Martín, J., López, P., Rheubert, J. L., Siegel, D. S., Trauth, S. E. Pheromones and chemical communication in lizards. Reproductive Biology and Phylogeny of Lizards and Tuatara. , 43-77 (2014).
- Mayerl, C., Baeckens, S., Van Damme, R. Evolution and role of the follicular epidermal gland system in non-ophidian squamates. Amphibia-Reptilia. 36 (3), 185-206 (2015).
- Mathies, T., Levine, B., Engeman, R., Savidge, J. A. Pheromonal control of the invasive brown treesnake: potency of female sexual attractiveness pheromone varies with ovarian state. International Journal of Pest Management. 59 (2), 141-149 (2013).
- Parker, M. R., Patel, S. M., Zachry, J. E., Kimball, B. A. Feminization of male brown treesnake methyl ketone expression via steroid hormone manipulation. Journal of Chemical Ecology. 44 (2), 189-197 (2018).
- Parker, M. R., Mason, R. T., Sever, D., Aldridge, R. Pheromones in snakes: history, patterns, and future research directions. Reproductive Biology and Phylogeny of Snakes. , 551-572 (2011).
- Parker, M. R., Mason, R. T. Low temperature dormancy affects the quantity and quality of the female sexual attractiveness pheromone in red-sided garter snakes. Journal of Chemical Ecology. 35 (10), 1234-1241 (2009).
- Parker, M. R., Mason, R. T. How to make a sexy snake: estrogen activation of female sex pheromone in male red-sided garter snakes. Journal of Experimental Biology. 215 (5), 723-730 (2012).
- Alberts, A. C. Constraints on the design of chemical communication systems in terrestrial vertebrates. American Naturalist. 139, S62-S89 (1992).
- Martín, J., Ortega, J., López, P. Interpopulational variations in sexual chemical signals of Iberian wall lizards may allow maximizing signal efficiency under different climatic conditions. PLoS ONE. 10 (6), e0131492 (2015).
- Baeckens, S., et al. Environmental conditions shape the chemical signal design of lizards. Functional Ecology. 32 (2), 566-580 (2018).
- Greene, M. J., Mason, R. T. Chemically mediated sexual behavior of the brown tree snake, Boiga irregularis. Ecoscience. 5 (3), 405-409 (1998).
- Mason, R. T., Rodda, G., Chiszar, D., Sawai, Y., Tanaka, H. Integrated pest management: The case for pheromonal control of habu and brown tree snakes. Snakes and Man: Controlling Pest Species for Conservation and Human Health. , 196-205 (1998).
- Pruett, J. A., et al. Evolutionary interactions between visual and chemical signals: chemosignals compensate for the loss of a visual signal in male Sceloporus lizards. Journal of Chemical Ecology. 42 (11), 1164-1174 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon