Method Article
Aislamiento químico, cuantificación y separación de los lípidos de la piel de los Reptiles
En este artículo
Resumen
En reptiles, los lípidos de la piel de sus congéneres son cruciales para la señalización sexual, con uso potencial en la gestión de especies invasoras. Aquí, describimos protocolos para la extracción de lípidos de la piel de la piel de la vertiente o animales enteros, determinar y analizar la masa total de lípidos y los lípidos cromatografía fraccionamiento mediante columna de separación.
Resumen
Reptiles de la señal a sus congéneres con lípidos en su piel, sobre todo para permitir el mate de seguimiento y evaluación. El aislamiento de estos lípidos tiene utilidad en la investigación que se centró en los mecanismos de comunicación química, además de entender el papel impermeabilizante de los lípidos en la evolución de la vida terrestre y patrones evolutivos. En un enfoque aplicado, tales señales basadas en la piel tienen uso potencial para los administradores de fauna con especies invasoras. Los pasos principales para la cuantificación de lípidos de la piel de reptil en el protocolo que presentamos incluyen extracción, determinación de lípidos totales y fraccionamiento por cromatografía de columna de, este último proceso resultando en eluídos purificados de compuestos que pueden entonces ya sea ser analizado para asignar identificaciones compuestas (por ejemplo, cromatografía de gases-espectrometría de masas [GC-MS]) o utilizados directamente en las pruebas biológicas más refinados. Los lípidos de la piel se puede extraer de la piel vivos, animales de piel, o el muerto enteros, usando solventes orgánicos no polares (por ejemplo, hexano, benceno, tolueno) de la vertiente. Extracción solubiliza los lípidos y, entonces, se puede evaporar el solvente para obtener un extracto lipídico sólo medible. Fraccionamiento implica la separación del extracto lipídico total en eluidos específica vía tradicional cromatografía de columna. El extracto lipídico total primero está enlazado a una columna base de sustrato (por ejemplo, alúmina) y, luego, eluatos individuales ("fracciones") de solvente en volúmenes específicos pasan secuencialmente a través de la columna a fin de eluir conjuntos de compuestos de la mezcla de lípidos basado en la polaridad común. El progreso de fracciones de polaridad en una secuencia estandarizada mediante el aumento de la cantidad relativa de solvente polar(por ejemplo, el éter dietílico) en solvente no polar. En este manuscrito, describen varios métodos para la extracción de lípidos de la piel de los reptiles y, luego, un protocolo estándar para aislar diferentes conjuntos de compuestos basados en polaridad, utilizando cromatografía de columna tradicional. Todo lípido extractos o fracciones específicas, entonces, utilizable en pruebas biológicas para determinar cualquier actividad biológica provocada por los compuestos en el mismo.
Introducción
Reptiles producen lípidos en la epidermis, directamente en las células de la piel o de las glándulas discretas que se usan en comunicación social, tales como mate evaluación y seguimiento, territorialidad, intra - y reconocimiento interespecífico1,2 ,3,4. El aislamiento de estos lípidos de la piel tiene utilidad en la investigación que se centró en patrones evolutivos y los mecanismos de comunicación química, además de entender el papel impermeabilizante de los lípidos en la evolución de la vida terrestre2,3 ,4. Además, muchos reptiles, especialmente escamosos (lagartos, serpientes), son especies invasoras en ecosistemas sensibles, y el desarrollo de señuelos basados en feromonas para mejorar la captura y eliminación continua5,6. La impermeabilidad de la piel de reptil facilita la extracción de los lípidos presentes para obtener extracciones relativamente puras de una fuente potencialmente robusta de señales químicas. Los pasos de principio para la cuantificación de los lípidos de la piel de reptil en el protocolo descrito incluyen extracción, determinación de lípidos totales y fraccionamiento mediante columna cromatografía1,6,7. Los métodos se han utilizado habitualmente como rinden bioactivos aislados que explican mucho sobre la elección de pareja y la selección, especialmente en serpientes2.
Los lípidos de la piel se pueden extraer de la piel viva, cubierto de piel, o reptiles muerto enteros, usando no polares o solventes orgánicos polares1,7,8,9. Cabe señalar que especímenes de Museo en solventes como el etanol no son óptimos para la extracción de lípidos de la piel, y sólo frescos o recién congelados cadáveres deben considerarse como posibles fuentes para la extracción. Los lípidos de la piel son inertes, que hace que se estable en la superficie de la piel y fácil de extraer7. En sus funciones de señalización en la ecología de reptiles, señales de lípidos de la piel a menudo se depositan en ambientes ásperos, pero debido a sus propiedades químicas robustas, tales señales pueden conservar su valor de la información durante largos periodos de tiempo10,11 , 12. el proceso de extracción solubiliza los lípidos, utilizando un disolvente no polar (por ejemplo, hexano, benceno, tolueno) en un remojo de horas de duración, seguido de la evaporación del disolvente, para dejar una masa medible de lípidos extracto7 , 8. lípidos de la piel son altamente miscibles en solventes no polares, y una amplia gama de hidrocarburos puede ser extraída de una igualmente amplia gama de fuentes.
Fraccionamiento es más laborioso que la extracción pero sirve para separar el extracto lipídico total en fracciones específicas mediante cromatografía en columna, para ayudar en la purificación y la posible identificación de los compuestos en1, 6 , 7 , 8. el extracto total de lípidos está enlazado a una columna base de sustrato, y luego, eluatos individuales ("fracciones") de solvente en volúmenes específicos pasan secuencialmente a través de la columna a fin de eluir conjuntos de compuestos de la mezcla de lípidos que tienen un común la polaridad6,7,8. En cromatografía de lípidos, el progreso de fracciones de polaridad en algunos estandarizados secuencia mediante el aumento de la cantidad relativa de solvente polar(por ejemplo, el éter dietílico) en solvente no polar (normalmente expresado como un porcentaje: 0%, 2%, 4% éter, etcetera. )6,7,8. Aunque métodos como la cromatografía en capa fina (TLC) puede ser utilizado para separar lípidos en una mezcla y son más simple, cromatografía en columna es preferido debido a que utiliza un sistema cerrado, es fácil de controlar, puede independiente más concentraron mezclas y es compatible con Multiplexación para la eficiencia. En este manuscrito, describen varios métodos para la extracción de lípidos de la piel de los reptiles y, luego, un protocolo estándar para aislar diferentes conjuntos de compuestos basados en polaridad, utilizando cromatografía de columna tradicional. En muchos proyectos de investigación que implica el aislamiento de señales químicas, el objetivo final es lograr un cambio en los receptores expuestos a esas señales. Todo lípido extractos o fracciones específicas se pueden, entonces, utilizados en pruebas biológicas para determinar que cualquier actividad biológica provocada por los compuestos en1,2,6,7. En la investigación biológica básica, por ejemplo, pruebas biológicas utilizando fracciones específicas pueden revelar a los investigadores que purificada fuente de las feromonas ha sido aislada, y luego, métodos para la identificación de los compuestos de la blanco pueden ser perseguidos. Desde una perspectiva de manejo de vida silvestre, identificación puede no ser el objetivo, y en cambio, la fracción activa puede ser utilizada en el campo para atraer a sus congéneres a trampas o inhibir a mate de seguimiento en el hábitat de especies no nativas13,14.
Protocolo
Todos los procedimientos que implican el uso de vertebrados fueron aprobados por el cuidado institucional de Animal y Use Comité de la Universidad James Madison.
1. extracción
-
Extracción de piel de la vertiente
- Recoger aproximadamente 30 cm2 de cobertizo de un reptil único, quitando la cabeza y secciones cloacales que pueden contaminar las muestras. Guantes de cloropreno y limpiar el galpón de desechos.
- TARE la balanza con una bolsa o pesan barco y pesan el cobertizo (± 0.01 g).
Nota: La precisión total es determinada por la precisión de la balanza. Galpón de piel total es el factor de normalización para la masa de lípidos extraídos de la piel (véase abajo) y significativamente covaries con lípidos extraídos masa. - Separar la nave en pedazos más pequeños (5 cm2) y añadir a un recipiente de vidrio herméticos con tapa compatible con hexano (por ejemplo, un tarro de masón de cristal con una tapa de metal o un frasco de laboratorio con tapa PTFE). Decantar suficiente hexano en el recipiente para sumergir completamente las piezas de piel de la vertiente. Sellar el recipiente.
PRECAUCIÓN: El hexano es inflamable, irritante respiratorio y se asocia con varios corto y largo plazo peligros para la salud. Procedimientos de hexano se realizan en una campana extractora (laboratorio) o al aire libre (campo) mientras se está usando equipo de protección personal (EPP) (p. ej., gafas resistentes a salpicaduras, guantes de cloropreno, mangas largas, zapatos cerrados). - Etiquetar el recipiente con un lápiz o bolígrafo resistente a disolventes. Deje el recipiente en la campana de humo a temperatura ambiente durante la noche o hasta 24 h.
- Retire las piezas de la vertiente con limpia metales pinzas o tenazas. Agitar las piezas para retener cualquier hexano restante en el envase. Permitir que los pedazos de piel secar sobre toallas de papel; entonces, deshacerse de ellos. Si se realizan varias extracciones, limpie las pinzas/pinzas entre cada muestra. Para limpiar las tenazas/pinzas, enjuáguelos en 50 mL de hexano en un vaso de precipitados.
- Si el extracto no debe ser utilizado inmediatamente, decantar o pipetear el extracto a un frasco de vidrio de volumen adecuado, sellar con un casquillo alineado PTFE, etiquetarla y almacenar a-20 ° C.
PRECAUCIÓN: Debido a que el extracto contiene hexane, almacenar los viales en un congelador a prueba de explosiones.
-
Animal muerto toda extracción
- Registrar la longitud hocico-cloaca (SVL; en centímetros) y masa (en gramos) del animal. Si la producción total de lípidos o feromona por unidad de área superficial de la piel debe ser determinado, utilizar la cinta métrica de sastre para obtener la circunferencia máxima del cuerpo (en centímetros).
- Para la extracción, elegir un contenedor que tiene un diámetro de 1/3 de la longitud del animal. Coloque el canal firmemente en la parte inferior del recipiente con la cabeza y la cloaca en la parte superior. Decantar el hexano suficiente en el recipiente para maximizar la superficie sumergida del cuerpo.
Nota: Si la cabeza o la cloaca se sumerja para cualquier cantidad de tiempo en la extracción, tenga en cuenta. - La tapa, etiqueta el envase y sumergirlo en una campana de humos a temperatura ambiente durante la noche o hasta 24 h.
- Al retirar el cadáver, uso limpia metales pinzas o tenazas. Retener el hexano residual en el canal en el contenedor por permitiendo a gotear desde el cuerpo, no de la cabeza o la cola. Sellar el recipiente.
- Si el extracto no debe ser utilizado inmediatamente, decantar el extracto o pipetear en un frasco de vidrio de volumen adecuado, sellar con un casquillo alineado PTFE, etiquetarla y almacenar a-20 ° C.
2. lípidos determinación de masas
Nota: Los lípidos extraídos masa puede determinarse de dos maneras: con un frasco de vidrio o con un matraz de fondo redondo, utilizando un evaporador rotatorio.
- Determinar los lípidos extraídos masiva vía el método de frasco de vidrio.
- Utilizar un frasco de un tamaño suficiente (7 mL, 22 mL, 50 mL, etc.). Incluyen la tapa y la etiqueta en la masa total, o siempre pesa el frasco sin tapa y etiqueta (marcado en la etiqueta de añade masa). Coloque la etiqueta en el cuello del frasco para evitar el contacto con el agua.
Nota: La evaporación en viales de vidrio es eficiente si el investigador tiene acceso a un sistema colector de gas donde múltiples viales se pueden evaporar simultáneamente bajo un chorro de2 N. - Transferir el extracto al frasco, usando una pipeta de vidrio con un bulbo de goma o de extractos de gran volumen, un aspirador electrónico con una pipeta de vidrio desechables 10 mL. Enjuagar el envase con 3 mL de hexano y transferencia para el vial, así.
- Evaporar la muestra bajo un chorro suave de2 N. Inclinar el frasco en un ángulo para permitir una máxima superficie solvente. Condensado se forma en el exterior del frasco como se evapora el hexano.
Nota: Anillos de lípidos se forman en el frasco como el hexano se evapora, así que periódicamente agitar el extracto. - Evaporar la muestra hasta la sequedad; entonces, reweigh. Registro de la producción total de lípidos.
Nota: Para el análisis a través de diferentes grupos, normalizar los lípidos a verter masa en masa (masa de lípidos [en gramos] dividida por la vertiente masa [g] x 100 rinde la masa de lípidos por ciento de la vertiente) o SVL del animal (lípidos masa en miligramos] dividida por SVL [en centímetros]; se obtiene la masa de lípidos por unidad de longitud). Animales más grandes producen más lípidos y muchas especies son fuertemente sexual dimorfa, que impone importantes sesgos en los datos.
- Utilizar un frasco de un tamaño suficiente (7 mL, 22 mL, 50 mL, etc.). Incluyen la tapa y la etiqueta en la masa total, o siempre pesa el frasco sin tapa y etiqueta (marcado en la etiqueta de añade masa). Coloque la etiqueta en el cuello del frasco para evitar el contacto con el agua.
- Determinar la lípidos extraídos masiva mediante el evaporador rotatorio.
- Para una más rápida evaporación por muestra individual, transferir el extracto a un matraz de fondo redondo previamente y se evapora utilizando un evaporador rotatorio.
- Si las partículas son sensibles en el extracto, filtrar la muestra colocando un cono de papel de filtro en el cuello del matraz; Luego, transferir el extracto en el matraz y deje al filtro de gravedad. Deseche el papel de filtro luego se transfirió el extracto completo.
Nota: Transferir el volumen de muestra (hasta ~ 80% matraz volumen) antes de evaporación rotatoria. Cualquier propagación del extracto en el condensador del evaporador rotatorio provoca contaminación y requiere el condensador para limpiarse. Una trampa de golpe puede colocarse entre el matraz y el cuello del condensador producirse burbujas o "golpes" en la mayoría de las muestras.
- Si las partículas son sensibles en el extracto, filtrar la muestra colocando un cono de papel de filtro en el cuello del matraz; Luego, transferir el extracto en el matraz y deje al filtro de gravedad. Deseche el papel de filtro luego se transfirió el extracto completo.
- Encienda el baño de agua y evaporador rotatorio (50 ° C, inferior del disolvente punto de ebullición). Encender el flujo de agua fría al condensador.
Nota: El condensador del evaporador rotatorio se conecta a un grifo de agua fría purga hacia el drenaje o un refrigerador por circulación. El flujo puede ser lento si el agua está más frío que el ambiente se condense el vapor solvente dejando el frasco y entrar en el condensador. - Encienda la fuente de vacío (vacío de agua o bomba). Asegúrese de que la presión de vacío es suficiente para sostener el frasco hasta el cuello del condensador. Abrir el respiradero presente en el extremo del condensador antes de conectar el matraz. Deslice el matraz en cuello de condensador, cerca de la rejilla de ventilación para sellar y asegurar que el frasco no puede desconectar el condensador cuando se suelta el frasco.
- Baje el matraz hasta ~ 50% está sumergido en el baño. Iniciar la rotación del matraz a velocidad media. Si el vacío, velocidad, flujo de condensador y temperatura del baño son óptimas, el vapor solvente dejando el matraz se condense en el serpentín y gotear en el frasco de recuperación.
- Si la muestra se reduce (por ejemplo, grandes burbujas, gases rápida), inmediatamente reducir el vacío y velocidad del evaporador rotatorio. Si la cocción continúa, apague la rotación del matraz, apague la aspiradora, levante el matraz del baño y liberar el sello de vacío. Repita los pasos 2.2.3 y 2.2.4.
Nota: Si no hay solvente es recoger en el frasco de recuperación pero obviamente se evapora el extracto, el vacío es probablemente nonoptimal y debe reajustarse.
- Si la muestra se reduce (por ejemplo, grandes burbujas, gases rápida), inmediatamente reducir el vacío y velocidad del evaporador rotatorio. Si la cocción continúa, apague la rotación del matraz, apague la aspiradora, levante el matraz del baño y liberar el sello de vacío. Repita los pasos 2.2.3 y 2.2.4.
- Evaporar la muestra bajo vacío hasta aproximadamente 2 mL de disolvente permanece en el matraz (extractos de gran volumen), o, si se utiliza un matraz previamente, se evapora hasta una gota de líquido con un < 1 cm de diámetro es visible en la parte inferior del matraz. Desactivar la rotación y el vacío; Luego, eleve el matraz fuera del baño.
- Sostenga el cuello del matraz como el vacío se libera el sello; a continuación, gire el cuello para deslizar desde el condensador. Si se utiliza un matraz de volumen grande, agitar el extracto condensado en el matraz para disolver lípidos visibles; Luego, transferir la solución mediante pipeta a un matraz de volumen más pequeño, un. Añadir 3 mL de hexano a enjuagar el frasco grande lo Remolino, pipeta al matraz más pequeño y se evaporan otra vez (pasos 2.2.3 - 2.2.5).
- El grano del líquido en el extracto se solidifique como el hexano se evapora. Una vez seco, permite que alcancen la temperatura ambiente. Los lípidos forman un blanco translúcido, amarillo cera en la mufla (~ 5 min). Pesar el matraz para obtener la masa final.
Nota: Dependiendo de la naturaleza de los lípidos extraídos, tendrán ya sea sólido (por ejemplo, cera) o propiedades de semisólido (p. ej., petróleo crudo), especialmente cuando lípidos fraccionados se evaporan (véase abajo).
- Para una más rápida evaporación por muestra individual, transferir el extracto a un matraz de fondo redondo previamente y se evapora utilizando un evaporador rotatorio.
- Solubilizar los lípidos en el volumen registrado de hexano a ≥1 mg de lípidos por cada 1 mL de hexano. El volumen de trabajo para progresar a cromatografía es de ~ 5 mL. Si transferir de frasco a frasco, mantener 2 mL de volumen total para enjuagar el matraz después de transferir la mayoría del extracto al frasco.
- Etiqueta los frascos, sellado con revestimiento de PTFE tapas y almacenar a-20 ° C.
3. cromatografía en columna
Nota: Para separar compuestos desconocidos basados en polaridad en fracciones específicas, lípidos extraídos masa puede ser columnas de cromatografía líquido añadido al preparado y fraccionado mediante la elución estándar.
- Preparación de la columna
- Dependiendo de la masa de lípidos en el extracto, utilizar una gran - o una columna de cromatografía de vidrio de pequeño volumen con una llave de paso de teflón. La columna está equipada con o fusionada a un depósito de volumen fijo (500 mL para una columna grande; 250 mL para una columna pequeña). En adelante, este protocolo sólo se refiere a una columna de cromatografía de gran volumen fundida a un depósito. Limpie cualquier nueva cristalería y piezas que se utiliza en cromatografía como se describe en la sección 4; Luego, enjuagar con hexano o con otro solvente no polar.
- Doblar un trozo de lana de fibra de vidrio (~ 14 cm de longitud [L] x 4 cm de ancho [W]) varias veces hasta que se forma un cuadrado de ~ 4 cm x 4 cm. Utilice una varilla de pasador de madera más larga de la columna para colocar la fibra de vidrio en la parte inferior de la columna.
- Fije la columna en una capucha a un soporte de anillo estándar con dos pinzas (e.g., giratorio o modular), una encima de la llave de paso y una debajo del cuello del depósito. Nivel de la columna. Posición de la columna a una altura para permitir la suficiente distancia para el vaso de precipitados de 500 mL caber fácilmente debajo de la columna. Abra la llave de paso.
- Vierta lava y seca la arena en la columna, hasta que un ~ 3 cm de arena sobre la fibra de vidrio. Coloque el papel negro u oscuro debajo de la columna y golpéelo suavemente. Si la arena cae de la columna con cada golpecito, la barrera de fibra de vidrio es insuficiente. Repita los pasos 3.1.2 - 3.1.4.
Nota: Utilice un clip desplegado con cinta el extremo de una varilla de pasador para obtener la fibra de vidrio de la parte inferior. - Coloque el vaso de precipitados de 500 mL en la columna. Decantar lentamente ~ 25 mL de hexano en un vaso de precipitados de 100 mL o probeta graduada en el depósito de la columna para mojar la arena. Cerrar la llave de paso cuando hay ~0.5 cm de hexano sobre la arena.
- Pesar alúmina neutra. Para cada columna pequeña, uso ~ 50 g; ~ 175 g para cada columna grande. Vierta la alúmina en un matraz Erlenmeyer de 1 L. Límite 400 g de alúmina por frasco de 1 L.
- Para activar la alúmina (actividad III), pipetear agua desionizada de un volumen igual al 6% de la alúmina masa (es decir, para 100 g de alúmina, añadir 6 mL de agua). Agregue el agua como gotas a lo largo de la alúmina.
- Cubrir el matraz con un corcho o papel de aluminio. Agitar vigorosamente (no agite) para dispersar uniformemente la carga. Continuar hasta que no queden grumos visibles.
Nota: El frasco se caliente como el agua reacciona con el óxido de aluminio, que es de esperarse. - Añadir hexano hasta que la alúmina está completamente forrada, con ~0.5 cm de hexano por encima de la alúmina. Agitar el frasco para formar una mezcla.
- Coloque un embudo con ventilación en el depósito de la columna y un vaso de precipitados de vidrio de 500 mL por debajo de la columna. Abra la llave de paso. Remolino de la alúmina y constantemente lo vierta en la columna. Asegúrese de la alúmina es colocar uniformemente en la columna y no grandes burbujas o grietas se forman en la columna de alúmina. Golpee suavemente el lado de la columna para colocar uniformemente la alúmina.
Nota: Debe agregarse adicional hexano para que vierte adicional, para mantener la mezcla. El hexano que recoge en el vaso debajo de la columna puede ser reutilizado si el vaso de vidrio estaba limpio al comienzo. - La columna se formó cuando la parte superior de la alúmina es estable y ~ 4 cm debajo del cuello de la columna en la base del depósito. Utilice una pipeta para enjuagar el interior del depósito con hexano para alúmina residual. Suavemente con un embudo, añadir una segunda capa de arena encima de la alúmina, a ~ 1 cm por debajo del depósito.
Nota: Hexano fluirá de la columna como la llave de paso sigue abierta. No deje que la columna seca. Si la columna se seca, el proceso debe comenzar de nuevo, a partir de paso 3.1.2. El protocolo se puede parar aquí si las columnas están preparadas un día antes de fraccionamiento. Firmemente Coloque un corcho en la parte superior del depósito o cubrir bien con papel de aluminio. Llene el depósito con ~ 100 mL de hexano. Apriete la llave de paso.
- Fraccionamiento del extracto lipídico
Nota: Independientemente del tamaño de la columna, fracciones del extracto de lípidos pueden ser recogidas individualmente y agrupados en base a su polaridad de fracción o desechados totalmente si no contienen compuestos objetivo conocido/identificados. Rondas de replicación elución (n = 3 volúmenes) pasan a través de la columna para asegurar la suficiente elución de los lípidos. Siga la tabla 1 para la elución de la columna de grandes (con un extracto total > 30 mg) o elución de la columna de pequeño (con un extracto masa < 30 mg). Un protocolo de elución a medida para aislar cetonas de metilo sólo está en la tabla 2.- Quite el hexano restante en la parte superior de la columna, utilizando una pipeta de gran volumen, o permitir que el hexano a gotear en un vaso limpio. Dejar aproximadamente 3 mL de hexano por encima de la arena en la parte superior de la columna.
Nota: El hexano recogido es puro si sólo contacto con material de vidrio limpio y se puede reciclar en la primera fracción. - Transferir el extracto lipídico a la columna, utilizando una pipeta de vidrio largo. Lentamente Pipetee el extracto para evitar perturbar la capa de arena. Enjuague el extracto frasco o matraz con ~ 5 mL de hexano y transferir a la columna.
Nota: Si el extracto se almacenó a-20 ° C, los lípidos se precipitó. Caliente el frasco hasta que el precipitado no es visible. - Abra la llave de paso y la muestra que se carga en la columna. Si el extracto tiene una masa grande (> 30 mg), una banda amarillenta puede ser visible en el alúmina, justo debajo de la arena en la parte superior. Recoge el flujo a través de un vaso de precipitados de residuos como este hexano no es limpio. Cierre la llave de paso cuando ~ 3 mL sigue en la cima de la arena.
PRECAUCIÓN: No sequen los lípidos en el extracto, obligado ahora a la alúmina y la columna, o la muestra se perderá. - Coloque un matraz de fondo redondo previamente y etiquetado (100 mL, 250 mL o 500 mL) debajo de la columna antes de verter la primera fracción. Fracciones que se descarten se pueden recoger en un recipiente de vidrio común.
- Preparar la primera fracción (100% hexano: 0% éter dietílico [hasta ese momento, "éter"]) en un cilindro graduado. Si preparar fracciones adelantado, cubierta con papel de aluminio o tapón de corcho.
Nota: Avance fracciones de polaridad; por lo tanto, el cilindro no necesita enjuagarse entre fracciones. - Añadir la primera fracción al depósito por verter a través de un embudo de vidrio con ventilación dirigida a un lado de la presa para evitar perturbar la capa de arena. Abra la llave de paso para iniciar la elución. Cierre la llave de paso cuando ~ 3 mL de hexano se mantiene por encima de la arena en la parte superior de la columna.
Nota: Nunca deje una elución en una fracción individual cerrando la llave de paso antes de que se ha recogido la mayoría de eluido. Entre fracciones, no deje la llave de paso cerrada por más de ~ 1 h porque demoras pueden alterar la calidad y repetibilidad de la elución. - Repita los pasos 3.2.4 - 3.2.6 para las fracciones 2 y 3. Recoger las fracciones en frascos de tamaños adecuado que permita espacio para evaporación rotatoria, especialmente si son se agruparon las fracciones.
- Preparar una cuarta fracción (2% de éter) y añadir al depósito. Coloque el frasco siguiente debajo de la columna, abra la llave de paso y recoger la fracción cuarta. Preparar una fracción Quinta; Luego, continuar según sea necesario.
Nota: Es posible evaporar la primera fraction(s) via rotatorio evaporación mientras recogiendo fracciones sucesivas. - Para la preparación de fracciones para ser utilizado en los análisis de GC-MS, obtener una masa de fracción mediante una balanza de precisión 0.01 o 0.1 mg. Solubilizar las fracciones de lípidos para producir 1 mg de lípidos por cada 1 mL de hexano.
- Quite el hexano restante en la parte superior de la columna, utilizando una pipeta de gran volumen, o permitir que el hexano a gotear en un vaso limpio. Dejar aproximadamente 3 mL de hexano por encima de la arena en la parte superior de la columna.
4. limpieza
- Deje abierta la llave de paso e invertir la columna en el vaso de residuos. La alúmina y la arena se ejecutan fuera de la columna; por otra parte, agite para acelerar el proceso. Utilizar una varilla de pasador para buscar la lana de fibra de vidrio si se pega (rayar cristal) o soplar con una secuencia de N2 .
- Desarmar y limpiar toda la cristalería, con laboratorio-grado detergente en agua caliente en un recipiente de plástico con un pincel de la cristalería (con pelo o cerdas de plástico). Lavar 3 x. Enjuague con abundante agua tibia hasta que el vidrio ya no mancha al tacto.
- Lavar la cristalería y herramientas 3 x con agua desionizada. Colocarlos sobre una rejilla para secar al aire. Para acelerar el secado, añadir un pequeño volumen de acetona (3 mL) a la cristalería, Remolino y deje que se seque al aire o quedarse bajo una corriente de2 N.
Resultados
Siguiente de la extracción, el lípido total masa es el primer tipo de datos que pueden ser adquiridos a través del protocolo presentado aquí. Sin embargo, valores de masa total de lípidos no deben analizarse sin algún intento de estandarizar los valores obtenidos. Pueden utilizarse varios enfoques, pero se recomienda sea la normalización de la masa de lípidos extraídos SVL del animal (en centímetros) o a la masa de la piel de la vertiente que se extrajo. Los resultados anteriores en un valor de masa de lípidos por longitud y el segundo será una proporción de fuente masiva. La razón de la estandarización es que los animales más grandes producen naturalmente más lípidos de la piel porque tienen una mayor superficie total de la piel. Figura 1A es un ejemplo de esta asociación, donde las escalas masa de lípidos de piel extraído linealmente con la masa de arrojan la piel extraída. Una vez estandarizadas a la masa de piel total de la vertiente, esta relación lineal es completamente eliminado (figura 1B).
Después de fraccionamiento, se puede utilizar el mismo enfoque de estandarización con las masas de las fracciones individuales (figura 2). En este conjunto de datos de muestra, cada fracción no contribuye igualmente al total de lípidos extraido masa: lípidos neutros (fracciones 1-3) son el conjunto dominante de compuestos de gran proporción en comparación con cada conjunto de lípidos más polares (fracciones 4-6, 7-9 y 10-12).
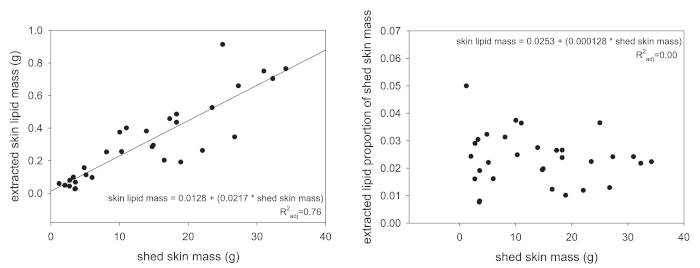
Figura 1: relaciones entre extrajeron los lípidos totales y entrada material. (A) en reptiles, la relación entre la vertiente total y la piel masa el lípido extraído de la piel masa está correlacionada positivamente (P < 0,001). (B) cuando el lípido extraído de la piel masa está estandarizada al arrojar masa total (lípidos masa dividida por la vertiente de la masa), esta relación ya no está presente (P = 0,46). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: estandarizado las masas de la fracción siguiente elución. Utilizando cromatografía de columna, extractos de lípidos de la piel pueden ser eluidos en fracciones, basados en la polaridad compuesta. La fracción de masa, entonces, expresa como una proporción del extracto lípido total (fracción masa en miligramos] dividida por la masa de extracto total de lípidos [en mg) para determinar diferencias entre fracciones o experimental grupos8. Las barras representan los medios. El error superior es SEM; el error de fondo es IC del 95%. Puntos de datos individuales se proporcionan para mayor claridad. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Representante Cromatógrafos de fracciones de metil cetona. (A) con la elución apropiada, metil cetonas son los compuestos más abundantes en la fracción 7 de la tabla 2 y puede ser vistas como coplas de picos (tiempo de retención = min 24-34). (B) fracción 6 de la tabla 2, sin embargo, sólo produce compuestos no objetivo. Este mismo resultado puede ocurrir cuando el solvente polar en la fase móvil está vencido o si la columna se detiene durante largos períodos de tiempo (> 1 h) entre fracciones. Tenga en cuenta la diferencia de abundancia molecular entre las dos huellas. Haga clic aquí para ver una versión más grande de esta figura.
| Fracción | Hexano (mL) | Éter dietílico (mL) |
| 1,2,3 | 100 [30] | 0 [0] |
| 4,5,6 | 98 [29.4] | 2 [0.6] |
| 7,8,9 | 96 [28.8] | 4 [1.2] |
| 10,11,12 | 92 [27.6] | 8 [2.4] |
| 13,14,15 | 84 [25.2] | 16 [4.8] |
Tabla 1: volumen de elución estándar para el fraccionamiento de lípidos de la piel. Porcentajes y volúmenes de solvente se dan para gran volumen (por ejemplo, 250 mL) y [volumen pequeño] (p. ej., 100 mL) columnas de cromatografía usando alúmina (actividad III). Hexano es el disolvente portador; el éter dietílico es la fase móvil.
| Fracción | Hexano (mL) | Éter dietílico (mL) | Notas |
| 1, 2, 3 | 30 | 0 | procederá a la elución; No recoja |
| 4, 5 | 28.8 | 1.2 | procederá a la elución; No recoja |
| 6, 7, 8 | 28.8 | 1.2 | recoger individualmente; mayoría de Cetona metílica de la Misa será en la fracción 7; Controles de calidad GC-MS se deben ejecutar en 6 y 8 para elución apropiado de las cetonas |
Tabla 2: esquema modificado de elución para cetonas metil de serpiente de Jarretera. Estos volúmenes son para uso con una columna de cromatografía de pequeño volumen y con la marca de alúmina disponible actualmente. La fracción eluída positiva para cetonas metil tiene una fuerte actividad biológica en ensayos de campo con salvajes, cortejando a serpientes de Jarretera macho1,7. Para confirmar la presencia de metil cetonas en las fracciones de blanco, las muestras pueden diluirse a 1 mg/mL y analizan mediante GC-MS. figura 3 muestra los cromatogramas representativos para resultados positivos y negativos después de elución.
Discusión
La extracción de lípidos de la piel en los reptiles puede aplicarse a la piel viva o muerta, además de piel de la vertiente, que ofrece versatilidad en la aplicación experimental de esta técnica. Además, se pueden hacer extracciones de los lípidos de la piel en el campo, para permitir una aplicación dinámica del método a una amplia gama de biólogos2,13. Extracción de lípidos de la piel es simple; por lo tanto, es fácil de escalar extracciones según sea necesario por experimento o diseño, y los médicos no necesitan conocimientos importantes para ejecutar los métodos. Los factores limitantes sólo para escalar son la disponibilidad de espacio de campana de humo, una abundancia de vidrio limpio, hermético y espacio de almacenamiento de solventes.
Piel lípidos Extracto de fraccionamiento puede ser adaptado a las necesidades del investigador y, por lo tanto, tiene una flexibilidad parecida a la extracción de lípidos. Por ejemplo, lípidos neutros pueden ser eluidos y luego descartados, para dar lugar a fracciones objetivo purificar compuestos de interés que pueden simplificar pruebas biológicas. Fraccionamiento puede realizarse en múltiples escalas dentro y a través de las muestras de lípidos. Por ejemplo, pueden ejecutar varias columnas al mismo tiempo para hacer más eficiente el proceso. O solamente una porción de un extracto lípido total puede ser fraccionada en una pequeña columna a, por lo tanto, los reactivos y el tiempo. Fraccionamiento está limitado principalmente por la masa del extracto total de lípidos y la precisión de los equipos disponibles para el investigador. Por ejemplo, si el investigador tiene una balanza con una precisión 10,0 mg, la determinación de la fracción de masa y, por tanto, la exactitud de la preparación de muestras para el análisis de GC-MS es significativamente, si no totalmente, impedida. Lo mismo vale para la cristalería. Si el investigador tiene una columna de gran volumen para el fraccionamiento, pero tiene una masa pequeña lípido total para separar, la elución o separación de los compuestos progresará, pero requerirá un importante despilfarro de solventes, reactivos, tiempo y potencialmente, el objetivo compuestos ellos mismos.
Se recomienda realizar una verificación de control de calidad antes de determinar el esquema de elución, como se ve en la tabla 2, y decidir qué fracciones pueden ser descartadas. Para confirmar la elución de los lípidos deseadas, una columna puede se run donde cada fracción, 1-15, se recoge individualmente y luego analiza utilizando GC-MS. En la figura 3, representante de cromatógrafo de gases trazas muestran que las cetonas metil de serpientes de la Liga sólo procederá a la elución de la columna en una fracción específica. Al realizar este paso de control de calidad, se puede desarrollar un esquema modificado de elución para que una determinada especie garantizar el máximo rendimiento de los compuestos de interés. Cambios en los materiales, como el proveedor o el lote de la alúmina o la edad del éter dietílico, resultará absolutamente en las diferencias de elución que deben controlarse para realizar una prueba de control de calidad.
Las técnicas descritas están limitadas principalmente por la naturaleza química de las señales que se pueden obtener. Principalmente, estos métodos sólo permiten a los investigadores aislar y separar los lípidos de cadena larga de la piel de los reptiles. Muchas especies de reptiles utilizan señales de aire o proteicos como señales químicas, y los métodos descritos son incompatibles con el aislamiento de dichas señales. Disolventes no polares, más no va a extraer señales acuosas de las superficies de los reptiles o de fuentes de deposición de cue (p. ej., agua de la jaula, materia fecal, sustrato acuático) que de hecho puede contener abundantes señales químicas. Métodos apropiados para la captura de estos tipos de señales están disponibles para los investigadores (e.g., microextracción en fase sólida [SPME] para claves volátiles y cromatografía líquida de alto rendimiento [HPLC] claves acuosa), aunque, como los métodos descritos anteriormente, existe una curva de aprendizaje técnica.
Lo más importante, la utilidad de la mezcla química final el investigador debe guiar los métodos utilizados. Por ejemplo, si un investigador quiere saber si un hombre animal focal puede distinguir entre las señales producidas por macho vs hembra conespecíficos en un bioensayo específico, la extracción es que el único método necesita2,3. Si el objetivo es la identificación de compuestos dimorfismo sexual, sin embargo, el extracto debe ser purificada, para permitir una mayor confianza en asignar identificaciones a moléculas específicas o grupos de moléculas a través de análisis químicos1, 6,9,11. Sin embargo, para incluso realizar cromatografía con una fuente de lípidos, una masa significativa de a partir de extracto es necesaria para que las masas medibles fracción pueden obtenerse; de lo contrario, la puesta en común de las muestras puede ser perseguido pero no es óptimo14.
Evolución futura de este protocolo incluye medidas para utilizar y adaptar el procedimiento para especies más reptilianas. También se están desarrollando métodos no invasivos adicionales de extracción de lípidos de la piel.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El desarrollo de estos métodos, especialmente la vertiente piel extracción, produjo acuerdos de cooperación (14-7412-1061-CA 15-7412-1155-CA y 16-7412-1269-CA) entre James Madison University (JMU) y el Animal Departamento de agricultura de Estados Unidos y planta de servicio de inspección sanitaria (APHIS). M.R.P. reconoce las contribuciones de los siguientes estudiantes para el desarrollo de los métodos de la piel de la vertiente: S. Patel (Universidad Washington and Lee [WLU]), J. Zachry (WLU), R. Flores (JMU), J. Noll (JMU) y S. Ashton (JMU).
Materiales
| Name | Company | Catalog Number | Comments |
| Powder-free Chloroprene Gloves | Microflex | NEC-288 | See "1.1 Shed Extraction set-up" (step 1.1.2 "gloves") |
| Ohaus Adventurer Precision Balance | Ohaus | AX622 | See "1.1 Shed Extraction set-up" (step 1.1.3 "balance") |
| Freund Container Ball 16oz Mason Jar & Lid | Ball | NC9661590 | See "1.1 Shed Extraction set-up" (step 1.1.5 "mason jar") |
| Hexane, Mixtures of Isomers | Sigma-Aldrich | 650544 | See "1.1 Shed Extraction set-up" (step 1.1.6 "hexane") |
| Hi/Lo Write-On Temperature Tape | Electron Microscopy Sciences | 5029927 | See "1.1 Shed Extraction set-up" (step 1.1.8 "tape") |
| Single-Neck Round-Bottom Flask, capacity 500 mL | Sigma-Aldrich | Z414514 | See "2. Extraction" (step 2.1.2.4 "500 mL") |
| Single-Neck Round-Bottom Flask, capacity 100 mL | Sigma-Aldrich | Z414492 | See "3.2 Fractionating" (step 3.2.4 "100 mL") |
| Cork Flask Support Ring | Sigma-Aldrich | Z512419 | See "2. Extraction" (step 2.1.2.1 "cork support ring") |
| Accu-jet Pro Pipette Controller | Sigma-Aldrich | Z671533 | See "2. Extraction" (step 2.1.1.3 "electric pipette controller") |
| Disposable Individually Wrapped Glass Serological Pipets, 10 mL | Pyrex | 13-666-7E | See "2. Extraction" (step 2.1.1.3 "10 mL pipette") |
| Rotavapor R II | Buchi | 2422A0 | See "2. Extraction" (step 2.1.2.1 "rotary evaporator") |
| Elliptical Bump Trap | Chemglass Life Science | 501215241 | See "2. Extraction" (step 2.1.2.1 "bump trap") |
| 7 mL Vials, Screw Top, Clear Glass | Supelco | 27151 | See "1.1 Shed Extraction set-up" (step 1.1.11 "7 mL vial") |
| 7 mL Vial Screw Cap, Solid Top with PTFE Liner | Supelco | 27152 | See "1.1 Shed Extraction set-up" (step 1.1.11 "cap") |
| 22 mL Vials, Screw Top, Clear Glass | Supelco | 27173 | See "1.1 Shed Extraction set-up" (step 1.1.11 "22 mL vial") |
| 22 mL Vial Screw Cap, Solid Top with PTFE Liner | Supelco | 27174-U | See "1.1 Shed Extraction set-up" (step 1.1.11 "cap") |
| Excellence XS Analytical Balance | Mettler-Toledo | XS205DU | See "2. Extraction" (step 2.1.2.1 "balance") |
| 5 3/4" Disposable Glass Pipette | Fisherbrand | NC0418555 | See "1.1 Shed Extraction set-up" (step 1.1.11 "pipette") |
| Chromatography column with PTFE Stopcock Assembly | Kimble-Chase | 17810-19300 | See "3.1 Preparing the column" (step 3.1.1 "small glass column") |
| Cast-Iron L-Shaped Base Support Stands | Fischerbrand | 11474207 | See "3.1 Preparing the column" (step 3.1.1 "support stand") |
| 3-Prong Dual Adjust Nickel-Plated Zinc Clamp | Troemner | 2300203 | See "3.1 Preparing the column" (step 3.1.1 "clamps") |
| Clamp Regular Holder | Fischerbrand | 05754Q | See "3.1 Preparing the column" (step 3.1.1 "clamp holder") |
| Sand,Washed and Dried | Macron Fine Chemical | MK-7062-212 | See "3.1 Preparing the column" (step 3.1.5 "sand") |
| Alumina, Neutral | Sorbtech | 15740-5 | See "3.1 Preparing the column" (step 3.1.7 "alumina"); only known manufacturer in the US |
| Narrow-Neck Heavy-Duty Glass Erlenmeyer Flask, 1000mL | Pyrex | 4980-1L | See "3.1 Preparing the column" (step 3.1.6 "Erlenmeyer flask") |
| Single-Neck Round-Bottom Flask, capacity 250 mL | Sigma-Aldrich | Z100684 | See "3.1 Preparing the column" (step 3.2.4 "250 mL round bottom flask") |
| Calibrated Chromatography Column with Solvent Reservoir | Sigma-Aldrich | Z560553 | See "3.2 Preparing the column" (step 3.2.1 "large glass column") |
| Ethyl Ether Anhydrous | Fisher Chemical | E138500 | See "3.2 Fractionating" (step 3.2.5 "ether") |
| Alconox Detergnet | Sigma-Aldrich | 242985 | See "4. Cleaning" (step 4.2 "Alconox") |
| Acetone (Certified ACS) | Fisher Chemical | A18P-4 | See "4. Cleaning" (step 4.4 "acetone") |
Referencias
- Mason, R. T., et al. Sex pheromones in snakes. Science. 245 (4915), 290-292 (1989).
- Mason, R. T., Parker, M. R. Social behavior and pheromonal communication in reptiles. Journal of Comparative Physiology A. 196 (10), 729-749 (2010).
- Martín, J., López, P., Rheubert, J. L., Siegel, D. S., Trauth, S. E. Pheromones and chemical communication in lizards. Reproductive Biology and Phylogeny of Lizards and Tuatara. , 43-77 (2014).
- Mayerl, C., Baeckens, S., Van Damme, R. Evolution and role of the follicular epidermal gland system in non-ophidian squamates. Amphibia-Reptilia. 36 (3), 185-206 (2015).
- Mathies, T., Levine, B., Engeman, R., Savidge, J. A. Pheromonal control of the invasive brown treesnake: potency of female sexual attractiveness pheromone varies with ovarian state. International Journal of Pest Management. 59 (2), 141-149 (2013).
- Parker, M. R., Patel, S. M., Zachry, J. E., Kimball, B. A. Feminization of male brown treesnake methyl ketone expression via steroid hormone manipulation. Journal of Chemical Ecology. 44 (2), 189-197 (2018).
- Parker, M. R., Mason, R. T., Sever, D., Aldridge, R. Pheromones in snakes: history, patterns, and future research directions. Reproductive Biology and Phylogeny of Snakes. , 551-572 (2011).
- Parker, M. R., Mason, R. T. Low temperature dormancy affects the quantity and quality of the female sexual attractiveness pheromone in red-sided garter snakes. Journal of Chemical Ecology. 35 (10), 1234-1241 (2009).
- Parker, M. R., Mason, R. T. How to make a sexy snake: estrogen activation of female sex pheromone in male red-sided garter snakes. Journal of Experimental Biology. 215 (5), 723-730 (2012).
- Alberts, A. C. Constraints on the design of chemical communication systems in terrestrial vertebrates. American Naturalist. 139, S62-S89 (1992).
- Martín, J., Ortega, J., López, P. Interpopulational variations in sexual chemical signals of Iberian wall lizards may allow maximizing signal efficiency under different climatic conditions. PLoS ONE. 10 (6), e0131492 (2015).
- Baeckens, S., et al. Environmental conditions shape the chemical signal design of lizards. Functional Ecology. 32 (2), 566-580 (2018).
- Greene, M. J., Mason, R. T. Chemically mediated sexual behavior of the brown tree snake, Boiga irregularis. Ecoscience. 5 (3), 405-409 (1998).
- Mason, R. T., Rodda, G., Chiszar, D., Sawai, Y., Tanaka, H. Integrated pest management: The case for pheromonal control of habu and brown tree snakes. Snakes and Man: Controlling Pest Species for Conservation and Human Health. , 196-205 (1998).
- Pruett, J. A., et al. Evolutionary interactions between visual and chemical signals: chemosignals compensate for the loss of a visual signal in male Sceloporus lizards. Journal of Chemical Ecology. 42 (11), 1164-1174 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados