Method Article
Chemische Isolierung, Quantifizierung und Trennung von Hautlipiden Reptilien
In diesem Artikel
Zusammenfassung
Bei Reptilien sind Hautlipiden von Artgenossen zum sexuellen signalisieren, mit möglichen Einsatz in invasive Arten Management entscheidend. Hier beschreiben wir Protokolle für die Gewinnung von Hautlipiden aus Schuppen Haut oder ganze Tiere, Bestimmung und Analyse der gesamten Lipid-Mass und trennt die Lipide mit Fraktionierung über Säulenchromatographie.
Zusammenfassung
Reptilien-signal zu Artgenossen mit Lipiden in ihrer Haut in erster Linie um Mate, die Verfolgung und Beurteilung zu ermöglichen. Die Isolation der diese Lipide hat Dienstprogramm in der Forschung konzentriert sich auf evolutionären Muster und Mechanismen der chemischen Kommunikation neben Abdichtung Rollenverständnis von Lipiden in der Evolution des irdischen Lebens. In angewandter Ansatz haben solche Haut basierenden Cues Einsatzmöglichkeiten für Wildtier-Manager Umgang mit invasiven Arten. Die wichtigsten Schritte zur Quantifizierung der Reptilien Hautlipiden im hier vorgestellten Protokoll gehören Extraktion, insgesamt Lipid Entschlossenheit und Fraktionierung über Säulenchromatographie, das letztere Verfahren gereinigten Eluate von Verbindungen, die dann wiederum entweder werden analysiert, um zusammengesetzte Identifikationen (z. B.Gaschromatographie-Massenspektrometrie [GC-MS]) zuweisen oder direkt in feiner Bioassays verwendet. Hautlipiden extrahiert werden können, von der lebenden Haut, Haut, oder tot ganze Tiere, mit unpolaren organischen Lösungsmitteln (z.B.Hexan, Benzol, Toluol) vergossen. Extraktion solubilisiert Lipide und dann das Lösungsmittel verdunstet werden kann, um eine messbare nur-Lipid-Extrakt ergeben. Fraktionierung bedeutet die Trennung von den insgesamt Lipid-Extrakt in bestimmten Eluate über traditionellen Säulenchromatographie. Der gesamten Lipid-Extrakt ist zunächst auf ein Substrat-basierten Spalte (z.B. Aluminiumoxid) gebunden und dann individuelle Eluate ("Fraktionen") des Lösungsmittels an bestimmte Volumes sind durchlaufen nacheinander die Spalte Sätze von Verbindungen aus der Lipid-Mischung eluieren basierend auf gemeinsamen Polarität. Die Fraktionen Fortschritte in der Polarität auf eine standardisierte Abfolge durch Erhöhung der relativen Menge des polaren Lösungsmittels (z.B. Diethylether) in unpolaren Lösungsmittel. In dieser Handschrift die, wir beschreiben mehrere Methoden zur Extraktion von Hautlipiden Reptilien und dann ein Standardprotokoll für unterschiedliche Verbindungen basierend auf Polarität, isolieren mit traditionellen Säulenchromatographie. Ganze Lipid-Extrakte oder bestimmte Fraktionen können dann in Bioassays biologischen Aktivität ausgelöst durch die Verbindungen darin bestimmen verwendet werden.
Einleitung
Reptilien produzieren Lipide in der Epidermis, entweder direkt aus Hautzellen oder aus diskreten Drüsen, die in sozialer Kommunikation, wie z. B. Mate Bewertung und Nachverfolgung, Territorialität, und intra- und interspezifische Anerkennung1,2 verwendet werden ,3,4. Die Isolation der diese Hautlipiden hat Dienstprogramm in der Forschung konzentriert sich auf evolutionären Muster und Mechanismen der chemischen Kommunikation neben Abdichtung Rollenverständnis von Lipiden in der Evolution des irdischen Lebens2,3 ,4. Darüber hinaus viele Reptilien, vor allem Squamates (Eidechsen, Schlangen), sind invasive Arten von Bedeutung in empfindliche Ökosysteme und die Entwicklung von Pheromon-basierte lockt zur Verbesserung der Fangmethoden und Entfernung ist laufenden5,6. Die Dichtheit von Reptilienhaut ermöglicht die Extraktion der Lipide vorhanden, relativ reine Extraktionen einer potenziell robuste Quelle der chemischen Signale zu erhalten. Das Prinzip Schritte zur Quantifizierung der Reptilien Hautlipiden im beschriebenen Protokoll gehören Extraktion, insgesamt Lipid Entschlossenheit und Fraktionierung über Spalte Chromatographie1,6,7. Die Methoden wurden routinemäßig verwendet, da sie erzielen bioaktive Isolate, die viel über Partnerwahl und Auswahl, vor allem in Schlangen2erklären.
Hautlipiden können lebende Haut, Schuppen-Haut, oder tot ganze Reptilien, mit unpolaren oder polaren organischen Lösungsmitteln1,7,8,9entnommen werden. Es sei darauf hingewiesen, dass Museumsexemplaren gespeichert in Lösungsmitteln wie Ethanol nicht optimal für die Gewinnung von Hautlipiden sind und nur frischen oder frisch gefrorenen Kadaver mögliche Quellen für die Extraktion als sollten. Hautlipiden sind träge, wodurch sie stabil an der Oberfläche der Haut und leicht zu7zu extrahieren. In ihre Signalisierung Rollen in Reptil-Ökologie Haut-Lipid-Cues sind oft in rauen Umgebungen hinterlegt, sondern wegen ihrer robusten chemischen Eigenschaften können solche Hinweise behalten ihren Informationswert über längere Zeit10,11 , 12. der Extraktionsprozess solubilisiert die Lipide mit einem unpolaren Lösungsmittel (z.B.Hexan, Benzol, Toluol) über eine Stunden lang einweichen, gefolgt von der Verdampfung des Lösungsmittels, lassen Sie eine messbare Masse von Lipid-Extrakt7 , 8. Hautlipiden sind hoch in unpolaren Lösungsmitteln mischbar, und eine Vielzahl von Kohlenwasserstoffen aus ebenso vielfältige Quellen extrahiert werden kann.
Fraktionierung ist mühsamer als Extraktion sondern dient dazu, die gesamten Lipid-Extrakt in bestimmten Fraktionen über Säulenchromatographie, Hilfe bei der Reinigung und mögliche Identifizierung der Verbindungen darin1, trennen 6 , 7 , 8. der gesamten Lipid-Extrakt wird gesprungen, um ein Substrat-basierten Spalte und dann einzelne Eluate ("Fraktionen") des Lösungsmittels an bestimmte Volumes sind durchlaufen nacheinander zu eluieren Sätze von Verbindungen aus der Lipid-Mischung, die eine gemeinsame Spalte Polarität6,7,8. Lipid-Chromatographie, standardisiert die Fraktionen Fortschritte in der Polarität an einigen Sequenz durch Erhöhung der relativen Menge des polaren Lösungsmittels (z.B. Diethylether) in unpolaren Lösungsmittel (in der Regel als Prozentwert ausgedrückt: 0 %, 2 %, 4 % Äther, etc.. )6,7,8. Obwohl Methoden wie Dünnschichtchromatographie (TLC) verwendet werden, kann um Lipide sind einfacher und Gemisch zu trennen, Säulenchromatographie bevorzugt, weil es ein geschlossenes System, nutzt leicht ist zu steuern, können separate mehr konzentrierte Mischungen, und ist kompatibel mit Multiplexing für Effizienz. In dieser Handschrift die, wir beschreiben mehrere Methoden zur Extraktion von Hautlipiden Reptilien und dann ein Standardprotokoll für unterschiedliche Verbindungen basierend auf Polarität, isolieren mit traditionellen Säulenchromatographie. In vielen Forschungsprojekten, an denen die Isolierung der chemischen Signale ist das ultimative Ziel um Veränderung in den Empfängern diese Cues ausgesetzt. Ganze Lipid-Extrakte oder bestimmte Fraktionen können dann in Bioassays verwendet werden, um festzustellen, dass biologischer Aktivität durch die Verbindungen darin1,2,6,7ausgelöst. In der biologischen Grundlagenforschung können beispielsweise Bioassays mit bestimmten Fraktionen Forscher offenbaren, dass eine gereinigte Quelle von Pheromonen isoliert wurde und dann Methoden zur Identifizierung der Ziel Verbindungen verfolgt werden können. Aus Sicht der Wildlife-Management Identifikation kann nicht das Ziel sein, und stattdessen könnten der aktiven Anteil im Feld zu Artgenossen in fallen locken oder hemmen Mate-tracking in ausländische Lebensraum13,14verwendet werden.
Protokoll
Alle Verfahren im Zusammenhang mit der Verwendung von Wirbeltieren stimmten die institutionellen Animal Care und verwenden Ausschuss der James Madison University.
1. Gewinnung
-
Schuppen-Haut-Extraktion
- Ein einziges Reptil, entfernen den Kopf und Blasenekstrophie Abschnitte, die die Proben kontaminieren können ca. 30 cm2 Schuppen entnehme. Chloropren-Handschuhe tragen und die Schuppen von Schmutz zu reinigen.
- Tarieren Sie die Balance mit einer Tasche oder wiegen Sie Boot und wiegen Sie den Schuppen (± 0,01 g).
Hinweis: Die Masse Genauigkeit richtet sich nach der Genauigkeit der Waage. Schuppen-Haut Masse ist die Standardisierung Faktor für extrahierte Haut Lipid Masse (siehe unten) und deutlich mit extrahierten Lipid covaries Masse. - Trennen Sie die Schuppen in kleinere Stücke (5 cm2) und fügen Sie sie in einen verschließbaren Glasbehälter mit Hexan-kompatiblen Deckel (z.B. ein Glas Einmachglas mit einem Metall-Deckel oder eine Labor-Flasche mit einem PTFE-Deckel). Dekantieren Sie genug Hexan in den Behälter, die Schuppen-Haut-Stücke vollständig eintauchen. Verschließen Sie den Behälter.
Achtung: Hexan ist brennbar, Atemwege reizend, und ist mit mehreren kurz- und langfristige Gesundheitsrisiken verbunden. Verfahren im Zusammenhang mit Hexan werden in einem Abzug (Labor) oder im Freien (Feld) durchgeführt, während das Tragen geeigneten persönlichen Schutzausrüstung (PSA) (z.B., Splash Schutzbrillen, Chloropren Handschuhe, lange Ärmel, enge Schuhe). - Beschriften Sie das Behältnis mit einem Bleistift oder Kugelschreiber lösungsmittelbeständig. Lassen Sie das Behältnis in der Dunstabzugshaube bei Raumtemperatur über Nacht oder bis zu 24 h.
- Entfernen Sie die Schuppen-Stücke mit sauberen Metall Pinzetten oder einer Zange. Schütteln Sie die Stücke, um alle verbleibenden Hexan im Container zu behalten. Lassen Sie die Haut-Stücke auf Küchenpapier trocknen; dann verwerfen. Wenn mehrere Extraktionen durchgeführt werden, reinigen Sie die Zange/Pinzette zwischen jeder Probe. Um die Zange/Pinzette zu reinigen, spülen Sie sie in ca. 50 mL Hexan in ein Becherglas.
- Wird der Extrakt nicht sofort verwendet werden, Dekantieren oder pipette den Auszug in eine Glasflasche angemessene Lautstärke, versiegeln Sie es mit einer PTFE-Gefütterte Mütze, beschriften Sie es und bei-20 ° c lagern
Achtung: Da der Extrakt Hexan enthält, speichern Sie die Fläschchen in eine explosionsgeschützte Tiefkühltruhe.
-
Tot ganze Tier Extraktion
- Notieren Sie die Kopf-Rumpf-Länge (KRL; in cm) und Masse (in Gramm) des Tieres. Wenn die Lipid oder Pheromon Gesamtproduktion pro Einheit der Fläche der Haut werden bestimmt soll, verwenden Sie ein Schneider-Maßband um die maximale Körperumkreis (in Zentimetern) abzurufen.
- Wählen Sie für die Gewinnung eines Containers mit einem Durchmesser, der 1/3 der Länge des Tieres ist. Positionieren Sie den Kadaver sicher an der Unterseite des Behälters mit dem Kopf und Kloake an der Spitze. Dekantieren Sie ausreichend Hexan in den Behälter, die untergetauchte Fläche des Körpers zu maximieren.
Hinweis: Wenn der Kopf oder Kloake für eine gewisse Zeit in der Extraktion eingetaucht werden, nehmen Sie Kenntnis. - Sichern Sie den Deckel, beschriften Sie die Behälter und legen Sie ihn in einer Dampfhaube bei Raumtemperatur über Nacht oder bis zu 24 h.
- Wenn Sie den Kadaver zu entfernen, verwenden Sie sauber Metall Pinzetten oder einer Zange. Behalten Sie das restliche Hexan auf den Kadaver in den Container dadurch, dass es aus dem Körper, nicht aus dem Kopf oder Rute zu Tropfen. Verschließen Sie den Behälter.
- Wird der Extrakt nicht sofort verwendet werden, Dekantieren des Extrakts oder in ein Glasfläschchen des entsprechenden Bandes pipette, versiegeln Sie es mit einer PTFE-Gefütterte Mütze, beschriften Sie es und bei-20 ° c lagern
(2) Lipid Massenbestimmung
Hinweis: Die extrahierten Lipid Masse kann auf zwei Arten ermittelt werden: mit einer Glasflasche oder mit einem Rundboden-Kolben mithilfe einer Drehverdampfer.
- Bestimmen Sie die extrahierten Lipid Masse über die Glas-Fläschchen-Methode.
- Verwenden Sie ein preweighed Fläschchen von ausreichender Größe (7 mL, 22 mL, 50 mL, etc.). Gehören die Kappe und das Label in der Gesamtmasse, oder immer wiegen das Fläschchen ohne Kappe und Label (Markierungen auf dem Etikett hinzufügen auch Masse). Platzieren Sie die Beschriftung auf den Hals der Flasche um Wasserkontakt zu vermeiden.
Hinweis: Die Verdunstung in Glasfläschchen ist effizient, wenn der Forscher hat Zugang zu einem vielfältigen Gasanlage wo können mehrere Fläschchen gleichzeitig unter einer N-2 -Stream verdampft werden. - Übertragen Sie den Extrakt auf das Fläschchen, mit einer Glaspipette mit einem Gummiball oder für großvolumige Extrakte, eine elektronische Pipette-Controller mit einem Einweg-10 mL Glaspipette. Spülen Sie den Behälter mit ~ 3 mL Hexan und Transfer zu den Fläschchen sowie.
- Die Probe unter einem sanften N-2 -Stream zu verdampfen. Kippen Sie das Fläschchen in einem Winkel zu eine maximale Lösungsmittel Fläche ermöglichen. Kondensat wird an der Außenseite der Flasche bilden, wie das Hexan verdunstet.
Hinweis: Ringe von Lipid werden in der Ampulle bilden, wie das Hexan verdunstet, also in regelmäßigen Abständen wirbeln den Extrakt. - Verdunsten Sie Probe zu Trockenheit; dann Erfolgsmessung. Aufzeichnung der gesamten Lipid-Ertrag.
Hinweis: Für die Analyse zwischen den verschiedenen Gruppen, standardisieren die Lipid Masse entweder Masse vergossen (Lipid Masse [g] geteilt durch Schuppen Masse [g] x 100 ergibt die prozentuale Lipid-Masse des Schuppens) oder das Tier SVL (Lipid Masse [mg] geteilt durch SVL [in Zentimeter]; liefert die Lipid-Masse pro Längeneinheit). Größere Tiere produzieren mehr Lipid, und viele Arten sind stark sexuell dimorphen, die auferlegt erhebliche Verzerrungen in den Daten.
- Verwenden Sie ein preweighed Fläschchen von ausreichender Größe (7 mL, 22 mL, 50 mL, etc.). Gehören die Kappe und das Label in der Gesamtmasse, oder immer wiegen das Fläschchen ohne Kappe und Label (Markierungen auf dem Etikett hinzufügen auch Masse). Platzieren Sie die Beschriftung auf den Hals der Flasche um Wasserkontakt zu vermeiden.
- Bestimmen Sie die extrahierten Lipid Masse über die Drehverdampfer.
- Für eine schnellere Verdampfung pro einzelne Probe den Extrakt auf einem preweighed Rundboden-Kolben übertragen und mit einem Drehverdampfer verdunsten.
- Wenn Partikel im Extrakt wahrnehmbar sind, Filtern Sie die Probe indem man einen Filterpapier Kegel in den Hals der Flasche; dann übertragen Sie das Extrakt in den Kolben und Schwerkraft Filter erlauben. Entsorgen Sie das Filterpapier, nach der vollständigen Extrakt übertragen wird.
Hinweis: Das Probenvolumen übertragen (bis zu ca. 80 % Flasche Volumen) vor rotary Verdampfung. Blasenbildung des Extraktes in den Kondensator der Drehverdampfer führt zu Verunreinigungen und erfordert den Kondensator gereinigt werden. Eine Beule Falle kann zwischen den Kolben und den Hals des Kondensators platziert werden, treten Bläschen oder "stoßen" in den meisten Proben.
- Wenn Partikel im Extrakt wahrnehmbar sind, Filtern Sie die Probe indem man einen Filterpapier Kegel in den Hals der Flasche; dann übertragen Sie das Extrakt in den Kolben und Schwerkraft Filter erlauben. Entsorgen Sie das Filterpapier, nach der vollständigen Extrakt übertragen wird.
- Schalten Sie das rotierende Verdampfer und Wasser Bad (50 ° C; niedriger als Lösemittel Siedepunkt). Schalten Sie die Kaltwasser fließen in den Kondensator.
Hinweis: Der Kondensator die Drehverdampfer ist entweder eine zirkulierende Kühler oder einem Kaltwasser Zapfen Entlüftung nach dem Abfluss verbunden. Die Durchflussmenge kann langsam sein, wenn das Wasser kälter als ambient, Lösungsmitteldampf die Flasche verlassen und betreten den Kondensator kondensiert ist. - Schalten Sie die Vakuumquelle (Wasser Vakuum oder Pumpe). Sicherstellen Sie, dass der Unterdruck ausreicht, um die Flasche an den Hals des Kondensators zu halten. Öffnen Sie die Vent am Ende des Kondensators vor dem Anschließen der Küvette. Schieben Sie den Kolben auf den Hals des Kondensators, in der Nähe des Schlot zu versiegeln, und sicherzustellen, dass die Flasche aus dem Kondensator trennen kann nicht, wenn der Kolben freigegeben wird.
- Senken Sie den Kolben bis ~ 50 % in das Bad eingetaucht ist. Starten Sie die Drehung des Kolbens bei mittlerer Geschwindigkeit. Wenn das Vakuum, Geschwindigkeit, Kondensator fließen und Badtemperatur optimal sind, wird der Lösemitteldampf verlassen den Kolben auf die Spule kondensieren und tropft in den Recovery-Kolben.
- Wenn die Probe kocht (z.B., große Luftblasen, schnelle Vergasung), sofort zu reduzieren, das Vakuum und/oder Geschwindigkeit der Drehverdampfer. Wenn das Kochen weiter, schalten Sie die Küvette Rotation, schalten Sie das Vakuum erhöhen Sie den Kolben aus dem Bad und lassen Sie die Vakuum-Dichtung. Wiederholen Sie 2.2.3 und 2.2.4.
Hinweis: Wenn keine Lösungsmittel in den Recovery-Kolben sammelt, aber der Extrakt ist offensichtlich verdunstet, das Vakuum ist höchstwahrscheinlich unrationelle und muss neu justiert werden.
- Wenn die Probe kocht (z.B., große Luftblasen, schnelle Vergasung), sofort zu reduzieren, das Vakuum und/oder Geschwindigkeit der Drehverdampfer. Wenn das Kochen weiter, schalten Sie die Küvette Rotation, schalten Sie das Vakuum erhöhen Sie den Kolben aus dem Bad und lassen Sie die Vakuum-Dichtung. Wiederholen Sie 2.2.3 und 2.2.4.
- Verdunsten die Probe unter Vakuum bis ~ 2 mL Lösungsmittel bleibt in der Flasche (großvolumige Auszüge) oder, wenn eine preweighed Flasche verwendet wird, zu verdunsten, bis eine Perle von Flüssigkeit mit einem < 1 cm Durchmesser ist in der Unterseite der Flasche sichtbar. Schalten Sie die Rotation und Vakuum; dann heben Sie die Flasche aus dem Bad.
- Halten Sie den Hals der Flasche, als das Vakuum, das Siegel freigegeben wird; Drehen Sie den Hals um es aus dem Kondensator zu schieben. Wenn ein große Menge Kolben verwendet wird, Wirbeln des kondensierten Extraktes in der Flasche sichtbar Lipide aufzulösen; übertragen Sie anschließend die Lösung per Pipette auf ein kleineres Volumen, preweighed Kolben. Fügen Sie 3 mL Hexan, spülen den großen Kolben, schwenken Sie es, in den kleineren Kolben pipette und wieder verdunsten (Schritte 2.2.3 - 2.2.5).
- Die Wulst der Flüssigkeit in den Extrakt wird verdunstet das Hexan zu festigen. Nach dem Trocknen, lassen Sie es auf Zimmertemperatur kommen. Lipide bilden eine durchscheinende, weiße bis gelbe Wachs in den Kolben (~ 5 min). Wiegen Sie die Flasche um die endgültige Masse zu erhalten.
Hinweis: Abhängig von der Art der Lipide extrahiert, müssen sie entweder fest (z.B. Wachs) oder halbfeste (z.B. Rohöl) Eigenschaften, vor allem wenn das fraktionierte Lipide verdampft sind (siehe unten).
- Für eine schnellere Verdampfung pro einzelne Probe den Extrakt auf einem preweighed Rundboden-Kolben übertragen und mit einem Drehverdampfer verdunsten.
- Lösen Sie die Lipide in das aufgenommene Volumen von Hexan ≥1 mg Lipid pro 1 mL Hexan zu liefern. Das Arbeitsvolumen für Chromatographie voran ist ~ 5 mL. Bei der Übertragung von Kolben, Fläschchen, 2 mL des Gesamtvolumens die Flasche Spülen nach der Übertragung der Mehrheit des Extraktes auf die Durchstechflasche zu behalten.
- Beschriften Sie die Fläschchen, mit PTFE-ausgekleidet Kappen verschließen und Lagern bei-20 ° C.
3. die Säulenchromatographie
Hinweis: Unbekannte Verbindungen basierend auf Polarität in bestimmten Fraktionen, extrahierten Lipid trennen Masse kann Spalten hinzugefügt mit vorbereiteten Flüssigkeitschromatographie und fraktioniert mit standard Elution.
- Vorbereitung der Spalte
- Abhängigkeit von der Masse der Lipid-Extrakt verwenden Sie entweder eine groß- oder eine Chromatographiesäule kleinvolumige Glas mit einem Teflon-Absperrhahn. Die Spalte ist entweder mit oder verschmolzen zu einem festen Volumen Reservoir (500 mL für eine große Spalte; 250 mL für eine kleine Spalte). Von nun an verweist dieses Protokoll nur auf eine großvolumige Chromatographiesäule verschmolzen zu einem Reservoir. Reinigen Sie jede neue Glaswaren und Teile in der Chromatographie verwendet werden, wie in Abschnitt 4 beschrieben gründlich; dann spülen sie mit Hexan oder anderen unpolaren Lösungsmittel.
- Falten Sie ein Stück Fiberglas Wolle (~ 14 cm in der Länge [L] X 4 cm in der Breite [W]) wiederholt, bis ein Quadrat von ~ 4 cm x 4 cm gebildet wird. Verwenden Sie einen hölzernen Dübel Stab länger als die um die Glasfaser am unteren Rand der Spalte zu positionieren.
- Sichern Sie die Spalte in eine Haube zu einem standard Ring Stand mit zwei Klammern (z.B., drehbar oder Modular), über den Absperrhahn und unter dem Hals des Stausees. Ebene der Spalte. Position der Spalte in einer Höhe um ausreichenden Arbeitsabstand für 500 mL-Becherglas leicht unter der Spalte passt zu ermöglichen. Öffnen Sie den Absperrhahn.
- Gießen Sie gewaschen und getrocknet Sand in die Spalte eine ~ 3 cm Sand über die Glasfaser aufliegt. Schwarz oder dunkelblau Papier unter der Spalte, und tippen sie sanft. Sand aus der Spalte mit jedem Wasserhahn fällt, reicht die Fiberglas-Barriere. Wiederholen Sie die Schritte 3.1.2 - 3.1.4.
Hinweis: Verwenden Sie eine entfaltete Büroklammer mit Klebeband an das Ende eines Stabes Dübel, um die Glasfaser aus dem Boden zu holen. - Stellen Sie den 500 mL-Becher unter der Spalte. Dekantieren Sie langsam ~ 25 mL Hexan aus einer 100 mL-Becherglas oder Messzylinder in Spalte eines Behälters, den Sand nass. Schließen Sie den Absperrhahn, wenn ~0.5 Hexan über dem Sand cm.
- Neutrales Aluminiumoxid abwiegen. Verwenden Sie für jede kleine Spalte ~ 50 g; ~ 175 g für jede große Spalte. Gießen Sie das Aluminiumoxid in eine 1 L-Erlenmeyerkolben. 400 g Aluminiumoxid pro 1 L Flasche zu begrenzen.
- Aktivieren der Tonerde (Aktivität III), pipette deionisiertes Wasser eines Datenträgers entspricht 6 % der Tonerde Masse (d.h., für 100 g Aluminiumoxid, 6 mL Wasser hinzufügen). Fügen Sie das Wasser als Tropfen in der Tonerde.
- Decken Sie den Kolben mit Alufolie oder einem Korken. Kräftig schwenken (nicht schütteln), die Ladung gleichmäßig zu verteilen. Fortgesetzt, bis keine sichtbaren Klumpen bleiben.
Hinweis: Die Küvette wird warm, wie das Wasser mit dem Aluminiumoxid reagiert, was zu erwarten ist. - Fügen Sie Hexan hinzu, bis die Tonerde mit ~0.5 cm von Hexan oberhalb der Tonerde vollständig bedeckt ist. Schwenken Sie die Flasche um einen Brei zu bilden.
- Setzen Sie einen belüfteten Trichter in das Reservoir der Spalte und einen 500-mL-Becherglas unterhalb der Spalte. Öffnen Sie den Absperrhahn. Wirbeln Sie das Aluminiumoxid und stetig Gießen Sie sie in der Spalte. Stellen Sie sicher das Aluminiumoxid ließ sich gleichmäßig in der Spalte und keine großen Luftblasen oder Risse in der Tonerde Spalte bilden. Klopfen Sie leicht die Seite der Spalte, die gleichmäßig die Tonerde zu begleichen.
Hinweis: Zusätzliche Hexan muss für zusätzliche gießt, weiterhin die Gülle hinzugefügt werden. Das Hexan sammeln in den Becher unter der Spalte kann wiederverwendet werden, wenn das Glasgefäß zu Beginn sauber war. - Die Spalte wird gebildet, wenn der obere Teil der Tonerde stabil und ~ 4 cm unter dem Hals der Spalte auf der Basis des Stausees ist. Verwenden Sie eine Pipette, um das Innere des Reservoirs mit Hexan für passives Aluminiumoxid zu spülen. Mit einem Trichter, sanft Hinzufügen einer zweiten Schicht aus Sand auf Aluminiumoxid, ~ 1 cm unter dem Reservoir.
Hinweis: Hexan fließt aus der Spalte der Absperrhahn geöffnet bleibt. Lassen Sie sich nicht die Spalte austrocknen. Wenn die Spalte austrocknet, muss der Prozess wieder beginnen ab Schritt 3.1.2. Das Protokoll kann hier beendet werden, wenn die Spalten, einen Tag vor der Fraktionierung bereit sind. Fest einen Korken in der Spitze des Stausees oder decken Sie eng mit Folie ab. Füllen Sie den Tank mit ~ 100 mL Hexan. Ziehen Sie den Absperrhahn.
- Fraktionierung von der Lipid-Extrakt
Hinweis: Unabhängig von der Spaltengröße, Bruchteile von Lipid-Extrakt können einzeln gesammelt und gebündelt anhand ihrer Polarität Bruchteil oder ausrangierte komplett wenn sie keine bekannten/identifiziert Ziel Verbindungen enthalten. Runden von replizieren Elution (n = 3 Bände) werden durch die Säule Sicherstellung ausreichender Elution der Lipide übergeben. Folgen Sie Tabelle 1 große Spalte Elution (mit einem Auszug Masse > 30 mg) oder kleine Spalte Elution (mit einem Auszug Masse < 30 mg). Eine maßgeschneiderte Elution Protokoll für die Isolierung von Methyl-Ketone ist in Tabelle 2.- Entfernen der restlichen Hexan am oberen Rand der Spalte, mit einer Pipette großvolumigen oder das Hexan, in ein sauberes Becherglas abtropfen lassen. Lassen Sie ca. 3 mL Hexan über dem Sand am oberen Rand der Spalte.
Hinweis: Die gesammelten Hexan ist rein, wenn es nur saubere Gläser kontaktiert und in der ersten Fraktion recycelt werden kann. - Die Lipid-Extrakt auf die Spalte, mit einer langen Glas-Pipette zu übertragen. Langsam pipette den Extrakt, um nicht zu stören die Sandschicht. Spülen Sie den Extrakt Vial oder Kolben mit ~ 5 mL Hexan und überträgt es auf die Spalte.
Hinweis: Wenn der Extrakt bei-20 ° C gelagert wurde, werden die Lipide ausgefällt. Wärmen Sie das Fläschchen, bis nicht mehr Niederschlag sichtbar ist. - Öffnen Sie den Absperrhahn und lassen Sie die Probe in der Spalte laden. Wenn der Extrakt eine große Masse hat (> 30 mg), eine gelbliche Band möglicherweise sichtbar aus Aluminiumoxid, knapp unter dem Sand an der Spitze. Der Durchfluss in einem Abfall Becherglas zu sammeln, wie diese Hexan nicht mehr sauber ist. Schließen Sie den Absperrhahn, wenn ~ 3 mL oben auf dem Sand bleibt.
Achtung: Die Lipid-Extrakt, jetzt verpflichtet, Tonerde und Spalte kann nicht austrocknet oder die Probe werden verloren gehen. - Legen Sie eine preweighed und beschriftete Rundboden-Flasche (100 mL, 250 mL oder 500 mL) unter der Spalte vor dem Gießen der ersten Fraktion. Brüche, die verworfen werden können in einem gemeinsamen Glasbehälter gesammelt werden.
- Vorbereiten die erste Fraktion (100 % Hexan: 0 % Diethylether [bisher, "Äther"]) in einem Messzylinder. Wenn Brüche im Voraus, mit Folie abdecken oder Stopper mit Kork vorbereiten.
Hinweis: Brüche Fortschritte in der Polarität; Daher muss der Zylinder nicht zwischen Brüchen gespült werden. - Fügen Sie die erste Fraktion zum Stausee von Gießen über eine belüftete Glastrichter auf einer Seite des Stausees geleitet, um nicht zu stören die Sandschicht hinzu. Öffnen Sie den Absperrhahn um die Elution zu starten. Schließen Sie den Absperrhahn, wenn ~ 3 mL Hexan über dem Sand am oberen Rand der Spalte bleibt.
Hinweis: Nie hören Sie eine Elution innerhalb einer einzelnen Bruches durch den Absperrhahn schließen, bevor der Großteil das Eluat gesammelt wurden auf. Zwischen den Fraktionen lassen Sie sich nicht der Absperrhahn geschlossen ~ 1 h länger weil Verzögerungen die Qualität und Wiederholbarkeit der Elution verändern können. - Wiederholen Sie die Schritte 3.2.4 - 3.2.6 für Brüche 2 und 3. Sammeln Sie die Brüche in entsprechend großen Korbflaschen, die Freiraum für rotary Verdunstung zu ermöglichen, vor allem, wenn die Fraktionen sind gebündelt werden.
- Bereiten Sie einen vierten Teil (2 % Äther) und fügen Sie es zum Stausee. Legen Sie die nächste Flasche unter der Spalte, öffnen Sie den Absperrhahn und sammeln Sie die vierte Fraktion zu. Bereiten Sie einen fünften Teil; dann weiter nach Bedarf.
Hinweis: Es ist möglich, die ersten Fraktion(en) über rotary Verdampfung beim Sammeln von aufeinander folgenden Fraktionen zu verdampfen. - Erhalten Sie für die Zubereitung von Fraktionen in GC-MS-Analysen verwendet werden eine Bruchteil Masse mit einer Präzisionswaage 0,01 oder 0,1 mg. Lösen Sie die Lipid-Fraktionen um 1 mg Lipid pro 1 mL Hexan ergeben.
- Entfernen der restlichen Hexan am oberen Rand der Spalte, mit einer Pipette großvolumigen oder das Hexan, in ein sauberes Becherglas abtropfen lassen. Lassen Sie ca. 3 mL Hexan über dem Sand am oberen Rand der Spalte.
4. Reinigung
- Lassen Sie den Absperrhahn geöffnet und invertieren Sie die Spalte in den Abfall Becher zu. Die Tonerde und Sand werden aus der Spalte ausgeführt; Alternativ schütteln Sie, um den Prozess zu beschleunigen. Verwenden Sie einen Dübel-Stab um die Fiberglas-Wolle zu holen, wenn es klemmt (vermeiden Sie Kratzer auf Glas) oder mit einer N-2 -Stream ausblasen.
- Zerlegen Sie und reinigen Sie alle Gläser, mit Laborqualität Reinigungsmittel in heißem Wasser in einer Kunststoffwanne mit einer Glas-Bürste (mit Haaren oder Kunststoffborsten). Waschen Sie 3 X. Spülen Sie mit viel warmem Wasser ab, bis das Glas nicht mehr glatt anfühlt.
- Spülen Sie das Glas und Werkzeuge 3 X mit entionisiertem Wasser. Legen Sie sie auf einem Gestell an der Luft trocknen. Um die Trocknung zu beschleunigen, fügen Sie ein kleines Volumen von Aceton (3 mL), Glaswaren, wirbeln, und lassen Sie ihn an der Luft trocknen oder unter einer N-2 -Stream laufen.
Ergebnisse
Folgenden Extraktion, die insgesamt Lipid Masse ist die erste Art von Daten, die durch das Protokoll hier vorgestellten erworben werden können. Insgesamt Lipid Massewerte sollte jedoch nie ohne irgendeinen Versuch, die erhaltenen Werte zu standardisieren analysiert werden. Mehrere Methoden können verwendet werden, aber wir empfehlen entweder Standardisierung der extrahierten Lipid-Mass des Tieres SVL (in Zentimetern) oder die Masse der Schuppen-Haut, die gewonnen wurde. Die früheren Ergebnisse in einen Wert mit Lipid-Masse-pro-Länge und Letzteres werden ein Teil der Quelle Masse. Der Grund für die Standardisierung ist, dass größere Tiere natürlich mehr Lipide der Haut zu produzieren, weil sie eine größere Fläche der gesamten Haut haben. Abbildung 1A steht beispielhaft für diese Zuordnung, wo die extrahierten Haut Lipid Masse Skalen linear mit der Masse von extrahiert Häuten. Sobald der gesamten Halle Haut Masse standardisiert, ist diese lineare Beziehung vollständig entfernt (Abbildung 1 b).
Nach der Fraktionierung kann der gleichen Ansatz der Standardisierung mit den Massen der einzelnen Fraktionen (Abbildung 2) verwendet werden. In diesem Beispieldatensatz jede Fraktion trägt nicht gleichmäßig auf die gesamte extrahierte Lipid Masse: neutrale Lipide (Fraktionen 1-3) sind die dominierenden Verbindungen durch Masse Anteil im Vergleich zu jedem Satz mehr polaren Lipide (Brüche, 4-6, 7-9 und 10-12).
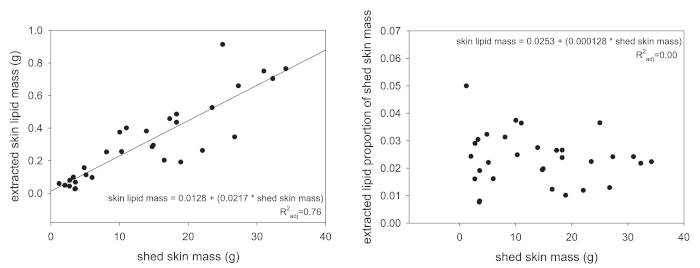
Abbildung 1: Beziehungen zwischen Lipid-Masse und input-Material extrahiert. (A) bei Reptilien, die Beziehung zwischen der gesamten Halle Masse und die extrahierten Haut Lipid Haut Masse positiv korreliert (P < 0,001). (B) wenn die extrahierten Haut Lipid Masse ist standardisiert, die gesamte Masse vergossen (die Lipid Masse geteilt durch den Schuppen Masse), diese Beziehung ist nicht mehr vorhanden (P = 0,46). Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: standardisiert nach Elution Massenanteile. Mit Säulenchromatographie, können Haut-Lipid-Extrakte in Fraktionen, basierend auf zusammengesetzte Polarität eluiert werden. Der Bruchteil Masse wird, dann, ausgedrückt als Anteil an der gesamten Lipid-Extrakt (Bruchteil Masse [in Milligramm] geteilt durch Gesamt Lipid-Extrakt Masse [in Milligramm) Unterschiede zwischen den Fraktionen oder experimentellen Gruppen8bestimmen. Die Balken repräsentieren die Mittel. Die obere Fehler ist SEM; der unteren Fehler ist 95 % CI. Einzelne Datenpunkte sind aus Gründen der Übersichtlichkeit zur Verfügung gestellt. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: repräsentative Gaschromatographen der Methyl-Keton-Fraktionen. (A) mit der richtigen Elution Methyl-Ketone sind die am häufigsten vorkommenden Verbindungen in Teil 7 aus Tabelle 2 und kann als Couplets der Gipfel gesehen werden (Verweilzeit = 24-34 min). (B) Teil 6 aus Tabelle 2ergibt jedoch nur Energiesubventionen Verbindungen. Dasselbe Ergebnis kann auftreten, wenn das polare Lösungsmittel verwendet in der mobilen Phase abgelaufen ist oder wenn die Spalte für längere Zeit beendet wird (> 1 h) zwischen den Fraktionen. Beachten Sie den Unterschied in molekularen Fülle zwischen den beiden Ablaufverfolgungen. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Bruchteil | Hexan (mL) | Diethylether (mL) |
| 1,2,3 | 100 [30] | 0 [0] |
| 4,5,6 | 98 [29,4] | 2 [0,6] |
| 7,8,9 | 96 [28.8] | 4 [1,2] |
| 10,11,12 | 92 [27,6] | 8 [2.4] |
| 13,14,15 | 84 [25.2] | 16 [4.8] |
Tabelle 1: Standard Elution Bände für Haut Lipid Fraktionierung. Solvent Mengen und Prozentsätze sind für großvolumige (z.B. 250 mL) und [kleinvolumigen] (z.B. 100 mL) Chromatographiesäulen mit Tonerde (Aktivität III) gegeben. Hexan ist der Träger Lösungsmittel; Diethylether ist die mobile Phase.
| Bruchteil | Hexan (mL) | Diethylether (mL) | Notizen |
| 1, 2, 3 | 30 | 0 | eluieren; sammeln keine |
| 4, 5 | 28,8 | 1.2 | eluieren; sammeln keine |
| 6, 7, 8 | 28,8 | 1.2 | individuell zu sammeln; Mehrheit der Methyl-Keton Masse werden in Teil 7; GC-MS Qualitätskontrollen sollte auf 6 und 8 richtige Elution von der Ketone darauf ausgeführt werden |
Tabelle 2: modifizierte Elution Schema für Garter Snake Methyl-Ketone. Diese Bände sind für den Einsatz mit einem kleinvolumigen Chromatographiesäule und mit der Marke von Aluminiumoxid, die derzeit zur Verfügung. Der eluierten Bruch positiv für Methyl-Ketone hat eine starke Bioaktivität in Feld-Assays mit Wild, umwerben männlichen Strumpfbandnattern1,7. Bestätigen das Vorhandensein von Methyl Ketone in den Ziel-Fraktionen, Proben können bis 1 mg/mL verdünnt werden und via GC-MS. analysiert vorsieht Abbildung 3 sowohl positive als auch negative Ergebnisse nach Elution repräsentative Chromatogramme.
Diskussion
Die Gewinnung von Hautlipiden bei Reptilien einsetzbar, lebende oder tote Haut, neben Schuppen-Haut, die Vielseitigkeit in der experimentellen Anwendung dieser Technik bietet. Darüber hinaus können Extraktionen von Hautlipiden im Feld ermöglichen eine dynamische Anwendung der Methode zu einer Vielzahl von Biologen2,13erfolgen. Gewinnung von Hautlipiden ist einfach; Daher, es ist leicht, scale-up Extraktionen Bedarf pro Experiment oder Design und Praktiker müssen nicht signifikante Erfahrung die Methoden ausführen. Die einzige limitierenden Faktoren für die Aufstockung sind die Verfügbarkeit von Dunstabzugshaube Platz, eine Fülle von sauberen, verschließbaren Glas und Lösungsmittel Stauraum.
Haut-Lipid-Extrakt-Fraktionierung kann auf ein Forscher Bedürfnisse zugeschnitten werden und daher hat ähnliche Flexibilität, Lipid-Extraktion. Beispielsweise können neutrale Lipide eluiert und dann verworfen, um Ziel Brüche führen, die eventuell Verbindungen des Interesses zu reinigen, Bioassays zu vereinfachen. Fraktionierung kann auf mehreren Skalen innerhalb und zwischen den Lipid-Proben durchgeführt werden. Beispielsweise können mehrere Spalten gleichzeitig ausgeführt werden, um den Prozess effizienter zu gestalten. Oder nur ein Teil des gesamten Lipid-Extrakt kann fraktioniert auf eine kleine Spalte zu, damit, Reagenzien und Zeit ersparen. Fraktionierung ist in erster Linie durch die Masse der gesamten Lipid-Extrakt und die Genauigkeit der Geräte zur Verfügung, um die Forscherin begrenzt. Zum Beispiel bei der Forscher eine Bilanz mit einer 10,0 mg-Präzision, die Bestimmung des Bruches Masse und somit ist die Genauigkeit der Probenvorbereitung für die GC-MS-Analyse deutlich, wenn auch nicht vollständig, behindert. Das gleiche gilt für die Glaswaren. Wenn der Forscher eine großvolumige Spalte für die Fraktionierung hat, aber eine kleine Summe Lipid-Masse hat zu trennen, die Elution oder Trennung der Verbindungen wird Fortschritt aber erfordert eine erhebliche Verschwendung von Lösemitteln, Reagenzien, Zeit und möglicherweise das Ziel Verbindungen selbst.
Es wird empfohlen, eine Qualitätskontrolle vor der Bestimmung der Elution Schema durchführen, wie in Tabelle 2dargestellt, und entscheiden, welche Fraktionen verworfen werden können. Die Elution der gewünschten Lipide, eine Spalte zu bestätigen kann Lauf wo jede Fraktion, 1-15, einzeln gesammelt und anschließend analysiert, GC-MS verwenden. In Abbildung 3zeigen repräsentative Gaschromatograph Spuren, dass Methyl-Ketone von Strumpfbandnattern nur aus der Spalte in einem bestimmten Bruchteil eluieren. Von diesem Schritt Qualitätskontrolle, kann eine modifizierte Elution Schema für eine gegebene Art um die maximale Ausbeute an die Verbindungen des Interesses zu gewährleisten entwickelt werden. Änderungen in den Materialien, wie z. B. Lieferant oder Menge von Aluminiumoxid oder das Alter der Diethylether werden absolut unterschiedlichen Elution führen, die für kontrolliert werden sollte, durch eine Qualitätskontrolle Test.
Die beschriebenen Techniken sind vor allem durch die chemische Natur der Cues beschränkt, die erreicht werden kann. Diese Methoden ermöglichen in erster Linie nur Forscher isolieren und langkettige Fette aus der Haut der Reptilien zu trennen. Viele Arten von Reptilien in der Luft und/oder proteinhaltige Cues als chemische Signale verwenden, und die beschriebenen Methoden sind nicht kompatibel mit genannten Hinweise zu isolieren. Weitere, unpolaren Lösungsmitteln extrahiert nicht wässrigen Hinweise von den Oberflächen der Reptilien oder Quellen der Cue-Ablagerung (z.B., Käfig Wasser, Fäkalien, aquatische Substrat), die in der Tat reichlich chemische Signale enthalten können. Geeignete Methoden für die Erfassung derartiger Hinweise stehen Forscher (z.B.Solid Phase Microextraction [SPME] für flüchtige Cues und Hochleistungs-Flüssigchromatographie [HPLC] für wässrige Hinweise), obwohl, wie die Methoden oben beschrieben, gibt es eine technische Lernkurve.
Am wichtigsten ist, sollte das Dienstprogramm der endgültige chemische Mischung, die Forscher verwendeten Methoden leiten. Beispielsweise wenn ein Forscher will wissen, ob die Signale, die durch männliche vs. weibliche Artgenossen in eine gezielte Bioassay produziert ein männliches fokale Tier unterscheiden kann, ist die Extraktion, brauchte die einzige Methode,2,3. Wenn die Identifizierung von sexuell dimorphen Verbindungen das Ziel ist, darf jedoch der Extrakt gereinigt werden, um mehr Vertrauen in bestimmte Moleküle oder Gruppen von Molekülen über chemische Analyse1Kennungen zuweisen zu können, 6,9,11. Um die Chromatographie mit einer Lipidquelle selbst durchführen zu können, ist eine bedeutende Masse des Beginnens Extrakt jedoch erforderlich damit messbare Massenanteile erzielt werden können; Andernfalls die Bündelung von Proben kann verfolgt werden jedoch nicht optimale14.
Zukünftige Entwicklungen dieses Protokolls gehören Maßnahmen zu nutzen und das Verfahren für mehr Reptilien Arten passen. Weitere nicht-invasive Methoden der Gewinnung von Hautlipiden werden auch entwickelt.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Entwicklung dieser Methoden, insbesondere Schuppen Haut Lipid Extraktion, Kooperationen (14-7412-1061-CA, 15-7412-1155-CA und 16-7412-1269-CA) zwischen James Madison University (JMU) und das US Department of Agriculture Animal aufgetreten und Plant Health Inspection Service (APHIS). M.R.P. anerkennt die Beiträge der folgenden Studenten zur Entwicklung der Schuppen-Haut-Methoden: S. Patel (Washington and Lee University [WLU]), J. Zachry (WLU), R. Flores (JMU), J. Noll (JMU) und S. Ashton (JMU).
Materialien
| Name | Company | Catalog Number | Comments |
| Powder-free Chloroprene Gloves | Microflex | NEC-288 | See "1.1 Shed Extraction set-up" (step 1.1.2 "gloves") |
| Ohaus Adventurer Precision Balance | Ohaus | AX622 | See "1.1 Shed Extraction set-up" (step 1.1.3 "balance") |
| Freund Container Ball 16oz Mason Jar & Lid | Ball | NC9661590 | See "1.1 Shed Extraction set-up" (step 1.1.5 "mason jar") |
| Hexane, Mixtures of Isomers | Sigma-Aldrich | 650544 | See "1.1 Shed Extraction set-up" (step 1.1.6 "hexane") |
| Hi/Lo Write-On Temperature Tape | Electron Microscopy Sciences | 5029927 | See "1.1 Shed Extraction set-up" (step 1.1.8 "tape") |
| Single-Neck Round-Bottom Flask, capacity 500 mL | Sigma-Aldrich | Z414514 | See "2. Extraction" (step 2.1.2.4 "500 mL") |
| Single-Neck Round-Bottom Flask, capacity 100 mL | Sigma-Aldrich | Z414492 | See "3.2 Fractionating" (step 3.2.4 "100 mL") |
| Cork Flask Support Ring | Sigma-Aldrich | Z512419 | See "2. Extraction" (step 2.1.2.1 "cork support ring") |
| Accu-jet Pro Pipette Controller | Sigma-Aldrich | Z671533 | See "2. Extraction" (step 2.1.1.3 "electric pipette controller") |
| Disposable Individually Wrapped Glass Serological Pipets, 10 mL | Pyrex | 13-666-7E | See "2. Extraction" (step 2.1.1.3 "10 mL pipette") |
| Rotavapor R II | Buchi | 2422A0 | See "2. Extraction" (step 2.1.2.1 "rotary evaporator") |
| Elliptical Bump Trap | Chemglass Life Science | 501215241 | See "2. Extraction" (step 2.1.2.1 "bump trap") |
| 7 mL Vials, Screw Top, Clear Glass | Supelco | 27151 | See "1.1 Shed Extraction set-up" (step 1.1.11 "7 mL vial") |
| 7 mL Vial Screw Cap, Solid Top with PTFE Liner | Supelco | 27152 | See "1.1 Shed Extraction set-up" (step 1.1.11 "cap") |
| 22 mL Vials, Screw Top, Clear Glass | Supelco | 27173 | See "1.1 Shed Extraction set-up" (step 1.1.11 "22 mL vial") |
| 22 mL Vial Screw Cap, Solid Top with PTFE Liner | Supelco | 27174-U | See "1.1 Shed Extraction set-up" (step 1.1.11 "cap") |
| Excellence XS Analytical Balance | Mettler-Toledo | XS205DU | See "2. Extraction" (step 2.1.2.1 "balance") |
| 5 3/4" Disposable Glass Pipette | Fisherbrand | NC0418555 | See "1.1 Shed Extraction set-up" (step 1.1.11 "pipette") |
| Chromatography column with PTFE Stopcock Assembly | Kimble-Chase | 17810-19300 | See "3.1 Preparing the column" (step 3.1.1 "small glass column") |
| Cast-Iron L-Shaped Base Support Stands | Fischerbrand | 11474207 | See "3.1 Preparing the column" (step 3.1.1 "support stand") |
| 3-Prong Dual Adjust Nickel-Plated Zinc Clamp | Troemner | 2300203 | See "3.1 Preparing the column" (step 3.1.1 "clamps") |
| Clamp Regular Holder | Fischerbrand | 05754Q | See "3.1 Preparing the column" (step 3.1.1 "clamp holder") |
| Sand,Washed and Dried | Macron Fine Chemical | MK-7062-212 | See "3.1 Preparing the column" (step 3.1.5 "sand") |
| Alumina, Neutral | Sorbtech | 15740-5 | See "3.1 Preparing the column" (step 3.1.7 "alumina"); only known manufacturer in the US |
| Narrow-Neck Heavy-Duty Glass Erlenmeyer Flask, 1000mL | Pyrex | 4980-1L | See "3.1 Preparing the column" (step 3.1.6 "Erlenmeyer flask") |
| Single-Neck Round-Bottom Flask, capacity 250 mL | Sigma-Aldrich | Z100684 | See "3.1 Preparing the column" (step 3.2.4 "250 mL round bottom flask") |
| Calibrated Chromatography Column with Solvent Reservoir | Sigma-Aldrich | Z560553 | See "3.2 Preparing the column" (step 3.2.1 "large glass column") |
| Ethyl Ether Anhydrous | Fisher Chemical | E138500 | See "3.2 Fractionating" (step 3.2.5 "ether") |
| Alconox Detergnet | Sigma-Aldrich | 242985 | See "4. Cleaning" (step 4.2 "Alconox") |
| Acetone (Certified ACS) | Fisher Chemical | A18P-4 | See "4. Cleaning" (step 4.4 "acetone") |
Referenzen
- Mason, R. T., et al. Sex pheromones in snakes. Science. 245 (4915), 290-292 (1989).
- Mason, R. T., Parker, M. R. Social behavior and pheromonal communication in reptiles. Journal of Comparative Physiology A. 196 (10), 729-749 (2010).
- Martín, J., López, P., Rheubert, J. L., Siegel, D. S., Trauth, S. E. Pheromones and chemical communication in lizards. Reproductive Biology and Phylogeny of Lizards and Tuatara. , 43-77 (2014).
- Mayerl, C., Baeckens, S., Van Damme, R. Evolution and role of the follicular epidermal gland system in non-ophidian squamates. Amphibia-Reptilia. 36 (3), 185-206 (2015).
- Mathies, T., Levine, B., Engeman, R., Savidge, J. A. Pheromonal control of the invasive brown treesnake: potency of female sexual attractiveness pheromone varies with ovarian state. International Journal of Pest Management. 59 (2), 141-149 (2013).
- Parker, M. R., Patel, S. M., Zachry, J. E., Kimball, B. A. Feminization of male brown treesnake methyl ketone expression via steroid hormone manipulation. Journal of Chemical Ecology. 44 (2), 189-197 (2018).
- Parker, M. R., Mason, R. T., Sever, D., Aldridge, R. Pheromones in snakes: history, patterns, and future research directions. Reproductive Biology and Phylogeny of Snakes. , 551-572 (2011).
- Parker, M. R., Mason, R. T. Low temperature dormancy affects the quantity and quality of the female sexual attractiveness pheromone in red-sided garter snakes. Journal of Chemical Ecology. 35 (10), 1234-1241 (2009).
- Parker, M. R., Mason, R. T. How to make a sexy snake: estrogen activation of female sex pheromone in male red-sided garter snakes. Journal of Experimental Biology. 215 (5), 723-730 (2012).
- Alberts, A. C. Constraints on the design of chemical communication systems in terrestrial vertebrates. American Naturalist. 139, S62-S89 (1992).
- Martín, J., Ortega, J., López, P. Interpopulational variations in sexual chemical signals of Iberian wall lizards may allow maximizing signal efficiency under different climatic conditions. PLoS ONE. 10 (6), e0131492 (2015).
- Baeckens, S., et al. Environmental conditions shape the chemical signal design of lizards. Functional Ecology. 32 (2), 566-580 (2018).
- Greene, M. J., Mason, R. T. Chemically mediated sexual behavior of the brown tree snake, Boiga irregularis. Ecoscience. 5 (3), 405-409 (1998).
- Mason, R. T., Rodda, G., Chiszar, D., Sawai, Y., Tanaka, H. Integrated pest management: The case for pheromonal control of habu and brown tree snakes. Snakes and Man: Controlling Pest Species for Conservation and Human Health. , 196-205 (1998).
- Pruett, J. A., et al. Evolutionary interactions between visual and chemical signals: chemosignals compensate for the loss of a visual signal in male Sceloporus lizards. Journal of Chemical Ecology. 42 (11), 1164-1174 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten