Method Article
Récolte de venin toxines d’Assassin Bugs et autres insectes hétéroptères
Dans cet article
Résumé
Bien que beaucoup d’insectes dans le sous-ordre des hétéroptères (Insecta : Hemiptera) sont venimeux, leur composition du venin et les fonctions de leurs toxines venin sont pour la plupart inconnues. Ce protocole décrit les méthodes pour récolter des hétéroptères venins pour davantage de caractérisation, utilisant l’électrostimulation, de harcèlement et dissection de la glande.
Résumé
Les insectes hétéroptères comme assassin bugs (Reduviidae) et punaises d’eau géantes (Belostomatidae) descendant d’un ancêtre commun de prédateur et venimeux, et la plupart des consommables existantes conserve cette stratégie trophique. Certains consommables sont passés au se nourrissant de sang de vertébrés (tels que les bogues de kissing, Triatominae ; et punaises de lit, Cimicidae) tandis que d’autres ont retourné à se nourrissant de plantes (plus Pentatomomorpha). Toutefois, à l’exception de la salive utilisée par kissing bugs pour faciliter l’alimentation en sang, peu est connu sur hétéroptères venins contre les venins de serpents, les scorpions et les araignées.
Un obstacle à la caractérisation des toxines venin hétéroptères est la structure et la fonction des glandes venin/labiale, qui sont morphologiquement complexes et d’effectuer de multiples rôles biologiques (défense, capture des proies et digestion extra-orale). Dans cet article, nous décrivons trois méthodes, que nous avons utilisé avec succès pour recueillir les hétéroptères venins. Tout d’abord, nous présentons électrostimulation comme un moyen pratique de recueillir le venin qui est souvent mortelle lorsqu’elle est injectée en proie des animaux, et qui permet d’éviter la contamination par du tissu glandulaire. Deuxièmement, nous montrons que doux harcèlement d’animaux est suffisante pour produire l’extrusion du venin de la trompe et/ou de venin craché dans certains groupes de consommables. En troisième lieu, nous décrivons des méthodes pour récolter des toxines venin par dissection des animaux anesthésiés pour obtenir les glandes à venin. Cette méthode est complémentaire aux autres méthodes, car elle peut permettre la récolte des toxines des taxons dans lequel l’électrostimulation et le harcèlement sont inefficaces. Ces protocoles permettra aux chercheurs de récolter les toxines des hétéroptères insectes pour la caractérisation de la structure-fonction et applications possibles en médecine et l’agriculture.
Introduction
Hétéroptères venins sont des substances bioactives puissamment1. Par exemple, les sécrétions de venin/salive de sang-alimentation hétéroptères comme kissing bugs (Triatominae) et les punaises de lit (Cimicidae) facilite l’alimentation en perturbant l’hémostase2. Toxines dans ces venins ciblent des voies multiples, y compris la coagulation, l’agrégation plaquettaire et une vasoconstriction, ainsi que la douleur et démangent des voies. Venins de la plupart des espèces d’hétéroptères sont adaptés pour faciliter la prédation plutôt que de nourrir de sang. Leurs venins causent la paralysie, la mort et la liquéfaction des tissus lorsqu’elle est injectée dans les invertébrés3,4. Lorsqu’elle est injectée dans les vertébrés, leur venin peut aussi avoir des effets drastiques. Par exemple, injection de venin de l’assassin bug Holotrichius innesi dans vertébrés provoque la douleur, une paralysie des muscles et l’hémorragie ; souris envenomated par ce bogue mourir rapidement à cause de la paralysie des muscles respiratoires5.
Études de transcriptomique et protéomique ont révélé la composition en protéines de certains venins hétéroptères. Venins d’espèces prédatrices sont riches en protéases, autres enzymes et des peptides et des protéines de structure inconnue et fonction6,7,8. Kissing bug venin est riche dans la famille des protéines triabin, dont les membres affectent profondément la coagulation, l’agrégation plaquettaire et une vasoconstriction2,9. Cependant, on ne sait pas quelles toxines sous-tendent la plupart des bioactivités de venin. Par exemple, le venin de Triatoma infestans kissing bug a été signalé à être analgésique et inhibent les canaux de sodium10, mais les composants responsables restent à élucider. De même, on ne sait pas quel composant du venin d’assassin bug cause la paralysie ou la douleur. Une condition sine qua non pour identifier les toxines responsables bioactivités venin particulier et pour la caractérisation de la structure et la fonction des toxines venin roman, est l’obtention de venin.
Venin a été obtenue de consommables par électrostimulation5,6,7,8,11,12,13, provocation de défensive réponses4,8, mécaniquement comprimant le thorax12,14,15,16, dissection venin glandes8,17 ,18,19,20,21,22et l’application des agonistes des récepteurs muscariniques de l’acétylcholine23. A en juger les éventuels avantages et inconvénients de n’importe quelle méthode est compliquée par la morphologie des glandes à venin hétéroptères, qui se composent d’une glande principale avec deux lumières séparées, la glande principale antérieure (AMG) et la glande principale postérieure (PMG), ainsi que d’un glandes accessoires associés (AG). Ces compartiments de différentes glandes produisent des sécrétions de différentes protéines, qui peuvent être spécialisées pour différentes fonctions biologiques, y compris la capture des proies, de défense et de digestion extra-orale8,17. Dans peiratine et ectrichodiine assassin bugs, l’AMG a été associé à la capture des proies et la PMG avec digestion extra-orale17. Toutefois, dans le harpactorine bug Pristhesancus plagipennis la PMG est spécialisée pour la capture des proies et la digestion tandis que l’AMG est l’hypothèse à sécréter venin défensif8. L’AG a été décrit comme ayant une fonction sécrétrice peu assassin bugs8 ou comme un important site de stockage de protéase dans les punaises d’eau géantes23. De toute évidence, les travaux supplémentaires sont nécessaire pour clarifier la fonction de chaque compartiment de la glande entre les divers sous-groupes d’hétéroptères et à déterminer la fonction de la plupart des toxines venin. Dans ce rapport, nous décrivons des protocoles pour la récolte des toxines venin de consommables pour atteindre ce but.
Protocole
Ce protocole est conforme à la politique de l’Université du Queensland énoncée dans Responsible Care et l’utilisation des animaux dans l’enseignement et de recherche (PPL 4.20.11) ainsi que la National Health et Medical Research Council code australien pour le soin et l’utilisation de animaux à des fins scientifiques (8ème édition 2013).
ATTENTION : prendre soin de ne pas pour être envenomated lors de la gestion des bugs de l’assassin. Prenez soin de protéger les yeux lors de la manipulation des espèces qui crachent le venin défensivement. Prendre soin dans l’ensemble ne pas de blesser les animaux de laboratoire. Cela comprend la surveillance de la pression sur les restrictions telles que des bandes de caoutchouc et de veiller à ce que la trompe n’est pas cassée.
Remarque : Vous pouvez également anesthésier animaux par l’exposition au CO2 pendant 0,5 à 2 min ou refroidissement de 4-10 ° C avant la récolte de venin dans vise 1-3 pour faciliter le transfert sûr et retenue. Anesthésie, n’est pas strictement nécessaire mais peut faciliter la retenue sûre des spécimens agiles ou fortes. Toutefois, les animaux doivent être éveillés pour permettre la récolte de venin. N’oubliez pas les applications en aval lorsqu’ils décident ou non d’ajouter des inhibiteurs de la protéase.
1. récolte de venin toxines par électrostimulation
- Obtenir des spécimens vivants permettant de récolter des toxines.
- Utilisation des brucelles en plastique préparés à l’avance avec des électrodes positives et négatives monté à chaque extrémité. Se connecter à pinces électrifiées à un électrostimulateur ou une source de tension constante qui permet le réglage de la tension.
- Pour les petites (environ 10 mm) et gros (~ 25 mm) assassin bugs, utiliser des tensions de crête de 15 et 25 V respectivement.
- Pour les plus grands consommables tels que les punaises d’eau géantes, utiliser jusqu'à 40 V.
- Retenir les insectes vivants par leur cerclage sur une plate-forme, à l’aide d’un élastique sur le thorax.
- Placer l’extrémité de la trompe dans une pointe de collecte appropriée. Pour les bugs de l’assassin, utiliser un embout de pipette P200. Pour les punaises d’eau géantes, couper l’extrémité large une pointe P200 pour augmenter la taille de l’ouverture.
- Soulevez la trompe avec une paire fermée de pince à épiler propre doucement et poussez l’ouverture de l’embout de la collection sur l’extrémité de la trompe.
- Si vous le souhaitez, absorption ~ 5 µL eau ultrapure avant de placer la trompe dans la collecte de pointe. Cela réduit les pertes de venin restant à l’intérieur de la pointe, bien que le venin récolté sera dilué.
- Appliquer l’électrostimulation. Plonger les électrodes stimulants en gel conducteur, tels que 2,5 M NaCl/50% glycérol. Appliquer les électrodes sur le thorax. Pour belostomatids, appliquer les deux électrodes à la surface dorsale postérieure de la tête.
- Stocker le venin pour empêcher autodégradation. Après que le venin est expulsé, transférer rapidement dans un tube à-20 ° C ou -60 ° C, ou d’un tube contenant le cocktail inhibiteur de protéase.
- Répétez les étapes 1.5 et 1.6 jusqu'à ce que le venin suffisant est acquis ou d’aucune autre venin n’est attendu.
2. récolte de venin toxines par le harcèlement
- Préparer les animaux pour la récolte de venin et placer l’extrémité de la trompe dans un vestibule de la collection, tel que décrit dans les paragraphes 1.1 et 1.3-1.4.
- Si le venin est expulsé spontanément, passez à l’étape 2.3. Si ce n’est pas le cas, harceler les animaux par le doucement toucher sur les jambes, l’abdomen et l’antenne avec des pincettes jusqu'à ce que le venin est produite.
- Transférer rapidement le venin dans un tube à-20 ° C-60 ° C ou un tube contenant inhibiteur de protéase cocktail, si vous le souhaitez.
3. récolte de venin toxines par le harcèlement de venin « Cracher » espèces
- Anesthésier, ou partiellement anesthésier, l’insecte avant de le retirer de son enceinte pour empêcher tout cracher défensive prématurée.
- Provoquer le venin craché de comportement. Contenir et repositionner l’insecte en utilisant le couvercle profond d’une norme 90 x 16 mm boîte de Pétri. Maintenir le couvercle légèrement en arrière et 1 à 4 cm au-dessus de l’insecte pour prévenir le vol. La plupart des insectes vont cracher plusieurs fois, souvent en succession rapide. S’assurer que tout venin n’est perçue sur le dessous du plat.
- Recueillir le venin sur la face inférieure de la boîte de Pétri en rinçant avec 10 µL d’eau ultrapure. Les transférer rapidement dans un tube à-20 ° C ou -60 ° C, ou d’un tube contenant le cocktail inhibiteur de protéase.
4. récolte de venin toxines par Dissection de la glande
- Sacrifier des animaux. Fortement anesthésier et tuer les animaux à l’aide de > 5 min l’exposition au CO2. Pipe pure CO2 directement dans les trous d’aération du boîtier de logement de l’animal.
- Insecte broche au plateau de dissection. Pour les bugs de l’assassin, disséquer par le biais de la face ventrale (4.3). Pour les punaises d’eau géantes, disséquer par le biais de la surface dorsale (4.4).
- Dissection ventrale
- Insérer les trois broches dans l’abdomen postérieur à maintenez l’insecte sans percer les glandes à venin.
- Couper une incision médiane court dans la surface ventrale de l’abdomen à l’aide d’un scalpel miniature. Utiliser des ciseaux miniatures de prolonger l’incision médiane antérieure à la tête, en prenant soin de couper l’exosquelette seulement et ne pas endommager les structures internes.
- Pour exposer les structures internes, faites plusieurs coupes latérales qui s’étend de l’incision de la ligne médiane du côté de l’insecte. Puis, broche arrière chaque lambeau de ventrale exosquelette pour révéler les structures internes.
- Pour grands assassin bugs, faire des incisions latérales quatre, dans le milieu de l’abdomen, antérieur l’abdomen, entre les jambes de premiers et deuxième et en face de la première manche.
- Dissection dorsale
- Retirer les ailes près de la base. Insérer les trois broches dans l’abdomen postérieur à maintenez l’insecte sans percer les glandes à venin.
- Couper une incision médiane de la tête à l’abdomen à l’aide de ciseaux miniatures et bistouri, en prenant soin de couper l’exosquelette seulement et ne pas endommager les structures internes.
- Forcer à part les deux moitiés de l’insecte. Placer plusieurs broches latéralement sur toute la longueur de l’insecte de quitter la cavité intérieure exposée.
- Supprimer les muscles du vol à l’aide de la pince à épiler.
- Inonder le plateau de dissection. Ajouter PBS jusqu'à ce que le bug est immergé pour permettre aux structures internes flottent vers le haut et être plus facilement visualisés.
- À l’aide de micro-ciseaux et pinces à épiler, retirez soigneusement le conjonctif et le tissu nerveux et la trachée. Les glandes à venin apparaissent comme allongé, structures translucides s’étendant le long de chaque côté du canal digestif.
- Identifier la glande principale par son aspect caractéristique, avec des lobes antérieurs et postérieurs et deux conduits au hile.
- Si vous le désirez, identifiez la glande accessoire en traçant la gaine depuis le hile. Gratuitement la glande principale en coupant les deux conduits émanant du hile.
- Récolter les lumens de glande désirée. Transférer la glande à une micro-centrifugeuse sur glace contenant 30 µL de PBS ou PBS et inhibiteur de la protéase cocktail. Lance les glandes avec une épingle propre forte.
- Vortexer pendant 10 s et centrifuger (1 min, 5 000 × g, 4 ° C) pour vider les lumens de la glande. Retirez le tissu glandulaire avec une pincette.
- Clarifier l’extrait de toxine. Centrifugeuse (5 min, 17 000 × g, 4° C) pour éliminer les particules solides, conservant le surnageant et jeter le culot. Conserver à-20 ° C ou -60 ° C à prévenir la dégradation de l’autoproteolytic.
Résultats
Certaines espèces d’hétéroptères, tels que le harpactorine P. plagipennis et le reduviine Platymeris Rhadamanthe, rendement fiable (5-20 µL) de grandes quantités de venin en réponse à l’électrostimulation (tableau 1). En général, la plupart des bugs peiratine, reduviine et harpactorine donnent venin en réponse à cette méthode. Parmi stenopodaine bogues, électrostimulation a suscité le venin de Oncocephalus SP., mais pas de Thodelmus sp. Les bugs de holoptiline et emesine échantillonnés n’ont pas donné de venin significative (par exemple assez pour l’analyse par spectrométrie de masse) en réponse à l’électrostimulation. Électrostimulation permet également de récolter du venin de belostomatid bogues et punaises prédatrices. Cependant, électrostimulation de scorpions d’eau (Nepidae) induit la libération du contenu des glandes céphaliques seulement, plutôt que du venin de la trompe. Échec à la récolte de venin par électrostimulation chez certaines espèces est probablement dû à la complexité morphologique des glandes à venin et les mécanismes physiologiques qui contrôlent la libération du venin8.
En plus de libérer le venin grâce à l’électrostimulation, les réduviidés P. plagipennis, Havinthus rufovarius, P. Rhadamanthe et le belostomatid distinctifemur Lethocerus, volonté spontanément éjecter le venin de la trompe lors de la manipulation. Cette éjection de venin est fréquemment accompagnée d’affichages défensives. Rhadamanthe P. crache également le venin défensivement4, un comportement qui se produit dans des serpents et des araignées24 25 mais dont nous ne sommes pas au courant de dans n’importe quelle autre espèce reduve.
SDS-PAGE et la protéomique des expériences démontrent que les venins récoltés par électrostimulation et le harcèlement sont riches en protéines6,7,8. Les protéines représentent une grande partie du matériel présent, mais il est également probable que les venins contiennent des ions inorganiques et autres substances. Bug assassin venin obtenu par électrostimulation et le harcèlement en général contient plus d’une centaine des peptides et protéines (Figure 1, Figure 2). Belostomatid venin signale déjà riche de lysophospholipides13. Spectres d’absorption infrarouge du venin de l’insecte d’eau belostomatine Diplonychus eques concordent avec une teneur en protéines et lysophospholipides. Pour le lethocerine L. distinctifemur, a trouvé la preuve que pour les protéines et non pas lysophospholipides6.
Tel qu’indiqué pour araignée venins26, venin récolté par des insectes hétéroptères est susceptible de varier en concentration et composition, selon l’insecte utilisé et la méthode par laquelle il est récolté. Spectroscopie UV d’échantillons dilués venin suggère des valeurs d’absorbance (un280) de 50 à 250 (longueur de chemin d’accès de 10 mm) pour venin non dilué, compatible avec une concentration élevée en protéines de ~ 50-250 mg/mL7,12,19. Privation de proies a été signalée à provoquer une augmentation successive venin concentration et paralytique potentiels3 ainsi que des diminutions successives de pH27. Toutefois, famine prolongée provoque une perte de condition et de la mort. Ainsi que de la concentration, la méthode par laquelle le venin est récolté dans consommables peut-être affecter sa composition. La composition de la toxine du venin de l’insecte assassin plagipennis P. diffère nettement selon s’il a été récolté par électrostimulation ou harcèlement8. Dans le cas de P. plagipennis, cela s’est avéré être en raison de l’électrostimulation, ce qui donne le contenu de la PMG, alors que le harcèlement a donné le contenu de l’AMG. Venin obtenu par électrostimulation, mais pas de harcèlement, puissamment paralysés proies insectes (Figure 3). Toutefois, on ignore dans quelle mesure ce résultat peut être généralisé aux autre Reduviidae ou autre Heteroptera.
Récolte de venin directement en disséquant des glandes à venin permet les mécanismes de contrôle des glandes à venin à être contournées, au détriment de la contamination avec des protéines de tissu glandulaire (non-venin). Malgré tout, les extraits obtenus de matériau découpé peuvent être utilisés pour les épreuves de bioactivité/toxicité. Par exemple, extraits du PMG, AMG et AG de P. plagipennis, établie à l’aide du protocole précité, ont été analysés par chromatographie en phase liquide/tandem spectrométrie de masse8. Ce processus a identifié un total de 182, 114 et 71 protéines au total, dont 45, 51 et 12 ont été classés comme des protéines de venin putatif basées sur les caractéristiques de séquence d’acides aminés, avec les autres protéines qualifiées de protéines de ménage putatif. Injection d’extraits de la PMG, mais pas AMG ou AG, en insectes a entraîné la paralysie et la mort8.
| Infra-ordre | Famille | Sous-famille des | Nom binominal | Nom commun | Électrostimulation | Harcèlement | Dissection |
| Cimicomorpha | Reduviidae | Harpactorinae | Pristhesancus plagipennis | Commune Brisbane assassin bug | √ | √ | √ |
| Havinthus rufovarius | Tigre rouge assassin bug | √ | √ | √ | |||
| Scipinia arenacea | Bug d’assassin tortue rouge | √ | ND | √ | |||
| Gminatus spp. | Grand orange assassin bug | √ | ND | √ | |||
| Trachylestes aspericollis | Petit rouge assassin bug | √ | ND | ND | |||
| Reduviinae | Platymeris spp. | Géant africain assassin bug | √ | √ | √ | ||
| Psytalla horrida | Aiguillat assassin bug | √ | ND | √ | |||
| Peiratinae | Ectomocoris spp. | Orange terrain assassin bug | √ | ND | √ | ||
| Peirates spp. | Noir assassin bug | √ | ND | ND | |||
| Stenopodainae | Oncocephalus spp. | - | √ | ND | √ | ||
| Thodelmus spp. | - | x | ND | √ | |||
| Holoptilinae | Lémurien Ptilocnemus | Bug de plume-pattes | x | x | ND | ||
| Emesinae | Stenolemus spp. | Bug à pattes fil | x | x | x | ||
| Pentatomomorpha | Pentatomidae | Asopinae | Amyotea hamata | Punaise prédatrice jaune | √ | ND | ND |
| Nepomorpha | Nepidae | Ranatrinae | Ranatra dispar | Scorpion d’eau | x, cg | x | √ |
| Belostomatidae | Belostomatinae | Diplonychus eques | Bug de l’eau | √ | ND | ND | |
| Belostomatidae | Lethocerinae | Lethocerus sp. | Léthocère | √ | √ | √ | |
| tique, réussie ; Croix, sans succès ; ND, non déterminé ; CG, sortie de glande céphalique seulement | |||||||
Tableau 1 : Les spécificité de Taxon des méthodes employées pour récolter le venin des consommables.
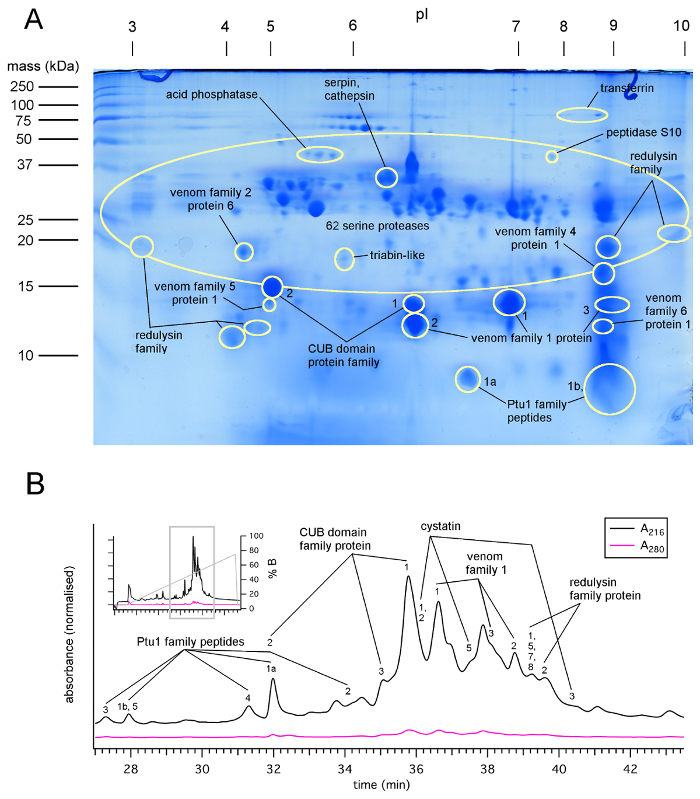
Figure 1 : Protéines détectées par LC-MS/MS analyse des taches de SDS-PAGE 2D et fractions HPLC de venin prélevés dans P. plagipennis par électrostimulation (protocole 1), montrant des protéases abondantes, protéines CUB-domaine et protéines hétéroptères venin famille 1. Gel 2D de SDS-PAGE (A) de pétrole brut plagipennis P. venin, montrant des familles de protéines identifiées par LC-MS/MS de gel taches. (B), HPLC chromatogramme par fractionnement de venin de plagipennis P. , montrant des familles de protéines identifiées par analyse LC-MS/MS des fractions collectées. Reproduit avec la permission de7. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : Proportion des séquences appartenant à chaque classe de protéine majeure dans le venin de P. plagipennis. Reproduit avec la permission de7. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
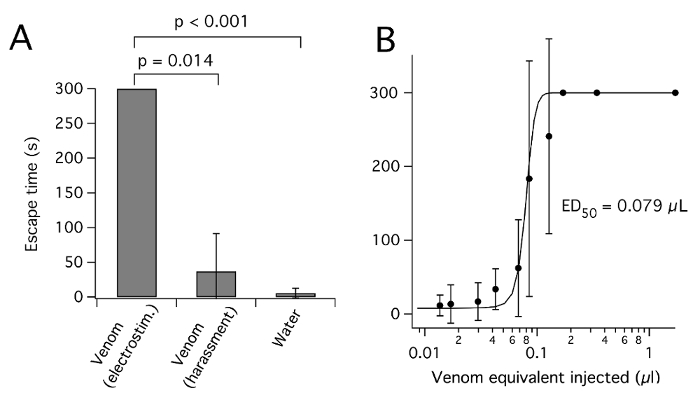
Figure 3 : Plagipennis P. venin obtenu par électrostimulation, mais pas de harcèlement, paralyse insectes. (A) effet de l’injection de venin obtenu par électrostimulation ou de harcèlement ou de l’eau, sur l’évasion de cricket. Pour chaque condition de venin, 0,17 venin µL équivalent a été injecté dans l’abdomen et le temps de s’échapper d’un couvercle de boîtes de Petri pointant vers le haut (en s, jusqu'à 300 s, moyenne ± écart type) a été marqué. (B) Dose-effet courbe pour l’inhibition de la réussite de l’évasion de venin provenant de P. plagipennis par électrostimulation. Reproduit avec la permission de8. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
L’étape la plus critique dans la récolte de venin d’assassin bug consiste à sélectionner la méthode appropriée selon les besoins de l’étude. Chacune des trois méthodes présentées pour la récolte des hétéroptères venins a des avantages et inconvénients selon les applications en aval.
Induisant des bogues pour expulser le venin de la trompe (protocoles 1-3) évite la contamination du venin de tissus glandulaires. En outre, ces méthodes sont non létales et peuvent être répétées plusieurs fois au cours de la vie d’un bogue. Électrostimulation généralement fournit les plus grandes quantités de venin et rendements venin dont la toxicité puissante à la proie d’insectes selon plusieurs études5,8. Provoquant une réaction de défense est une autre façon de susciter le venin de la trompe et qui peuvent donner le venin de la teneur en protéines différentes d’électrostimulation8. Cependant, électrostimulation et la provocation ne travaillent pas pour de nombreuses espèces, et sans enquêtes parallèles de la production sécrétoire des glandes à venin, on ne sait pas quel lumen de la glande (ou quelle combinaison de lumens glande) est récolté.
Récolte de venin par dissection (Protocole N° 4) est à bien des égards complémentaires. Dissection représente un moyen direct d’accéder venin stockée et chaque compartiment de la glande à venin peut être récoltée séparément ou en commun (c'est-à-dire, la possibilité que le venin de « mauvais » ont été récolté est prévenu). Toutefois, la méthode est mortelle et en outre provoque une légère contamination de venin par composants tissulaires. Heteroptera nombreux sont trop petites (ou trop allongée dans le cas de Emesinae, les bugs à pattes fil) pour permettre la récolte de venin par dissection. Si la dissection est utilisée pour extraire des protéines des compartiments individuels glande séparément, il est essentiel de séparer les lobes rapidement et extraire leur contenu séparément afin d’éviter la contamination croisée.
Les méthodes présentées ici devront être modifiées selon l’espèce étudiée. Pour la collecte de venin par électrostimulation, les aspects principaux d’optimiser sont comment le bogue est sobre. Par exemple, la plupart réduviidés sont capables de prolonger leur trompe sur une large plage de mouvement. Ces espèces peuvent être simplement sobre droit way-up sur une plate-forme à l’aide d’un élastique, et la trompe éversée manuellement. Pour les espèces avec trompe moins souple, tels que belostomatids, il faut au contraire empêcher les insectes dans une position tête en bas et abaisser un récipient de collecte à l’angle correct à l’aide d’un autoclave ou un bras mécanique. L’ampleur et le motif de l’électricité appliquée doivent également être optimisées, et dans ce cas, il est préférable de commencer bas et augmentez progressivement la tension appliquée afin d’éviter la létalité.
Si une étude vise à atteindre une compréhension détaillée de comment une espèce particulière produit et utilise le venin, une enquête approfondie associant plusieurs récolte méthodes, ainsi que des technologies telles que la spectrométrie de masse et des expériences de RNA-Seq, peut être Obligatoire. Si le but est d’utiliser des hétéroptères venins comme bibliothèques de molécules biologiques à subir pour quelque activité biologique souhaitée, puis un panel d’échantillons de venin obtenu par électrostimulation, harcèlement, et/ou dissection peut convenir. Cependant, nous constatons que le rôle biologique normal du venin récolté est susceptible de déterminer quels bioactivités sont présentes. Par exemple, venin utilisé pour la prédation est plus susceptible de contenir des composés insecticides, tandis que le venin utilisé pour la défense est plus susceptible de contenir des agents algogènes (causant des douleurs).
Nous n’avons pas inclus récolte de venin par application de la pilocarpine d’agoniste des récepteurs muscariniques de l’acétylcholine dans le présent protocole. Expériences futures sont nécessaires pour déterminer les caractéristiques de l’expulsion de venin induite par la pilocarpine par rapport aux méthodes ci-dessus.
Dans cet article, nous présentons des méthodes qui permettront aux chercheurs d’obtenir des venins d’insectes hétéroptères. Collection de venin réussie permettra davantage enquêtes sur la production, la composition, la fonction et l’évolution du venin dans Heteroptera. En outre, certaines toxines hétéroptères peuvent trouver utilitaire comme insecticides respectueux de l’environnement, molécules de plomb pour développer la thérapeutique humaine, ou comme des outils scientifiques d’enquêter sur les systèmes biologiques.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous reconnaissons financial support de l’Australian Research Council (subventions DP130103813 et LP140100832 à G.F.K., DE160101142 bourse DECRA à EABU), l’Australian National Health & Medical Research Council (Bourse de recherche Principal APP1044414 à G.F.K.) et l’Université du Queensland (Bourse de recherche postdoctorale à A.A.W.).
matériels
| Name | Company | Catalog Number | Comments |
| Electostimulator | Grass Technologies | S48 Square Pulse Stimulator | Electrostimulator allowing pulsed electrostimulation |
| Featherlight tweezers | Australian Entomological Supplies | E122B | For handling live venomous insects |
| Protease inhibitor cocktail | Sigma | 4693124001 | For preventing autoproteolytic digestion of venom |
| Dissection equipment | Australian Entomological Supplies | E152Micro | For fine dissections |
| Insect pins | Australian Entomological Supplies | E162 | For fine dissections |
Références
- Walker, A. A., Weirauch, C., Fry, B. G., King, G. F. Venoms of heteropteran insects: A treasure trove of diverse pharmacological toolkits. Toxins. 8 (2), 43(2016).
- Ribeiro, J. M. C., Assumpção, T. C., Francischetti, I. M. B. An insight into the sialomes of bloodsucking Heteroptera. Psyche (Stuttg). 2012, 1-16 (2012).
- Ambrose, D. P., Maran, S. P. M. Quantification protein content and paralytic potential of saliva of fed and prey deprived reduviid Acanthaspis pedestris Stål (Heteroptera: Reduviidae: Reduviinae). Indian Journal of Environmental Science. 3 (1), 11-16 (1999).
- Edwards, J. S. The action and compostion of the saliva of an assassin bug Platymeris rhadamanthus Gaerst. (Hemiptera, Reduviidae). Journal of Experimental Biology. 38, 61-77 (1961).
- Zerachia, T., Bergmann, F., Shulov, A. Animal and Plant Toxins. Kaiser, E. , Goldman. 143-146 (1973).
- Walker, A. A., Hernández-Vargas, M. J., Corzo, G., Fry, B. G., King, G. F. Giant fish-killing water bug reveals ancient and dynamic venom evolution in Heteroptera. Cellular and Molecular Life Sciences. , (2018).
- Walker, A. A., et al. Giant fish-killing water bug reveals ancient and dynamic venom evolution in Heteroptera. Cell. Mol. Life Sci. , (2018).
- Walker, A. A., et al. The assassin bug Pristhesancus plagipennis produces two distinct venoms in separate gland lumens. Nature Communications. 9 (1), 755(2018).
- Hernández-Vargas, M. J., Santibáñez-López, C. E., Corzo, G. An insight into the triabin protein family of American hematophagous reduviids: Functional, structural and phylogenetic analysis. Toxins. 8 (2), 44(2016).
- Dan, A., Pereira, M. H., Pesquero, J. L., Diotaiuti, L., Beirao, P. S. Action of the saliva of Triatoma infestans (Heteroptera: Reduviidae) on sodium channels. Journal of Medical Entomology. 36 (6), 875-879 (1999).
- Corzo, G., Adachi-Akahane, S., Nagao, T., Kusui, Y., Nakajima, T. Novel peptides from assassin bugs (Hemiptera: Reduviidae): isolation, chemical and biological characterization. FEBS Letters. 499 (3), 256-261 (2001).
- Sahayaraj, K., Kumar, S. M., Anandh, G. P. Evaluation of milking and electric shocks for venom collection from hunter reduviids. Entomon. 31 (1), 65-68 (2006).
- Silva-Cardoso, L., et al. Paralytic activity of lysophosphatidylcholine from saliva of the waterbug Belostoma anurum. Journal of Experimental Biology. 213 (19), 3305-3310 (2010).
- Noeske-Jungblut, C., et al. Triabin, a highly potent exosite inhibitor of Thrombin. Journal of Biological Chemistry. 270 (48), 28629-28634 (1995).
- Noeske-Jungblut, C., et al. An inhibitor of collagen-induced platelet aggregation from the saliva of Triatoma pallidipennis. Journal of Biological Chemistry. 269 (7), 5050-5053 (1994).
- Sahayaraj, K., Borgio, J. F., Muthukumar, S., Anandh, G. P. Antibacterial activity of Rhynocoris marginatus (Fab.) and Catamirus brevipennis (Servile) (Hemiptera: Reduviidae) venoms against human pathogens. Journal of Venomous Animals and Toxins Including Tropical Diseases. 12 (3), 487-496 (2006).
- Haridass, E. T., Ananthakrishnan, T. N. Functional morphology of the salivary system in some reduviids (Insecta-Heteroptera-Reduviidae). Proceedings of the Indian Academy of Sciences. Animal Sciences. 90 (2), 145-160 (1981).
- Ignacimuth, A., Sen, A., Janarthanan, S. Biotechnological Applications for Integrated Pest Management. , Oxford Publishing. 125-131 (2000).
- Maran, S. P. M., Selvamuthu, K., Rajan, K., Kiruba, D. A., Ambrose, D. P. Insect Pest Management, A Current Scenario. Ambrose, D. P. , Entomology Research Unit. 346-361 (2011).
- Pereira, M. H., et al. Anticoagulant activity of Triatoma infestans and Panstrongylus megistus saliva (Hemiptera/Triatominae). Acta Tropica. 61, 255-261 (1996).
- Ribeiro, J. M., Marinotti, O., Gonzales, R. A salivary vasodilator in the blood-sucking bug, Rhodnius prolixus. British Journal of Pharmacology. 101 (4), 932-936 (1990).
- Ribeiro, J. M., Schneider, M., Guimarães, J. A. Purification and characterization of prolixin-S (nitrophorin 2), the salivary anticoagulant of the blood-sucking bug Rhodnius prolixus. Biochem Journal. 308 (1), 243-249 (1995).
- Swart, C. C., Deaton, L. E., Felgenhauer, B. E. The salivary gland and salivary enzymes of the giant waterbugs (Heteroptera; Belostomatidae). Comparative Biochemistry and Physiology A Molecular & Integrative Physiology. 145 (1), 114-122 (2006).
- Rasmussen, S., Young, B., Krimm, H. On the 'spitting' behaviour in cobras (Serpentes: Elapidae). Journal of Zoology. 237 (1), 27-35 (1995).
- Fink, L. S. Venom spitting by the green lynx spider, Peucetia viridans (Araneae, Oxyopidae). Journal of Arachnology. 12, 372-373 (1984).
- Herzig, V. Ontogenesis, gender, molting influence the venom yield in the spider Coremiocnemis tropix (Araneae, Theraphosidae). Journal of Venomous Research. 1, 76-83 (2010).
- Sahayaraj, K., Subramanium, M., Rivers, D. Biochemical and electrophoretic analyses of saliva from the predatory reduviid species Rhynocoris marginatus (Fab). Acta Biochimica Polonica. 60 (1), 91-97 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon