Method Article
从刺客臭虫和其他 Heteropteran 昆虫身上采集毒液毒素
摘要
虽然亚目翅 (昆虫纲: 半翅目) 中的许多昆虫是有毒的, 但它们的毒液成分和毒液毒素的作用大多是未知的。本议定书描述了利用刺激、骚扰和腺体解剖来收获 heteropteran 毒液以进一步表征的方法。
摘要
Heteropteran 昆虫, 如刺客臭虫 (Reduviidae) 和巨大的水虫 (Belostomatidae) 从一个共同的捕食性天敌和恶毒的祖先后裔, 和大多数现存的 heteropterans 保留这一营养战略。一些 heteropterans 已经转变为喂养脊椎动物的血液 (如接吻臭虫, Triatominae; 和床虫, Cimicidae), 而另一些已经恢复到植物喂养 (大多数 Pentatomomorpha)。然而, 除了接吻虫子用来促进血液喂养的唾液之外, heteropteran 毒液与蜘蛛、蝎子和蛇的毒液相比, 很少被知晓。
heteropteran 毒液毒素特征的一个障碍是毒液/唇腺的结构和功能, 它们既形态复杂, 又具有多种生物作用 (防御、猎物捕获和超口服消化)。在本文中, 我们描述了三种方法, 我们已经成功地用于收集 heteropteran 毒液。首先, 我们提出刺激作为一种方便的方法收集毒液, 这往往是致命的, 当注射到猎物的动物, 并省却污染的腺组织。第二, 我们表明, 对动物的温柔骚扰足以产生毒液挤压从喙和/或毒液随地吐痰的一些群体的 heteropterans。第三, 我们描述的方法, 以收集毒液毒素的麻醉动物的解剖, 以获得毒液腺体。这种方法与其他方法相辅相成, 因为它可能允许从刺激和骚扰无效的分类群中收集毒素。这些协议将使研究人员能够从 heteropteran 昆虫身上获得毒素, 用于结构功能表征和在医药和农业中的可能应用。
引言
Heteropteran 毒液是完全生物活性物质1。例如, 血液喂养翅的毒液/唾液分泌物, 如接吻臭虫 (Triatominae) 和床虫 (Cimicidae) 通过扰乱止血2来促进喂养。这些毒液中的毒素靶向多个途径, 包括凝血、血小板聚集和血管收缩, 以及疼痛和瘙痒通路。大多数其他 heteropteran 物种的毒液都适于捕食, 而不是供血。他们的毒液导致瘫痪, 死亡和组织液化时, 注入无脊椎动物3,4。当注入脊椎动物时, 它们的毒液也可能产生剧烈的影响。例如, 从刺客 bug Holotrichius innesi中注入毒液会导致疼痛、肌肉麻痹和出血;由于呼吸麻痹5, envenomated 的老鼠很快就死了。
Transcriptomic 和蛋白质组学研究揭示了一些 heteropteran 毒液的蛋白质组成。捕食性天敌种类的毒液富含蛋白酶、其他酶, 以及未知结构和功能的多肽和蛋白质6, 7, 8.接吻臭虫毒液富含 triabin 蛋白家族, 其成员对凝血、血小板聚集和收缩29产生深刻影响。然而, 它不知道哪些毒素的基础上最具生物活性的毒液。例如, 接吻 bug Triatoma 疫病的毒液被报告为止痛药和抑制钠通道10, 但负责的组件仍有待阐明。同样, 还不知道刺客臭虫毒液的成分会导致麻痹或疼痛。确定对特定毒液生物活性负责的毒素, 以及表征新型毒液毒素的结构和功能的先决条件是获取毒液。
毒液已经从 heteropterans 获得了由刺激5,6,7,8,11,12,13, 挑衅防御响应4,8, 机械地压缩胸部12,14,15,16, 剖析毒液腺体8,17 、18、19、20、21、22和毒蕈乙酰胆碱受体的激动剂23的应用。判断任何方法的潜在优点和缺点是复杂的 heteropteran 毒液腺体的形态学, 它由一个主腺体与两个独立的流明, 前主腺体 (AMG) 和后主腺体 (普纳), 以及伴生的附属的腺体 (AG)。这些不同的腺体间隔产生不同的蛋白质分泌物, 这可能是专门用于不同的生物功能, 包括猎物捕获, 防御和额外口服消化8,17。在 peiratine 和 ectrichodiine 刺客臭虫, AMG 已经与猎物捕获和普纳的额外口服消化17。但是, 在 harpactorine bug Pristhesancus plagipennis中, 普纳专门用于捕获和消化, 而 AMG 则被假定为分泌防御毒液8。该 AG 已被描述为在刺客 bug8或作为一个主要的地方蛋白酶存储在巨型水臭虫23中的分泌功能很少。显然, 需要进一步的工作来澄清各个 heteropteran 子群之间各腺体间的功能, 并确定大多数毒液毒素的功能。在本报告中, 我们描述了从 heteropterans 到这个目标的收集毒液毒素的协议。
研究方案
该议定书符合昆士兰大学在教学和研究中负责照料和使用动物的政策 (4.20.11) 以及国家卫生和医学研究理事会的澳大利亚保护和使用动物为科学目的(8th编辑 2013)。
注意: 在处理刺客 bug 时, 注意不要被 envenomated。在处理毒液防御的物种时, 要注意保护眼睛。注意不要伤害实验动物。这包括监测压力的限制, 如橡胶带和确保喙没有打破。
注: 有选择地, 麻醉动物通过接触 CO2为 0.5-2 分钟或冷却到4-10 °c 之前为目标1-3 的毒液收获促进安全转移和克制。Anaesthetization 不是严格的要求, 但可能有助于安全约束敏捷或强大的标本。然而, 动物必须是清醒的, 以允许毒液收割。在决定是否添加蛋白酶抑制剂时, 请牢记下游应用。
1. 刺激收集毒液毒素
- 获得活标本, 从中收获毒素。
- 使用预先准备好的塑料镊子, 正负电极安装在任一尖端。将电气化镊子连接到 electrostimulator 或稳压电源, 以允许调整电压。
- 对于小 (~ 10 毫米) 和大 (~ 25 毫米) 刺客臭虫, 使用峰值电压分别为15和 25 V。
- 对于较大的 heteropterans, 如巨型水虫, 使用多达 40 v。
- 通过在胸腔上使用橡皮筋将它们绑在平台上, 来抑制活虫。
- 将喙尖放在适当的收集尖端。对于刺客臭虫, 使用 P200 吸管尖端。对于巨大的水虫, 切断 P200 尖端的肢体, 以增加光圈的大小。
- 用闭合的清洁镊子轻轻举起喙, 将收集尖端的开口孔推到喙的末端。
- 如果需要, 吸收5µL 超纯水之前, 把喙放入收集尖端。这减少了毒液残留在尖端的损失, 虽然收获的毒液将被稀释。
- 应用刺激。将刺激电极浸在导电凝胶中, 如2.5 米 NaCl/50%glycerol。将电极应用于胸腔。对于 belostomatids, 将两个电极应用于头部后表面。
- 贮存毒液以防止 autodegradation。在毒液被挤出后, 迅速将其转移到-20 摄氏度或-60 摄氏度的管子上, 或含有蛋白酶抑制剂鸡尾酒的管子。
- 重复步骤1.5 和 1.6, 直到获得足够的毒液或没有进一步的毒液即将到来。
2. 通过骚扰收集毒液毒素
- 准备动物的毒液收割和放置在收集前庭的喙尖, 如第1.1 和 1.3-1.4 所述。
- 如果毒液自发地挤压, 请转到步骤2.3。如果没有, 用镊子轻轻抚摸它的腿, 腹部和触角, 直到毒液产生时, 骚扰动物。
- 如果需要, 迅速将毒液转移到-20 摄氏度或-60 摄氏度的管子, 或含有蛋白酶抑制剂鸡尾酒的管子。
3. 从毒液 "随地吐痰" 种的骚扰中获取毒液毒素
- 麻醉, 或部分麻醉, 在将昆虫从其外壳中除去之前, 防止任何过早的防御性吐痰。
- 引发毒液吐痰行为。使用标准的 90 x 16 毫米培养皿的深盖子来控制和重新定位昆虫。把盖子稍后, 1-4 厘米以上的昆虫, 以防止飞行。大多数昆虫会随地吐痰几次, 往往是快速的连续。确保在盘子的底部收集所有毒液。
- 用10µL 的超纯水冲洗培养皿底部的毒液。迅速将其转移到管在-20 °c 或-60 °c, 或一管含有蛋白酶抑制剂鸡尾酒。
4. 通过腺体解剖收集毒液毒素
- 牺牲动物。严重麻醉或杀死动物使用 > 5 分钟暴露到 CO2。管道纯 CO2直接插入到动物外壳外壳的空气孔中。
- 针昆虫到解剖托盘。对于刺客臭虫, 解剖通过腹面 (4.3)。对于巨大的水虫, 解剖通过背部表面 (4.4)。
- 腹壁解剖
- 插入三针到后腹部, 以保持昆虫下来, 不刺穿毒液腺体。
- 用微型手术刀切开腹部腹面的短中线切口。使用微型剪刀将中线切口前方到头部, 注意切开外骨骼, 不损伤内部结构。
- 为了暴露内部结构, 使多个横向切口延伸从中线切开到昆虫的侧面。然后, 把每个腹外骨骼的皮瓣钉回, 以揭示内部结构。
- 对于大型刺客臭虫, 做四侧向切口, 在中腹部, 前腹部, 在第一和第二腿之间, 并且在第一条腿前面。
- 背夹层
- 移除底座附近的机翼。插入三针到后腹部, 以保持昆虫下来, 不刺穿毒液腺体。
- 用微型剪刀和手术刀切开从头部到腹部的中线切口, 注意切开外骨骼, 而不是损伤内部结构。
- 把昆虫的两半分开。沿昆虫的长度横向放置几个引脚, 使内腔暴露。
- 使用镊子去除飞行肌肉。
- 把解剖托盘给淹了。添加 PBS, 直到该 bug 被淹没, 以允许内部结构浮动和更容易可视化。
- 使用镊子和微剪刀, 小心地去除结缔组织和神经组织和气管。毒液腺体呈拉长的、半透明的结构, 沿消化道的两侧延伸。
- 以其特征外观识别主要腺体, 前后裂片和两个导管会在门。
- 如果需要, 通过从门中追踪管道来识别副腺体。通过切割来自门的两个导管, 释放主腺体。
- 收获所需的腺体流明。将腺体转移到含有30µL pbs 或 pbs 加蛋白酶抑制剂鸡尾酒的冰上的离心。用干净锋利的别针把腺体长矛。
- 漩涡为十年代和离心机 (1 分钟, 5000 x g, 4 °c) 空的腺体流明。用镊子去除腺组织。
- 澄清毒素提取物。离心机 (5 分钟, 1.7万 x 克, 4°c) 去除任何固体颗粒, 保留上清和丢弃颗粒。贮存在20°c 或-60 摄氏度, 以防止 autoproteolytic 降解。
结果
某些 heteropteran 物种 (如 harpactorine P plagipennis和 reduviine Platymeris rhadamanthus) 可靠地产生大量 (5-20 µL) 的毒液, 以响应刺激 (表 1)。一般而言, 大多数 peiratine、reduviine 和 harpactorine bug 会产生毒液来响应这种方法。在 stenopodaine bug 中, 刺激从Oncocephalus sp 中引发毒液, 而不是Thodelmus sp。取样的 holoptiline 和 emesine bug 并没有产生显著的毒液 (例如足以进行质谱分析), 以应对刺激。刺激也可用于从 belostomatid 虫和捕食性 stinkbugs 中收获毒液。然而, 刺激的水蝎子 (Nepidae) 诱导释放的头腺体的内容, 而不是毒液从喙。由于毒液腺体的形态学复杂性和控制毒液释放的生理机制, 刺激在某些物种中未能获得毒液的可能性很大, 这很可能是8。
除了释放毒液由于刺激, reduviids p. plagipennis, Havinthus rufovarius, p. rhadamanthus和 belostomatid Lethocerus distinctifemur, 将自发地从喙中排出毒液在搬运过程中。这种毒液喷射经常伴有防御性的显示。rhadamanthus还吐出毒液防御4, 这种行为发生在蛇24和蜘蛛25 , 但我们不知道在任何其他 reduviid 物种。
SDS 页和蛋白质组实验表明, 刺激和骚扰所收获的毒液是富含蛋白质的6,7,8。蛋白质占很大比例的物质存在, 虽然它也可能是毒液含有无机离子和其他物质。刺客臭虫毒液获得的刺激和骚扰通常包含100多肽和蛋白质 (图 1,图 2)。Belostomatid 毒液以前被报告在磷脂13中是丰富的。belostomatine 水中毒液的红外吸光度谱Diplonychus 移康智能与蛋白质和磷脂的内容一致。对于 lethocerine distinctifemur, 发现的证据仅用于蛋白质, 而不是磷脂6。
如报告的蜘蛛毒液26, 从 heteropteran 昆虫收获的毒液可能会在浓度和成分变化, 取决于使用的昆虫和它的收获方法。稀释毒液样品的紫外光谱表明, 对未稀释毒液的吸光度值 (280) 为 50-250 (10 毫米路径长度), 与高蛋白质浓度的 ~ 50-250 毫克/毫升7,12,19一致。据报道, 捕食者被剥夺会导致毒液浓度和麻痹电位的连续增加 (3 , 以及 pH 值27的连续下降。然而, 长期饥饿会导致疾病和死亡的损失。除了浓度, 从 heteropterans 中提取毒液的方法可能会影响其组成。刺客 bug plagipennis中毒液的毒素组成差异明显, 具体取决于它是由刺激还是骚扰8。在plagipennis的情况下, 这被证明是由于刺激产生普纳的内容, 而骚扰产生了 AMG 的内容。毒液获得的刺激, 但不是骚扰, 完全瘫痪的猎物昆虫 (图 3)。然而, 目前还不清楚这一结果在多大程度上可以推广到其他 Reduviidae 或其他翅。
通过解剖毒液腺体直接采集毒液, 可以规避毒液腺体的控制机制, 其代价是用腺组织 (非毒液) 蛋白进行污染。无论如何, 从解剖材料获得的提取物可用于生物活性/毒性测定。例如, 使用上述协议编写的P. plagipennis的普纳、AMG 和 AG 的提取物用液相色谱/串联质谱法8进行了分析。这一过程确定了总共182、114和71蛋白质, 其中45、51和12被归类为基于氨基酸序列特征的假定毒液蛋白, 其余的蛋白质被归类为假定的管家蛋白。注射普纳的提取物, 但不 AMG 或 AG, 入昆虫导致麻痹和死亡8。
| Infraorder | 家庭 | 亚科 | 二项名称 | 公用名称 | 刺激 | 骚扰 | 夹层 |
| Cimicomorpha | Reduviidae | Harpactorinae | Pristhesancus plagipennis | 常见的布里斯班刺客臭虫 | √ | √ | √ |
| Havinthus rufovarius | 红虎刺客臭虫 | √ | √ | √ | |||
| Scipinia arenacea | 红刺刺客臭虫 | √ | 钕 | √ | |||
| Gminatus 。 | 大橙色刺客臭虫 | √ | 钕 | √ | |||
| Trachylestes aspericollis | 小红刺客臭虫 | √ | 钕 | 钕 | |||
| Reduviinae | Platymeris 。 | 巨型非洲刺客臭虫 | √ | √ | √ | ||
| Psytalla 黑粉病 | 刺的刺客臭虫 | √ | 钕 | √ | |||
| Peiratinae | Ectomocoris 。 | 橙色地面刺客臭虫 | √ | 钕 | √ | ||
| Peirates 。 | 黑刺客臭虫 | √ | 钕 | 钕 | |||
| Stenopodainae | Oncocephalus 。 | - | √ | 钕 | √ | ||
| Thodelmus 。 | - | X | 钕 | √ | |||
| Holoptilinae | Ptilocnemus 狐猴 | 羽毛腿臭虫 | X | X | 钕 | ||
| Emesinae | Stenolemus 。 | 线脚 bug | X | X | X | ||
| Pentatomomorpha | 蝽 | Asopinae | Amyotea hamata | 黄色掠食臭味虫 | √ | 钕 | 钕 |
| Nepomorpha | Nepidae | Ranatrinae | Ranatra 蛾 | 水蝎子 | x, cg | X | √ |
| Belostomatidae | Belostomatinae | Diplonychus 移康智能 | 水虫 | √ | 钕 | 钕 | |
| Belostomatidae | Lethocerinae | Lethocerus sp。 | 巨型水虫 | √ | √ | √ | |
| 滴答作响, 成功;交叉, 不成功;不确定;cg, 头腺体放电仅 | |||||||
表 1: 用于从 heteropterans 获取毒液的方法的分类特异性。
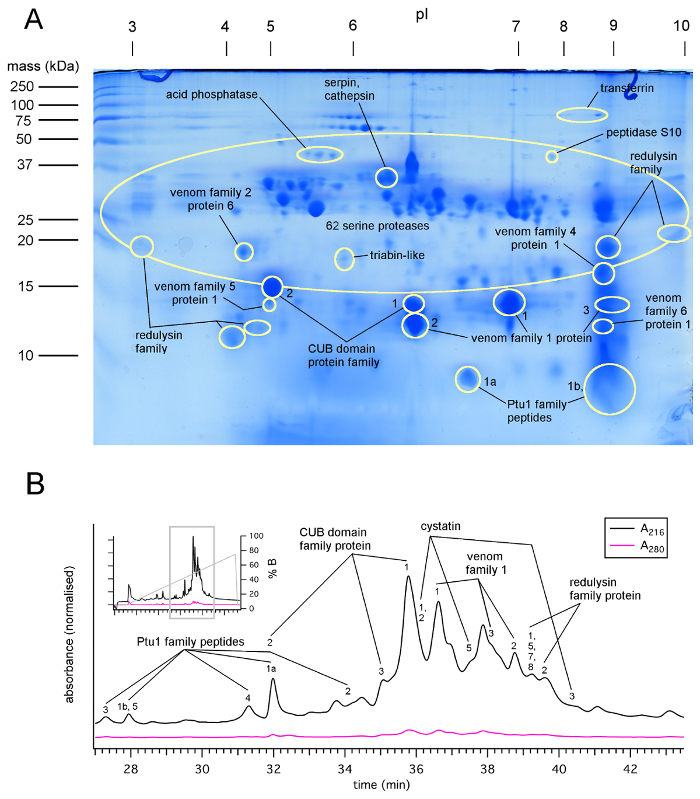
图 1: 通过 LC-ms/毫秒分析检测到的蛋白质 2D SDS 页点和收集的毒液的 HPLC 分数plagipennis 刺激 (协议 1), 显示丰富的蛋白酶, 幼域蛋白和 heteropteran 毒液家族1蛋白.(A) 2D 粗体plagipennis毒液的 SDS 页凝胶, 显示由凝胶斑点的 LC-ms 或 ms 识别的蛋白质家族。(B) HPLC 法从P. plagipennis毒液的分馏中分离出蛋白质家族, 并通过 LC-ms/ms 分析收集到的分数。使用权限7复制。请单击此处查看此图的较大版本.

图 2: 在毒液中属于每个主要蛋白质类的序列的比例plagipennis.使用权限7复制。请单击此处查看此图的较大版本.
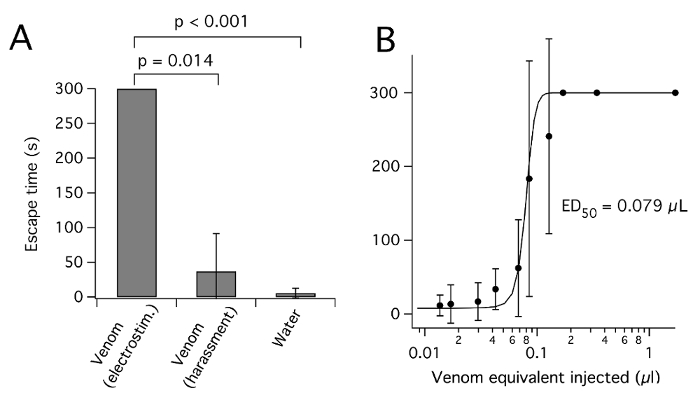
图 3:plagipennis 刺激获得的毒液, 而不是骚扰, 麻痹昆虫.(A) 通过刺激或骚扰 (或水) 获得的注射毒液对板球逃逸的影响。对于每种毒液的情况, 0.17 µL 毒液当量被注入到腹部和时间, 以摆脱向上的培养皿盖子 (在 s, 由 300s, 意味着 @ SD) 得分。(B) 剂量响应曲线, 用于通过刺激从plagipennis获得的毒液抑制逃逸成功。使用权限8复制。请单击此处查看此图的较大版本.
讨论
捕获刺客臭虫毒液最关键的一步是根据研究的目的选择合适的方法。三种收集 heteropteran 毒液的方法中, 每种都有优缺点, 这取决于下游的应用。
诱导臭虫从喙中排出毒液 (1-3 协议) 避免了腺组织对毒液的污染。此外, 这些方法是非致命的, 可以重复多次在一个 bug 的生活过程中。刺激通常提供最大数量的毒液, 并产生毒液具有强大的毒性对猎物昆虫根据几个研究5,8。挑衅的防御反应是另一种方法, 以获取毒液从喙, 并可能产生毒液的不同蛋白质含量的刺激8。然而, 刺激和挑衅对许多种类不起作用, 并且没有对毒液腺体分泌物的平行的调查它不清楚哪些腺体流明 (或腺流明的组合) 被收获。
通过解剖收集毒液 (4 号议定书) 在许多方面是互补的。解剖是一种直接的方法来存取储存的毒液, 毒液腺体的每个隔间可以单独或汇集 (即, 被提取的 ' 错误 ' 毒液的可能性被排除)。然而, 这种方法是致命的, 另外还会引起组织成分对毒液的轻微污染。许多翅是太小 (或太拉长的情况下, Emesinae, 线程腿的 bug), 以允许毒液捕捞通过解剖。如果解剖是用来提取单独的腺体隔间的蛋白质, 这是至关重要的分离的裂片迅速和提取其内容分开, 以避免交叉污染。
在这里提出的方法将需要修改, 取决于特定的物种研究。为了收集毒液的刺激, 优化的主要方面是如何抑制 bug。例如, 大多数 reduviids 能够延长他们的喙在广泛的运动范围内。这些物种可以被简单地限制在一个平台上使用橡皮筋的权利, 和喙外翻手工。对于不太灵活的喙的物种, 如 belostomatids, 它是必要的, 以抑制昆虫在一个颠倒的位置, 并降低一个收集插座在正确的角度使用反击或机械手臂。电力应用的规模和模式也必须优化, 在这种情况下, 最好是启动低, 慢慢增加应用电压, 以避免杀伤力。
如果一项研究的目的是要对特定物种如何产生和使用毒液进行详细的了解, 那么, 结合多种收获方法以及质谱和 RNA 序列实验等技术进行深入调查, 可能必填。如果目的是使用 heteropteran 毒液作为生物分子的文库来筛选一些理想的生物活性, 那么刺激、骚扰和/或解剖所获得的毒液样本可能是合适的。然而, 我们注意到, 所收获的毒液的正常生物学作用可能决定了生物活性的存在。例如, 用于捕食的毒液更有可能含有杀虫化合物, 而用于防御的毒液更可能含有 algogenic (止痛) 剂。
毒蕈乙酰胆碱受体激动剂在本议定书中的应用, 我们还没有包括毒液的收获。与上述方法相比, 需要进行今后的实验, 以确定匹特诱导毒液排出的特征。
在本文中, 我们提出的方法, 将允许研究人员获得毒液从 heteropteran 昆虫。成功的毒液收集将允许进一步调查翅中毒液的产生、组成、功能和进化。此外, 一些 heteropteran 毒素可能会发现效用作为生态友好的杀虫剂, 铅分子开发人类疗法, 或作为科学工具来调查生物系统。
披露声明
作者没有什么可透露的。
致谢
我们承认澳大利亚研究理事会的财政支持 (赠款 DP130103813 和 LP140100832 G.F.K., DECRA 奖学金 DE160101142 EABU), 澳大利亚国家健康 & 医学研究理事会 (主要研究金APP1044414 到 G.F.K.) 和昆士兰大学 (博士后奖学金 A.A.W.)。
材料
| Name | Company | Catalog Number | Comments |
| Electostimulator | Grass Technologies | S48 Square Pulse Stimulator | Electrostimulator allowing pulsed electrostimulation |
| Featherlight tweezers | Australian Entomological Supplies | E122B | For handling live venomous insects |
| Protease inhibitor cocktail | Sigma | 4693124001 | For preventing autoproteolytic digestion of venom |
| Dissection equipment | Australian Entomological Supplies | E152Micro | For fine dissections |
| Insect pins | Australian Entomological Supplies | E162 | For fine dissections |
参考文献
- Walker, A. A., Weirauch, C., Fry, B. G., King, G. F. Venoms of heteropteran insects: A treasure trove of diverse pharmacological toolkits. Toxins. 8 (2), 43 (2016).
- Ribeiro, J. M. C., Assumpção, T. C., Francischetti, I. M. B. An insight into the sialomes of bloodsucking Heteroptera. Psyche (Stuttg). 2012, 1-16 (2012).
- Ambrose, D. P., Maran, S. P. M. Quantification protein content and paralytic potential of saliva of fed and prey deprived reduviid Acanthaspis pedestris Stål (Heteroptera: Reduviidae: Reduviinae). Indian Journal of Environmental Science. 3 (1), 11-16 (1999).
- Edwards, J. S. The action and compostion of the saliva of an assassin bug Platymeris rhadamanthus Gaerst. (Hemiptera, Reduviidae). Journal of Experimental Biology. 38, 61-77 (1961).
- Zerachia, T., Bergmann, F., Shulov, A., Kaiser, E. . Animal and Plant Toxins. , 143-146 (1973).
- Walker, A. A., Hernández-Vargas, M. J., Corzo, G., Fry, B. G., King, G. F. Giant fish-killing water bug reveals ancient and dynamic venom evolution in Heteroptera. Cellular and Molecular Life Sciences. , (2018).
- Walker, A. A., et al. Giant fish-killing water bug reveals ancient and dynamic venom evolution in Heteroptera. Cell. Mol. Life Sci. , (2018).
- Walker, A. A., et al. The assassin bug Pristhesancus plagipennis produces two distinct venoms in separate gland lumens. Nature Communications. 9 (1), 755 (2018).
- Hernández-Vargas, M. J., Santibáñez-López, C. E., Corzo, G. An insight into the triabin protein family of American hematophagous reduviids: Functional, structural and phylogenetic analysis. Toxins. 8 (2), 44 (2016).
- Dan, A., Pereira, M. H., Pesquero, J. L., Diotaiuti, L., Beirao, P. S. Action of the saliva of Triatoma infestans (Heteroptera: Reduviidae) on sodium channels. Journal of Medical Entomology. 36 (6), 875-879 (1999).
- Corzo, G., Adachi-Akahane, S., Nagao, T., Kusui, Y., Nakajima, T. Novel peptides from assassin bugs (Hemiptera: Reduviidae): isolation, chemical and biological characterization. FEBS Letters. 499 (3), 256-261 (2001).
- Sahayaraj, K., Kumar, S. M., Anandh, G. P. Evaluation of milking and electric shocks for venom collection from hunter reduviids. Entomon. 31 (1), 65-68 (2006).
- Silva-Cardoso, L., et al. Paralytic activity of lysophosphatidylcholine from saliva of the waterbug Belostoma anurum. Journal of Experimental Biology. 213 (19), 3305-3310 (2010).
- Noeske-Jungblut, C., et al. Triabin, a highly potent exosite inhibitor of Thrombin. Journal of Biological Chemistry. 270 (48), 28629-28634 (1995).
- Noeske-Jungblut, C., et al. An inhibitor of collagen-induced platelet aggregation from the saliva of Triatoma pallidipennis. Journal of Biological Chemistry. 269 (7), 5050-5053 (1994).
- Sahayaraj, K., Borgio, J. F., Muthukumar, S., Anandh, G. P. Antibacterial activity of Rhynocoris marginatus (Fab.) and Catamirus brevipennis (Servile) (Hemiptera: Reduviidae) venoms against human pathogens. Journal of Venomous Animals and Toxins Including Tropical Diseases. 12 (3), 487-496 (2006).
- Haridass, E. T., Ananthakrishnan, T. N. Functional morphology of the salivary system in some reduviids (Insecta-Heteroptera-Reduviidae). Proceedings of the Indian Academy of Sciences. Animal Sciences. 90 (2), 145-160 (1981).
- Maran, S. P. M., Ambrose, D. P., Ignacimuth, A., Sen, A., Janarthanan, S. . Biotechnological Applications for Integrated Pest Management. , 125-131 (2000).
- Maran, S. P. M., Selvamuthu, K., Rajan, K., Kiruba, D. A., Ambrose, D. P., Ambrose, D. P. . Insect Pest Management, A Current Scenario. , 346-361 (2011).
- Pereira, M. H., et al. Anticoagulant activity of Triatoma infestans and Panstrongylus megistus saliva (Hemiptera/Triatominae). Acta Tropica. 61, 255-261 (1996).
- Ribeiro, J. M., Marinotti, O., Gonzales, R. A salivary vasodilator in the blood-sucking bug, Rhodnius prolixus. British Journal of Pharmacology. 101 (4), 932-936 (1990).
- Ribeiro, J. M., Schneider, M., Guimarães, J. A. Purification and characterization of prolixin-S (nitrophorin 2), the salivary anticoagulant of the blood-sucking bug Rhodnius prolixus. Biochem Journal. 308 (1), 243-249 (1995).
- Swart, C. C., Deaton, L. E., Felgenhauer, B. E. The salivary gland and salivary enzymes of the giant waterbugs (Heteroptera; Belostomatidae). Comparative Biochemistry and Physiology A Molecular & Integrative Physiology. 145 (1), 114-122 (2006).
- Rasmussen, S., Young, B., Krimm, H. On the 'spitting' behaviour in cobras (Serpentes: Elapidae). Journal of Zoology. 237 (1), 27-35 (1995).
- Fink, L. S. Venom spitting by the green lynx spider, Peucetia viridans (Araneae, Oxyopidae). Journal of Arachnology. 12, 372-373 (1984).
- Herzig, V. Ontogenesis, gender, molting influence the venom yield in the spider Coremiocnemis tropix (Araneae, Theraphosidae). Journal of Venomous Research. 1, 76-83 (2010).
- Sahayaraj, K., Subramanium, M., Rivers, D. Biochemical and electrophoretic analyses of saliva from the predatory reduviid species Rhynocoris marginatus (Fab). Acta Biochimica Polonica. 60 (1), 91-97 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。