Method Article
Recolección de las toxinas del veneno de insectos asesinos y otros insectos Heteropteran
En este artículo
Resumen
Aunque muchos insectos en el suborden Heteroptera (Insecta: Hemiptera) son venenoso, su composición del veneno y las funciones de las toxinas de su veneno son en su mayoría desconocidas. Este protocolo describe métodos para cosechar heteropteran venenos de más caracterización, mediante electroestimulación, acoso y disección de la glándula.
Resumen
Heteropteran insectos tales como chinches (Reduviidae) de asesino y gigante chinches de agua (Belostomatidae) descienden de un antepasado común de colocar y venenoso, y la mayoría de las heteropterans mantener esta estrategia trófica. Algunos heteropterans han pasaron a alimentarse de sangre vertebrado (como vinchucas, Triatominae; y chinches, Cimicidae) mientras otros han vuelto a alimentarse de las plantas (la mayoría Pentatomomorpha). Sin embargo, a excepción de saliva utilizado por vinchucas para facilitar la alimentación de sangre, poco se sabe sobre venenos heteropteran comparados con los venenos de arañas, escorpiones y serpientes.
Uno de los obstáculos a la caracterización de las toxinas del veneno de la heteropteran es la estructura y función de las glándulas de veneno labial, que son morfológicamente complejos y realizar múltiples funciones biológicas (defensa, captura de presas y digestión extra oral). En este artículo, se describen tres métodos que hemos utilizado con éxito para recoger heteropteran venenos. En primer lugar, presentamos la electroestimulación como una manera conveniente de recoger veneno que suele ser letal cuando se inyecta en animales de presa, y que evita la contaminación por el tejido glandular. En segundo lugar, mostramos que el acoso suave de animales es suficiente para producir extrusión de veneno de la probóscide o veneno escupe en algunos grupos de heteropterans. En tercer lugar, se describen métodos para sacar las toxinas del veneno por la disección de animales anestesiados para obtener de las glándulas de veneno. Este método es complementario a otros métodos, como pueden permitir extracción de toxinas de taxa en los que la electroestimulación y el acoso son ineficaces. Estos protocolos permiten a los investigadores recoger toxinas de insectos heteropteran para la caracterización de la estructura y función y posibles aplicaciones en medicina y agricultura.
Introducción
Heteropteran venenos son sustancias potencialmente bioactivas1. Por ejemplo, las secreciones de saliva/veneno de Heteroptera alimentan de sangre como vinchucas (Triatominae) y chinches de cama (Cimicidae) facilita la alimentación alteran la hemostasia2. Las toxinas de estos venenos objetivo múltiples vías incluyendo la coagulación, agregación plaquetaria y vasoconstricción, así como el dolor y pican caminos. Venenos de la mayoría de otras especies de heteropteran se adaptan para facilitar la depredación más que alimentan de sangre. Sus venenos causan parálisis, muerte y licuefacción del tejido cuando se inyecta en invertebrados3,4. Cuando se inyecta en los vertebrados, su veneno también puede tener efectos drásticos. Por ejemplo, inyección de veneno de insecto asesino Holotrichius innesi en vertebrados provoca parálisis del músculo, dolor y hemorragia; ratones envenomated por este fallo mueren rápidamente debido a la parálisis respiratoria5.
Estudios transcriptómicos, proteómicos han revelado la composición proteica de algunos venenos heteropteran. Venenos de las especies depredadoras son ricos en proteasas, enzimas y péptidos y proteínas de estructura desconocida y función6,7,8. Veneno de la vinchuca es rica en la familia de proteínas de triabin, cuyos miembros afectan profundamente a la coagulación, agregación plaquetaria y vasoconstricción2,9. Sin embargo, no se sabe que las toxinas subyacen la mayoría bioactividades del veneno. Por ejemplo, veneno de la vinchuca Triatoma infestans se ha divulgado para ser analgésico e inhibir los canales de sodio10, pero los componentes responsables siguen siendo ser aclarado. Asimismo, no se sabe qué componentes del veneno de insecto asesino de causan dolor o parálisis. Un requisito previo para identificar las toxinas responsables bioactividades veneno particular y para la caracterización de la estructura y función de las toxinas del veneno de la novela, es la obtención de veneno.
Veneno ha sido obtenido de heteropterans por electroestimulación5,6,7,8,11,12,13, provocación de defensiva respuestas4,8, mecánicamente exprimiendo el tórax12,14,15,16, disección de las glándulas de veneno8,17 ,18,19,20,21,22y la aplicación de agonistas del receptor muscarínico23. Juzgar las posibles ventajas y desventajas de cualquier método es complicado por la morfología de glándulas heteropteran, que consisten en una glándula principal con dos lúmenes separados, la glándula principal anterior (AMG) y posterior glándula principal (PMG), así como un glándula accesoria asociada (AG). Estos compartimientos diferentes glándulas producen secreciones diferentes de proteínas, que pueden ser especializadas para diferentes funciones biológicas incluyendo la captura de presas, defensa y digestión extra oral8,17. En peiratine y ectrichodiine insectos de asesino, el AMG se ha asociado con la captura de presas y el PMG con digestión extra oral17. Sin embargo, en el harpactorine error plagipennis de Pristhesancus el PMG está especializada para la captura de presas y la digestión mientras que el AMG se presume para secretar veneno defensivo8. El AG se ha descrito como teniendo poca función secretora en insectos asesinos8 o como un sitio principal de almacenamiento de información de proteasa en chinches de agua gigantes23. Claramente, más trabajo es necesario aclarar la función de cada compartimiento de la glándula entre distintos subgrupos de heteropteran y para determinar la función de más toxinas del veneno. En este informe se describen los protocolos para la recolección de las toxinas del veneno de heteropterans hacia esta meta.
Protocolo
Este protocolo cumple con la política de la Universidad de Queensland en el cuidado responsable y uso de animales en docencia e investigación (PPL 4.20.11) así como la Nacional de salud y de Consejo de investigación médica Código Australiano para el cuidado y uso de animales para fines científicos (8th edición 2013).
PRECAUCIÓN: tenga cuidado para no ser envenomated al manipular insectos asesinos. Tenga cuidado para proteger los ojos al manipular especies que escupen veneno defensivo. Tenga cuidado en no para herir a los animales experimentales. Esto incluye la monitorización de la presión sobre restricciones tales como gomas y asegurando que la probóscide no está rota.
Nota: Opcionalmente, anestesiar animales por la exposición a CO2 por 0.5-2 min o 4-10 ° c de enfriamiento antes de la cosecha de veneno en tiene como objetivo 1-3 para facilitar la transferencia segura y moderación. Para la anestesia no es estrictamente necesaria pero puede facilitar la sujeción segura de ejemplares ágiles y fuertes. Sin embargo, animales deben estar despiertos para permitir la recolección de veneno. Tener aplicaciones posteriores en cuenta al decidir si o no agregar inhibidores de la proteasa.
1. extracción de toxinas del veneno por electroestimulación
- Obtener a especímenes vivos de que cosecha las toxinas.
- Pinzas plásticas preparadas de uso con los electrodos positivos y negativos montan en cada extremo. Conectar pinzas electrificadas a un electroestimulador o una fuente de tensión constante que permite el ajuste de la tensión.
- De pequeño (~ 10 mm) y grande (~ 25 m m) insectos de asesino, utilizar tensiones de pico de 15 y 25 V respectivamente.
- Para mayor heteropterans como chinches de agua gigantes, usar hasta 40 V.
- Contener errores vivo por cercar a una plataforma, usando una banda elástica sobre el tórax.
- Coloque la punta de la probóscide en una punta de recogida adecuada. Insectos de asesino, utilice una punta de pipeta P200. Gigante chinches de agua, cortar la extremidad de una punta de P200 para aumentar el tamaño de la abertura.
- Suavemente Levante la probóscide con una pinzas limpiamos cerrado y empuje la abertura abierta de la punta de la colección sobre el final de la probóscide.
- Si lo desea, punta de agua ultrapura de absorción ~ 5 μl antes de colocar la probóscide en la recolección. Esto reduce las pérdidas de veneno restante dentro de la punta, aunque el veneno cosechado se diluirá.
- Aplicar electroestimulación. Sumergir los electrodos estimulantes en gel conductor, tales como 2, 5 M NaCl/50% glicerol. Aplique los electrodos en el tórax. Para belostomatids, aplicar los dos electrodos a la superficie dorsal posterior de la cabeza.
- Almacenar el veneno para evitar autodegradation. Después se saca el veneno, transferir rápidamente a un tubo a-20 ° C o -60 ° C, o un tubo que contiene el cóctel de inhibidor de la proteasa.
- Repita los pasos del 1.5 y 1.6 hasta que se adquiere la suficiente veneno o no hay veneno más próxima.
2. extracción de toxinas del veneno por acoso
- Preparar animales para cosechar el veneno y la punta de la probóscide en un vestíbulo de colección, como se describe en los subapartados 1.1 y 1.3-1.4.
- Si espontáneamente se saca veneno, vaya al paso 2.3. Si no, acosar a los animales tocándolo suavemente en las piernas, abdomen y antenas con pinzas hasta que se produce el veneno.
- Transferir rápidamente veneno a un tubo a-20 ° C o -60 ° C o un tubo que contiene inhibidor de la proteasa coctel, si lo desea.
3. extracción de toxinas del veneno por el acoso de "Escupir" especie de veneno
- Anestesiar o anestesie parcialmente, el insecto antes de sacar de su gabinete para evitar cualquier escupir defensiva prematura.
- Provocar la conducta de escupir veneno. Contienen y vuelva a colocar el insecto usando la tapa profunda de un estándar 90 x 16 mm plato de Petri. Sostenga la tapa ligeramente posterior y 1-4 cm por encima de los insectos para evitar que el vuelo. Mayoría de los insectos escupirá varias veces, a menudo en rápida sucesión. Asegúrese de que todo veneno es recogido en la parte inferior del plato.
- Recoger el veneno en la parte inferior de la caja Petri mediante enjuague con 10 μl de agua ultrapura. Transferir rápidamente a un tubo a-20 ° C o -60 ° C, o un tubo que contiene el cóctel de inhibidor de la proteasa.
4. extracción de toxinas del veneno por la disección de la glándula
- Sacrificio de animales. Muy anestesiar o matar animales con > 5 minutos de exposición al CO2. Tubo de puro CO2 directamente en los agujeros de aire de cerramiento de cubierta del animal.
- Insecto de PIN a la bandeja de disección. Insectos de asesino, disecar a través de la superficie ventral (4.3). Para chinches de agua gigantes, disecar a través de la superficie dorsal (4.4).
- Disección ventral
- Inserte las clavijas de tres en el abdomen posterior presionado el insecto sin pinchar las glándulas de veneno.
- Cortar una incisión de línea media corta en la superficie ventral del abdomen con un bisturí miniatura. Utilizar tijeras de miniatura para extender la incisión de línea media anterior a la cabeza, teniendo cuidado de cortar sólo el exoesqueleto y no dañar las estructuras internas.
- Para exponer las estructuras internas, hacer varios cortes laterales que se extienden desde la incisión de línea media hacia el lado del insecto. Entonces, el perno detrás cada aleta de exoesqueleto ventral para revelar las estructuras internas.
- Grandes insectos de asesino, hacer cuatro incisiones laterales, en el abdomen abdomen medio, anterior, entre las piernas primeras y segunda y delante de la primera etapa.
- Disección dorsal
- Quitar las alas cerca de la base. Inserte las clavijas de tres en el abdomen posterior presionado el insecto sin pinchar las glándulas de veneno.
- Cortar una incisión de línea media de la cabeza al abdomen con miniatura tijeras y bisturí, teniendo cuidado de cortar sólo el exoesqueleto y no dañar las estructuras internas.
- Fuerza aparte de las dos mitades del insecto. Colocar varios pernos lateralmente a lo largo de la longitud del insecto a salir de la cavidad interna expuesta.
- Quitar los músculos de vuelo con unas pinzas.
- Inunde la bandeja de disección. Añadir PBS hasta que el fallo esté sumergido para permitir que las estructuras internas flotan para arriba y ser más fácilmente visualizado.
- Utilizando pinzas y tijeras micro, retire con cuidado conectivo y tejido nervioso y la tráquea. Las glándulas de veneno aparecen como alargado, estructuras translúcidas que se extiende a lo largo de cada lado del canal alimenticio.
- Identificar la glándula principal por su aspecto característico, con lóbulos anteriores y posteriores y los dos conductos en el hilio.
- Si lo desea, identificar la glándula accesoria trazando el conducto desde el hilio. Libre la glándula principal, cortando los dos conductos que emana desde el hilio.
- Cosechar los lúmenes glándula deseada. Transferencia de la glándula en una microcentrífuga en hielo con 30 μl de PBS o PBS plus inhibidor de la proteasa cóctel. Lanza las glándulas con un alfiler limpio agudo.
- Vortex de 10 s y centrífuga (1 min, 5.000 × g, 4 º C) para vaciar los lúmenes de la glándula. Eliminar el tejido glandular con unas pinzas.
- Aclarar el extracto de la toxina. Centrífuga (5 min, 17.000 x g, 4° C) para extraer las partículas sólidas, conservar el sobrenadante y desechar el precipitado. Almacenar a-20 ° C o -60 ° C para evitar la degradación de autoproteolytic.
Resultados
Algunas especies heteropteran como la harpactorine p. plagipennis y el reduviine Platymeris Radamanto, fiable rendimiento grandes cantidades (5-20 μl) de venom en respuesta a la electroestimulación (tabla 1). En general, más peiratine, reduviine y harpactorine bugs rendimiento veneno en respuesta a este método. Entre stenopodaine bugs, electroestimulación produce veneno de Oncocephalus SP., pero no Thodelmus sp. Los errores holoptiline y emesine muestreados no dió veneno significativo (por ejemplo, suficiente para análisis por espectrometría de masa) en respuesta a la electroestimulación. La electroestimulación puede utilizarse también para cosechar el veneno de belostomatid insectos y depredadores stinkbugs. Sin embargo, electroestimulación de los escorpiones de agua (Nepidae) inducida por liberación del contenido de las glándulas cefálicas, en lugar de veneno de la probóscide. Falta de recoger veneno por electroestimulación en algunas especies es muy probablemente debido a la complejidad morfológica de las glándulas de veneno y los mecanismos fisiológicos que controlan la liberación de veneno8.
Además de soltar veneno por electroestimulación, reduviids p. plagipennis, Havinthus rufovarius, p. Radamanto y belostomatid Lethocerus distinctifemur, voluntad espontáneamente expulsar el veneno de la probóscide durante la manipulación. Tal expulsión de veneno es acompañado con frecuencia por exhibiciones defensivas. P. Radamanto también escupe veneno defensivo4, un comportamiento que se produce en serpientes24 y arañas25 pero de que no somos conscientes de en cualquier otra especie de reduviid.
SDS-PAGE y proteómica experimentos demuestran que los venenos por electroestimulación y el acoso son ricos en proteínas6,7,8. Las proteínas representan una gran proporción de material presente, aunque también es probable que los venenos contienen iones inorgánicos y otras sustancias. Veneno de insecto asesino obtenida por electroestimulación y el acoso generalmente contiene más de 100 péptidos y proteínas (figura 1, figura 2). Belostomatid veneno se ha divulgado previamente para ser rico en IgE13. Espectros de absorción infrarroja del veneno del bicho de agua belostomatine Diplonychus eques son consistentes con un contenido de proteínas y de IgE. Para el lethocerine distinctifemur L., se encontraron pruebas sólo para proteínas y no IgE6.
Según lo divulgado para venenos de araña26, veneno de insectos heteropteran es probable que varíe en concentración y composición, según el insecto utilizado y el método por el cual se cosecha. Espectroscopía UV de las muestras de veneno diluido sugiere los valores de absorbancia (un280) de 50-250 (10 mm de longitud de ruta de acceso) de veneno puro, coherente con una concentración alta de proteína de ~ 50-250 mg/mL7,12,19. Privación de presa se ha divulgado para causar aumento sucesivo en veneno concentración y paralítico potencial3 así como sucesivas disminuciones de pH27. Sin embargo, inanición prolongada resultará en pérdida de la condición y la muerte. Así como la concentración, el método por el cual veneno es cosechado de heteropterans puede afectar su composición. La composición de la toxina del veneno del bicho asesino plagipennis p. diferenciaron marcado dependiendo de si fue cosechado por electroestimulación o acoso8. En el caso de p. plagipennis, esto fue demostrado para ser debido a la electroestimulación que rinde los contenidos de lo PMG, considerando que el acoso rindió el contenido de la AMG. Veneno había obtenido por electroestimulación, pero no acoso, potentemente paralizado presa insectos (figura 3). Sin embargo, no está claro hasta qué punto este resultado se puede generalizar a otros Reduviidae u otros Heteroptera.
Recolección de veneno directamente por glándulas de disección permite que los mecanismos de control de las glándulas de veneno a sortear, a costa de la contaminación con proteínas de tejido glandular (sin veneno). Cueste lo que cueste, los extractos obtenidos de material disecado pueden utilizarse para ensayos de bioactividad, toxicidad. Por ejemplo, extractos del PMG, AMG y AG de plagipennis p., preparado usando el protocolo anterior, se analizaron mediante cromatografía líquida/tándem de espectrometría de masas8. Este proceso identificaron un total de 182, 114 y 71 proteínas en total, de los cuales 45, 51 y 12 fueron clasificados como proteínas de veneno supuesto basadas en características de la secuencia de aminoácidos con las proteínas restantes clasificadas como proteínas de supuesta limpieza. Inyección de extractos de la PMG, pero no AMG o AG, en insectos dio lugar a la parálisis y muerte8.
| Infraorden | Familia | Subfamilia | Nombre binomial | Nombre común | Electroestimulación | Acoso | Disección |
| Cimicomorpha | Reduviidae | Harpactorinae | Pristhesancus plagipennis | Insecto de asesino de Brisbane común | √ | √ | √ |
| Havinthus rufovarius | Insecto de asesino de tigre rojo | √ | √ | √ | |||
| Scipinia arenacea | Insecto de asesino Espinosa rojo | √ | ND | √ | |||
| Gminatus spp. | Insecto de asesino naranja grande | √ | ND | √ | |||
| Trachylestes aspericollis | Pequeño insecto asesino rojo | √ | ND | ND | |||
| Reduviinae | Platymeris spp. | Insecto de asesino africano gigante | √ | √ | √ | ||
| Psytalla horrida | Insecto de asesino Espinosa | √ | ND | √ | |||
| Peiratinae | Ectomocoris spp. | Insecto de asesino de tierra naranja | √ | ND | √ | ||
| Peirates spp. | Insecto de asesino negro | √ | ND | ND | |||
| Stenopodainae | Oncocephalus spp. | - | √ | ND | √ | ||
| Thodelmus spp. | - | x | ND | √ | |||
| Holoptilinae | Ptilocnemus lemur | Insecto de patas de pluma | x | x | ND | ||
| Emesinae | Stenolemus spp. | Insecto de patas de hilo | x | x | x | ||
| Pentatomomorpha | Pentatomidae | Asopinae | Amyotea hamata | Chinche depredador amarillo | √ | ND | ND |
| Nepomorpha | Nepidae | Ranatrinae | Dispar de Ranatra | Escorpión de agua | x, cg | x | √ |
| Belostomatidae | Belostomatinae | Diplonychus eques | Agua error | √ | ND | ND | |
| Belostomatidae | Lethocerinae | El Lethocerus sp. | Error de agua gigante | √ | √ | √ | |
| garrapata, éxito; Cruz, sin éxito; ND, no determinado; CG, secreción de la glándula cefálica sólo | |||||||
Tabla 1: Especificidad de la taxonomía de los métodos usados para cosechar el veneno de heteropterans.
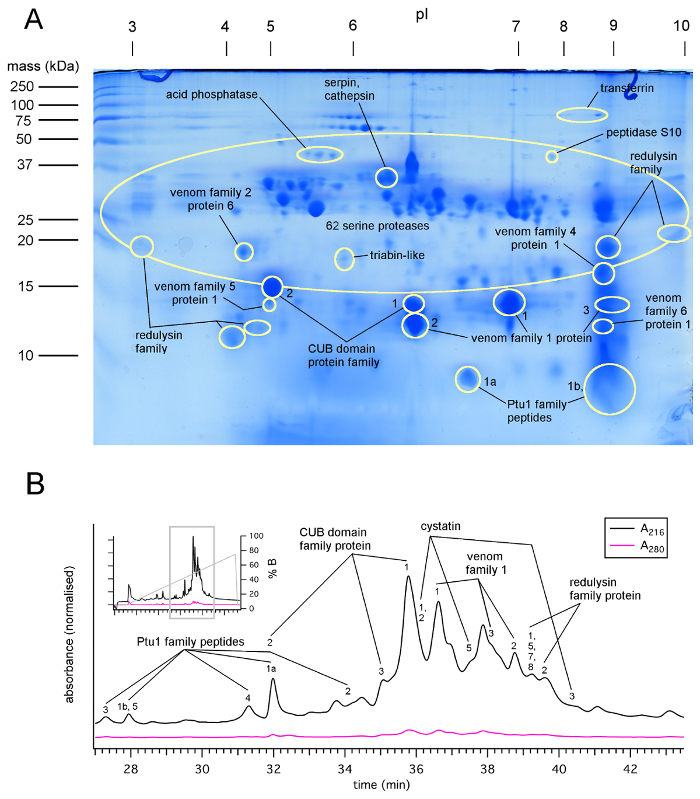
Figura 1 : Proteínas detectadas por LC-MS/MS análisis de los puntos 2D de SDS-PAGE y HPLC fracciones de veneno recolectaron de P. plagipennis por electroestimulación (protocolo 1), que muestra abundantes proteasas, proteínas de dominio CUB y proteínas heteropteran veneno familia 1. (A) 2D gel de SDS-PAGE de crudo veneno de p. plagipennis , que muestran familias de proteínas identificadas por LC-MS/MS de puntos de gel. (B) HPLC cromatograma del fraccionamiento de veneno de p. plagipennis , que muestran familias de proteínas identificadas por LC-MS/MS análisis de fracciones recogidas. Reproducido con permiso de7. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2 : Proporción de secuencias pertenecientes a cada clase de proteína principal en el veneno de Plagipennis p.. Reproducido con permiso de7. Haga clic aquí para ver una versión más grande de esta figura.
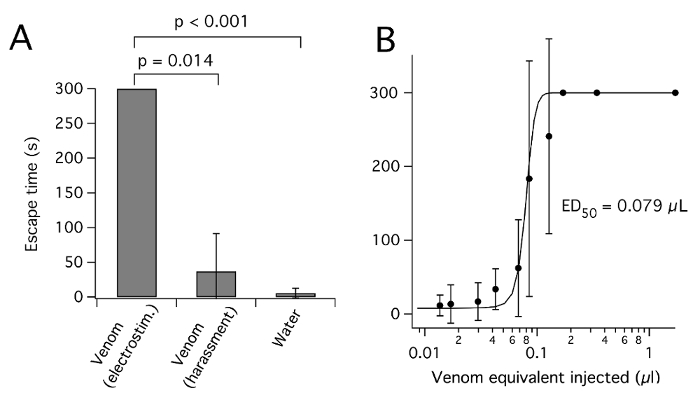
Figura 3 : Plagipennis p. obtenido por electroestimulación, pero no acoso, veneno paraliza insectos. (A) efecto de inyectar veneno por electroestimulación o acoso o agua, en escape de cricket. Para cada condición de veneno, veneno de μl 0.17 equivalente fue inyectado en el abdomen y el tiempo para escapar de una tapa del plato de petri hacia arriba (en la s, hasta 300 s, media ± SD) fue anotada. (B) respuesta a la dosis de la curva para la inhibición del éxito de fuga por veneno Obtenido de p. plagipennis por electroestimulación. Reproducido con permiso de8. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El paso más crítico en la recolección de veneno de insecto asesino es seleccionar el método apropiado dependiendo de los propósitos del estudio. Cada uno de los tres métodos presentados para la recolección de heteropteran venenos tiene ventajas y desventajas dependiendo de aplicaciones posteriores.
Inducir a errores a expulsar el veneno de la probóscide (protocolos 1-3) evita la contaminación de veneno por los tejidos glandulares. Además, estos métodos son no letales y pueden repetirse muchas veces a lo largo de la vida de un insecto. La electroestimulación produce veneno potente toxicidad presa insectos según varios estudios5,8y generalmente proporciona la mayor cantidad de veneno. Provocar una respuesta defensiva es otra forma de sacar el veneno de la probóscide y que pueden producir veneno del contenido de proteínas diferentes a la electroestimulación8. Sin embargo, la electroestimulación y la provocación no funcionan para muchas especies, y sin investigaciones paralelas de la salida de secreción de las glándulas de veneno está claro que lumen de la glándula (o qué combinación de lúmenes de la glándula) se cosecha.
Veneno por disección (Protocolo 4) es en muchos sentidos complementarias. Disección representa una forma directa a veneno almacenado, y cada compartimiento de la glándula de veneno puede ser cosechada por separado o agrupado (es decir, la posibilidad de que el veneno 'mal' ha sido cosechado es obviado). Sin embargo, el método es letal y además causa contaminación ligera de veneno por componentes tisulares. Muchos Heteroptera son demasiado pequeños (o demasiado alargada en el caso de Emesinae, los insectos de patas de hilo) para permitir la recolección de veneno por la disección. Si la disección se utiliza para extraer las proteínas de los compartimentos de cada glándula por separado, es importante separar los lóbulos rápidamente y extraer su contenido por separado para evitar la contaminación cruzada.
Los métodos presentados aquí tendrá que ser modificado dependiendo de la especie estudiada. Para la recolección de veneno por la electroestimulación, los principales aspectos para optimizar son cómo el error es refrenado. Por ejemplo, reduviids la mayoría son capaces de extender su probóscide sobre una amplia gama de movimiento. Estas especies pueden ser simplemente restringido derecho-forma-para arriba en una plataforma con una banda elástica, y la probóscide evertido manualmente. Para las especies con menos flexible probóscide, como belostomatids, en cambio es necesario contener insectos en posición boca abajo y bajar un receptáculo de la colección en el ángulo correcto con una réplica o brazo mecánico. La magnitud y el patrón de la electricidad aplicada también deben ser optimizados, y en este caso, es mejor empezar bajo y lentamente aumente la tensión aplicada para evitar la mortalidad.
Si un estudio pretende alcanzar una comprensión detallada de cómo una especie en particular se produce y utiliza veneno, puede ser una investigación en profundidad combinando múltiples cosecha métodos, así como tecnologías tales como experimentos de RNA-Seq y espectrometría de masas Obligatorio. Si el objetivo es utilizar venenos heteropteran como bibliotecas de moléculas biológicas que se proyectarán para alguna actividad biológica deseada, luego un panel de muestras de veneno obtenido por electroestimulación, acoso, o la disección puede ser conveniente. Sin embargo, observamos que la función biológica normal del veneno cosechada es probable determinar qué bioactividades. Por ejemplo, veneno utilizado para la depredación es más probable que contenga compuestos insecticidos, mientras que el veneno utilizado para la defensa es más probable que contienen a agentes algógenas (que causa dolor).
No hemos incluido cosecha de veneno por el uso de la pilocarpina de agonista de receptor muscarínico en el presente Protocolo. Experimentos futuros son necesarios para determinar las características de expulsión inducida por pilocarpina veneno en comparación con los métodos anteriores.
En este artículo, hemos presentado los métodos que le permiten a los investigadores obtener venenos de insectos heteropteran. Colección de veneno éxito permitirá más investigaciones sobre la producción, composición, función y evolución del veneno en Heteroptera. Además, algunas toxinas de heteropteran pueden encontrar utilidad como insecticidas ecológicos, moléculas de plomo para el desarrollo de la terapéutica humana, o como herramientas científicas para investigar sistemas biológicos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Reconocemos financieros de apoyo del Consejo australiano de investigación (becas DP130103813 y LP140100832 a G.F.K., DECRAN beca DE160101142 a EABU), el Australian National Health & Medical Research Council (beca de investigación Principal APP1044414 a G.F.K.) y la Universidad de Queensland (Beca Postdoctoral a A.A.W.).
Materiales
| Name | Company | Catalog Number | Comments |
| Electostimulator | Grass Technologies | S48 Square Pulse Stimulator | Electrostimulator allowing pulsed electrostimulation |
| Featherlight tweezers | Australian Entomological Supplies | E122B | For handling live venomous insects |
| Protease inhibitor cocktail | Sigma | 4693124001 | For preventing autoproteolytic digestion of venom |
| Dissection equipment | Australian Entomological Supplies | E152Micro | For fine dissections |
| Insect pins | Australian Entomological Supplies | E162 | For fine dissections |
Referencias
- Walker, A. A., Weirauch, C., Fry, B. G., King, G. F. Venoms of heteropteran insects: A treasure trove of diverse pharmacological toolkits. Toxins. 8 (2), 43 (2016).
- Ribeiro, J. M. C., Assumpção, T. C., Francischetti, I. M. B. An insight into the sialomes of bloodsucking Heteroptera. Psyche (Stuttg). 2012, 1-16 (2012).
- Ambrose, D. P., Maran, S. P. M. Quantification protein content and paralytic potential of saliva of fed and prey deprived reduviid Acanthaspis pedestris Stål (Heteroptera: Reduviidae: Reduviinae). Indian Journal of Environmental Science. 3 (1), 11-16 (1999).
- Edwards, J. S. The action and compostion of the saliva of an assassin bug Platymeris rhadamanthus Gaerst. (Hemiptera, Reduviidae). Journal of Experimental Biology. 38, 61-77 (1961).
- Zerachia, T., Bergmann, F., Shulov, A., Kaiser, E. . Animal and Plant Toxins. , 143-146 (1973).
- Walker, A. A., Hernández-Vargas, M. J., Corzo, G., Fry, B. G., King, G. F. Giant fish-killing water bug reveals ancient and dynamic venom evolution in Heteroptera. Cellular and Molecular Life Sciences. , (2018).
- Walker, A. A., et al. Giant fish-killing water bug reveals ancient and dynamic venom evolution in Heteroptera. Cell. Mol. Life Sci. , (2018).
- Walker, A. A., et al. The assassin bug Pristhesancus plagipennis produces two distinct venoms in separate gland lumens. Nature Communications. 9 (1), 755 (2018).
- Hernández-Vargas, M. J., Santibáñez-López, C. E., Corzo, G. An insight into the triabin protein family of American hematophagous reduviids: Functional, structural and phylogenetic analysis. Toxins. 8 (2), 44 (2016).
- Dan, A., Pereira, M. H., Pesquero, J. L., Diotaiuti, L., Beirao, P. S. Action of the saliva of Triatoma infestans (Heteroptera: Reduviidae) on sodium channels. Journal of Medical Entomology. 36 (6), 875-879 (1999).
- Corzo, G., Adachi-Akahane, S., Nagao, T., Kusui, Y., Nakajima, T. Novel peptides from assassin bugs (Hemiptera: Reduviidae): isolation, chemical and biological characterization. FEBS Letters. 499 (3), 256-261 (2001).
- Sahayaraj, K., Kumar, S. M., Anandh, G. P. Evaluation of milking and electric shocks for venom collection from hunter reduviids. Entomon. 31 (1), 65-68 (2006).
- Silva-Cardoso, L., et al. Paralytic activity of lysophosphatidylcholine from saliva of the waterbug Belostoma anurum. Journal of Experimental Biology. 213 (19), 3305-3310 (2010).
- Noeske-Jungblut, C., et al. Triabin, a highly potent exosite inhibitor of Thrombin. Journal of Biological Chemistry. 270 (48), 28629-28634 (1995).
- Noeske-Jungblut, C., et al. An inhibitor of collagen-induced platelet aggregation from the saliva of Triatoma pallidipennis. Journal of Biological Chemistry. 269 (7), 5050-5053 (1994).
- Sahayaraj, K., Borgio, J. F., Muthukumar, S., Anandh, G. P. Antibacterial activity of Rhynocoris marginatus (Fab.) and Catamirus brevipennis (Servile) (Hemiptera: Reduviidae) venoms against human pathogens. Journal of Venomous Animals and Toxins Including Tropical Diseases. 12 (3), 487-496 (2006).
- Haridass, E. T., Ananthakrishnan, T. N. Functional morphology of the salivary system in some reduviids (Insecta-Heteroptera-Reduviidae). Proceedings of the Indian Academy of Sciences. Animal Sciences. 90 (2), 145-160 (1981).
- Maran, S. P. M., Ambrose, D. P., Ignacimuth, A., Sen, A., Janarthanan, S. . Biotechnological Applications for Integrated Pest Management. , 125-131 (2000).
- Maran, S. P. M., Selvamuthu, K., Rajan, K., Kiruba, D. A., Ambrose, D. P., Ambrose, D. P. . Insect Pest Management, A Current Scenario. , 346-361 (2011).
- Pereira, M. H., et al. Anticoagulant activity of Triatoma infestans and Panstrongylus megistus saliva (Hemiptera/Triatominae). Acta Tropica. 61, 255-261 (1996).
- Ribeiro, J. M., Marinotti, O., Gonzales, R. A salivary vasodilator in the blood-sucking bug, Rhodnius prolixus. British Journal of Pharmacology. 101 (4), 932-936 (1990).
- Ribeiro, J. M., Schneider, M., Guimarães, J. A. Purification and characterization of prolixin-S (nitrophorin 2), the salivary anticoagulant of the blood-sucking bug Rhodnius prolixus. Biochem Journal. 308 (1), 243-249 (1995).
- Swart, C. C., Deaton, L. E., Felgenhauer, B. E. The salivary gland and salivary enzymes of the giant waterbugs (Heteroptera; Belostomatidae). Comparative Biochemistry and Physiology A Molecular & Integrative Physiology. 145 (1), 114-122 (2006).
- Rasmussen, S., Young, B., Krimm, H. On the 'spitting' behaviour in cobras (Serpentes: Elapidae). Journal of Zoology. 237 (1), 27-35 (1995).
- Fink, L. S. Venom spitting by the green lynx spider, Peucetia viridans (Araneae, Oxyopidae). Journal of Arachnology. 12, 372-373 (1984).
- Herzig, V. Ontogenesis, gender, molting influence the venom yield in the spider Coremiocnemis tropix (Araneae, Theraphosidae). Journal of Venomous Research. 1, 76-83 (2010).
- Sahayaraj, K., Subramanium, M., Rivers, D. Biochemical and electrophoretic analyses of saliva from the predatory reduviid species Rhynocoris marginatus (Fab). Acta Biochimica Polonica. 60 (1), 91-97 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados