Method Article
Analyse de surface cellulaire Adhérence remodelage en réponse à la tension mécanique utilisant des billes magnétiques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
adhérences de surface cellulaire sont au cœur de la mécanotransduction, car ils transmettent une tension mécanique et d'initier les voies de signalisation impliquées dans l'homéostasie et le développement des tissus. Ici, nous présentons un protocole pour disséquer les voies biochimiques qui sont activés en réponse à une tension, en utilisant des microbilles magnétiques revêtues de ligand et l'application de la force sur les récepteurs d'adhérence.
Résumé
complexes d'adhésion de la surface cellulaire mécanosensibles permettent aux cellules pour détecter les propriétés mécaniques de leur environnement. Des études récentes ont identifié deux molécules de détection de force sur les sites d'adhésion, et les facteurs de transcription de force dépendante qui régulent l'expression des gènes spécifiques à la lignée et conduisent les sorties phénotypiques. Cependant, les réseaux de signalisation de conversion tension mécanique dans les voies biochimiques sont restées insaisissables. Pour explorer les voies de signalisation engagées sur une tension mécanique appliquée à un récepteur de surface cellulaire, les microbilles superparamagnétiques peuvent être utilisés. Ici, nous présentons un protocole utilisant des billes magnétiques pour appliquer des forces à des protéines d'adhésion de surface cellulaire. En utilisant cette approche, il est possible d'étudier non seulement la force dépendant de signalisation cytoplasmique voies par diverses approches biochimiques, mais aussi l'adhérence remodelage par l'isolement magnétique de complexes d'adhésion fixés aux billes de ligand revêtu. Ce protocole comprend la préparation du ligand-coperles superparamagnétiques és, et l'application de définir les forces de traction suivie par des analyses biochimiques. En outre, nous fournissons un échantillon représentatif de données démontrant que la tension appliquée à l'adhésion sur la base intégrine déclenche l'adhérence remodelage et altère la protéine tyrosine phosphorylation.
Introduction
En métazoaires, la tension mécanique dirige le développement des tissus et de l' homéostasie grâce à la réglementation d'une myriade de processus cellulaires tels que la prolifération, la différenciation et la survie 1, 2. la tension mécanique peut provenir de la matrice extracellulaire, ou peut être produite par des cellules adhérentes, ce qui leur échantillon de l'environnement extracellulaire par l'appareil contractile actomyosine qui tire sur la matrice extracellulaire et les sondes grâce à sa rigidité des molécules de tension sensible. En réponse à la tension, les protéines d'adhésion mécanosensibles subissent des changements conformationnels qui déclenchent des cascades de signalisation complexes. À leur tour, ces voies de signalisation orchestrer une mechanoresponse englobant la prolifération, la différenciation et la survie qui permet de régler le comportement cellulaire dans l'environnement extracellulaire. De tels procédés peuvent être réglés dans une période de temps à court terme (secondes à quelques minutes) pour nourrir rapidement revenir sur la boucle de mecha notransduction en modifiant les structures mécanosensibles. Par exemple, sur la base des adhérences intégrine renforcent en réponse à la tension par l' intermédiaire de Rho GTPase à médiation par le remodelage du cytosquelette 3, 4, 5. En parallèle, d' autres voies de signalisation sont activés sur les heures et les jours pour contrôler les programmes génétiques qui ont finalement un impact sur le destin des cellules 6. Considérant que, de nombreuses études ont mis en évidence l'effet de la rigidité de la matrice sur le déterminisme cellulaire et le développement de la maladie 1, 2, les mécanismes moléculaires précis de mécanotransduction d'adhérence médiée demeurent insaisissables.
Diverses approches ont été développées pour étudier les effets des forces générées cellules ou des forces externes sur le comportement des cellules, y compris les systèmes d'écoulement, le transfert d'énergie de résonance de fluorescence (FRET) capteurs -Tension 7,lass = "xref"> 8, substrats conformes 9, pinces magnétiques, pinces optiques 10 et microscopie à force atomique (AFM) 11. Ici, nous présentons un protocole en utilisant des billes superparamagnétiques pour caractériser les voies de mécano en réponse aux forces de traction appliquées aux récepteurs d'adhésion spécifiques. des billes superparamagnétiques sont des particules qui magnétisent réversiblement lorsqu'il est placé dans un champ magnétique. Une fois revêtu d'un ligand pour un récepteur spécifique, ces perles fournissent un outil puissant pour étudier les effets de l'application de la force extracellulaire. Cette méthode a été validée par plusieurs études 3, 5, 12 - 17 et présentent l'avantage de faciliter largement l' analyse biochimique sur les cellules adhérentes. En utilisant des billes magnétiques revêtues de collagène similaires suivie d'une analyse biochimique, les premiers travaux ont signalé une augmentationla protéine tyrosine phosphorylation et l' activation de RhoA en réponse à la tension 5, 18, 19. Le procédé décrit ci - dessous a également été utilisé avec de la fibronectine (FN) des perles revêtues d' caractériser les voies de signalisation en aval de la tension appliquée aux intégrines 3. Dans cette étude, Guilluy et al. a montré que la tension active RhoA par le recrutement des deux facteurs d'échange guanine nucléotide (GEF), LARG et GEF-H1, à des complexes d'adhésion intégrine. Depuis lors, d' autres études ont montré que le GEF-H1 est recruté pour des complexes d'adhérence en réponse à la tension générée aux cellules en utilisant différentes méthodes 20, 21, ce qui démontre la robustesse de la méthode décrite ici. Par conséquent, RhoA activée a été montré pour favoriser l'adhérence de renforcement, par l'intermédiaire du cytosquelette remodelage. Ce système a également été utilisé pour explorer la tension appliquée to des récepteurs d'adhésion cellule / cellulaire. Application de forces sur des billes magnétiques recouvertes avec le domaine extracellulaire de la E-cadhérine a induit une augmentation du recrutement de vinculine est similaire à l' intégrine associés complexes d'adhésion 12. Collins et ses collègues ont observé que l' application de la tension à PECAM-1 favorise intégrine et RhoA activation 13. Une autre approche expérimentale utilisant des billes magnétiques est l'étude de la tension appliquée aux noyaux isolés. En utilisant des billes revêtues avec des anticorps contre la protéine de l' enveloppe nucléaire nesprin-1, ont été purifiés complexes de l' enveloppe nucléaire pour montrer qu'ils sont dynamiquement réglées en réponse à une tension mécanique 22. Ces résultats appuient la puissance de cette méthode dans l'étude des voies de mécanotransduction. En outre, alors que les systèmes d'écoulement ou la force de traction stimulent les processus cellulaires générales, des billes magnétiques ciblent spécifiquement un récepteur d'adhérence cellulaire en utilisant soit des ligands du récepteur 3 ou des anticorps monoclonaux dirigés contre des récepteurs de surface cellulaire 13, 15.
Un autre avantage de ce procédé est l'isolement des complexes d'adhésion par le biais d'une procédure de purification par affinité du ligand simple. Il est bien connu que l' addition de billes de ligand se lie à des cellules revêtues des récepteurs d'adhésion et induit le recrutement de plusieurs protéines d'adhésion 23. En outre l' application de forces à des billes magnétiques revêtues ligand transforme ces complexes d'adhésion dans les plates - formes macromoléculaires qui médie diverses voies de signalisation de tension dépendant 4, 24. la lyse des cellules suivie d'une concentration de billes en utilisant un aimant permet d'isoler des plates-formes d'adhérence. D'autres procédés utilisés pour purifier les complexes d'adhérence ont déjà été utilisés dans des cellules adhérentes. Elles combinent une réticulation chimique pour conserver les interactions protéine-protéineet une étape de lyse des cellules par un détergent et de l' écoulement de cisaillement ou de sonification 20, 21, 25, 26, 27, 28. La dernière étape est la collecte des membranes plasmiques ventrale résultant contenant les complexes d'adhérence. Contrairement à ces procédés, des billes magnétiques permettent à un niveau supérieur de purification de complexes d'adhérence cellulaire en ciblant sélectivement une famille spécifique de récepteurs d'adhésion. Les billes magnétiques ont déjà été utilisés pour purifier les complexes d'adhésion dans les cellules non adhérentes attachées à des microbilles de ligand revêtu 29, 30. La méthode décrite ci-dessous imite les situations biologiques où la force est appliquée pendant une période prolongée de courte durée (secondes à quelques minutes). Par conséquent, il fournit un outil puissant pour étudier à la fois la composition moléculaire des complexes d'adhérence purifiés etles voies de signalisation en aval mécanosensibles.
Nous présentons ici un protocole expérimental détaillé pour l'utilisation de billes magnétiques pour appliquer des forces de tensionnels aux protéines de surface d'adhérence. Un aimant néodyme permanent est placé au-dessus de la surface de la boîte de culture. La face polaire de l'aimant est placé à une hauteur de 6 mm de telle sorte que la force exercée sur un seul 2,8 um bille magnétique est constante (environ 30-40 pN) 31. La durée de la stimulation de la tension est déterminée par l'opérateur en fonction de la molécule d'intérêt et de son échelle de temps d'activation. Les cellules sont enfin lysées, des complexes d'adhérence sont purifiés par séparation des billes en utilisant un aimant et des analyses biochimiques sont traitées. Ce protocole comprend la préparation de billes superparamagnétiques revêtues de ligands, et l'application d'une tension à travers l'aimant suivie par des analyses biochimiques. En outre, nous fournissons un échantillon représentatif de données démontrant que la tension appliquée à adh base intégrineesions induit l'adhérence et le remodelage des protéines altère la phosphorylation sur tyrosine.
Protocole
1. Ligand Conjugaison à des billes magnétiques
Remarque: la conjugaison Ligand est réalisée en utilisant des billes de tosyle activé superparamagnétiques avec un 2,8 um de diamètre (concentration stock solution 10 8 billes / mL, 30 mg de billes / mL). Le protocole suivant est basé sur des échantillons d'environ 2 x 10 5 cellules, qui correspondent à des cellules MRC-5 cultivées jusqu'à 80% de confluence dans une plaque de culture tissulaire de 60 mm. Réglez le volume des perles et des réactifs en conséquence si en utilisant des plaques de tailles différentes ou des cellules à différents confluences. Utilisez une quantité de billes superparamagnétiques afin d'avoir 2 perles par cellule. Par conséquent, 4 x 10 5 perles sont nécessaires pour une plaque de 60 mm.
- resuspendre soigneusement les perles dans le flacon d'origine par tourbillonnement au moins 30 s. Aliquoter 40 ul des billes superparamagnétiques remis en suspension (correspondant à 4 x 10 6 billes) à 1,5 ml microtube.
- Placer le tube sur un separati magnétiqueen attente afin de séparer les billes magnétiques de la solution. Jeter le surnageant, retirer le tube du support de séparation magnétique et remettre en suspension les billes dans 1 ml de 0,1 M Na-phosphate pH 7,4.
- étape de lavage à répétition deux fois avec 1 ml de 0,1 M de phosphate de sodium à pH 7,4.
- Après le lavage final, la remise en suspension des billes dans 1 ml de 0,1 M de phosphate de sodium à pH 7,4.
- Combiner 100 ug bovine fibronectine (FN) ou tout autre ligand du récepteur de l'adhésion cellulaire au 1 ml de 0,1 M de phosphate de sodium pH 7,4 contenant des billes et mélanger par pipetage.
- Répéter les étapes précédentes en remplaçant FN ou tout autre ligand spécifique avec de la BSA, la poly-D-lysine ou de l'apo-transferrine pour les témoins négatifs.
- Eventuellement, pour l'analyse de gel, prendre une partie aliquote de 10 pi de solution de ligand pour l'analyse de l'efficacité de réticulation et mélanger avec un volume approprié de concentré échantillon Laemmli Buffer.
- Incuber des perles avec la solution de ligand contenant pour 12 à 24 h à 37 ° C sur un rotor.
- Si les agrégats de perles apparaissent après la réaction a eu lieu, sonication (puissance 39 W en continu) pour pas plus de 10-20 s.
- Isoler les perles en utilisant stand de séparation magnétique, aspirez la solution restante et ajouter 1 ml de PBS / BSA à 0,2% pH 7,6 solution. Incuber pendant 1 h sur rotor à 37 ° C.
- Laver les billes en utilisant un aimant à deux reprises avec 1 ml de PBS / 0,2% de SAB, pH 7,6. Remettre les billes dans 1 ml de PBS / 0,2% BSA pH 7,6.
- perles Soniquer si les agrégats semblent pas plus de 20-30 s.
- En option, retirer une partie aliquote de 10 pi pour analyser le couplage efficacité par western blot (mélanger avec un volume approprié de concentré tampon d'échantillon Laemmli).
- Passez à la cellule des essais ou des billes de magasin à 4 ° C pendant 1 mois.
- Eventuellement, exécuter un gel SDS-PAGE et coloration au bleu de Coomassie pour analyser FN réticulation aux billes magnétiques.
2. Application des forces de tension sur les perles Ligand enduit Bound à Adhérence Receptors sur la DorsaleSurface des cellules
- La culture des cellules adhérentes sur la boîte de 60 mm pour culture de tissus dans un milieu de croissance approprié (habituellement DMEM à 4,5 g / L de D-glucose additionné de FCS à 10%) jusqu'à atteindre 80% de confluence.
- Préparer un tampon de lyse non dénaturante non-ionique (20 mM de Tris HCl pH 7,6, 150 mM de NaCl, 2 mM de MgCl2, 0,1% de NP-40) et de refroidissement des tubes centrifuger.
- Pellet les perles de ligand revêtu de la section 1.10 et remettre en suspension dans 1 ml de PBS / BSA à 0,2% à pH 7,6. Ajouter 100 ul de la solution de billes de ligand revêtu de 5 ml de milieu de culture chaud et vortex.
- milieu Aspirer à 60 mm boîte de culture et ajouter 5 ml de milieu de croissance chaud complété avec des perles.
- Incuber pendant 20 min dans des conditions de culture cellulaire (37 ° C et 5% de CO 2) pour permettre aux billes de se sédimenter et adhèrent aux cellules. Il est crucial de ne pas dépasser 20 min depuis billes peuvent être internalisés par phagocytose.
- Eventuellement, observer les perles sous un microscope optique en utilisant un obje 10X ou 20Xctive et vérifier l'adhérence talon en secouant légèrement le plat de discriminer entre les perles attachées et flottantes.
- Tout en gardant la boîte de culture dans l'incubateur, échanger le couvercle plat normal pour un couvercle avec un aimant néodyme de 38 mm rond fixé sur la face supérieure. L'aimant est maintenu en place par deux petits aimants en néodyme de 13 mm positionnés sur la face inférieure du couvercle. Étant donné que les aimants sont très puissants, les manipuler avec soin.
- Incuber des cellules soumises à des tensions aux points temporels souhaités dans des conditions de culture cellulaire (37 ° C et 5% de CO 2).
- Après le traitement, placez plat sur la glace et soigneusement aspirer tout le milieu de la boîte.
- Ajouter 300 pi de tampon de lyse cellulaire, et incuber pendant 10 minutes sur de la glace. Recueillir le lysat à l'aide d'un grattoir à cellules et transférer dans un tube à microcentrifugation prérefroidi de 1,5 ml.
- Pellet les billes magnétiques en utilisant le support de séparation magnétique et transférer le lysat cellulaire total à une nouvelle pré-refroidissemented 1,5 microtube mL. Conservez cette fraction à -20 ° C pour analyse ultérieure.
- Laver les billes 3 fois par ml de tampon de lyse 1 glacée. Ajouter 50 tampon d'échantillon Laemmli pi au culot de perles, mélanger par pipetage et faire bouillir à 95 ° C pendant 5 minutes en utilisant un chauffe-bloc sec. Cette fraction contient les complexes d'adhérence isolés. Procéder à une analyse biochimique ou conserver à -20 ° C.
- À partir du lysat cellulaire total obtenu après la séparation des perles (environ 300 pi), retirer une partie aliquote de 50 ul pour une analyse Western blot.
NOTE: Les 250 pi de gauche peut être utilisé pour d'autres études biochimiques telles que des études d'interaction protéine-protéine (immunoprécipitation, des dosages GST pull-down) ou des expériences d'activité GTPase (changement du tampon de lyse peuvent être nécessaires en fonction de la GTPase d'intérêt).
Résultats
Le schéma de la technique est illustrée sur la figure 1a. Suite à la conjugaison du ligand, les billes magnétiques sont mises en incubation avec les cellules pendant 20 min, puis un aimant permanent est utilisé pour appliquer des forces de traction d'environ 30 à 40 pN pour différents laps de temps. La figure 1b représente 2,8 um billes magnétiques revêtues de FN MRC5 liés à des récepteurs d'adhésion cellulaire.
Les étapes de lavage des billes superparamagnétiques, après la lyse des cellules sont cruciales et déterminent le degré de purification. Un minimum de trois lavages est recommandée. Immunoblots GADPH avec les longues expositions peuvent être utiles pour tester la pureté des complexes d'adhérence (Figure 2a).
perles FN revêtus ont été utilisés pour étudier les processus de mécanotransduction qui se produisent au fil du temps dans les complexes d'adhérence en réponse à la tension. Après la séparation magnétique de l'adhésion fraction complexe, le lysat et l'adhésion fraction complexe ont été analysés parwestern blot. Comme on s'y attendait, on a observé taline, la vinculine et de la paxilline, mais pas dans la fraction GAPDH de complexes d'adhérence , même en l' absence de stimulation mécanique (figure 2b). Cohérente avec des rapports antérieurs 32, 33, la tension déclenche le recrutement vinculine à des complexes d'adhérence. Alors que la tension n'a aucune incidence sur le recrutement paxillin à des complexes d'adhérence, sa phosphorylation sur la tyrosine 31 a été améliorée en réponse à une tension mécanique à la fois dans le lysat cellulaire totale et l'adhérence fraction complexe.
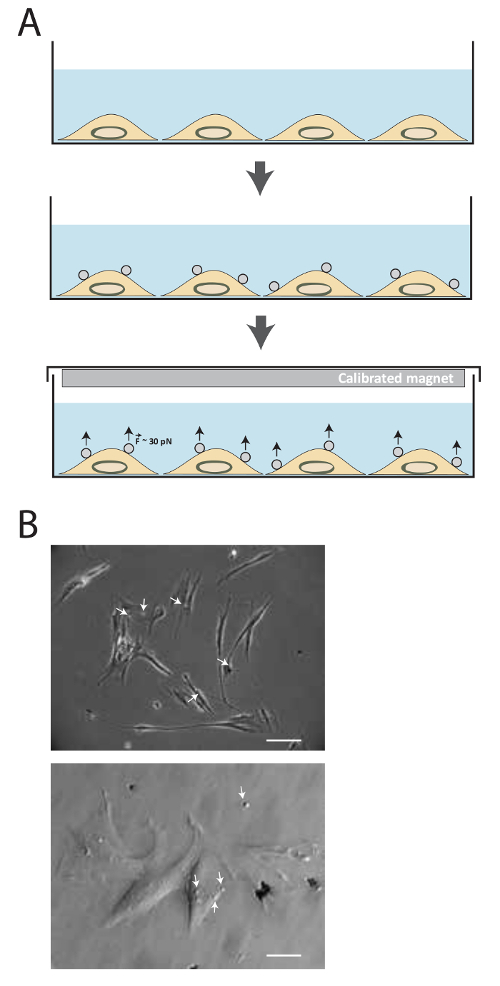
Figure 1. Description de la méthode. (A) Représentation schématique de la technique. Les cellules sont d'abord cultivées dans un milieu de culture jusqu'à la confluence souhaitée soit atteinte. Ensuite, perles superparamagnétiques sont ajoutés pendant 15-20 min. forces de traction sont environ 30 à 40 pNensuite appliqué en utilisant l'aimant étalonné pour quantité différente de temps. (B) des billes superparamagnétiques fibronectine se lient aux récepteurs d'adhésion cellulaire. Les cellules sont imagées par contraste de phase en lumière transmise microscopie 15 min après avoir ajouté les perles superparamagnétiques (flèche blanche) dans le milieu. (Image du haut: Barre d'échelle = 25 um, l' image de fond: Barre d' échelle = 100 um) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
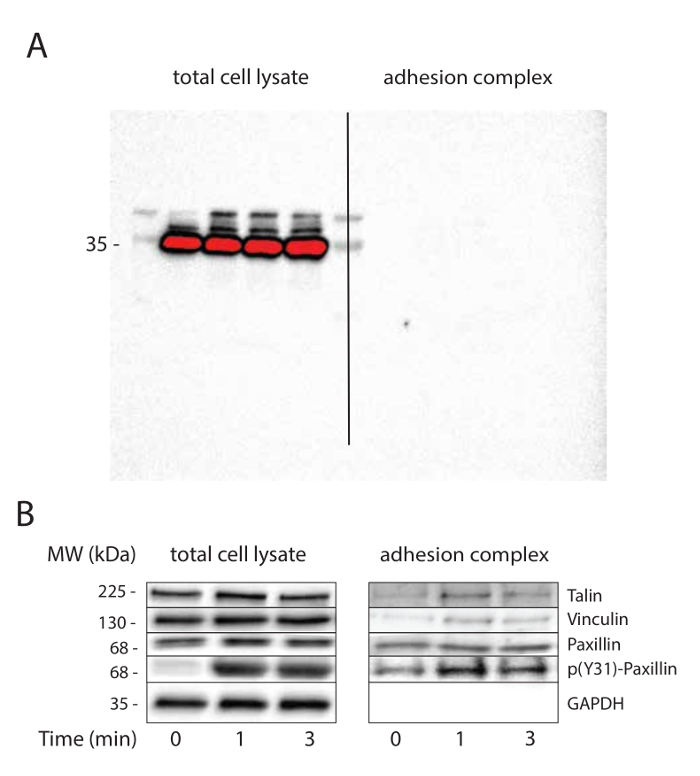
Figure 2. tension mécanique induit l' adhérence maturation. (A) La purification de complexes d'adhérence. GAPDH immunoblotting est utilisé comme contrôle de chargement pour lysat cellulaire totale et pour vérifier la pureté des complexes d'adhérence. La membrane de nitrocellulose a été imagé à l'aide d'une longue exposition à démontrer ee absence de signal dans la fraction d'adhérence complexe. (B) La tension induit l' adhérence maturation. commande de chargement (GAPDH) et candidats (vinculine, Talin et paxillin) connus pour être recrutés ou phosphorylée au niveau des complexes d'adhérence en réponse à une tension mécanique sont immunoblottées. Cette expérience a été réalisée sur les cellules MRC5. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
La méthode décrite ici constitue une approche simple pour appliquer une tension à des récepteurs d'adhésion de la surface cellulaire et permettent leur purification ultérieure. Cependant, certaines étapes sont essentielles pour effectuer efficacement la purification de l'adhérence et l'optimisation potentielle peut être fait en fonction des récepteurs d'adhésion ciblés. Nous présentons les problèmes potentiels que l'utilisateur peut rencontrer ci-dessous.
Nous avons utilisé des billes magnétiques de 2,8 um de diamètre, mais plus grandes perles peuvent être utilisées telles que 4,5 um de diamètre. Cependant, le diamètre du cordon devrait être limitée à 2-5 pm depuis phagocytose pourrait se produire plus rapidement pendant 30-60 min d' incubation et de plus grandes perles ont une adhérence plus forte de sorte que le déplacement bourrelet serait limitée sous champ magnétique 34, 35. Par conséquent, il est important de limiter le temps d'incubation pour de courtes périodes, et utiliser la bonne taille des billes. Le nombre de perles incubé par cellule aura un impact sur la quantité de fexpérience orce par une seule cellule. Alors que l'on veut stimuler efficacement les cellules avec une tension, trop de billes par cellule peuvent conduire à l'activation des voies de signalisation non pertinentes. Nous incubons habituellement une moyenne de deux perles par cellule pour perles FN-enduites, mais cette quantité peut être ajustée [1 à 5 billes par cellule] en fonction du type cellulaire et le récepteur de surface cellulaire. En ce qui concerne l'aimant, la méthode décrite ici utilise un aimant dont la force résultante sur un 2,8 pm a été mesuré (environ 30 à 40 pN en mesurant le déplacement de billes magnétiques dans le glycérol non diluée, d' un liquide newtonien ayant une viscosité connue 31, bien qu'il est possible d'utiliser de plus grands aimants pour appliquer plus grande quantité de force si nécessaire. Il est important de noter que ces aimants sont extrêmement puissants et de les manipuler avec soin.
Après 12-24 h d'incubation avec un ligand ECM (étape 1.7) et après 1 heure d'incubation (étape 1.9) avec du PBS / 0,2% de SAB, pH 7,6 tampon, le mmicrobilles agnétiques pourraient former des agrégats. Il est alors essentiel de séparer les perles autant que possible à respecter le rapport de 2 billes par cellule. Cependant, il est encore acceptable d'avoir un ratio de 5: 1. La séparation des billes peut être réalisé soit par mélange et pipetage ou en utilisant des ultrasons, bien que pendant une courte période (de 20 à 30 s).
Diverses protéines peuvent être conjugués à des billes, y compris le ligand d'intégrine (FN, le collagène), des protéines ou des anticorps recombinants ciblant des récepteurs spécifiques de la surface cellulaire. L'attachement des billes magnétiques revêtues de ligand à la surface cellulaire dorsale peut être affaiblie par le manque d'efficacité de couplage du ligand sur les billes. Il est recommandé de vérifier la liaison aux billes en recueillant une fraction aliquote de la solution de ligand dilué avant d'ajouter aux perles et une aliquote de billes, à la fin du processus de couplage du ligand. Ces portions aliquotes peuvent être traités pour une analyse par SDS-PAGE et coloration au bleu de Coomassie.
Si aucun changementvoies ou processus de mechanosensing attendus sont détectés de signalisation, il est important de considérer les différentes possibilités. Une façon d'identifier le problème consiste à moduler la durée de l'expérience avec l'aimant. Il est bien connu que la vitesse des processus cellulaires varie en fonction du type cellulaire utilisé. Une autre option serait de tester des molécules de tension sensibles connues et vérifier leurs modifications post-traductionnelles par Western blot (par exemple paxillin phosphorylation ou FAK phosphorylation peut être analysée). Le montant de la force peut être aussi critique et en utilisant un aimant plus épais (même grade N52) ou plus grandes perles peut être une option. En outre, l'efficacité de liaison au ligand / récepteur peut être explorée par une analyse complexe d'adhérence et de rechercher des récepteurs de surface cellulaire (par exemple cadhérine ou d'intégrine). La confluence cellulaire peut également affecter la réponse cellulaire à la tension. Comme il a été observé que la cellule / cellule adhérence peut affecter le comportement des cellules et cystokeletal prétension, il est important à noter que la confluence peut affecter la réponse cellulaire à la tension. Même si nous recommandons 80% de confluence pour l'application de la tension à des adhérences à base intégrines, des conditions différentes peuvent être testées afin d'optimiser le système expérimental.
Bien que cette méthode fournit un outil puissant pour déchiffrer le adhesome sensible à la tension, ainsi que les voies de signalisation associées, il y avait aussi quelques limitations. Premièrement, puisque la principale préoccupation en utilisant ces billes magnétiques de petite taille est le risque de leur intériorisation par les cellules, cette méthode ne peut pas être utilisé pour l'étude de signalisation mécanosensible réponses cellulaires à long terme qui modifient le destin des cellules tels que la différenciation et la prolifération. Une autre limitation réside dans la manière de la façon dont les forces sont appliquées à la couche de cellules dans la plaque de culture. En effet, étant donné que le champ magnétique est toujours supérieure à la périphérie de l'aimant, les forces peuvent varier à la surface de la plaque de culture avec un gradient décroissant de la celluleétirement de la périphérie vers le centre et pourrait conduire à des réponses cellulaires hétérogènes.
La procédure décrite ici constitue une méthode efficace simple et économique qui permet d'étudier les voies cellulaires mécanosensibles ainsi que rechercher la composition moléculaire de complexes d'adhésion soumis à des tensions. D'autres approches, comme dispositif qui applique déformation cyclique dans des cellules d'étirage, conduit à l'application d'une tension à tous les récepteurs de la surface cellulaire qui interagissent avec la matrice extracellulaire. La méthode décrite ici a l'avantage de permettre la stimulation d'un sous-ensemble spécifique de récepteurs de surface cellulaire et une grande variété de ligands force peut être utilisée, comme l'intégrine des ligands ou des anticorps ciblant les récepteurs de surface cellulaire, ce qui permet l'étude de nombreux systèmes mécanosensibles distincts. Un autre avantage de cette méthode est qu'elle conduit à la purification des complexes de protéines qui ont connu des tensions et de travailler sur des porteurs en elements qui sont connus pour jouer un rôle central dans la mécanotransduction 36. Le complexe d'adhérence purifié peut également être utilisé pour diverses approches biochimiques, tels que les 14 dosages de kinase pour étudier l' activité de la kinase en réponse à la tension ou de dosage de la polymérisation de l' actine. En outre, ce système expérimental peut être couplé avec une pince magnétique pour étudier la réponse mécanique cellulaire et de corréler cette réponse avec les voies de signalisation identifiés. Fait intéressant, les nanoparticules magnetoplasmonic ont été utilisées récemment mécaniquement Notch de charge et E-cadhérine avec un contrôle précis dans le temps et l' espace 37. Cette évolution récente peut aider à explorer les voies de signalisation mécanosensibles avec différentes entrées spatiales, temporelles et mécaniques.
Déclarations de divulgation
Les auteurs déclarent une absence d'intérêts financiers en compétition.
Remerciements
CG est soutenu par des subventions de l'Agence Nationale de la Recherche (ANR-13-JSV1-0008), du septième programme-cadre de l'Union européenne (Marie Curie Intégration de carrière n˚8304162) et du Conseil européen de la recherche (CER) au titre Horizon de l'Union européenne 2020 programme de recherche et d'innovation (ERC n˚639300 de subvention de départ).
matériels
| Name | Company | Catalog Number | Comments |
| Neodymium magnets (on the upper face of 60 mm dish) | K&J Magnetics, Inc | DX88-N52 | grade N52 dimension: 1 1/2" dia. x 1/2" thick |
| Neodymium magnets (on the lower face of 60 mm dish) | K&J Magnetics, Inc | D84PC-BLK | grade N42 dimension: 1/2" dia. x 1/4" thick Black Plastic Coated |
| Dynabeads M280 Tosylactivated | Thermofisher | 14203 | superparamagnetic beads |
| DynaMag-2 Magnet | Thermofisher | 12321D | |
| Fibronectin | Sigma-Aldrich | F1141-5MG | Fibronectin from bovine plasma |
| Poly-D-Lysine | Sigma-Aldrich | P7280-5MG | |
| Apo-Transferrin | Sigma-Aldrich | T1428-50MG | Bovine Apo-Transferrin |
| Bovine serum albumin | Sigma-Aldrich | A7906-500G | |
| DMEM high glucose, GlutaMAX supplement, pyruvate | Life Technologies | 31966-021 | DMEM+GlutaMAX-I 500 ml |
| 60*15 mm culture dish | Falcon | 353004 |
Références
- Discher, D. E., Janmey, P., Wang, Y. -. L. . Tissue cells feel and respond to the stiffness of their substrate. 310 (5751), 1139-1143 (2005).
- DuFort, C. C., Paszek, M. J., Weaver, V. M. Balancing forces: architectural control of mechanotransduction. Nat Rev Mol Cell Biol. 12 (5), 308-319 (2011).
- Guilluy, C., et al. The Rho GEFs LARG and GEF-H1 regulate the mechanical response to force on integrins. Nat Cell Biol. 13 (6), 722-727 (2011).
- Matthews, B. D., Overby, D. R., Mannix, R., Ingber, D. E. Cellular adaptation to mechanical stress: role of integrins, Rho, cytoskeletal tension and mechanosensitive ion channels. J Cell Sci. 119 (3), 508-518 (2006).
- Zhao, X. -. H., et al. Force activates smooth muscle alpha-actin promoter activity through the Rho signaling pathway. J Cell Sci. 120 (Pt 10), 1801-1809 (2007).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Austen, K., Kluger, C., Freikamp, A., Chrostek-Grashoff, A., Grashoff, C. Generation and analysis of biosensors to measure mechanical forces within cells. Meth Mol Biol. 1066, 169-184 (2013).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466 (7303), 263-266 (2010).
- Pelham, R. J., Wang, Y. l. . Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci USA. 94 (25), 13661-13665 (1997).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin-cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Chaudhuri, O., Parekh, S. H., Lam, W. A., Fletcher, D. A. Combined atomic force microscopy and side-view optical imaging for mechanical studies of cells. Nat Meth. 6 (5), 383-387 (2009).
- Bays, J. L., et al. Vinculin phosphorylation differentially regulates mechanotransduction at cell-cell and cell-matrix adhesions. J Cell Biol. 205 (2), 251-263 (2014).
- Collins, C., et al. Localized tensional forces on PECAM-1 elicit a global mechanotransduction response via the integrin-RhoA pathway. Curr Biol. 22 (22), 2087-2094 (2012).
- Gordon, W. R., et al. Mechanical Allostery: Evidence for a Force Requirement in the Proteolytic Activation of Notch. Dev Cell. 33 (6), 729-736 (2015).
- Lessey-Morillon, E. C., et al. The RhoA guanine nucleotide exchange factor, LARG, mediates ICAM-1-dependent mechanotransduction in endothelial cells to stimulate transendothelial migration. J Immunol. 192 (7), 3390-3398 (2014).
- Osborne, L. D., et al. TGF-β regulates LARG and GEF-H1 during EMT to affect stiffening response to force and cell invasion. Mol Biol Cell. 25 (22), 3528-3540 (2014).
- Scott, D. W., Tolbert, C. E., Burridge, K. Tension on JAM-A activates RhoA via GEF-H1 and p115 RhoGEF. Mol Biol Cell. 27 (9), 1420-1430 (2016).
- Glogauer, M., Ferrier, J., McCulloch, C. A. Magnetic fields applied to collagen-coated ferric oxide beads induce stretch-activated Ca2+ flux in fibroblasts. Am J Physiol - Cell Physiol. 269 (5), C1093-C1104 (1995).
- Glogauer, M., et al. Calcium ions and tyrosine phosphorylation interact coordinately with actin to regulate cytoprotective responses to stretching. J Cell Sci. 110 (Pt 1), 11-21 (1997).
- Kuo, J. -. C., Han, X., Hsiao, C. -. T., Yates, J. R., Waterman, C. M. Analysis of the myosin-II-responsive focal adhesion proteome reveals a role for β-Pix in negative regulation of focal adhesion maturation. Nat Cell Biol. 13 (4), 383-393 (2011).
- Schiller, H. B., et al. β1- and αv-class integrins cooperate to regulate myosin II during rigidity sensing of fibronectin-based microenvironments. Nat Cell Biol. 15 (6), 625-636 (2013).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nat Cell Biol. 16 (4), 376-381 (2014).
- Plopper, G. E., McNamee, H. P., Dike, L. E., Bojanowski, K., Ingber, D. E. Convergence of integrin and growth factor receptor signaling pathways within the focal adhesion complex. Mol Biol Cell. 6 (10), 1349-1365 (1995).
- Roca-Cusachs, P., Gauthier, N. C., Del Rio, ., A, M. P., Sheetz, Clustering of alpha(5)beta(1) integrins determines adhesion strength whereas alpha(v)beta(3) and talin enable mechanotransduction. Proc Natl Acad Sci USA. 106 (38), 16245-16250 (2009).
- Ajeian, J. N., et al. Proteomic analysis of integrin-associated complexes from mesenchymal stem cells. Proteomics Clin Appl. 10 (1), 51-57 (2016).
- Horton, E. R., Astudillo, P., Humphries, M. J., Humphries, J. D. Mechanosensitivity of integrin adhesion complexes: Role of the consensus adhesome. Exp Cell Res. , (2015).
- Jones, M. C., et al. Isolation of integrin-based adhesion complexes. Curr Protoc Cell Biol. 66, 9.8.1-9.8.15 (2015).
- Ng, D. H. J., Humphries, J. D., Byron, A., Millon-Frémillon, A., Humphries, M. J. Microtubule-dependent modulation of adhesion complex composition. PloS One. 9 (12), e115213 (2014).
- Byron, A., Humphries, J. D., Bass, M. D., Knight, D., Humphries, M. J. Proteomic analysis of integrin adhesion complexes. Sci Sign. 4 (167), pt2 (2011).
- Byron, A., Humphries, J. D., Craig, S. E., Knight, D., Humphries, M. J. Proteomic analysis of α4β1 integrin adhesion complexes reveals α-subunit-dependent protein recruitment. Proteomics. 12 (13), 2107-2114 (2012).
- Marjoram, R. J., Guilluy, C., Burridge, K. Using magnets and magnetic beads to dissect signaling pathways activated by mechanical tension applied to cells. Methods. , (2015).
- Pasapera, A. M., Schneider, I. C., Rericha, E., Schlaepfer, D. D., Waterman, C. M. Myosin II activity regulates vinculin recruitment to focal adhesions through FAK-mediated paxillin phosphorylation. J Cell Biol. 188 (6), 877-890 (2010).
- Sawada, Y., Sheetz, M. P. Force transduction by Triton cytoskeletons. J Cell Biol. 156 (4), 609-615 (2002).
- Grinnell, F., Geiger, B. Interaction of fibronectin-coated beads with attached and spread fibroblasts. Binding, phagocytosis, and cytoskeletal reorganization. Exp Cell Res. 162 (2), 449-461 (1986).
- Schroeder, F., Kinden, D. A. Measurement of phagocytosis using fluorescent latex beads. J Biochem Biophys Meth. 8 (1), 15-27 (1983).
- Hoffman, B. D., Grashoff, C., Schwartz, M. A. Dynamic molecular processes mediate cellular mechanotransduction. Nature. 475 (7356), 316-323 (2011).
- Seo, D., et al. A Mechanogenetic Toolkit for Interrogating Cell Signaling in Space and Time. Cell. 165 (6), 1507-1518 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon