Method Article
El análisis de la superficie celular Adhesión Remodeling en respuesta a la tensión mecánica usando perlas magnéticas
* Estos autores han contribuido por igual
En este artículo
Resumen
adherencias de la superficie celular son fundamentales en mechanotransduction, ya que transmiten la tensión mecánica e inician las vías de señalización implicadas en la homeostasis del tejido y el desarrollo. A continuación, presentamos un protocolo para la disección de las vías bioquímicas que se activan en respuesta a la tensión, utilizando microperlas magnéticas recubiertas con ligando y aplicación de la fuerza a los receptores de adhesión.
Resumen
mechanosensitive complejos de adhesión que permiten a las células detectar las propiedades mecánicas de su entorno. Estudios recientes han identificado ambas moléculas de detección de la fuerza en los sitios de adhesión, y factores de transcripción dependiente de la fuerza que regulan la expresión de genes específicos de linaje y conducen salidas fenotípicas. Sin embargo, las redes de señalización de conversión de la tensión mecánica en las vías bioquímicas han sido difícil de alcanzar. Para explorar las vías de señalización dedicadas a la tensión mecánica aplicada a receptor de superficie celular, microperlas superparamagnéticas se pueden utilizar. Aquí se presenta un protocolo para el uso de perlas magnéticas para aplicar fuerzas a las proteínas de adhesión de la superficie celular. Utilizando este enfoque, es posible investigar no sólo las vías de señalización citoplásmica dependiente de la fuerza por diversos enfoques bioquímicos, sino también el remodelado adhesión por aislamiento magnético de los complejos de adhesión unidos a las perlas de ligando-revestido. Este protocolo incluye la preparación de ligando-coperlas superparamagnéticas ATED, y la aplicación de fuerzas de tracción definen seguido de análisis bioquímicos. Además, ofrecemos una muestra representativa de los datos que demuestran que la tensión aplicada a la adhesión a base de integrina desencadena remodelación adherencia y altera la fosforilación de la proteína tirosina.
Introducción
En metazoos, la tensión mecánica dirige el desarrollo de tejido y la homeostasis a través de la regulación de una gran variedad de procesos celulares tales como la proliferación, la diferenciación y la supervivencia 1, 2. tensión mecánica puede surgir de la matriz extracelular o puede ser generada por las células adherentes, que muestra su ambiente extracelular a través de la maquinaria contráctil actomiosina que tira en la matriz extracelular y las sondas de su rigidez a través de moléculas de tensión y minúsculas. En respuesta a la tensión, las proteínas de adhesión mechanosensitive experimentan cambios conformacionales que desencadenan cascadas de señalización complejos. A su vez, estas vías de señalización orquestan un mechanoresponse abarca la proliferación, diferenciación y supervivencia que ajusta el comportamiento celular al entorno extracelular. Tales procesos pueden ser resueltas en un período de tiempo corto plazo (segundos o minutos) para alimentar rápidamente de nuevo en el bucle de la mecha notransduction mediante la modificación de las estructuras mechanosensitive. Por ejemplo, las adherencias a base de integrina refuerzan en respuesta a la tensión a través mediada por Rho GTPasa remodelación del citoesqueleto 3, 4, 5. Paralelamente, otras vías de señalización se activan durante horas y días para controlar los programas genéticos que finalmente afectan el destino celular 6. Considerando que, muchos estudios han puesto de manifiesto el efecto de la rigidez de la matriz en el determinismo celular y desarrollo de la enfermedad 1, 2, los mecanismos moleculares precisos de mechanotransduction adhesión mediada siguen siendo difícil de alcanzar.
Diversos enfoques se han desarrollado para estudiar los efectos de las fuerzas generadas por células o fuerzas externas sobre el comportamiento celular, incluyendo los sistemas de flujo, transferencia de energía por resonancia de fluorescencia (FRET) sensores -tension 7,lass = "xref"> 8, 9, sustratos compatibles con pinzas magnéticas, las pinzas ópticas 10 y microscopía de fuerza atómica (AFM) 11. Aquí se presenta un protocolo utilizando perlas superparamagnéticas para caracterizar las vías mechanotransduction en respuesta a las fuerzas de tensión aplicadas a los receptores de adhesión específicas. perlas superparamagnéticas son partículas que magnetizar reversiblemente cuando se coloca en un campo magnético. Una vez recubierto con un ligando para un receptor específico, estas perlas proporcionan una poderosa herramienta para estudiar los efectos de aplicación de la fuerza extracelular. Este método ha sido validado por varios estudios 3, 5, 12 - 17 y presentan la ventaja de facilitar en gran medida el análisis bioquímico de las células adherentes. El uso de perlas magnéticas recubiertas de colágeno similares, seguido de análisis bioquímico, los primeros trabajos reportó un incremento enla fosforilación de tirosina de proteínas y la activación de RhoA en respuesta a la tensión 5, 18, 19. El método descrito a continuación también se ha utilizado con fibronectina (FN) perlas recubiertas para caracterizar las vías de señalización corriente abajo de tensión aplicada a las integrinas 3. En este estudio, Guilluy et al. mostró que la tensión activa RhoA a través de la contratación de los dos factores de intercambio de nucleótidos de guanina (GEFs), LARG y GEF-H1, a los complejos de adhesión integrina. Desde que, otros estudios han demostrado que el GEF-H1 es reclutado para los complejos de adhesión en respuesta a la tensión generada por células utilizando diferentes métodos 20, 21, lo que demuestra la robustez de la metodología descrita aquí. Como resultado, RhoA activado se muestra para promover la adhesión de refuerzo, a través de la remodelación del citoesqueleto. Este sistema también se utilizó para explorar tensión aplicada to receptores de adhesión celular / móvil. La aplicación de fuerzas sobre perlas magnéticas recubiertas con el dominio extracelular de cadherina E inducida por un aumento en el reclutamiento vinculina de manera similar a los complejos de adhesión integrina asociada 12. Collins y sus colegas observaron que la aplicación de tensión a PECAM-1 promueve la integrina y la activación de RhoA 13. Otro enfoque experimental usando perlas magnéticas es el estudio de tensión aplicada a los núcleos aislados. El uso de perlas recubiertas con anticuerpos contra la proteína de envoltura nuclear nesprin-1, los complejos de la envoltura nuclear se purificaron para mostrar que están regulados de forma dinámica en respuesta a la tensión mecánica 22. Estos resultados apoyan la omnipotencia de este método en el estudio de las vías mechanotransduction. Por otra parte, mientras que los sistemas de flujo de fuerza de tracción o estimulan los procesos celulares generales, perlas magnéticas se dirigen específicamente a un receptor de la adhesión celular mediante el uso de cualquiera de los ligandos del receptor 3 o anticuerpos monoclonales contra el receptor de la superficie celular 13, 15.
Otra ventaja de este método es el aislamiento de los complejos de adhesión a través de un procedimiento de purificación de afinidad de ligando sencillo. Es bien conocido que la adición de perlas de ligando recubierto a las células se une receptores de adhesión e induce el reclutamiento de varias proteínas de adhesión 23. Además aplicación de fuerzas a perlas magnéticas recubiertas con ligando convierte a estos complejos de adhesión en las plataformas macromoleculares que media en varias vías de señalización de tensión dependiente de 4, 24. La lisis celular seguido de la concentración de perlas usando un imán permite el aislamiento de las plataformas de adhesión. Otros métodos utilizados para purificar los complejos de adhesión ya se han utilizado en células adherentes. Combinan reticulación química para conservar las interacciones proteína-proteínay una etapa de lisis celular por el detergente y el flujo de tensiones o sonicación 20, 21, 25, 26, 27, 28. El paso final es la recogida de las membranas plasmáticas ventrales resultantes que contienen los complejos de adhesión. A diferencia de estos métodos, perlas magnéticas permiten un mayor nivel de purificación de los complejos de adhesión celular mediante la orientación selectiva de una familia específica de los receptores de adhesión. Las perlas magnéticas se han utilizado ya para purificar los complejos de adhesión en las células no adherentes acoplados a microperlas ligando recubierto 29, 30. El método descrito a continuación imita situaciones biológicas, donde se aplica la fuerza durante un período sostenido corto (de segundos a minutos). Por lo tanto, proporciona una herramienta poderosa para la investigación de tanto la composición molecular de los complejos de adhesión purificadas ylas vías de señalización corriente abajo mechanosensitive.
Aquí se presenta un protocolo experimental detallado para el uso de perlas magnéticas para aplicar fuerzas de tracción a las proteínas de la superficie de adherencia. Un imán de neodimio permanente se coloca en la parte superior de la superficie de placa de cultivo. La cara del polo del imán se coloca a una altura de 6 mm, de modo que la fuerza en una sola perla magnética 2,8 micras es constante (alrededor de 30 a 40 pN) 31. La duración de la estimulación de tensión se determina por el operador en función de la molécula de interés y su escala de tiempo de activación. Las células se lisaron por último, los complejos de adhesión se purifican mediante separación de perlas usando un imán y análisis bioquímicos se procesan. Este protocolo incluye la preparación de perlas superparamagnéticas ligando recubierto, y la aplicación de tensión a través de imán seguido de análisis bioquímicos. Además, ofrecemos una muestra representativa de los datos que demuestran que la tensión aplicada a la ADH a base de integrinaesions induce remodelación adhesión y altera la fosforilación de tirosina de proteínas.
Protocolo
1. Ligando Conjugación con perlas magnéticas
Nota: la conjugación del ligando se lleva a cabo usando perlas activadas con tosilo superparamagnéticas con un 2,8 m de diámetro (concentración de la solución de stock 10 8 cuentas / ml, 30 mg de perlas / ml). El siguiente protocolo se basa en muestras de aproximadamente 2 x 10 5 células, que corresponden a las células MRC-5 cultivadas a 80% de confluencia en una placa de cultivo de tejidos de 60 mm. Ajuste el volumen de los granos y los reactivos en consecuencia si el uso de placas de diferentes tamaños o células en diferentes confluencias. Utilizar una cantidad de perlas superparamagnéticas con el fin de tener 2 perlas por célula. Por lo tanto, se necesitan 4 x 10 5 perlas para una placa de 60 mm.
- Minuciosamente suspender las microesferas en el vial original por agitación al menos 30 s. Alícuota de 40 l de las perlas superparamagnéticas resuspendidos (correspondientes a 4 x 10 6 bolas) a 1,5 ml tubo de microcentrífuga.
- Se coloca el tubo en un separati magnéticaen el soporte con el fin de separar las perlas magnéticas de la solución. Descartar el sobrenadante, retirar el tubo del soporte de separación magnética y resuspender las perlas en 1 ml de 0,1 M fosfato de Na pH 7,4.
- Repita paso de lavado dos veces con 1 ml de 0,1 M fosfato de Na pH 7,4.
- Después del lavado final, resuspender las perlas en 1 ml de 0,1 M fosfato de Na pH 7,4.
- Combinar 100 g bovina La fibronectina (FN) o cualquier otro ligando de receptor de la adhesión celular a la M fosfato de Na pH 1 ml 0,1 7,4 que contiene perlas y se mezcla mediante pipeteo.
- Repetir los pasos anteriores sustituyendo FN o cualquier otro ligando específico con BSA, poli-D-lisina o apo-transferrina para controles negativos.
- Opcionalmente, para el análisis de gel, tomar una alícuota de 10 l de solución de ligando para el análisis de la eficiencia de reticulación y se mezclan con un volumen apropiado de concentrado de muestra Laemmli Buffer.
- Incubar perlas con la solución que contiene ligando para 12 a 24 horas a 37 ° C en un rotor.
- Si los agregados de cuentas aparecen después de la reacción se ha producido, se somete a ultrasonidos (potencia continua 39 W) durante no más de 10-20 s.
- Aislar las perlas utilizando soporte de separación magnética, aspirar la solución restante y añadir 1 ml de PBS / 0,2% BSA pH 7,6 solución. Incubar durante 1 h en el rotor a 37 ° C.
- Lavar perlas usando un imán dos veces con 1 ml de PBS / 0,2% BSA pH 7,6. perlas de resuspender en 1 ml de PBS / 0,2% BSA pH 7,6.
- Someter a ultrasonidos cuentas si aparecen agregados por no más de 20-30 s.
- Opcionalmente, eliminar una parte alícuota de 10 l para analizar la eficiencia de acoplamiento por Western blot (de la mezcla con un volumen apropiado de concentrado de tampón de muestras Laemmli).
- Proceder a la celda ensayos o almacén de los granos a 4 ° C por hasta 1 mes.
- Opcionalmente, ejecute un gel SDS-PAGE y tinción con azul de Coomassie para analizar FN reticulación a las perlas magnéticas.
2. La aplicación de fuerzas de tensión en las perlas recubiertas con ligando Límite a los receptores en la adhesión dorsalSuperficie de las células
- Cultura células adherentes en 60 mm placa de cultivo tisular en medio de crecimiento apropiado (por lo general DMEM 4,5 g / L de D-glucosa suplementado con FCS 10%) hasta alcanzar 80% de confluencia.
- Preparar tampón de lisis no desnaturalizante no iónico (20 mM Tris HCl pH 7,6, NaCl 150 mM, 2 mM MgCl2, 0,1% de NP-40) y tubos de microcentrífuga de enfriamiento.
- Sedimentar las perlas recubiertas con ligando de la sección 1.10 y resuspender en 1 ml de PBS / BSA al 0,2%, pH 7,6. Añadir 100 ml de la solución de perlas de ligando-revestido a 5 ml de medio de cultivo caliente y vórtice.
- Aspirar el medio en placa de cultivo de 60 mm y añadir 5 ml de medio de crecimiento caliente que complementado con los granos.
- Incubar durante 20 min en condiciones de cultivo celular (37 ° C y 5% de CO 2) para permitir que las perlas se sedimentan y se adhieren a las células. Es crucial para no exceder los 20 min desde perlas pueden ser internalizados por fagocitosis.
- Opcionalmente, observar las cuentas bajo un microscopio óptico con un obje 10X o 20Xctivo y comprobar la adhesión del grano sacudiendo ligeramente el plato para discriminar entre los talones unidos y flotantes.
- Mientras se mantiene la placa de cultivo en la incubadora, cambiar la tapa de la placa normal para una tapa con una ronda de 38 mm imán de neodimio adjunta en la cara superior. El imán se mantiene en su lugar por dos imanes de neodimio de 13 mm más pequeños situados en la cara inferior de la tapa. Puesto que los imanes son muy poderosos, manipular con cuidado.
- Incubar las células sometidas a la tensión para los puntos de tiempo deseados en condiciones de cultivo celular (37 ° C y 5% de CO 2).
- Después del tratamiento, introducir la cápsula en el hielo y con cuidado aspirar el medio completo desde el plato.
- Añadir 300 l de tampón de lisis celular, y se incuba durante 10 min en hielo. Recoger el lisado utilizando un rascador de células y la transferencia a un pre-refrigerada 1,5 ml tubo de microcentrífuga.
- Sedimentar las perlas magnéticas utilizando el soporte de separación magnética y transferir el lisado celular total a un nuevo pre-enfriamientoed 1,5 ml tubo de microcentrífuga. Almacenar esta fracción a -20 ° C para su posterior análisis.
- Lavar las perlas 3 veces con 1 ml de tampón de lisis enfriado en hielo. Añadir 50 l de tampón de muestra Laemmli al sedimento de perlas, se mezcla mediante pipeteo y hierven a 95 ° C durante 5 min usando un calentador de bloque seco. Esta fracción contiene los complejos de adhesión aisladas. Proceder a un análisis bioquímico o almacenar a -20 ° C.
- Desde el lisado celular total obtenida después de la separación perlas (aproximadamente 300 l), retirar una alícuota de 50 l para el análisis de transferencia Western.
NOTA: Los 250 l izquierda se puede utilizar para otros estudios bioquímicos tales como los estudios de interacción proteína-proteína (inmunoprecipitación, ensayos de GST pull-down) o experimentos de actividad de GTPasa (cambiando el tampón de lisis pueden ser necesarias dependiendo de la GTPasa de interés).
Resultados
El esquema de la técnica se ilustra en la Figura 1a. Después de la conjugación ligando, perlas magnéticas se incubaron con las células durante 20 min, y a continuación, un imán permanente se utiliza para aplicar fuerzas de tracción de alrededor de 30 a 40 pN para diversas cantidades de tiempo. La Figura 1b muestra 2.8 micras perlas magnéticas recubiertas con FN con destino a los receptores de adhesión celular MRC5.
Los pasos de lavado de perlas superparamagnéticas después de la lisis de células son cruciales y determinan el grado de purificación. Se recomienda un mínimo de tres lavados. Inmunotransferencias GADPH con exposiciones largas pueden ser útiles para poner a prueba la pureza de los complejos de adhesión (Figura 2a).
perlas recubiertas con FN se utilizaron para investigar los procesos mechanotransduction que se producen con el tiempo en los complejos de adhesión en respuesta a la tensión. Después de la separación magnética de la fracción de complejo de adhesión, el lisado y la fracción de complejo de adhesión se analizaron porWestern blot. Como era de esperar, se observó talina, vinculina y paxilina, pero no GAPDH en la fracción de los complejos de adhesión incluso en ausencia de la estimulación mecánica (Figura 2b). De acuerdo con informes anteriores 32, 33, la tensión provocó reclutamiento vinculina a los complejos de adhesión. Mientras que la tensión no afectó el reclutamiento paxillin a los complejos de adhesión, su fosforilación en tirosina 31 se mejoró en respuesta a la tensión mecánica tanto en el lisado total de células y en la fracción de complejo de adhesión.
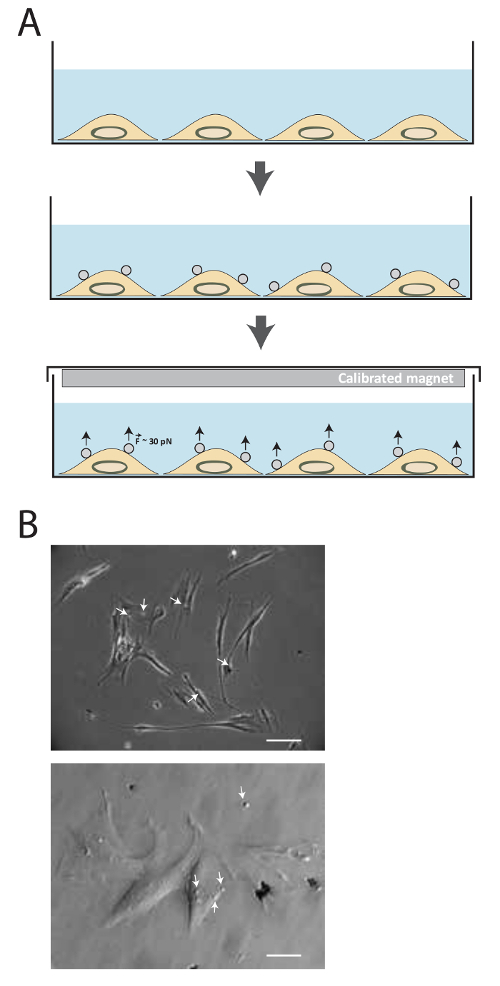
La figura 1. Descripción del método. (A) Ilustración esquemática de la técnica. Las células se cultivan en primer lugar en medio de cultivo hasta que se alcanza la confluencia deseada. A continuación, se añaden perlas superparamagnéticas durante 15-20 min. fuerzas de tensión alrededor de 30-40 pN sonluego se aplica utilizando el imán calibrado para diferentes cantidades de tiempo. (B) perlas superparamagnéticas recubiertas de fibronectina se unen a receptores de adhesión celular. Las células se crean imágenes de contraste de fase en la microscopía de luz transmitida 15 minutos después de la adición de las perlas superparamagnéticas (flecha blanca) en el medio. (Imagen superior: Barra de escala = 25 micras, imagen inferior: Barra de escala = 100 m) Haga clic aquí para ver una versión más grande de esta figura.
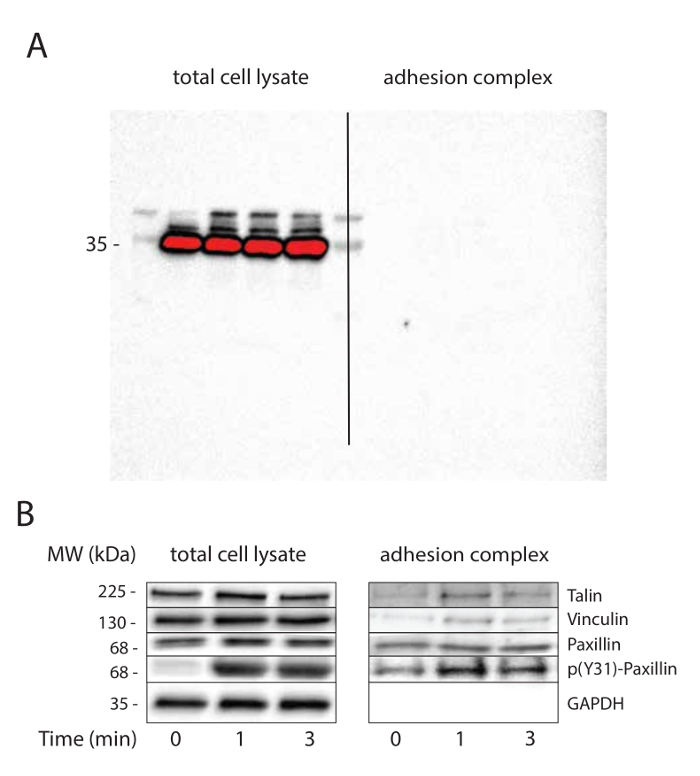
Figura 2. tensión mecánica induce la maduración de adhesión. (A) Purificación de los complejos de adhesión. inmunotransferencia GAPDH se utiliza como control de carga para lisado total de células y para verificar la pureza de los complejos de adhesión. La membrana de nitrocelulosa ha sido fotografiado con una larga exposición para demostrar THe ausencia de señal en la fracción de complejo de adhesión. (B) La tensión induce la maduración de adhesión. control de carga (GAPDH) y los candidatos (vinculina, Talin y paxillin) se sabe que son reclutados o fosforilada en los complejos de adhesión en respuesta a la tensión mecánica se immunoblotted. Este experimento se ha realizado en células MRC5. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método descrito aquí constituye un enfoque directo para aplicar tensión a los receptores de adhesión de la superficie celular y permitir su posterior purificación. Sin embargo, algunas medidas son fundamentales para llevar a cabo la purificación de adhesión eficiente y la optimización potencial se puede hacer en función de los receptores de adhesión específicas. Presentamos los posibles problemas que el usuario pueda encontrar a continuación.
Se utilizó perlas magnéticas de 2,8 m de diámetro, pero los granos grandes se pueden utilizar como 4,5 micras de diámetro. Sin embargo, el diámetro del grano debe limitarse a 2-5 micras desde la fagocitosis podría ocurrir más rápidamente durante 30 a 60 min de incubación y los granos más grandes tienen una adherencia más fuerte de modo que el desplazamiento del grano sería restringido bajo campo magnético 34, 35. Por lo tanto, es importante para limitar el tiempo de incubación a períodos cortos y utilizar el tamaño adecuado de talón. El número de cuentas se incubaron por célula tendrá un impacto en la cantidad de fexperiencia orce por una sola célula. Mientras que uno quiere estimular eficazmente las células con tensión, demasiadas perlas por célula puede conducir a la activación de vías de señalización irrelevantes. Por lo general, incubamos un promedio de dos perlas por célula para perlas recubiertas con FN, pero esta cantidad se puede ajustar [1 a 5 granos por célula] dependiendo del tipo de célula y el receptor de la superficie celular. En cuanto a la imán, el método descrito aquí utiliza un imán para que la fuerza resultante en un 2,8 micras se ha medido (alrededor de 30 a 40 pN midiendo el desplazamiento de perlas magnéticas en glicerol sin diluir, un líquido Newtoniano con una viscosidad conocida 31, aunque es posible utilizar imanes más grandes para aplicar mayor cantidad de fuerza si es necesario. es importante señalar que estos imanes son extremadamente potente y de manipular con cuidado.
Después de 12 a 24 h de incubación con el ligando ECM (paso 1.7) así como después de 1 h de incubación (paso 1,9) con tampón de PBS / 0,2% BSA pH 7,6, la mmicroperlas agnetic podrían formar agregados. Es entonces importante para separar los granos tanto como sea posible para respetar la relación de 2 granos por célula. Sin embargo, todavía es aceptable tener una proporción de 5: 1. Perlas de separación se puede lograr ya sea por mezcla y pipetear o mediante el uso de sonicación, aunque por un corto período de tiempo (20-30 s).
Varias proteínas pueden conjugarse a las perlas, incluyendo ligando de integrina (FN, colágeno), proteínas recombinantes o anticuerpos dirigidos a receptores de superficie celular específicos. La unión de perlas magnéticas recubiertas de ligando a la superficie celular dorsal puede ser debilitada por la baja eficiencia de acoplamiento del ligando sobre las perlas. Se recomienda comprobar para la unión a las perlas mediante la recopilación de una alícuota de la solución de ligando diluido antes de añadir a las perlas y una parte alícuota de perlas al final del proceso de acoplamiento de ligandos. Estas alícuotas se pueden procesar para el análisis SDS-PAGE y tinción con azul de Coomassie.
Si no hay cambios en lasvías o procesos mechanosensing esperados son detectados señalización, es importante tener en cuenta diferentes posibilidades. Una manera de identificar la cuestión es modular la duración del experimento con el imán. Es bien conocido que la velocidad de los procesos celulares varía en función del tipo de célula utilizado. Otra opción sería poner a prueba las moléculas sensibles a la tensión conocidos y comprobar si sus modificaciones post traduccionales por el Western Blot (por ejemplo fosforilación paxillin o fosforilación de FAK puede ser analizada). La cantidad de fuerza también puede ser crítico y el uso de perlas un imán más grueso (el mismo grado N52) o más grandes pueden ser una opción. Además, la eficiencia de unión ligando / receptor puede ser explorado mediante el análisis complejo de adhesión y busque receptores de la superficie celular (como la cadherina o integrina). La confluencia de células también puede afectar a la respuesta celular a la tensión. Como se ha observado que la adhesión celular / célula puede afectar al comportamiento celular y pretensado cystokeletal, es important observar que la confluencia puede afectar a la respuesta celular a la tensión. A pesar de que se recomienda 80% de confluencia para la aplicación de tensión a las adherencias a base de integrina, diferentes condiciones se pueden ensayar con el fin de optimizar el sistema experimental.
Aunque este método ofrece una herramienta poderosa para descifrar el adhesome sensible tensión, así como las vías de señalización asociados, sino que también tiene algunas limitaciones. En primer lugar, puesto que la principal preocupación el uso de tales perlas magnéticas de tamaño pequeño es el riesgo de su internalización por las células, este método no se puede utilizar para el estudio a largo plazo respuestas celulares de señalización mechanosensitive que modifican el destino celular, tales como la diferenciación y la proliferación. Otra limitación radica en la forma de cómo se aplican fuerzas a la capa de células en la placa de cultivo. De hecho, ya que el campo magnético es siempre mayor en la periferia del imán, las fuerzas podrían variar en la superficie de la placa de cultivo con un gradiente decreciente de célulasque se extiende desde la periferia hacia el centro y podría dar lugar a respuestas celulares heterogéneas.
El procedimiento descrito aquí constituye un método eficaz y sencillo costo que permite el estudio de las vías celulares mechanosensitive así como la investigación de la composición molecular de los complejos de adhesión sometidos a tensión. Otros enfoques, como el dispositivo que se aplica la tensión cíclica a las células de estiramiento, conducen a la aplicación de tensión a todos los receptores de la superficie celular que interactúan con la matriz extracelular. El método descrito aquí tiene la ventaja de permitir la estimulación fuerza de un subconjunto específico de los receptores de la superficie celular y una gran variedad de ligandos se pueden utilizar, tales como ligandos de integrina o anticuerpos dirigidos a receptores de superficie celular, lo que permite el estudio de muchos sistemas mechanosensitive distintas. Otra ventaja de este método es que conduce a la purificación de los complejos de proteínas que experimentó la tensión y para trabajar en portantes elemeNTS que se sabe que juegan un papel central en mechanotransduction 36. El complejo de adhesión purificada también se puede utilizar para diversos enfoques bioquímicos 14, tales como ensayos de quinasa para investigar la actividad quinasa en respuesta a la tensión, o un ensayo de polimerización de la actina. Además, este sistema experimental se puede acoplar con pinzas magnéticas para explorar la respuesta mecánica celular y para correlacionar esta respuesta con las vías de señalización identificadas. Curiosamente, las nanopartículas magnetoplasmónicas se han utilizado recientemente para mecánicamente Notch carga y E-cadherina con un control preciso en el tiempo y en el espacio 37. Este desarrollo reciente puede ayudar a la exploración de vías de señalización mechanosensitive con diferentes entradas espaciales, temporales y mecánicas.
Divulgaciones
Los autores declaran no tener intereses financieros en competencia.
Agradecimientos
CG es apoyado por becas de la Agencia Nacional de Investigación (ANR-13-JSV1-0008), procedentes del Séptimo Programa Marco de la Unión Europea (Marie Curie Integración Carrera n˚8304162) y de Consejo Europeo de Investigación (CEI) a través del horizonte de la Unión Europea 2020 programa de innovación (CEI para n˚639300 subvención) la investigación y.
Materiales
| Name | Company | Catalog Number | Comments |
| Neodymium magnets (on the upper face of 60 mm dish) | K&J Magnetics, Inc | DX88-N52 | grade N52 dimension: 1 1/2" dia. x 1/2" thick |
| Neodymium magnets (on the lower face of 60 mm dish) | K&J Magnetics, Inc | D84PC-BLK | grade N42 dimension: 1/2" dia. x 1/4" thick Black Plastic Coated |
| Dynabeads M280 Tosylactivated | Thermofisher | 14203 | superparamagnetic beads |
| DynaMag-2 Magnet | Thermofisher | 12321D | |
| Fibronectin | Sigma-Aldrich | F1141-5MG | Fibronectin from bovine plasma |
| Poly-D-Lysine | Sigma-Aldrich | P7280-5MG | |
| Apo-Transferrin | Sigma-Aldrich | T1428-50MG | Bovine Apo-Transferrin |
| Bovine serum albumin | Sigma-Aldrich | A7906-500G | |
| DMEM high glucose, GlutaMAX supplement, pyruvate | Life Technologies | 31966-021 | DMEM+GlutaMAX-I 500 ml |
| 60*15 mm culture dish | Falcon | 353004 |
Referencias
- Discher, D. E., Janmey, P., Wang, Y. -L. Tissue cells feel and respond to the stiffness of their substrate. 310 (5751), Science. New York, N.Y. 1139-1143 (2005).
- DuFort, C. C., Paszek, M. J., Weaver, V. M. Balancing forces: architectural control of mechanotransduction. Nat Rev Mol Cell Biol. 12 (5), 308-319 (2011).
- Guilluy, C., et al. The Rho GEFs LARG and GEF-H1 regulate the mechanical response to force on integrins. Nat Cell Biol. 13 (6), 722-727 (2011).
- Matthews, B. D., Overby, D. R., Mannix, R., Ingber, D. E. Cellular adaptation to mechanical stress: role of integrins, Rho, cytoskeletal tension and mechanosensitive ion channels. J Cell Sci. 119 (3), 508-518 (2006).
- Zhao, X. -H., et al. Force activates smooth muscle alpha-actin promoter activity through the Rho signaling pathway. J Cell Sci. 120 (Pt 10), 1801-1809 (2007).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Austen, K., Kluger, C., Freikamp, A., Chrostek-Grashoff, A., Grashoff, C. Generation and analysis of biosensors to measure mechanical forces within cells. Meth Mol Biol. 1066, 169-184 (2013).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466 (7303), 263-266 (2010).
- Pelham, R. J., Wang, Y. l Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci USA. 94 (25), 13661-13665 (1997).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin-cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Chaudhuri, O., Parekh, S. H., Lam, W. A., Fletcher, D. A. Combined atomic force microscopy and side-view optical imaging for mechanical studies of cells. Nat Meth. 6 (5), 383-387 (2009).
- Bays, J. L., et al. Vinculin phosphorylation differentially regulates mechanotransduction at cell-cell and cell-matrix adhesions. J Cell Biol. 205 (2), 251-263 (2014).
- Collins, C., et al. Localized tensional forces on PECAM-1 elicit a global mechanotransduction response via the integrin-RhoA pathway. Curr Biol. 22 (22), 2087-2094 (2012).
- Gordon, W. R., et al. Mechanical Allostery: Evidence for a Force Requirement in the Proteolytic Activation of Notch. Dev Cell. 33 (6), 729-736 (2015).
- Lessey-Morillon, E. C., et al. The RhoA guanine nucleotide exchange factor, LARG, mediates ICAM-1-dependent mechanotransduction in endothelial cells to stimulate transendothelial migration. J Immunol. 192 (7), 3390-3398 (2014).
- Osborne, L. D., et al. TGF-β regulates LARG and GEF-H1 during EMT to affect stiffening response to force and cell invasion. Mol Biol Cell. 25 (22), 3528-3540 (2014).
- Scott, D. W., Tolbert, C. E., Burridge, K. Tension on JAM-A activates RhoA via GEF-H1 and p115 RhoGEF. Mol Biol Cell. 27 (9), 1420-1430 (2016).
- Glogauer, M., Ferrier, J., McCulloch, C. A. Magnetic fields applied to collagen-coated ferric oxide beads induce stretch-activated Ca2+ flux in fibroblasts. Am J Physiol - Cell Physiol. 269 (5), C1093-C1104 (1995).
- Glogauer, M., et al. Calcium ions and tyrosine phosphorylation interact coordinately with actin to regulate cytoprotective responses to stretching. J Cell Sci. 110 (Pt 1), 11-21 (1997).
- Kuo, J. -C., Han, X., Hsiao, C. -T., Yates, J. R., Waterman, C. M. Analysis of the myosin-II-responsive focal adhesion proteome reveals a role for β-Pix in negative regulation of focal adhesion maturation. Nat Cell Biol. 13 (4), 383-393 (2011).
- Schiller, H. B., et al. β1- and αv-class integrins cooperate to regulate myosin II during rigidity sensing of fibronectin-based microenvironments. Nat Cell Biol. 15 (6), 625-636 (2013).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nat Cell Biol. 16 (4), 376-381 (2014).
- Plopper, G. E., McNamee, H. P., Dike, L. E., Bojanowski, K., Ingber, D. E. Convergence of integrin and growth factor receptor signaling pathways within the focal adhesion complex. Mol Biol Cell. 6 (10), 1349-1365 (1995).
- Roca-Cusachs, P., Gauthier, N. C., Del Rio,, A,, Sheetz, M. P. Clustering of alpha(5)beta(1) integrins determines adhesion strength whereas alpha(v)beta(3) and talin enable mechanotransduction. Proc Natl Acad Sci USA. 106 (38), 16245-16250 (2009).
- Ajeian, J. N., et al. Proteomic analysis of integrin-associated complexes from mesenchymal stem cells. Proteomics Clin Appl. 10 (1), 51-57 (2016).
- Horton, E. R., Astudillo, P., Humphries, M. J., Humphries, J. D. Mechanosensitivity of integrin adhesion complexes: Role of the consensus adhesome. Exp Cell Res. , (2015).
- Jones, M. C., et al. Isolation of integrin-based adhesion complexes. Curr Protoc Cell Biol. 66, 9.8.1-9.8.15 (2015).
- Ng, D. H. J., Humphries, J. D., Byron, A., Millon-Frémillon, A., Humphries, M. J. Microtubule-dependent modulation of adhesion complex composition. PloS One. 9 (12), e115213(2014).
- Byron, A., Humphries, J. D., Bass, M. D., Knight, D., Humphries, M. J. Proteomic analysis of integrin adhesion complexes. Sci Sign. 4 (167), pt2(2011).
- Byron, A., Humphries, J. D., Craig, S. E., Knight, D., Humphries, M. J. Proteomic analysis of α4β1 integrin adhesion complexes reveals α-subunit-dependent protein recruitment. Proteomics. 12 (13), 2107-2114 (2012).
- Marjoram, R. J., Guilluy, C., Burridge, K. Using magnets and magnetic beads to dissect signaling pathways activated by mechanical tension applied to cells. Methods. , San Diego, Calif. (2015).
- Pasapera, A. M., Schneider, I. C., Rericha, E., Schlaepfer, D. D., Waterman, C. M. Myosin II activity regulates vinculin recruitment to focal adhesions through FAK-mediated paxillin phosphorylation. J Cell Biol. 188 (6), 877-890 (2010).
- Sawada, Y., Sheetz, M. P. Force transduction by Triton cytoskeletons. J Cell Biol. 156 (4), 609-615 (2002).
- Grinnell, F., Geiger, B. Interaction of fibronectin-coated beads with attached and spread fibroblasts. Binding, phagocytosis, and cytoskeletal reorganization. Exp Cell Res. 162 (2), 449-461 (1986).
- Schroeder, F., Kinden, D. A. Measurement of phagocytosis using fluorescent latex beads. J Biochem Biophys Meth. 8 (1), 15-27 (1983).
- Hoffman, B. D., Grashoff, C., Schwartz, M. A. Dynamic molecular processes mediate cellular mechanotransduction. Nature. 475 (7356), 316-323 (2011).
- Seo, D., et al. A Mechanogenetic Toolkit for Interrogating Cell Signaling in Space and Time. Cell. 165 (6), 1507-1518 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados