Method Article
分析细胞表面粘附重塑回应机械张力使用磁珠
摘要
细胞表面粘连是在机械传导的中心,因为它们传输机械张力,并开始参与组织稳态和发展的信号通路。这里,我们提出了解剖被响应于张力激活生化途径,使用包被配体 - 磁珠和施力到粘附受体的协议。
摘要
机械敏感细胞表面粘附物使细胞感测与其周围环境的机械性能。最近的研究已经确定了在固定区域既力传感分子和调节谱系特异性基因表达和驱动表型输出力依赖性转录因子。然而,信令网络转换机械张力成生化途径仍然难以捉摸。探索时施加到细胞表面受体的机械张力接合的信号传导途径,可以使用超顺磁性微珠。在这里,我们提出了一个协议利用磁珠力量应用到细胞表面粘附蛋白。使用这种方法,可以通过安装在涂覆配体珠粘附复合物的磁隔离,调查通过各种生物化学方法不仅力依赖性细胞质信号传导途径,而且粘附重塑。这个协议包括配体 - 共聚的制备ated超顺磁珠,和应用程序中定义的拉力接着生物化学分析。此外,我们提供的数据表明应用于基于整合素的粘附张力的代表性样品触发粘附重塑和改变蛋白质的酪氨酸磷酸化。
引言
在后生动物,机械张力通过细胞过程如增殖,分化和存活1,2无数的调节指导组织发育和内环境稳定。机械张力可以从细胞外基质产生,或可通过贴壁细胞,其样品通过拉动到细胞外基质,并通过张力敏感分子探测其刚性的肌动球蛋白收缩机械它们的胞外环境中产生的。为了应对紧张局势,机械敏感粘附蛋白发生触发复杂的信号级联反应的构象变化。反过来,这些信号传导途径编排一个mechanoresponse包含增殖,分化和存活是调节细胞行为到细胞外环境。这样的方法可以在短期时间周期进行结算(数秒至数分钟)快速反馈到机甲的环通过修改机械敏感结构notransduction。例如,基于整联粘连加强在通过的Rho GTP酶-介导的细胞骨架重构3,4,5响应于张力。与此同时,其他的信号通路超过几小时或几天来控制的遗传程序,最终影响细胞的命运6激活。然而,许多研究强调矩阵刚度对细胞确定性和疾病发展1,2的效果,粘附介导的机械传导的精确分子机制仍然不清楚。
各种方法已被开发来研究细胞的行为的细胞产生的力或外力,包括流动系统,荧光共振能量转移(FRET)-tension传感器7的影响,小姑娘="外部参照"> 8,柔性基板9,磁镊子,光学镊子10和原子力显微镜(AFM)11。在这里,我们使用超顺磁珠响应于施加到特定粘附受体的张力来表征机械传导途径提出的协议。超顺磁珠是放置在一个磁场时可逆地磁化的颗粒。一旦涂覆有对特定受体的配体,这些珠粒提供了有力的工具来研究细胞外力的应用程序的影响。此方法已被若干研究3,5,12验证- 17和呈现的优点在很大程度上促进在贴壁细胞的生化分析。使用类似的胶原包被的磁珠,随后通过生物化学分析,早期工作报告中的增加蛋白酪氨酸磷酸化和RhoA激活响应于张力5,18,19。下面描述的方法也被用于与纤连蛋白(FN)包被的珠从施加到整3张力下游表征信号通路。在这项研究中,Guilluy等。表明张力通过两个鸟嘌呤核苷酸交换因子(全环基金),LARG和全球环境基金-H1,以整合的粘附物招募激活的RhoA。因为,在其他的研究已经表明,GEF-H1被用不同的方法20,21,表现出这里描述的方法的稳健性招募到粘附物响应于细胞产生的张力。其结果是,活化的RhoA被证明促进粘附加固,通过细胞骨架重构。该系统也被用来探索张力施加吨O单元/细胞粘附受体。力到涂有诱导纽蛋白招募增加同样地整合伴生附着配合物12 E-钙粘蛋白的胞外域磁珠应用。柯林斯和他的同事观察到紧张的应用PECAM-1促进整合和RhoA的活性13。采用磁珠另一种实验方法是紧张适用于孤立的核研究。使用涂覆有对核包膜蛋白nesprin-1抗体珠,核膜复合物进行纯化,以显示它们响应于机械张力22动态地调节。这些结果支持在机械传导途径的研究该方法的有力度。此外,虽然流或牵引力系统刺激一般的细胞过程,磁珠特别通过使用受体配体靶向细胞粘附受体 3或反对细胞表面受体13,15单克隆抗体。
这种方法的另一个优点是粘附复合物通过一个简单的配体的亲和纯化过程的隔离。这是众所周知的,加入的涂覆配体珠的细胞结合粘附受体和诱导几个粘附蛋白23的募集。力的涂覆配体磁珠进一步应用开启这些粘附配合成介导的各种张力依赖性信号通路4,24大分子平台。细胞裂解,随后通过使用磁铁珠浓度允许的附着平台的隔离。用于纯化粘附物的其它方法已经在贴壁细胞使用。他们结合化学交联,以节省蛋白质 - 蛋白质相互作用和细胞裂解步骤由洗涤剂和剪切流动或超声处理20,21,25,26,27,28。最后一步是含有粘合性复合物所得到的腹侧质膜的集合。不像这些方法,磁珠允许通过选择性靶向粘附受体的特定家族细胞粘附复合物的更大的纯化水平。磁珠已经用于纯化粘附络合物附着到涂覆配体的微珠29,30非贴壁细胞。下面模拟生物环境中描述的方法,其中施加短持续时间(数秒至数分钟)力。因此,它提供了一个有力的工具,调查两个纯化粘附复合物的分子组成和下游机械敏感-信号通路。
在这里,我们提出了一个详细的实验协议利用磁珠的张力适用于粘接面的蛋白质。永久钕磁铁被放置在培养皿表面的顶部。磁铁的磁极面被放置在6mm的高度,使得在单个2.8微米磁珠上的力是恒定的(约30-40 PN)31。张力刺激的持续时间是由根据兴趣和其时间尺度活化的分子上的操作者确定。将细胞最后裂解,粘附络合物通过珠粒分离利用磁铁纯化和生物化学分析被处理。这个协议包括的涂覆配体超顺磁珠的制备,和张力通过磁体的应用,随后通过生物化学分析。此外,我们还提供应用于基于整联-ADH数据表明张力的代表性样品esions诱导粘附重塑和改变蛋白质的酪氨酸磷酸化。
研究方案
1.配体偶联磁珠
注意:使用超顺磁性甲苯磺酰基活化的珠用直径2.8微米,进行配体缀合(原液浓度10 8珠/毫升,30毫克珠粒/毫升)。以下协议是基于约2×10 5个细胞,这对应于在一个60mm组织培养板上生长至80%汇合MRC-5细胞的样品。相应地,如果使用不同大小或细胞的板在不同汇流调整的珠粒和试剂的体积。使用顺序的超顺磁珠的量具有每单元2珠。因此,需要用于60毫米板4×10 5珠。
- 通过涡旋至少30秒彻底重新悬浮在原始小瓶的珠子。等分试样40微升的再悬浮超顺磁珠(相应于4×10 6珠)至1.5毫升离心管中。
- 放置在管上的磁性separati上支架以将磁珠从溶液中分离出来。弃去上清液,从磁性分离底座上卸下管和在1mL的0.1M磷酸钠pH 7.4的重悬珠子。
- 用1mL的0.1M磷酸钠pH 7.4的重复洗涤步骤两次。
- 最后一次洗涤后,重悬珠子于1mL的0.1M磷酸钠pH 7.4的。
- 结合100微克牛纤连蛋白(FN)或任何其他细胞粘附受体配体以含有小珠的1毫升的0.1M磷酸钠pH 7.4的并通过移液混合。
- 通过更换FN或用BSA,聚-D-赖氨酸或脱辅基转铁蛋白为阴性对照的任何其他特异性配体重复前面的步骤。
- 任选地,用于凝胶分析,采取的配位体溶液中的10μL的等分试样对的交联效率分析,用浓的Laemmli样品缓冲液的适当体积混合。
- 孵育为12-24小时,在37℃上的转子的配位体含有溶液珠。
- 如果小珠的聚集体出现的反应发生,声处理(连续39功率W)不超过10-20之后一下。
- 隔离用磁选支架上的珠子,吸出剩余的溶液,并添加1毫升的PBS / 0.2%BSA的pH 7.6的溶液。孵育在37℃下于转子1小时。
- 用1毫升的PBS / 0.2%BSA的pH值7.6洗使用磁体珠两次。悬浮珠粒于1mL的PBS / 0.2%BSA的pH值7.6。
- 超声处理珠子如果出现聚集不超过20-30秒。
- 或者,删除10微升等分来分析免疫印迹耦合效率(用浓Laemmli样品缓冲液适当体积混合)。
- 继续在4℃下对细胞测定或商店珠粒长达1个月。
- 任选地,运行SDS-PAGE凝胶和染色用考马斯蓝给FN交联分析到磁性珠粒。
的张力对绑定到粘附受体在背配体涂层珠2.应用细胞表面
- 在适当的生长培养基60mm组织培养皿培养贴壁细胞(通常的DMEM为4.5g / l D同时葡萄糖补充有FCS的10%),直至达到80%汇合。
- 制备非变性非离子裂解缓冲液(20mM的Tris盐酸pH值7.6,150 mM氯化钠,2mM的MgCl 2的,0.1%的NP-40)和冷却的离心管中。
- 从颗粒部分1.10,重悬涂配体珠1毫升的PBS / 0.2%BSA pH值7.6。添加涂布配体珠粒溶液至5毫升温暖的培养基和旋涡的100微升。
- 至60mm培养皿中吸并加入5毫升辅以珠温暖的生长介质。
- 孵育细胞培养条件下20分钟(37℃和5%的CO 2),以允许珠粒沉淀并附着到细胞中。关键的是要不超过20分钟,因为珠可以通过吞噬作用被内化。
- 或者,观察使用10X或20X OBJE光学显微镜下珠莫如和微微颤抖的菜连接并漂珠区分检查珠附着力。
- 同时保持培养皿在培养箱,交换为一个盖子正常盘盖与安装在该上表面上的圆38毫米钕磁铁。磁体代替由定位在盖的下表面两个较小13毫米钕磁铁保持。由于磁铁是非常强大的,小心操作它们。
- 孵育进行在细胞培养条件张力所需的时间点(37℃和5%CO 2)的细胞。
- 治疗后,置于冰上菜,小心吸从盘整个网上平台。
- 添加细胞裂解缓冲液的300微升,并孵育在冰上10分钟。收集用细胞刮刀,并转移到预冷的1.5毫升微量离心管中的溶胞产物。
- 沉淀用磁选支架磁珠和总细胞裂解物转移到一个新的预寒意编1.5毫升离心管中。在-20℃下用于进一步分析存储此级分。
- 用1mL冰冷的裂解缓冲液洗涤珠粒3次。添加50微升Laemmli样品缓冲液至珠粒料,使用干块加热器5分钟,在95℃,通过移液和煮沸混合。这部分包含了孤立的粘连物。继续生化分析或储存在-20°C。
- 从后珠粒分离(约300微升)中获得的总细胞裂解物,除去免疫印迹分析50微升等分试样。
注:左,可用于进一步的生化研究,如蛋白质 - 蛋白质相互作用的研究(免疫沉淀,GST下拉测定)或GTP酶活性实验的250微升(改变裂解缓冲液可以根据所关注的GTP酶是必要的)。
结果
该技术的原理在图1a中示出。以下的配体缀合,磁珠与细胞孵育20分钟,然后一个永久磁铁用于施加约30-40 PN的拉伸力对各种量的时间。 图1b示出了2.8微米势必MRC5细胞粘附受体的FN包被的磁珠。
细胞裂解后的超顺磁珠洗涤步骤是关键的,并确定纯化的程度。建议三次洗涤最低。 GADPH免疫印迹与长时间曝光可以测试粘附复合物的纯度(图2a)是有用的。
FN包被的珠子被用来研究响应于张力的粘附物随时间发生的机械传导过程。的粘合复合馏分的磁性分离后,将裂解物和粘合复合馏分被分析免疫印迹。正如预期的那样,我们甚至在不存在机械性刺激(图2b)的观察到的密合性复合馏分踝蛋白,纽蛋白和桩,但不是GAPDH。与以前的报告一致的32,33,紧张引发纽招聘粘连物。而张力没有影响桩蛋白招募粘附配合物,其对酪氨酸31磷酸化响应于两者中的总细胞裂解物,并在粘附复杂馏分机械张力增强。
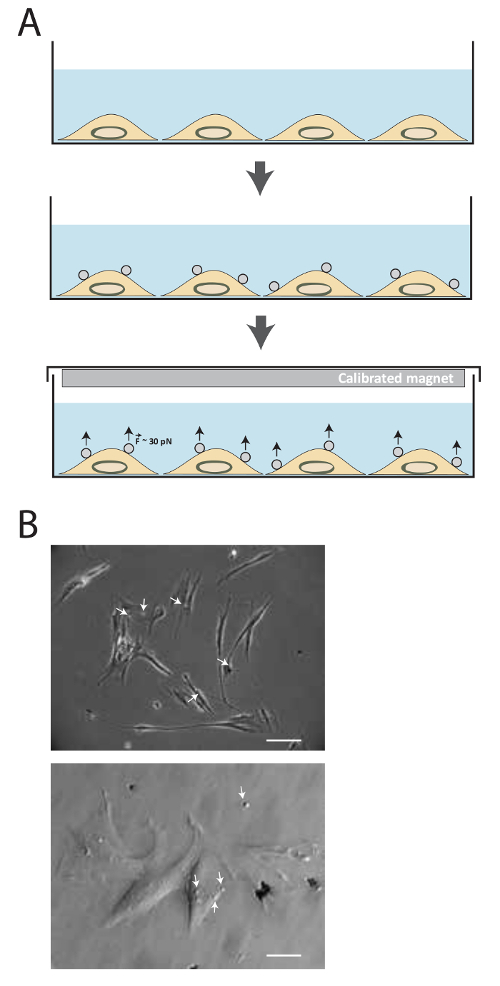
图1的方法的说明。 ( 一 )技术的示意图。细胞在培养基培养首先培养,直至达到所需的汇合。然后,超顺磁性珠加入15-20分钟。的张力约30-40 PN是然后使用不同量的时间校准磁体应用。 (B)的纤连蛋白包被的超顺磁珠结合细胞粘附受体。细胞相差在透射光镜15分钟,在培养基中加入超顺珠(白色箭头)后成像。 (上图:比例尺= 25微米,底部图像:比例尺= 100微米) 点击此处查看该图的放大版本。
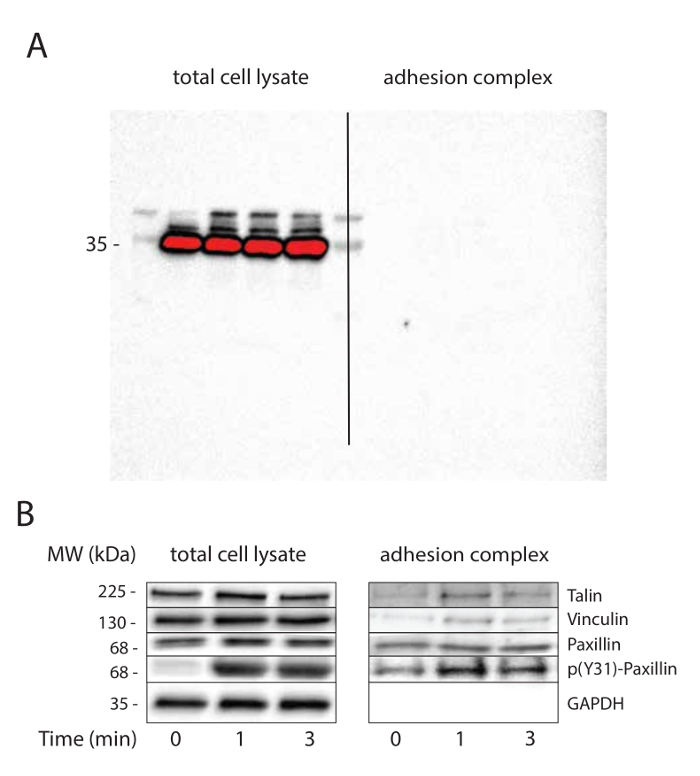
图2.机械张力引起粘连成熟。 (A)的粘合物的净化。 GAPDH的免疫印迹用作总细胞裂解物上样对照,并检查粘附复合物的纯度。硝酸纤维素膜已使用长时间曝光来证明日成像E在附着力复杂的分数没有信号。 (B)张力引起粘连成熟。装载控制(GAPDH)和已知响应机械张力被招募或粘连物磷酸候选人(纽蛋白,塔林和桩蛋白)的免疫印迹。此实验对MRC5细胞被执行。 请点击此处查看该图的放大版本。
讨论
此处所描述的方法构成,以施加张力到细胞表面粘附受体,并允许其随后的纯化一个简单的方法。然而,一些步骤是进行高效粘附纯化的和潜在的优化可以做取决于目标粘附受体的关键。我们目前的用户可能会遇到下面的潜在问题。
我们使用直径2.8微米的磁性珠粒但较大的小珠可用于直径如4.5微米。然而,珠子直径应限制在2-5微米自吞噬可能在30-60分钟温育发生更快速和更大的珠具有更强的粘附性,使得胎圈的位移将根据磁场34,35受到限制。因此,培养时间限制到短周期和使用适当的珠尺寸是重要的。每个细胞培养的小珠的数量将影响f的量由单个细胞奥尔塞体验。而一个人想有效地刺激与张力的细胞,每个细胞过多珠可导致不相关信号途径的激活。我们通常孵育的每单元两个胎为FN包被的珠子的平均,但是该数量可以根据不同的细胞类型和细胞表面受体来调节[每单元1至5小珠。关于磁体,这里所描述的方法中使用的量上的2.8微米的合力已经测量(约30-40 PN磁体通过测量在未经稀释的甘油,牛顿液体与已知粘度31磁珠的位移,虽然它可以使用较大的磁铁,如果需要施加更大的力的量。要注意的是,这些磁体是非常强大和仔细操纵它们是重要的。
后12-24小时的温育与ECM配体(步骤1.7)以及后1小时的温育(步骤1.9),用PBS / 0.2%BSA的pH 7.6的缓冲液中,m个agnetic微珠可能形成聚集。它是那么关键分开珠粒尽可能尊重每单元2珠的比率。然而,它仍然是可以接受的一个5:1的比例。珠分离可以通过混合和移液,或通过超声处理来实现,虽然在短期内(20-30多个)。
各种蛋白质可以缀合到珠粒,包括整联配体(FN,胶原蛋白),重组蛋白质或抗体靶向特定的细胞表面受体。的涂覆配体磁珠于背细胞表面的附着可能是由配体的低耦合效率到珠粒被削弱。它建议检查配体通过向珠和在耦合过程结束的珠粒的等分试样之前收集稀释的配位体溶液的等分试样结合到珠子上。这些等分试样可被处理以SDS-PAGE分析和考马斯亮蓝染色。
如果没有变化信号通路或检测到预期mechanosensing过程中,必须考虑不同的可能性是非常重要的。识别问题的一种方法是调节与磁铁实验的持续时间。它公知的是细胞过程的速度取决于所用的细胞类型而变化。另一种选择是,以测试已知的紧张敏感的分子和检查免疫印迹的翻译后修饰(如磷酸化桩蛋白或FAK磷酸进行分析)。的力的量可以是也重要,可以用更厚的磁铁(相同的等级N52)或更大珠粒可以是一种选择。此外,配体/受体结合的效率可以通过分析附着力复杂的探索和寻找细胞表面受体(如钙粘蛋白或整合)。所述细胞汇合也可以影响到张力的细胞反应。因为已经观察到,细胞/细胞粘着可影响细胞的行为和cystokeletal预应力,它是important键注意,汇合可能影响到张力的细胞反应。尽管我们推荐张力基于整合素的粘连应用80%汇合,不同的条件可以优化实验系统进行测试。
虽然这种方法提供了一个有力的工具,以破译张力敏感adhesome以及相关的信号传导途径,它也有一些限制。首先,由于使用这样的小尺寸的磁性珠的主要关注的是由细胞的内化的危险,不能用于研究修改细胞命运诸如分化和增殖的长期机械敏感信令细胞应答此方法。另一个限制在于的力如何应用于细胞在培养板中的层的方式。的确,由于磁场是在磁体的周边总是较高,部队可以在培养板的表面与电池的减小梯度变化从外周延伸到中心,并有可能导致异质细胞应答。
此处描述的方法构成,允许研究机械敏感细胞途径以及调查受到张力粘附复合物的分子组成的简单的和成本有效的方法。其它方法,如拉伸适用循环应变于细胞的装置,导致紧张的应用到所有的细胞表面受体与胞外基质相互作用。此处所描述的方法具有能够与细胞表面受体的特定子集和大量的各种配位体的力的刺激的优点,可以使用如整合素配体或抗体的靶向细胞表面受体,从而使多个不同机械敏感系统的研究。这种方法的另一个优点是,它会导致蛋白质复合物在经历张力和对承重eleme工作纯化这是已知的NTS以机械传导36中发挥中心作用。纯化的粘附复杂,也可用于各种生化方法14,例如激酶测定法来调查响应于张力,或肌动蛋白聚合测定激酶活性。此外,本实验体系可以用磁镊子耦合到探索蜂窝机械响应,并与所识别的信号传导途径该响应相关联。有趣的是,magnetoplasmonic纳米颗粒最近已用于机械载荷的Notch和E-cadherin,在时间和空间37精确控制。这种新的发展可能有助于探索不同的空间,时间和机械投入机械敏感的信号通路。
披露声明
作者宣称没有竞争经济利益。
致谢
CG是由来自法新社法国国家(ANR-13-JSV1-0008),来自欧盟第七框架计划(居里夫人职业集成n˚8304162),由根据欧盟的地平线欧洲研究委员会(ERC)资助项目2020年研究和创新计划(ERC启动格兰特n˚639300)。
材料
| Name | Company | Catalog Number | Comments |
| Neodymium magnets (on the upper face of 60 mm dish) | K&J Magnetics, Inc | DX88-N52 | grade N52 dimension: 1 1/2" dia. x 1/2" thick |
| Neodymium magnets (on the lower face of 60 mm dish) | K&J Magnetics, Inc | D84PC-BLK | grade N42 dimension: 1/2" dia. x 1/4" thick Black Plastic Coated |
| Dynabeads M280 Tosylactivated | Thermofisher | 14203 | superparamagnetic beads |
| DynaMag-2 Magnet | Thermofisher | 12321D | |
| Fibronectin | Sigma-Aldrich | F1141-5MG | Fibronectin from bovine plasma |
| Poly-D-Lysine | Sigma-Aldrich | P7280-5MG | |
| Apo-Transferrin | Sigma-Aldrich | T1428-50MG | Bovine Apo-Transferrin |
| Bovine serum albumin | Sigma-Aldrich | A7906-500G | |
| DMEM high glucose, GlutaMAX supplement, pyruvate | Life Technologies | 31966-021 | DMEM+GlutaMAX-I 500 ml |
| 60*15 mm culture dish | Falcon | 353004 |
参考文献
- Discher, D. E., Janmey, P., Wang, Y. -. L. . Tissue cells feel and respond to the stiffness of their substrate. 310 (5751), 1139-1143 (2005).
- DuFort, C. C., Paszek, M. J., Weaver, V. M. Balancing forces: architectural control of mechanotransduction. Nat Rev Mol Cell Biol. 12 (5), 308-319 (2011).
- Guilluy, C., et al. The Rho GEFs LARG and GEF-H1 regulate the mechanical response to force on integrins. Nat Cell Biol. 13 (6), 722-727 (2011).
- Matthews, B. D., Overby, D. R., Mannix, R., Ingber, D. E. Cellular adaptation to mechanical stress: role of integrins, Rho, cytoskeletal tension and mechanosensitive ion channels. J Cell Sci. 119 (3), 508-518 (2006).
- Zhao, X. -. H., et al. Force activates smooth muscle alpha-actin promoter activity through the Rho signaling pathway. J Cell Sci. 120 (Pt 10), 1801-1809 (2007).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Austen, K., Kluger, C., Freikamp, A., Chrostek-Grashoff, A., Grashoff, C. Generation and analysis of biosensors to measure mechanical forces within cells. Meth Mol Biol. 1066, 169-184 (2013).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466 (7303), 263-266 (2010).
- Pelham, R. J., Wang, Y. l. . Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci USA. 94 (25), 13661-13665 (1997).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin-cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Chaudhuri, O., Parekh, S. H., Lam, W. A., Fletcher, D. A. Combined atomic force microscopy and side-view optical imaging for mechanical studies of cells. Nat Meth. 6 (5), 383-387 (2009).
- Bays, J. L., et al. Vinculin phosphorylation differentially regulates mechanotransduction at cell-cell and cell-matrix adhesions. J Cell Biol. 205 (2), 251-263 (2014).
- Collins, C., et al. Localized tensional forces on PECAM-1 elicit a global mechanotransduction response via the integrin-RhoA pathway. Curr Biol. 22 (22), 2087-2094 (2012).
- Gordon, W. R., et al. Mechanical Allostery: Evidence for a Force Requirement in the Proteolytic Activation of Notch. Dev Cell. 33 (6), 729-736 (2015).
- Lessey-Morillon, E. C., et al. The RhoA guanine nucleotide exchange factor, LARG, mediates ICAM-1-dependent mechanotransduction in endothelial cells to stimulate transendothelial migration. J Immunol. 192 (7), 3390-3398 (2014).
- Osborne, L. D., et al. TGF-β regulates LARG and GEF-H1 during EMT to affect stiffening response to force and cell invasion. Mol Biol Cell. 25 (22), 3528-3540 (2014).
- Scott, D. W., Tolbert, C. E., Burridge, K. Tension on JAM-A activates RhoA via GEF-H1 and p115 RhoGEF. Mol Biol Cell. 27 (9), 1420-1430 (2016).
- Glogauer, M., Ferrier, J., McCulloch, C. A. Magnetic fields applied to collagen-coated ferric oxide beads induce stretch-activated Ca2+ flux in fibroblasts. Am J Physiol - Cell Physiol. 269 (5), C1093-C1104 (1995).
- Glogauer, M., et al. Calcium ions and tyrosine phosphorylation interact coordinately with actin to regulate cytoprotective responses to stretching. J Cell Sci. 110 (Pt 1), 11-21 (1997).
- Kuo, J. -. C., Han, X., Hsiao, C. -. T., Yates, J. R., Waterman, C. M. Analysis of the myosin-II-responsive focal adhesion proteome reveals a role for β-Pix in negative regulation of focal adhesion maturation. Nat Cell Biol. 13 (4), 383-393 (2011).
- Schiller, H. B., et al. β1- and αv-class integrins cooperate to regulate myosin II during rigidity sensing of fibronectin-based microenvironments. Nat Cell Biol. 15 (6), 625-636 (2013).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nat Cell Biol. 16 (4), 376-381 (2014).
- Plopper, G. E., McNamee, H. P., Dike, L. E., Bojanowski, K., Ingber, D. E. Convergence of integrin and growth factor receptor signaling pathways within the focal adhesion complex. Mol Biol Cell. 6 (10), 1349-1365 (1995).
- Roca-Cusachs, P., Gauthier, N. C., Del Rio, ., A, M. P., Sheetz, Clustering of alpha(5)beta(1) integrins determines adhesion strength whereas alpha(v)beta(3) and talin enable mechanotransduction. Proc Natl Acad Sci USA. 106 (38), 16245-16250 (2009).
- Ajeian, J. N., et al. Proteomic analysis of integrin-associated complexes from mesenchymal stem cells. Proteomics Clin Appl. 10 (1), 51-57 (2016).
- Horton, E. R., Astudillo, P., Humphries, M. J., Humphries, J. D. Mechanosensitivity of integrin adhesion complexes: Role of the consensus adhesome. Exp Cell Res. , (2015).
- Jones, M. C., et al. Isolation of integrin-based adhesion complexes. Curr Protoc Cell Biol. 66, 9.8.1-9.8.15 (2015).
- Ng, D. H. J., Humphries, J. D., Byron, A., Millon-Frémillon, A., Humphries, M. J. Microtubule-dependent modulation of adhesion complex composition. PloS One. 9 (12), e115213 (2014).
- Byron, A., Humphries, J. D., Bass, M. D., Knight, D., Humphries, M. J. Proteomic analysis of integrin adhesion complexes. Sci Sign. 4 (167), pt2 (2011).
- Byron, A., Humphries, J. D., Craig, S. E., Knight, D., Humphries, M. J. Proteomic analysis of α4β1 integrin adhesion complexes reveals α-subunit-dependent protein recruitment. Proteomics. 12 (13), 2107-2114 (2012).
- Marjoram, R. J., Guilluy, C., Burridge, K. Using magnets and magnetic beads to dissect signaling pathways activated by mechanical tension applied to cells. Methods. , (2015).
- Pasapera, A. M., Schneider, I. C., Rericha, E., Schlaepfer, D. D., Waterman, C. M. Myosin II activity regulates vinculin recruitment to focal adhesions through FAK-mediated paxillin phosphorylation. J Cell Biol. 188 (6), 877-890 (2010).
- Sawada, Y., Sheetz, M. P. Force transduction by Triton cytoskeletons. J Cell Biol. 156 (4), 609-615 (2002).
- Grinnell, F., Geiger, B. Interaction of fibronectin-coated beads with attached and spread fibroblasts. Binding, phagocytosis, and cytoskeletal reorganization. Exp Cell Res. 162 (2), 449-461 (1986).
- Schroeder, F., Kinden, D. A. Measurement of phagocytosis using fluorescent latex beads. J Biochem Biophys Meth. 8 (1), 15-27 (1983).
- Hoffman, B. D., Grashoff, C., Schwartz, M. A. Dynamic molecular processes mediate cellular mechanotransduction. Nature. 475 (7356), 316-323 (2011).
- Seo, D., et al. A Mechanogenetic Toolkit for Interrogating Cell Signaling in Space and Time. Cell. 165 (6), 1507-1518 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。