Method Article
تحليل الخلايا السطحية التصاق إعادة عرض في الاستجابة للتوتر الميكانيكية باستخدام الخرز المغناطيسي
In This Article
Summary
التصاقات سطح الخلية هي المركزية في mechanotransduction، كما نقل التوتر الميكانيكية والشروع في مسارات الإشارات المشاركة في توازن الأنسجة والتنمية. هنا، نقدم بروتوكول لتشريح المسارات البيوكيميائية التي يتم تفعيلها في فعل للتوتر، وذلك باستخدام ميكروبيدات المغناطيسي المغلفة يجند وتطبيق قوة لمستقبلات الالتصاق.
Abstract
المجمعات التصاق سطح الخلية Mechanosensitive يسمح للخلايا لاستشعار الخصائص الميكانيكية للمحيطهم. وقد حددت الدراسات الحديثة على حد سواء جزيئات الاستشعار القوة في مواقع الالتصاق، وعوامل النسخ التي تعتمد على القوة التي تنظم التعبير الجيني النسب المحددة ودفع مخرجات المظهرية. ومع ذلك، ظلت شبكات الإشارات تحويل التوتر الميكانيكية في الممرات الحيوية بعيد المنال. لاستكشاف مسارات الإشارات تعمل على التوتر الميكانيكية المطبقة على مستقبلات سطح الخلية، ميكروبيدات مغنطيسية مسايرة فائقة superparamagnetic يمكن استخدامها. هنا نقدم بروتوكول لاستخدام حبات مغناطيسية لتطبيق قوى للبروتينات التصاق سطح الخلية. باستخدام هذا النهج، فمن الممكن للتحقيق ليس فقط مسارات الإشارات هيولي التي تعتمد على القوة من قبل النهج البيوكيميائية المختلفة، ولكن أيضا إعادة عرض التصاق بواسطة العزلة المغناطيسية المجمعات الالتصاق تعلق حبات المغلفة يجند. ويشمل هذا البروتوكول إعداد يجند المشتركATED الخرز مغنطيسية مسايرة فائقة superparamagnetic، وتطبيق تحدد قوات الشد تليها التحليلات الكيميائية الحيوية. بالإضافة إلى ذلك، ونحن نقدم عينة تمثيلية من البيانات مما يدل على أن التوتر تطبيقها على التصاق القائم على إنتغرين مشغلات التصاق إعادة عرض ويغير البروتين التيروزين الفسفرة.
Introduction
في metazoa والتوتر الميكانيكية يوجه تطوير الأنسجة والتوازن خلال تنظيم عدد لا يحصى من عمليات الخلوية مثل انتشار الأسلحة النووية، والتمايز والبقاء على قيد الحياة 1 و 2. التوتر الميكانيكية يمكن أن تنشأ من المصفوفة خارج الخلية أو يمكن أن تتولد من قبل الخلايا الملتصقة، التي عينة بيئة خارج الخلية من خلال آلية مقلص أكتوميوزين التي تشد على المصفوفة خارج الخلية و المسابير صلابة من خلال جزيئات والتوتر الحساسة. وردا على التوتر والبروتينات التصاق mechanosensitive تخضع التغييرات متعلق بتكوين التي تؤدي شلالات الإشارات المعقدة. في المقابل، هذه المسارات يشير تنسق mechanoresponse تشمل الانتشار، والتمايز والبقاء على قيد الحياة أن يضبط السلوك الخلوي للبيئة خارج الخلية. هذه العمليات يمكن تسويتها في فترة زمنية قصيرة الأجل (ثواني إلى دقائق) لتغذية بسرعة مرة أخرى على حلقة من ميكا notransduction عن طريق تعديل الهياكل mechanosensitive. على سبيل المثال، التصاقات القائم على إنتغرين تعزز ردا على التوتر من خلال توسط GTPase-رو هيكل الخلية إعادة عرض 3، 4، 5. في موازاة ذلك، يتم تفعيل مسارات إشارات أخرى خلال الساعات والأيام للسيطرة على برامج الوراثية التي تؤثر في نهاية المطاف خلية مصير 6. في حين أن العديد من الدراسات قد سلط الضوء على تأثير تصلب مصفوفة على الحتمية الخلية وتطور المرض 1، 2، الآليات الجزيئية الدقيقة للmechanotransduction بوساطة الالتصاق لا يزال بعيد المنال.
وقد تم تطوير مناهج مختلفة لدراسة تأثيرات القوى المولدة خلية أو القوى الخارجية على سلوك الخلية، بما في ذلك نظم تدفق ونقل مضان الطاقة الرنين (الحنق) أجهزة الاستشعار -tension 7،معشوقة = "XREF"> 8، ركائز متوافقة 9، ملاقط المغناطيسية، ملاقط بصرية 10 و مجهر القوة الذرية (AFM) 11. هنا نقدم بروتوكول باستخدام الخرز مغنطيسية مسايرة فائقة superparamagnetic لتوصيف مسارات mechanotransduction استجابة لقوى المتوترة تطبيقها على مستقبلات الالتصاق محددة. حبات مغنطيسية مسايرة فائقة superparamagnetic هي الجزيئات التي جذب عكسية عند وضعها في مجال مغناطيسي. مرة واحدة المغلفة مع يجند لمستقبلات محددة، وتوفر هذه الخرز أداة قوية لدراسة آثار تطبيق قوة خارج الخلية. وقد تم التحقق من صحة هذه الطريقة من قبل العديد من الدراسات 3، 5، 12-17 ويقدم ميزة لتسهيل تحليل الكيمياء الحيوية إلى حد كبير على الخلايا الملتصقة. باستخدام الخرز المغناطيسي المغلفة الكولاجين مماثلة تليها تحليل الكيمياء الحيوية، وذكر العمل في وقت مبكر زيادة فيبروتين تيروزين الفسفرة وتفعيل RhoA ردا على التوتر 5، 18، 19. كما تم استخدام الأسلوب هو موضح أدناه مع فبرونيكتين (FN) الخرز المغلفة لتوصيف مسارات إشارات المصب من التوتر تطبق على integrins 3. في هذه الدراسة، Guilluy وآخرون. أظهرت أن التوتر ينشط RhoA من خلال تعيين اثنين من العوامل الصرف جوانين النوكليوتيدات (GEFs)، LARG ومرفق البيئة العالمية-H1، إلى المجمعات التصاق إنتغرين. ومنذ ذلك، أظهرت دراسات أخرى أن GEF-H1 يتم تجنيده لالمجمعات الالتصاق ردا على التوتر ولدت الخلية باستخدام أساليب مختلفة 20، 21، مما يدل على متانة المنهجية الواردة هنا. ونتيجة لذلك، فقد تبين RhoA تفعيلها لتعزيز التصاق التعزيز، من خلال إعادة تشكيل هيكل الخلية. وقد استخدم هذا النظام أيضا لاستكشاف التوتر تطبيقها رس مستقبلات الخلايا / التصاق الخلية. تطبيق القوات على حبات مغناطيسية المغلفة مع المجال خارج الخلية من E-كادهيرين الناجم عن زيادة في التوظيف فينكولين على نحو مماثل لإنتغرين المرتبطة المجمعات التصاق 12. ولاحظ كولينز وزملاؤه أن تطبيق التوتر PECAM-1 يشجع إنتغرين وتفعيل RhoA 13. المنهج التجريبي آخر باستخدام الخرز المغناطيسي هو دراسة التوتر تطبيقها على نواة معزولة. باستخدام حبات مغلفة مع أجسام مضادة ضد بروتين الغلاف النووي nesprin-1، وتنقية المجمعات المغلف النووية أن تظهر أنها تنظم حيوي في استجابة للتوتر الميكانيكية 22. وتدعم هذه النتائج تتحول القوة من هذه الطريقة في دراسة مسارات mechanotransduction. وعلاوة على ذلك، في حين نظم تدفق أو قوة الجر تحفز العمليات الخلوية العامة، الخرز المغناطيسي تستهدف على وجه التحديد مستقبلات التصاق الخلية باستخدام إما بروابط مستقبلات 3 أو الأجسام المضادة وحيدة النسيلة ضد مستقبلات سطح الخلية 13 و 15.
ميزة أخرى لهذه الطريقة هي عزلة المجمعات الالتصاق من خلال إجراء تنقية تقارب يجند مباشرة. ومن المعروف أن إضافة حبات المغلفة يجند للخلايا تربط مستقبلات الالتصاق ويستحث تجنيد العديد من البروتينات التصاق 23. تطبيق مزيد من القوات إلى حبات مغناطيسية المغلفة يجند يتحول هذه المجمعات التصاق إلى منصات الجزيئات التي تتوسط المختلفة التي تعتمد على التوتر مسارات الإشارات 4، 24. تحلل الخلية تليها تركيز حبة باستخدام مغناطيس يسمح عزل منصات التصاق. وقد تم بالفعل استخدام أساليب أخرى تستخدم في تنقية المجمعات الالتصاق في الخلايا الملتصقة. فهي تجمع بين يشابك الكيميائية للحفاظ على تفاعلات البروتين البروتينوخطوة خلية تحلل من المنظفات وتدفق القص أو صوتنة 20، 21، 25، 26، 27، 28. والخطوة الأخيرة هي جمع ينتج عن ذلك من أغشية البلازما البطنية التي تحتوي على مجمعات التصاق. وخلافا لهذه الأساليب، حبات مغناطيسية تسمح بمستوى تنقية أكبر المجمعات التصاق الخلية من خلال استهداف انتقائي عائلة محددة من مستقبلات الالتصاق. وقد تم بالفعل استخدام الخرز المغناطيسي لتنقية المجمعات الالتصاق في الخلايا غير ملتصقة تعلق على ميكروبيدات المغلفة يجند 29، 30. الأسلوب هو موضح أدناه الحالات البيولوجية يقلد حيث يتم تطبيق قوة لفترة طويلة قصيرة (ثواني إلى دقائق). ولذلك، فإنه يوفر أداة قوية للتحقيق في كل من التركيب الجزيئي للمجمعات التصاق تنقيته ومسارات المصب يشير mechanosensitive.
هنا نقدم بروتوكول تجريبي مفصل لاستخدام حبات مغناطيسية لتطبيق القوات المتوترة للبروتينات سطح الالتصاق. يتم وضع مغناطيس النيوديميوم دائم على الجزء العلوي من سطح الطبق الثقافة. يتم وضع وجهه قطب المغناطيس على ارتفاع 6 مم بحيث القوة على 2.8 ميكرومتر حبة المغناطيسي واحد هو ثابت (حوالي 30-40 السندات الإذنية) 31. يتم تحديد مدة التحفيز التوتر من قبل المشغل اعتمادا على جزيء من الفوائد ولها على نطاق ووقت التنشيط. وهي lysed الخلايا أخيرا، يتم تنقية المجمعات التصاق بواسطة فصل حبات باستخدام مغناطيس وتتم معالجة التحليلات الكيميائية الحيوية. ويشمل هذا البروتوكول إعداد حبات مغنطيسية مسايرة فائقة superparamagnetic المغلفة يجند، وتطبيق التوتر من خلال المغناطيس تليها التحليلات الكيميائية الحيوية. بالإضافة إلى ذلك، ونحن نقدم عينة تمثيلية من البيانات مما يدل على أن التوتر تطبيقها على معاذ القائم على إنتغرينesions يدفع التصاق إعادة عرض ويغير البروتين التيروزين الفسفرة.
Protocol
1. يجند الإقتران إلى الخرز المغناطيسي
ملاحظة: يتم تنفيذ اقتران يجند باستخدام الخرز تفعيلها tosyl مغنطيسية مسايرة فائقة superparamagnetic مع 2.8 ميكرون قطر (تركيز الأسهم حل 10 8 حبات / مل، 30 ملغم حبات / مل). ويستند البروتوكول التالية على عينات من ما يقرب من 2 × 10 5 خلايا، والتي تتوافق مع MRC-5 الخلايا المزروعة إلى 80٪ confluency في لوحة زراعة الأنسجة 60 مم. ضبط حجم الخرز والكواشف وفقا لذلك في حالة استخدام لوحات مختلفة الأحجام أو الخلايا في ملتقيات مختلفة. استخدام كمية من الخرز مغنطيسية مسايرة فائقة superparamagnetic من أجل الحصول على 2 حبات في كل خلية. لذلك، هناك حاجة إلى 4 × 10 5 حبات لوحة 60 ملم.
- تماما resuspend والخرز في قارورة الأصلي قبل vortexing لا يقل عن 30 ق. قسامة 40 ميكرولتر من الخرز مغنطيسية مسايرة فائقة superparamagnetic معلق (الموافق 4 × 10 6 حبات) إلى 1.5 مل أنبوب microcentrifuge.
- وضع أنبوب على separati المغناطيسيعلى أهبة الاستعداد من أجل فصل حبات مغناطيسية من الحل. تجاهل طاف، إزالة أنبوب من الوقوف الفصل المغناطيسي و resuspend حبات في 1 مل 0.1 م نا-الفوسفات ودرجة الحموضة 7.4.
- كرر غسل خطوة مرتين مع 1 مل 0.1 م نا-الفوسفات ودرجة الحموضة 7.4.
- بعد غسل النهائي، resuspend والخرز في 1 مل 0،1 M-نا الفوسفات ودرجة الحموضة 7.4.
- الجمع بين 100 ميكروغرام الأبقار فيبرونكتين] (الجبهة الوطنية) أو أي التصاق الخلايا مستقبلات يجند إلى 1 مل 0.1 م نا-الفوسفات ودرجة الحموضة 7.4 تحتوي على الخرز ومزيج من قبل pipetting.
- كرر الخطوات السابقة عن طريق استبدال FN أو أي يجند محددة أخرى مع جيش صرب البوسنة، بولي D يسين أو APO-ترانسفيرين للضوابط السلبية.
- اختياريا، لتحليل هلام، واتخاذ قسامة 10 ميكرولتر من محلول يجند لتحليل يشابك كفاءة وتخلط مع حجم مناسب من المركز Laemmli عينة العازلة.
- احتضان حبات مع تحتوي على حل يجند لمدة 12-24 ساعة عند 37 درجة مئوية على الدوار.
- في حالة ظهور المجاميع حبة بعد حدوث رد فعل، يصوتن (مستمر قوة 39 واط) لمدة لا تتجاوز 10-20 ق.
- عزل الخرز استخدام موقف الفصل المغناطيسي، ونضح الحل المتبقية وإضافة 1 مل من برنامج تلفزيوني / 0.2٪ BSA درجة الحموضة 7.6 الحل. احتضان لمدة 1 ساعة على الدوار عند 37 درجة مئوية.
- تغسل حبات باستخدام مغناطيس مرتين مع 1 مل PBS / 0.2٪ BSA درجة الحموضة 7.6. حبات Resuspend في 1 مل PBS / 0.2٪ BSA درجة الحموضة 7.6.
- حبات يصوتن في حالة ظهور المجاميع مدة لا تزيد عن 20-30 ق.
- اختياريا، إزالة قسامة 10 ميكرولتر لتحليل كفاءة اقتران لطخة الغربية (خلط مع حجم مناسب من الاحتياطي عينة Laemmli المركزة).
- انتقل إلى الخلية المقايسات أو الخرز تخزينها في 4 درجة مئوية لمدة تصل إلى 1 في الشهر.
- اختياريا، تشغيل هلام SDS-PAGE وصمة عار مع Coomassie الأزرق لتحليل FN يشابك إلى حبات مغناطيسية.
تطبيق 2. من القوات المتوترة على الخرز المغلفة يجند ملزمة لالتصاق المستقبلات على ظهريسطح الخلايا
- ثقافة الخلايا الملتصقة على 60 مم طبق زراعة الأنسجة في المتوسط نمو المناسب (عادة DMEM 4.5 جم / لتر مد الجلوكوز تستكمل مع FCS 10٪) حتى تصل إلى 80٪ confluency.
- إعداد العازلة تحلل غير تغيير طبيعة غير الأيونية (+20 ملي تريس حمض الهيدروكلوريك درجة الحموضة 7.6، 150 مم كلوريد الصوديوم، 2 مم MgCl 2 و 0.1٪ NP-40) وmicrocentrifuge لالبرد الأنابيب.
- بيليه حبات المغلفة يجند من القسم 1.10 و resuspend في 1 مل PBS / 0.2٪ BSA درجة الحموضة 7.6. إضافة 100 ميكرولتر من محلول المغلفة الخرز يجند إلى 5 مل من مستنبت دافئ ودوامة.
- نضح المتوسطة في صحن الثقافة 60 مم وإضافة 5 مل متوسطة النمو الدافئة تستكمل مع الخرز.
- احتضان لمدة 20 دقيقة في ظل ظروف زراعة الخلايا (37 درجة مئوية و 5٪ CO 2) للسماح للالخرز على الرسوبيات والتمسك الخلايا. ومن الأهمية بمكان أن لا تتجاوز 20 دقيقة منذ الخرز قد يكون داخليا من البلعمة.
- اختياريا، ومراقبة الخرز تحت المجهر الضوئي باستخدام 10X أو 20X objeالتفاعلية الذي نظمه والتحقق من وجود التصاق حبة عن طريق هز قليلا في طبق للتمييز بين حبات المرفقة والعائمة.
- مع الحفاظ على طبق ثقافة في الحاضنة، تبديل غطاء طبق الطبيعي لغطاء مع الجولة 38 ملم النيوديميوم المغناطيس المرفقة على الوجه العلوي. يقام المغناطيس في مكان من قبل اثنين من أصغر مغناطيس النيوديميوم 13 ملم وضعه على الوجه السفلي من غطاء. منذ المغناطيس هي قوية جدا، والتعامل معها بعناية.
- احتضان خلايا يتعرضون لتوتر لنقاط الوقت المطلوب في ظروف زراعة الخلايا (37 درجة مئوية و 5٪ CO 2).
- بعد العلاج، ووضع الطبق على الجليد وبعناية نضح المتوسط بأكمله من الطبق.
- إضافة 300 ميكرولتر من العازلة خلية تحلل، واحتضان لمدة 10 دقيقة على الجليد. جمع المحللة باستخدام مكشطة خلية ونقلها إلى قبل المبردة أنبوب 1.5 مل microcentrifuge.
- بيليه حبات مغناطيسية باستخدام موقف الفصل المغناطيسي ونقل الكلي المحللة خلية إلى ما قبل فتور جديدإد أنبوب 1.5 مل microcentrifuge. تخزين هذا الكسر في -20 درجة مئوية لمزيد من التحليل.
- تغسل حبات 3 مرات مع 1 مل تحلل العازلة الجليد الباردة. إضافة 50 العازلة عينة ميكرولتر Laemmli لبيليه حبة، مزيج من قبل pipetting ويغلي عند درجة حرارة 95 درجة مئوية لمدة 5 دقائق باستخدام سخان كتلة جافة. هذا جزء يحتوي على مجمعات التصاق معزولة. انتقل إلى تحليل الكيمياء الحيوية أو مخزن في -20 درجة مئوية.
- من إجمالي المحللة خلية تم الحصول عليها بعد حبات فصل (حوالي 300 ميكرولتر)، إزالة قسامة 50 ميكرولتر لتحليل لطخة الغربي.
ملاحظة: ميكرولتر 250 غادر يمكن استخدامها لإجراء المزيد من الدراسات البيوكيميائية مثل دراسات البروتين البروتين التفاعل (مناعي، المقايسات GST المنسدلة) أو تجارب النشاط GTPase (تغيير العازلة تحلل قد يكون من الضروري تبعا لGTPase من الفائدة).
النتائج
ويتضح التخطيطي للتقنية في الشكل 1A. بعد اقتران يجند، يتم تحضين حبات مغناطيسية مع الخلايا لمدة 20 دقيقة، ثم يستخدم المغناطيس الدائم لتطبيق قوى الشد من حوالي 30-40 السندات الإذنية لكمية مختلفة من الزمن. ويبين الشكل 1B 2.8 ميكرون الخرز المغناطيسي المغلفة FN-بد أن MRC5 مستقبلات الخلايا الالتصاق.
الخطوات غسل حبات مغنطيسية مسايرة فائقة superparamagnetic بعد تحلل الخلية حاسمة وتحدد درجة من التنقية. ويوصى ما لا يقل عن ثلاثة يغسل. immunoblots GADPH مع التعرض لفترة طويلة يمكن أن تكون مفيدة لاختبار نقاء المجمعات التصاق (الشكل 2A).
واستخدمت المغلفة FN-الخرز للتحقيق في عمليات mechanotransduction التي تحدث مع مرور الوقت في المجمعات الالتصاق ردا على التوتر. بعد الفصل المغناطيسي للجزء التصاق معقدة، وقد تم تحليل المحللة والتصاق جزء معقد من قبللطخة غربية. كما هو متوقع، لاحظنا تالين، فينكولين وpaxillin، ولكن ليس GAPDH في جزء المجمعات الالتصاق حتى في غياب التحفيز الميكانيكي (الشكل 2B). تمشيا مع تقارير سابقة 32، 33، أثار التوتر التوظيف فينكولين إلى المجمعات الالتصاق. في حين التوتر لم يؤثر التوظيف paxillin إلى المجمعات الالتصاق، وتعززت الفسفرة على التيروزين 31 في فعل للتوتر الميكانيكية على حد سواء في مجموع الخلايا المحللة وفي جزء التصاق معقدة.
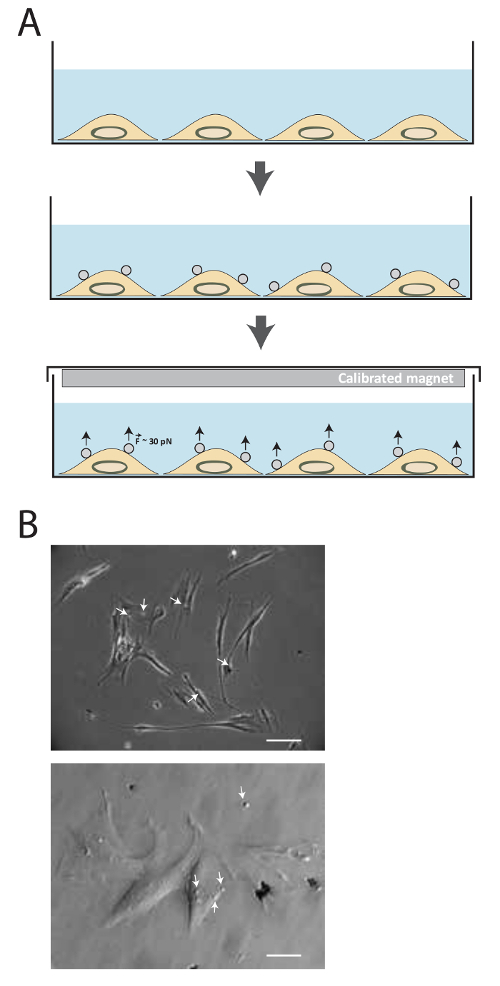
الشكل 1. وصف الأسلوب. (أ) توضيح تخطيطي لتقنية. كما يتم استزراع خلايا أولا في الثقافة متوسطة حتى يتم الوصول إلى confluency المطلوب. ثم، تضاف حبات مغنطيسية مسايرة فائقة superparamagnetic لمدة 15-20 دقيقة. القوات المتوترة حوالي 30-40 السندات الإذنية همثم تطبيقها باستخدام المغناطيس معايرة لكمية مختلفة من الزمن. (ب) حبات مغنطيسية مسايرة فائقة superparamagnetic فبرونيكتين المغلفة ربط لمستقبلات الخلايا الالتصاق. يتم تصوير الخلايا المرحلة التباين في ينتقل الضوء المجهري 15 دقيقة بعد إضافة حبات مغنطيسية مسايرة فائقة superparamagnetic (السهم الأبيض) في المتوسط. (أعلى الصورة: شريط مقياس = 25 ميكرومتر، الصورة السفلى: مقياس بار = 100 ميكرون) الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
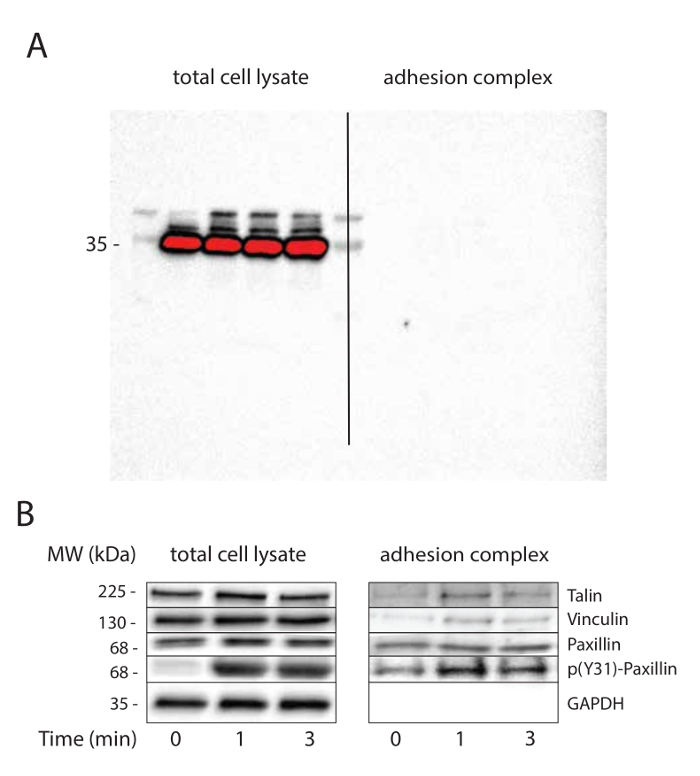
الشكل 2. التوتر الميكانيكية يدفع التصاق النضج. (A) تنقية المجمعات الالتصاق. يستخدم GAPDH immunoblotting عن السيطرة تحميل لإجمالي الخلايا المحللة وللتأكد من نقاء المجمعات الالتصاق. وقد تم تصوير غشاء النيتروسليلوز باستخدام التعرض الطويل للتظاهر عشره عدم وجود إشارة في التصاق جزء معقد. (ب) التوتر يدفع التصاق النضج. وimmunoblotted السيطرة تحميل (GAPDH) والمرشحين (فينكولين، تالين وpaxillin) من المعروف أن المجندين أو فسفرته في المجمعات الالتصاق ردا على التوتر الميكانيكية. وقد تم تنفيذ هذه التجربة على MRC5 الخلايا. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
الطريقة الموصوفة هنا يشكل نهجا واضحة لتطبيق التوتر لمستقبلات الالتصاق سطح الخلية والسماح تنقية لاحقا. ومع ذلك، بعض الخطوات الهامة لأداء كفاءة تنقية التصاق وتحسين محتمل يمكن أن يتم اعتمادا على المستقبلات التصاق المستهدفة. نقدم المشاكل المحتملة التي قد يواجهها المستخدم أدناه.
كنا 2.8 ميكرون قطر حبات مغناطيسية ولكن حبات أكبر يمكن استخدام مثل 4.5 ميكرون قطر. ومع ذلك، ينبغي أن يقتصر قطر حبة إلى 2-5 ميكرون منذ قد تحدث البلعمة بسرعة أكبر خلال 30-60 دقيقة حضانة والخرز أكبر يكون التصاق أقوى ذلك سيقتصر أن النزوح حبة تحت حقل مغناطيسي 34، 35. وبالتالي، فمن المهم الحد من فترة حضانة لفترات قصيرة واستخدام حجم حبة السليم. وعدد من الخرز المحتضنة في الخلية يؤثر على كمية وتجربة أورثي من خلية واحدة. بينما كان أحد يريد لتحفيز الخلايا مع التوتر بشكل فعال، يمكن أن الكثير من الخرز لكل خلية يؤدي إلى تفعيل مسارات الإشارات غير ذات صلة. ونحن عادة احتضان بمتوسط اثنين حبات لكل خلية لحبات مغلفة FN، ولكن هذه الكمية يمكن تعديلها [1-5 حبات في كل خلية] اعتمادا على نوع من الخلايا ومستقبلات سطح الخلية. وفيما يتعلق المغناطيس، الطريقة الموصوفة هنا يستخدم المغناطيس التي تم قياس القوة الناتجة عن 2.8 ميكرون (حوالي 30-40 السندات الإذنية عن طريق قياس تشريد حبات مغناطيسية في الجلسرين مخفف، السائل النيوتونية مع اللزوجة المعروفة 31، على الرغم من أنه هو ممكن لاستخدام مغناطيس أكبر لتطبيق كمية أكبر من القوة إذا لزم الأمر. ومن المهم أن نلاحظ أن هذه هي مغناطيس قوية للغاية والتلاعب لها بدقة.
بعد 12-24 ساعة الحضانة مع ECM يجند (الخطوة 1.7)، وكذلك بعد 1 ساعة الحضانة (الخطوة 1.9) مع برنامج تلفزيوني / 0.2٪ BSA درجة الحموضة 7.6 العازلة، مميكروبيدات agnetic قد تشكل الحصى. ومن ثم حاسما لفصل حبات قدر الإمكان على احترام نسبة 2 حبات في كل خلية. ومع ذلك، فإنه لا يزال مقبولا لديك 5: 1 نسبة. حبات الفصل يمكن أن يتحقق إما عن طريق خلط وpipetting لأو باستخدام صوتنة، على الرغم من فترة قصيرة (20-30 ق).
البروتينات المختلفة يمكن مترافق مع الخرز، بما في ذلك يجند إنتغرين (FN، الكولاجين) والبروتينات المؤتلف أو الأجسام المضادة التي تستهدف مستقبلات سطح الخلية المحددة. المرفق من الخرز المغلفة يجند المغناطيسي لسطح الخلية ظهري قد ضعفت بسبب انخفاض كفاءة اقتران يجند على الخرز. فمن المستحسن للتحقق من يجند ملزمة لحبات من خلال جمع قسامة من الحل يجند المخفف قبل إضافة إلى الخرز وقسامة من الخرز في نهاية عملية اقتران. هذه قسامات يمكن معالجتها لتحليل SDS-PAGE وCoomassie تلطيخ الأزرق.
إذا لم تحدث تغيرات فيمسارات الإشارات أو الكشف عن عمليات mechanosensing المتوقع، فمن المهم النظر في مختلف الاحتمالات. طريقة واحدة لتحديد المشكلة لتعديل مدة التجربة مع المغناطيس. ومن المعلوم أن سرعة العمليات الخلوية يختلف اعتمادا على نوع من الخلايا المستخدمة. وثمة خيار آخر هو لاختبار المعروف جزيئات والتوتر الحساسة والتحقق من التعديلات بعد متعدية من قبل غرب النشاف (على سبيل المثال paxillin الفسفرة أو FAK الفسفرة يمكن تحليلها). كمية القوة قد تكون أيضا عاملا حاسما واستخدام الخرز سمكا المغناطيس (نفس الصف N52) أو أكبر يمكن أن يكون خيارا. بالإضافة إلى ذلك، يجند / مستقبلة كفاءة ملزمة يمكن أن تستكشف من خلال تحليل مجمع التصاق والبحث عن مستقبلات سطح الخلية (مثل كادهيرين أو إنتغرين). يمكن للconfluency خلية تؤثر أيضا على استجابة الخلايا للتوتر. كما لوحظ أن التصاق الخلية / خلية يمكن أن تؤثر على سلوك الخلية وprestress cystokeletal، فمن الاهميهر أن نلاحظ أن confluency قد تؤثر على استجابة الخلايا للتوتر. على الرغم من أننا نوصي 80٪ confluency لتطبيق التوتر لالتصاقات على أساس إنتغرين، ويمكن اختبار مختلف الظروف من أجل تحسين نظام تجريبي.
على الرغم من أن هذا الأسلوب يوفر أداة قوية لفك adhesome حساسة التوتر فضلا عن مسارات الإشارات المرتبطة بها، كان له أيضا بعض القيود. أولا، لأن الشغل الشاغل استخدام هذه صغر حجم حبات مغناطيسية هو خطر التدويل من خلال الخلايا، وهذه الطريقة لا يمكن أن تستخدم لدراسة الإشارات mechanosensitive استجابات الخلايا على المدى الطويل أن تعديل مصير الخلايا مثل التمايز والانتشار. الحد آخر يكمن في طريقة لكيفية تطبيق قوات إلى طبقة من الخلايا في لوحة الثقافة. في الواقع، منذ المجال المغناطيسي هو أعلى دائما في محيط من المغناطيس، القوات يمكن أن تختلف على سطح لوحة الثقافة مع التدرج تقليل من الخلاياتمتد من المحيط إلى المركز، وربما تؤدي إلى استجابات الخلايا غير المتجانسة.
الإجراء الموضح هنا يشكل طريقة مباشرة وفعالة من حيث التكلفة التي تسمح دراسة مسارات الخلوية mechanosensitive وكذلك التحقيق في التركيب الجزيئي المجمعات الالتصاق تعرض للتوتر. المناهج الأخرى، مثل تمتد جهاز تطبيق سلالة دوري للخلايا، يؤدي إلى تطبيق التوتر على جميع مستقبلات سطح الخلية التفاعل مع المصفوفة خارج الخلية. الطريقة الموصوفة هنا لديه ميزة تمكين التحفيز قوة من مجموعة فرعية معينة من مستقبلات سطح الخلية ومجموعة كبيرة ومتنوعة من بروابط يمكن استخدامها، مثل إنتغرين بروابط أو الأجسام المضادة التي تستهدف مستقبلات سطح الخلية، مما يتيح للدراسة العديد من النظم mechanosensitive متميزة. ميزة أخرى لهذا الأسلوب هو أنه يؤدي إلى تنقية المجمعات البروتينات التي شهدت التوتر والعمل على تحميلية إيليمياليلة التي هي معروفة لتلعب دورا محوريا في mechanotransduction 36. ويمكن أيضا مجمع التصاق النقي أن تستخدم لمختلف النهج البيوكيميائية 14، مثل المقايسات كيناز للتحقيق في النشاط كيناز ردا على التوتر، أو الأكتين فحص البلمرة. بالإضافة إلى ذلك، فإن هذا النظام التجريبي يمكن أن يقترن مع ملاقط المغناطيسية لاستكشاف استجابة الميكانيكية الخلوية وربط هذه الاستجابة مع مسارات إشارات محددة. ومن المثير للاهتمام، وقد استخدمت النانوية magnetoplasmonic مؤخرا إلى ميكانيكيا الشق الحمل وE-كادهيرين مع مراقبة دقيقة في الزمان والمكان 37. هذا التطور الأخير قد تساعد استكشاف مسارات الإشارات mechanosensitive مع مختلف المدخلات المكانية والزمنية والميكانيكية.
Disclosures
الكتاب تعلن أي المصالح المالية المتنافسة.
Acknowledgements
ويدعم الفريق الاستشاري من المنح المقدمة من الوكالة الوطنية للبحوث (وكالة الاستخبارات الوطنية-13-JSV1-0008)، من البرنامج الإطاري السابع للاتحاد الأوروبي (ماري كوري التكامل الوظيفي n˚8304162) ومن مجلس الأبحاث الأوروبي (ERC) تحت الأفق الاتحاد الأوروبي 2020 البحوث والابتكار برنامج (ERC ابتداء غرانت n˚639300).
Materials
| Name | Company | Catalog Number | Comments |
| Neodymium magnets (on the upper face of 60 mm dish) | K&J Magnetics, Inc | DX88-N52 | grade N52 dimension: 1 1/2" dia. x 1/2" thick |
| Neodymium magnets (on the lower face of 60 mm dish) | K&J Magnetics, Inc | D84PC-BLK | grade N42 dimension: 1/2" dia. x 1/4" thick Black Plastic Coated |
| Dynabeads M280 Tosylactivated | Thermofisher | 14203 | superparamagnetic beads |
| DynaMag-2 Magnet | Thermofisher | 12321D | |
| Fibronectin | Sigma-Aldrich | F1141-5MG | Fibronectin from bovine plasma |
| Poly-D-Lysine | Sigma-Aldrich | P7280-5MG | |
| Apo-Transferrin | Sigma-Aldrich | T1428-50MG | Bovine Apo-Transferrin |
| Bovine serum albumin | Sigma-Aldrich | A7906-500G | |
| DMEM high glucose, GlutaMAX supplement, pyruvate | Life Technologies | 31966-021 | DMEM+GlutaMAX-I 500 ml |
| 60*15 mm culture dish | Falcon | 353004 |
References
- Discher, D. E., Janmey, P., Wang, Y. -L. Tissue cells feel and respond to the stiffness of their substrate. 310 (5751), Science. New York, N.Y. 1139-1143 (2005).
- DuFort, C. C., Paszek, M. J., Weaver, V. M. Balancing forces: architectural control of mechanotransduction. Nat Rev Mol Cell Biol. 12 (5), 308-319 (2011).
- Guilluy, C., et al. The Rho GEFs LARG and GEF-H1 regulate the mechanical response to force on integrins. Nat Cell Biol. 13 (6), 722-727 (2011).
- Matthews, B. D., Overby, D. R., Mannix, R., Ingber, D. E. Cellular adaptation to mechanical stress: role of integrins, Rho, cytoskeletal tension and mechanosensitive ion channels. J Cell Sci. 119 (3), 508-518 (2006).
- Zhao, X. -H., et al. Force activates smooth muscle alpha-actin promoter activity through the Rho signaling pathway. J Cell Sci. 120 (Pt 10), 1801-1809 (2007).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126 (4), 677-689 (2006).
- Austen, K., Kluger, C., Freikamp, A., Chrostek-Grashoff, A., Grashoff, C. Generation and analysis of biosensors to measure mechanical forces within cells. Meth Mol Biol. 1066, 169-184 (2013).
- Grashoff, C., et al. Measuring mechanical tension across vinculin reveals regulation of focal adhesion dynamics. Nature. 466 (7303), 263-266 (2010).
- Pelham, R. J., Wang, Y. l Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc Natl Acad Sci USA. 94 (25), 13661-13665 (1997).
- Choquet, D., Felsenfeld, D. P., Sheetz, M. P. Extracellular matrix rigidity causes strengthening of integrin-cytoskeleton linkages. Cell. 88 (1), 39-48 (1997).
- Chaudhuri, O., Parekh, S. H., Lam, W. A., Fletcher, D. A. Combined atomic force microscopy and side-view optical imaging for mechanical studies of cells. Nat Meth. 6 (5), 383-387 (2009).
- Bays, J. L., et al. Vinculin phosphorylation differentially regulates mechanotransduction at cell-cell and cell-matrix adhesions. J Cell Biol. 205 (2), 251-263 (2014).
- Collins, C., et al. Localized tensional forces on PECAM-1 elicit a global mechanotransduction response via the integrin-RhoA pathway. Curr Biol. 22 (22), 2087-2094 (2012).
- Gordon, W. R., et al. Mechanical Allostery: Evidence for a Force Requirement in the Proteolytic Activation of Notch. Dev Cell. 33 (6), 729-736 (2015).
- Lessey-Morillon, E. C., et al. The RhoA guanine nucleotide exchange factor, LARG, mediates ICAM-1-dependent mechanotransduction in endothelial cells to stimulate transendothelial migration. J Immunol. 192 (7), 3390-3398 (2014).
- Osborne, L. D., et al. TGF-β regulates LARG and GEF-H1 during EMT to affect stiffening response to force and cell invasion. Mol Biol Cell. 25 (22), 3528-3540 (2014).
- Scott, D. W., Tolbert, C. E., Burridge, K. Tension on JAM-A activates RhoA via GEF-H1 and p115 RhoGEF. Mol Biol Cell. 27 (9), 1420-1430 (2016).
- Glogauer, M., Ferrier, J., McCulloch, C. A. Magnetic fields applied to collagen-coated ferric oxide beads induce stretch-activated Ca2+ flux in fibroblasts. Am J Physiol - Cell Physiol. 269 (5), C1093-C1104 (1995).
- Glogauer, M., et al. Calcium ions and tyrosine phosphorylation interact coordinately with actin to regulate cytoprotective responses to stretching. J Cell Sci. 110 (Pt 1), 11-21 (1997).
- Kuo, J. -C., Han, X., Hsiao, C. -T., Yates, J. R., Waterman, C. M. Analysis of the myosin-II-responsive focal adhesion proteome reveals a role for β-Pix in negative regulation of focal adhesion maturation. Nat Cell Biol. 13 (4), 383-393 (2011).
- Schiller, H. B., et al. β1- and αv-class integrins cooperate to regulate myosin II during rigidity sensing of fibronectin-based microenvironments. Nat Cell Biol. 15 (6), 625-636 (2013).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nat Cell Biol. 16 (4), 376-381 (2014).
- Plopper, G. E., McNamee, H. P., Dike, L. E., Bojanowski, K., Ingber, D. E. Convergence of integrin and growth factor receptor signaling pathways within the focal adhesion complex. Mol Biol Cell. 6 (10), 1349-1365 (1995).
- Roca-Cusachs, P., Gauthier, N. C., Del Rio,, A,, Sheetz, M. P. Clustering of alpha(5)beta(1) integrins determines adhesion strength whereas alpha(v)beta(3) and talin enable mechanotransduction. Proc Natl Acad Sci USA. 106 (38), 16245-16250 (2009).
- Ajeian, J. N., et al. Proteomic analysis of integrin-associated complexes from mesenchymal stem cells. Proteomics Clin Appl. 10 (1), 51-57 (2016).
- Horton, E. R., Astudillo, P., Humphries, M. J., Humphries, J. D. Mechanosensitivity of integrin adhesion complexes: Role of the consensus adhesome. Exp Cell Res. , (2015).
- Jones, M. C., et al. Isolation of integrin-based adhesion complexes. Curr Protoc Cell Biol. 66, 9.8.1-9.8.15 (2015).
- Ng, D. H. J., Humphries, J. D., Byron, A., Millon-Frémillon, A., Humphries, M. J. Microtubule-dependent modulation of adhesion complex composition. PloS One. 9 (12), e115213(2014).
- Byron, A., Humphries, J. D., Bass, M. D., Knight, D., Humphries, M. J. Proteomic analysis of integrin adhesion complexes. Sci Sign. 4 (167), pt2(2011).
- Byron, A., Humphries, J. D., Craig, S. E., Knight, D., Humphries, M. J. Proteomic analysis of α4β1 integrin adhesion complexes reveals α-subunit-dependent protein recruitment. Proteomics. 12 (13), 2107-2114 (2012).
- Marjoram, R. J., Guilluy, C., Burridge, K. Using magnets and magnetic beads to dissect signaling pathways activated by mechanical tension applied to cells. Methods. , San Diego, Calif. (2015).
- Pasapera, A. M., Schneider, I. C., Rericha, E., Schlaepfer, D. D., Waterman, C. M. Myosin II activity regulates vinculin recruitment to focal adhesions through FAK-mediated paxillin phosphorylation. J Cell Biol. 188 (6), 877-890 (2010).
- Sawada, Y., Sheetz, M. P. Force transduction by Triton cytoskeletons. J Cell Biol. 156 (4), 609-615 (2002).
- Grinnell, F., Geiger, B. Interaction of fibronectin-coated beads with attached and spread fibroblasts. Binding, phagocytosis, and cytoskeletal reorganization. Exp Cell Res. 162 (2), 449-461 (1986).
- Schroeder, F., Kinden, D. A. Measurement of phagocytosis using fluorescent latex beads. J Biochem Biophys Meth. 8 (1), 15-27 (1983).
- Hoffman, B. D., Grashoff, C., Schwartz, M. A. Dynamic molecular processes mediate cellular mechanotransduction. Nature. 475 (7356), 316-323 (2011).
- Seo, D., et al. A Mechanogenetic Toolkit for Interrogating Cell Signaling in Space and Time. Cell. 165 (6), 1507-1518 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved