Method Article
Développement d'un
Dans cet article
Résumé
Les modèles actuels in vitro pour l' évaluation des lentilles de contact (Cls) et d' autres applications liés aux yeux sont très limitées. La plate-forme oculaire présenté simule l'écoulement physiologique de la déchirure, le volume larme, exposition à l'air et à l'usure mécanique. Ce système est très polyvalent et peut être appliquée à diverses analyses in vitro avec NFT.
Résumé
Currently, in vitro evaluations of contact lenses (CLs) for drug delivery are typically performed in large volume vials,1-6 which fail to mimic physiological tear volumes.7 The traditional model also lacks the natural tear flow component and the blinking reflex, both of which are defining factors of the ocular environment. The development of a novel model is described in this study, which consists of a unique 2-piece design, eyeball and eyelid piece, capable of mimicking physiological tear volume. The models are created from 3-D printed molds (Polytetrafluoroethylene or Teflon molds), which can be used to generate eye models from various polymers, such as polydimethylsiloxane (PDMS) and agar. Further modifications to the eye pieces, such as the integration of an explanted human or animal cornea or human corneal construct, will permit for more complex in vitro ocular studies. A commercial microfluidic syringe pump is integrated with the platform to emulate physiological tear secretion. Air exposure and mechanical wear are achieved using two mechanical actuators, of which one moves the eyelid piece laterally, and the other moves the eyeballeyepiece circularly. The model has been used to evaluate CLs for drug delivery and deposition of tear components on CLs.
Introduction
Deux domaines importants d'intérêt dans le domaine des lentilles de contact (CL) comprennent l'inconfort et le développement de nouvelles applications de CL. Élucider les mécanismes sous - jacents CL inconfort est une question qui a échappé le domaine depuis des décennies. 8 Le développement de nouveaux CLs fonctionnels, tels que les dispositifs d' administration de médicaments 1,3,9 et biocapteurs, 10-12 est un domaine d'intérêt croissant, avec des marchés potentiels importants. Dans les deux cas, un système sophistiqué dans le modèle in vitro pourrait fournir des informations pertinentes pour aider à la sélection appropriée des matériaux de lentilles ou des caractéristiques de conception lors de la phase de développement. Malheureusement, le courant des modèles in vitro pour évaluer CLs et d' autres applications oculaires liées sont relativement brut et sophistiqué. Traditionnellement, les études in vitro CL évaluant le dépôt du film lacrymal ou la délivrance de médicaments sont effectuées dans des flacons statiques, les grands volumes de fluide contenant un volume fixe, qui greadépasse tly quantités physiologiques. En outre, ce modèle simple n'a pas la composante de flux lacrymal naturel et le réflexe de clignement, qui sont tous deux des facteurs de l'environnement oculaire déterminant.
Le développement d'un «modèle» sophistiqué, physiologiquement pertinente de l' œil , il faudra une approche multidisciplinaire et exigent substantielle validation in vivo. Pour ces raisons, le cadre fondamental pour notre modèle in vitro de l' œil est très polyvalent, de sorte que le modèle peut être continuellement amélioré grâce à des améliorations et des modulations futures. À ce jour, le modèle est capable de simuler le volume larme, flux lacrymal, l'usure mécanique et exposition à l'air. L'objectif est de créer un modèle in vitro qui fournira des résultats significatifs, qui est prédictive et complémentaire à in vivo et ex vivo observations.
Protocole
Toutes les expériences ont été réalisées en conformité et le respect de toutes les directives pertinentes énoncées par l'Université de Waterloo le comité d'éthique de la recherche animale. Les yeux de l'espèce bovine sont généreusement offerts à partir d'un abattoir local.
1. Eye Model
- Conception et production de moules 13
- Concevoir les modèles de l' oeil en fonction des dimensions physiologiques moyennes des yeux humains adultes. 13
- Laissez un espace de 250 um entre le globe oculaire et les morceaux de la paupière du modèle de l'oeil. Concevoir les moules respectifs à l'aide de la conception (CAO) assistée par ordinateur.
- Créer un nouveau fichier .cad ou d'un fichier .sldprt avec AutoCAD ou Solidworks. Créer des modèles 3D du globe oculaire / paupière humaine. Créer des moules des modèles et enregistrer les moules sous forme de fichiers .stl.
- Importation de fichiers .stl dans le logiciel de l' imprimante 3D (par exemple, makeware pour replicator2). Spécifiez les paramètres de l'impression (localisation, faible densité, l' échelle, l' orientation, la douceur, etc. ) 13.
- Enregistrez le fichier en tant que fichier G-code pour les imprimantes 3D à lire. Sélectionner des matériaux tels que le PLA (acide polylactique), l' ABS (styrène-butadiène - acrylonitrile), PC (polycarbonate), ou une combinaison de ceux - ci, pour imprimer les moules 13.
- Installer filament souhaitée du matériau de choix. Importer le fichier G-code dans l'imprimante 3D à lire. Imprimer le moule.
NOTE: En variante, la production des moules à l'aide d'un oeil commande numérique par ordinateur (CNC), si une surface plus lisse sur le modèle d'oeil est souhaitée. Pour CNC production de moules, des matériaux pour les moules ne sont plus limités aux plastiques thermiques, mais étendent sur le métal, la céramique et des polymères chimiquement résistants tels que le polytétrafluoroéthylène. - Ouvrir l'interface de logiciel CNC qui est relié à un foret de coupe. Construire des moules 3D selon la face, de dessus, de côté et des vues en perspective des moules modèles globe oculaire / paupière précédemment construits dans l'interface du logiciel de commande. Sélectionnez les paramètres appropriés pour lausinage (taille de bits, matériau de substrat, l'épaisseur du matériau) et procéder à couper le moule.
- Synthèse de Oculaires Utilisation PDMS
- En utilisant une seringue, mesurer 10 ml volume de PDMS (polydiméthylsiloxane) de base et le remplir dans un tube de centrifugeuse 15-50 ml. Ajouter 10% p / v de la solution d'élastomère en poids total du PDMS. L'utilisation d'une tige d'agitation, bien mélanger les solutions.
- Verser la solution PDMS dans le globe oculaire et la paupière moules. Laisser les PDMS à régler à TA O / N (ou pendant au moins 12 heures) pour démarrer la polymérisation et pour permettre aux bulles de se dissoudre hors du polymère.
REMARQUE: Assurez-vous qu'il n'y a pas de bulles laissées dans le PDMS qui pourrait augmenter ou se développer. - Par la suite, mettre les moules dans un four à 75 ° C (167 ° F) pendant 1 heure, ou 150 ° C (302 ° F) pendant 5 min. Pour un gel doux, laisser les PDMS sont assis à la température ambiante pendant au moins 48 heures pour polymériser complètement.
- Placer les échantillons dans un congélateur pendant quelques minutes; cela va réduire les PDMS et simplifierla suppression des échantillons provenant des moules. Extraire les oculaires des moules à l'aide d'une spatule fine.
- Pour la livraison de la solution dans l'espace entre le globe oculaire et pièces paupière, connectez un tube de polytétrafluoroéthylène 1/16 "x 1/8" avec un "connecteur de tube de coupleur 1/16 de la jambe égale et l'attacher à la pièce de la paupière au niveau du trou de tube .
- Synthèse de Eyeball Piece Utilisation Agarose
NOTE: Le morceau du globe oculaire peut être synthétisé en utilisant d'autres polymères tels que l'agarose. La procédure suivante peut être également modifié pour produire des morceaux de l'oeil à partir d'une variété de types de gélose, tels que PDA (agar de dextrose de pomme de terre) ou SDA (dextrose de Sabouraud agar-agar).- Pour produire un 2% (2 g / 100 ml) de gel, mesure 2 g d'agarose et mélanger avec 100 ml d'eau ultrapure. Porter la solution à ébullition (100 ° C) de telle sorte que l'agarose se dissout complètement. Laisser la solution refroidir pendant 5 min.
- Verser la solution dans le moule du globe oculaire et laisser la solution refroidir pendant 30 min à température ambiante. Retirer les morceaux du globe oculaire avec une spatule. Stocker l'agar du globe oculaire dans un -20 ° C congélateur pour une utilisation ultérieure. Pour les études de microbiologie, stériliser les moules du globe oculaire par autoclavage et / ou UV-irradiation.
- Incorporation de Bovine Cornea sur PDMS Eyeball
NOTE:. Ce protocole a été adapté de Parekh et al 14- Effectuer la dissection et l'incorporation des cornées bovines dans des conditions stériles sous une hotte à flux laminaire. Acquérir les yeux et les disséquer le même jour.
- Tourner la hotte à flux pendant 10 minutes avant utilisation et désinfecter avec de l'alcool d'éthanol à 70%. Veiller à ce que tous les matériaux et instruments sont stériles par autoclavage à 273 ° F / 133 ° C pendant 45 min, et positionnés pas moins de 4 pouces de l'entrée de la hotte à flux.
- Immerger l'oeil bovin dans un bêcher contenant une solution de povidone-iode dilué pendant 2 min. Rincer l'oeil dans un bêcher contenant du tampon phosphate salin (PBS) pH 7,4. Utilisation des pinces placent doucement l'œil sur une boîte de Pétri en verre, de la cornée face vers le haut.
- Retirer l'excès de muscle et le tissu adipeux en coupant au niveau des points de fixation scléral avec des ciseaux émoussés de dissection de fin. Éliminer le tissu en excès dans un bécher stérile désigné pour les déchets animaux.
- Utilisation de micro-ciseaux, retirer la conjonctive de l'œil. Envelopper l'oeil avec de la gaze stérile, en maintenant une distance d'au moins 1 cm à partir du limbe.
- À l'aide d'un scalpel, inciser la sclère d'environ 2 mm de la région limbique et superficiellement de manière à éviter la pénétration de la choroïde sous-jacente et le corps vitré. étendre soigneusement l'incision de 360 ° à l'aide d'un scalpel ou des ciseaux de dissection sans déformer la cornée de sa courbure naturelle.
- Avec une pince fine, enlever la cornée de l'oeil. En utilisant des pinces, retirez avec précaution tout tissu uvéal adhérant et rincer cornée avec PBS.
- Rangez la cornée à 31ºC dans un récipient stérile avec la culturemoyen (comme moyen 199) contenant 3% de sérum bovin fœtal pour maintenir l'humidité des tissus et de la nourriture de la cellule.
- Avant l'expérimentation, reposer la cornée excisée sur le globe oculaire PDMS, et serrer les deux pièces ensemble avec une pince spécialisée.
2. Blink-plateforme
- Conception et production de Blink-plateforme
NOTE: Le blink-plate-forme est composée de trois parties fonctionnelles: modèle d'oeil (décrit dans la section 1), système d'engrenage, et un système électronique.- Conception et fabrication de la plate-forme de clignotement en utilisant la CAO et l'impression 3D, similaire à celle décrite pour le modèle de l'œil (section 1.1). Concevoir le système d'engrenage tel qu'il se traduit par simple rotation des moteurs dans les mouvements latéraux et de rotation des oculaires. 15
- En utilisant le pignon et le mécanisme d'engrenage, à traduire le mouvement d'un moteur pas à pas de rotation en un mouvement latéral d'un pignon, qui est relié aux éléments de la paupière.
- En utilisant lesystème d'engrenage conjugué, d'amplifier un mouvement de rotation d'un moteur pas à pas en trois (ou plus) des mouvements de rotation pour trois pièces de globe oculaire différentes.
- Aligner les deux systèmes d'engrenage, l'un pour la paupière et l'autre pour globe oculaire, de sorte que la distance entre les deux sont constants. Assembler le système électronique avec un microcontrôleur, le capotage moteur et deux moteurs.
REMARQUE: Utilisez deux moteurs pas à pas pour fournir des moteurs de rotation, ce qui se traduit par le système d'engrenage en un mouvement de clignoter. - Relier les deux moteurs pas à pas avec un système constitué d'un bouclier de moteur empilé sur le microcontrôleur. Connecter et configurer les composants électroniques pour travailler avec des logiciels open source.
- Programmer le système pour contrôler les paramètres du moteur tels que tours par minute (RPM), le nombre de tours avant, nombre de tours en arrière, et le style de tournage.
REMARQUE: Se reporter au "fichier de code Arduino" supplémentaire pour plus de détails. - Télécharger le logiciel système de la male site Web de nufacturers.
- Installez le logiciel et ouvrez-le. Ecrire du code pour la commande de moteurs pas à pas dans la configuration souhaitée. Connecter le système à une source pour alimenter le système électronique de façon à ce que les moteurs se déplacent de la manière désirée telle que définie par le chercheur.
REMARQUE: Se reporter au "fichier de code Arduino" supplémentaire.
- Montage avec microfluidique (Solution de larmes artificielles)
- Prenez le globe oculaire synthétisé et des morceaux de la paupière et de les glisser sur leur clip-ons correspondantes pour l'œil-modèle. Branchez le tuyau qui est relié avec une seringue et placée sur la pompe microfluidique avec la pièce de la paupière (section 1.2.5). Test de fonctionner la plate-forme et vérifier pour un mouvement cohérent.
- Premier tube et vérifier un flux constant de solution de larmes artificielles (ATS). La recette de l' ATS a été rapporté précédemment. 16
- déplacer manuellement les pièces de modèle oculaire ensemble sur un plan horizontal, de telle sorte que le globe oculaire et l'oeilcouvercle sont en contact. Régler le débit de la pompe microfluidique aux valeurs souhaitées d'écoulement. Régler les débits physiologiques à 1-1,5 ul / min. 17
- Démarrer la pompe et les actionneurs pour commencer l'expérience. Pour les expériences d'administration de médicaments, placer la lentille de contact contenant un médicament sur la pièce de globe oculaire.
- Laisser le liquide d'écoulement au goutte à goutte dans une plaque de 12 puits. Aux intervalles fixés désirés de temps, de quantifier la concentration d' un analyte ou d'un médicament en utilisant des procédés de détection communs , tels que la spectroscopie de fluorescence ou UV-Vis. 1,4,18
- Pour les études évaluant le dépôt des composants de larmes sur les lentilles de contact, placez la lentille de contact sur le "globe oculaire" morceau. Recueillir le fluide d'écoulement, qui peut être mis au rebut.
- Une fois que les intervalles de temps désirés, retirer la lentille de contact de la pièce de globe oculaire et préparer la lentille pour une analyse ultérieure telle que la microscopie confocale.
Résultats
Les moules oculaires synthétisés obtenus à partir du magasin de machine et de l' impression 3D sont représentés sur la figure 1. Ces moules peuvent être utilisés avec une variété de polymères tels que le PDMS et d' agarose, pour produire des oculaires avec les propriétés souhaitées. L'assemblage fit signe de la plate - forme du modèle d'oeil avec une pompe à seringue microfluidique est représentée sur la figure 2. La plate - forme simule l' usure mécanique par la rotation de la pièce du globe oculaire, et l' exposition à l' air à travers la partie latérale et sortir le mouvement de la pièce paupière. le liquide lacrymal est infusé dans la paupière d'une pompe microfluidique au débit d'écoulement souhaité, et le fluide d'écoulement peut être recueillie dans une plaque à 12 puits.
La procédure pour la dissection d'une lentille de bovin, et le montage sur un oculaire PDMS est représenté sur la figure 3. Les tissus en excès sont séparés de l'oeil et mis au rebut, suivie de l'éliminationde la conjonctive. L'enlèvement de la cornée commence par une incision dans la sclère à proximité du limbe. La figure 4 montre la variété des oculaires qui peuvent être utilisés pour diverses analyses in vitro. Les morceaux de globe oculaire montés indiqués sont synthétisés à partir de PDMS, agar, et un ex-vivo bovine cornée montés sur un globe oculaire pièce PDMS.
La figure 5 représente une étude évaluant la libération d'un antibiotique, la moxifloxacine, du CCRS. 18 Lorsqu'ils sont mesurés dans le modèle de flacon traditionnel, la libération du médicament se produit dans les 2 premières heures suivie d'une phase de plateau. En revanche, le modèle de l' oeil roman montre la libération du médicament à être lente et durable pour un maximum de 24 heures. 18 Une étude évaluant le dépôt de cholestérol sur CCRS est représentée sur la figure 6. Le taux de cholestérol dans l'étude a été fluorescence marqué sous la forme de NBD -cholestérol (7-nitrobenz-2-oxa-1,3-diazole-4-yl-cholestérol) et dépoition a été imagée en utilisant le balayage laser microscopie confocale. Les résultats indiquent qu'il existe des différences importantes lorsque les études de dépôt sont réalisées dans un flacon par rapport au modèle d'oeil.

Figure 1. moules Oculaire. (A) Eyeball pièce de moule de l' atelier d'usinage. (B) Eye couvercle moule de l' impression 3-D. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Une plate - forme oculaire in vitro. (A) Le mouvement circulaire simule l' usure mécanique. (B) un mouvement latéral produit de l' air intermittentexposition. (C) de perfusion dans le liquide lacrymal de la paupière. (D) Collecte plaque de puits. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
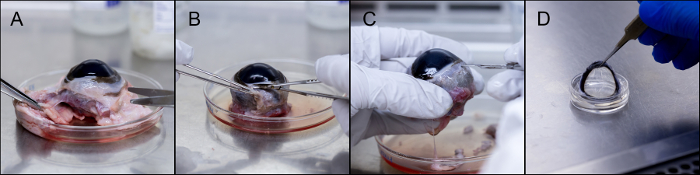
Figure 3. Dissection et l' incorporation de la cornée bovine. (A) Élimination des tissus en excès. (B) Retrait de la conjonctive. (C) Incision dans la région limbique. (D) La cornée excisée peut être stockée ou montée sur une boule d'oeil morceau PDMS. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4. Exemples oculaires. Exemple de pièce d'oeil PDMS avec une lentille de contact, une pièce d'oeil agar, et ex vivo bovin cornée oculaire monté. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Livraison Figure 5. Drug utilisant in vitro plateforme oculaire. La libération de moxifloxacine de quotidiens lentilles de contact jetables de (A) un grand flacon statique de volume et (B) le modèle de l' oeil (Re-print avec la permission de l'Association pour la recherche en vision et Ophtalmologie). 18 Toutes les données sont présentées sous forme de moyenne ± écart - type. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 6. dépôt de cholestérol en utilisant la plate - forme oculaire in vitro. Images confocale montrant une section transversale de étafilcon A, nelfilcon A, nesofilcon A, Ocufilcon B delefilcon A, somofilcon A, narafilcon A après 4 heures d' incubation avec NBD-cholestérol dans le flacon et le modèle de l' oeil. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Il y a trois étapes critiques dans le protocole qui nécessitent une attention particulière: la conception et la production de moules (section 1.1), l'ensemble de la plate-forme (section 2.2.1-2.2.3), et le suivi de l'essai expérimental (section 2.2.4-2.2.7 ). En termes de conception et de production de moules (section 1.1), la pièce de globe oculaire doit être conçu selon les dimensions d'une cornée humaine. Cependant, il peut nécessiter plusieurs prototypes du moule avant une pièce de globe oculaire peut être créé qui correspond parfaitement à une lentille de contact commercial (CL). En outre, les 250 um doit être maintenue lorsque le globe oculaire et la paupière pièce sont en contact pour assurer le liquide lacrymal circule librement à travers le modèle de l'oeil entier lorsque CL est présent. Cette distance peut être modifiée dans les versions futures, mais ne devrait pas être inférieure à 150 um pour permettre suffisamment espacement pour adapter un CL. L'ensemble de la plate-forme (section 2.2.1-2.2.3) nécessite une attention particulière à ce que le globe oculaire et la paupière pièce entrent en contact pendant le mouvement de clignotement. Si les oculaires ne sont pas en contact parfait, alors la simulation d'une paupière fermée et frottement mécanique échoue. L'opérateur doit observer la plate-forme en mouvement pendant quelques cycles pour garantir que tant le globe oculaire et de la paupière sont en contact, et que le frottement se produit comme programmé. La plate-forme actuelle est conçu pour fonctionner en continu sur un mois, mais un opérateur doit toujours vérifier la stabilité du système toutes les 24 heures lors de l'exécution d'une expérience (section 2.2.4-2.2.7). Ceci est important car la plate-forme actuelle ne possède pas un contrôle de la température ou de l'humidité, et les fluctuations de ces paramètres pourrait tarir les CL. Si cela se produit, placer le modèle d'oeil à l'intérieur d'une chambre d'humidité et de température contrôlée. En outre, pour des expériences de délivrance de médicaments, le fluide d'écoulement collecté doit être analysé ou entreposé au moins toutes les 2 heures pour éviter l'évaporation importante de l'échantillon.
Il existe actuellement deux limites de la présentemodèle de l'œil. La première limite est en ce qui concerne l'exposition à l'environnement. Actuellement, parce que les pièces oculaires ne sont pas enfermés dans une chambre contrôlée, des changements tels que la température et l'humidité dans la zone de travail vont influencer divers aspects des expériences. Par exemple, si l'environnement est trop sec, les CLs sèchent plus rapidement et pourraient se séparer de la pièce du globe oculaire, ou le fluide d'écoulement pourraient s'évaporer. Pour résoudre ce problème, les futures itérations abritera le modèle de l'oeil dans une chambre à température et humidité contrôlées. La deuxième limite concerne la pièce complexité du globe oculaire. Actuellement, les oculaires sont simples, consistant en soit PDMS ou agarose, qui ne représente vraiment les propriétés de surface de la cornée. Les travaux futurs viseront à produire des modèles oculaires qui imite de plus près les structures de surface de la cornée.
In vitro la recherche oculaire est généralement considérée comme la phase de test précédent pour la recherche in vivo. cependant,il est important de garder à l' esprit que la recherche in vitro peut également être complémentaire aux données in vivo, en fournissant des renseignements cruciaux qui , autrement , ne peuvent pas être atteints de la seule études in vivo. Malheureusement, le courant des modèles in vitro pour CLs d'essai sont rudimentaires et manque plusieurs éléments clés pour imiter adéquatement l'environnement in vivo. Par exemple, les études in vitro CL sont réalisées dans des fioles contenant 2 à 5 ml de solution saline tamponnée au phosphate, 06.01 qui dépasse largement le volume de déchirement physiologique à 7,0 ± 2 pi. 7 De plus, deux facteurs importants de l'environnement oculaire, le flux lacrymal naturel et le réflexe de clignement, sont absents du modèle flacon statique simple. Les limites du modèle de flacon classique ont été reconnus par les chercheurs, et des tentatives ont été faites pour créer des modèles uniques dans l' oeil in vitro simulant l'environnement oculaire, en incluant un composant de remplissage d'arrachage 2 microfluidique0-24 et / ou exposition à l'air intermittent. 25,26 Sans surprise, les résultats obtenus à partir de ces expériences sont très différentes de celles obtenues avec le modèle de flacon classique, et peut ressembler davantage à des données in vivo. 20-25 Ainsi, le développement d' une complexes dans le modèle de l' oeil in vitro pour examiner CCRS fournir de nouvelles perspectives sur l'interaction des matériaux de lentille avec la surface oculaire, et aider à faciliter le développement de nouveaux matériaux et de nouvelles applications pour NFT dans les décennies à venir.
Sans doute, l' un des aspects les plus controversés du modèle in vitro de l' oeil est de savoir si l'oeil ressemble à un puits infini, ce qui est particulièrement important en ce qui concerne l' administration de médicaments en provenance de CLS. Dans des conditions de puits infini, le volume de la solution environnante est significativement plus élevé que le volume de saturation du médicament, de telle sorte que la libération du médicament ne soit pas affectée par la solubilité du médicament. 27 Les partisans de la fiole en tant que accemodèle oeil ptable soutiennent que la cornée, de la conjonctive, et entourant les tissus oculaires ensemble fonctionnent comme un puits infini. Bien qu'en théorie cela peut être vrai, le médicament doit d'abord se dissoudre dans le liquide lacrymal. Cette étape limitant la vitesse est probablement pas une condition de l'évier, et dépendra à la fois sur le volume et le débit de déchirure que simulée par notre modèle.
L'identité unique du modèle présenté réside dans sa capacité à imiter le film lacrymal. En adoptant une conception en deux parties, une section "cornéen / scléral" du globe oculaire et une "paupière", il est possible de créer une couche mince uniformément répartie du film lacrymal à travers la pièce du globe oculaire lorsque les deux pièces entrent en contact. Pour simuler davantage la surface oculaire, l'usure mécanique et exposition à l'air est incorporé dans le modèle à travers deux actionneurs mécaniques. Comme la pièce la paupière se déplace latéralement, il simule la fermeture de l'œil et de l'exposition de l'air intermittent. La rotation du globe oculaire simule l'usure mécanique produite during clignote. Le système est couplé à une pompe microfluidique, qui insuffle le modèle d'oeil avec le fluide lacrymal à un débit physiologique ou tout autre débit d'écoulement souhaité. Le film lacrymal est formé chaque fois que les deux pièces entrent en contact, et la déchirure rupture se produit lorsque les deux pièces séparées.
Le but est de créer une plate - forme de test universel pour évaluer CLs pour diverses analyses in vitro. Afin d'être polyvalents, les pièces du globe oculaire peuvent être synthétisés à partir de divers polymères, tels que le polydiméthylsiloxane (PDMS) ou d'agar-agar. Pour les études oculaires simples, ces polymères, qui représentent des surfaces hydrophobes et hydrophiles, respectivement, suffisent. Cependant, des analyses plus complexes sont nécessaires, par exemple des études de pénétration oculaire du médicament ou de toxicité, les morceaux oculaires doivent encore être modifié. Ces modifications supplémentaires apportées au modèle, tels que l'inclusion d'une cornée ex vivo , comme indiqué, sont relativement réalisables. Cependant, d'autres études de validationsont nécessaires, et les travaux futurs viseront à améliorer la validité de ce modèle en le comparant avec des modèles in vivo.
Déclarations de divulgation
Les auteurs ont rien à révéler.
Remerciements
Les auteurs tiennent à remercier notre source de financement du CRSNG 20/20 Réseau pour le développement d'Advanced Materials ophtalmiques.
matériels
| Name | Company | Catalog Number | Comments |
| Arduino Uno R3 (Atmega328 - assembled) | Adafruit | 50 | Board |
| Stepper motor | Adafruit | 324 | Motor and Motor shield |
| Equal Leg Coupler 1.6mm 1/16" | VWR | CA11009-280 | 50 pcs of tube connector |
| Tubing PT/SIL 1/16"x1/8" | VWR | 16211-316 | Case of 50feet |
| PDMS | Dow Corning | Sylgard 184 Solar Cell Encapsulation | |
| Agarose, Type 1-A, low EEO | Sigma-Aldrich | A0169-25G | |
| PHD UltraTM | Harvard Apparatus | 703006 | MicroFluidic Pump |
| Bovine cornea | Cargill, Guelph/ON | ||
| Soldidworks | Dassault Systemes | Software | |
| 3-D printing | University of Waterloo - 3D Print Centre | ||
| Dissection tools | Fine Science Tools | General dissection tools | |
| Medium 199 | Sigma-Aldrich | Culture medium storage for cornea | |
| Fetal bovine serum | Thermo Fisher | Add to culture medium, 3% total volume |
Références
- Phan, C. M., Subbaraman, L. N., Jones, L. In vitro drug release of natamycin from beta-cyclodextrin and 2-hydroxypropyl-beta-cyclodextrin-functionalized contact lens materials. J Biomater Sci Polym Ed. 25, 1907-1919 (2014).
- Peng, C. C., Kim, J., Chauhan, A. Extended delivery of hydrophilic drugs from silicone-hydrogel contact lenses containing vitamin E diffusion barriers. Biomaterials. 31, 4032-4047 (2010).
- Hui, A., Willcox, M., Jones, L. In vitro and in vivo evaluation of novel ciprofloxacin-releasing silicone hydrogel contact lenses. Invest Ophthalmol Vis Sci. 55, 4896-4904 (2014).
- Boone, A., Hui, A., Jones, L. Uptake and release of dexamethasone phosphate from silicone hydrogel and group I, II, and IV hydrogel contact lenses. Eye Contact Lens. 35, 260-267 (2009).
- Lorentz, H., Heynen, M., Trieu, D., Hagedorn, S. J., Jones, L. The impact of tear film components on in vitro lipid uptake. Optom Vis Sci. 89, 856-867 (2012).
- Hall, B., Phan, C. M., Subbaraman, L., Jones, L. W., Forrest, J. Extraction versus in situ techniques for measuring surface-adsorbed lysozyme. Optom Vis Sci. 91, 1062-1070 (2014).
- Mishima, S., Gasset, A., Klyce, S. D., Baum, J. L. Determination of tear volume and tear flow. Invest Ophthalmol Vis Sci. 5, 264-276 (1966).
- Nichols, J. J., et al. The TFOS international workshop on contact lens discomfort: executive summary. Invest Ophthalmol Vis Sci. 54, 7-13 (2013).
- Peng, C. C., Burke, M. T., Carbia, B. E., Plummer, C., Chauhan, A. Extended drug delivery by contact lenses for glaucoma therapy. J Control Release. 162, 152-158 (2012).
- Faschinger, C., Mossbock, G. Continuous 24 h monitoring of changes in intraocular pressure with the wireless contact lens sensor Triggerfish. First results in patients. Der Ophthalmologe : Zeitschrift der Deutschen Ophthalmologischen Gesellschaft. 107, 918-922 (2010).
- Shaw, A. J., Davis, B. A., Collins, M. J., Carney, L. G. A technique to measure eyelid pressure using piezoresistive sensors. IEEE transactions on bio-medical engineering. 56, 2512-2517 (2009).
- Liao, Y. T., Yao, H. F., Lingley, A., Parviz, B., Otis, B. P. A 3-mu W CMOS glucose sensor for wireless contact-lens tear glucose monitoring. Ieee J Solid-St Circ. 47, 335-344 (2012).
- Coster, D. J. . Cornea. , (2002).
- Parekh, M., et al. A simplified technique for in situ excision of cornea and evisceration of retinal tissue from human ocular globe. Journal of visualized experiments : JoVE. , e3765 (2012).
- Way, S. Gear and pinion. US patent. , (1942).
- Lorentz, H., et al. Contact lens physical properties and lipid deposition in a novel characterized artificial tear solution. Molecular vision. 17, 3392-3405 (2011).
- Furukawa, R. E., Polse, K. A. Changes in tear flow accompanying aging. American journal of optometry and physiological optics. 55, 69-74 (1978).
- Bajgrowicz, M., Phan, C. M., Subbaraman, L., Jones, L. Release of ciprofloxacin and moxifloxacin from daily disposable contact lenses from an in vitro eye model. Invest Ophthalmol Vis Sci. , (2015).
- Luensmann, D., Zhang, F., Subbaraman, L., Sheardown, H., Jones, L. Localization of lysozyme sorption to conventional and silicone hydrogel contact lenses using confocal microscopy. Current eye research. 34, 683-697 (2009).
- Tieppo, A., Pate, K. M., Byrne, M. E. In vitro controlled release of an anti-inflammatory from daily disposable therapeutic contact lenses under physiological ocular tear flow. Eur J Pharm Biopharm. 81, 170-177 (2012).
- Ali, M., et al. Zero-order therapeutic release from imprinted hydrogel contact lenses within in vitro physiological ocular tear flow. J Control Release. 124, 154-162 (2007).
- White, C. J., McBride, M. K., Pate, K. M., Tieppo, A., Byrne, M. E. Extended release of high molecular weight hydroxypropyl methylcellulose from molecularly imprinted, extended wear silicone hydrogel contact lenses. Biomaterials. 32, 5698-5705 (2011).
- Kaczmarek, J. C., Tieppo, A., White, C. J., Byrne, M. E. Adjusting biomaterial composition to achieve controlled multiple-day release of dexamethasone from an extended-wear silicone hydrogel contact lens. J Biomater Sci Polym Ed. 25, 88-100 (2014).
- Mohammadi, S., Postnikoff, C., Wright, A. M., Gorbet, M. Design and development of an in vitro tear replenishment system. Ann Biomed Eng. 42, 1923-1931 (2014).
- Lorentz, H., Heynen, M., Khan, W., Trieu, D., Jones, L. The impact of intermittent air exposure on lipid deposition. Optom Vis Sci. 89, 1574-1581 (2012).
- Peng, C. C., Fajardo, N. P., Razunguzwa, T., Radke, C. J. In vitro spoilation of silicone-hydrogel soft contact lenses in a model-blink cell. Optom Vis Sci. 92, 768-780 (2015).
- Liu, P., et al. Dissolution studies of poorly soluble drug nanosuspensions in non-sink conditions. AAPS PharmSciTech. 14, 748-756 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon