Method Article
Desarrollo de una
En este artículo
Resumen
Los modelos actuales in vitro para la evaluación de las lentes de contacto (CLS) y otras aplicaciones relacionadas con el ojo son muy limitadas. La plataforma ocular presentado simula fisiológica flujo lagrimal, volumen de lágrimas, la exposición al aire y el desgaste mecánico. Este sistema es muy versátil y se puede aplicar a diversos análisis in vitro con CLS.
Resumen
Currently, in vitro evaluations of contact lenses (CLs) for drug delivery are typically performed in large volume vials,1-6 which fail to mimic physiological tear volumes.7 The traditional model also lacks the natural tear flow component and the blinking reflex, both of which are defining factors of the ocular environment. The development of a novel model is described in this study, which consists of a unique 2-piece design, eyeball and eyelid piece, capable of mimicking physiological tear volume. The models are created from 3-D printed molds (Polytetrafluoroethylene or Teflon molds), which can be used to generate eye models from various polymers, such as polydimethylsiloxane (PDMS) and agar. Further modifications to the eye pieces, such as the integration of an explanted human or animal cornea or human corneal construct, will permit for more complex in vitro ocular studies. A commercial microfluidic syringe pump is integrated with the platform to emulate physiological tear secretion. Air exposure and mechanical wear are achieved using two mechanical actuators, of which one moves the eyelid piece laterally, and the other moves the eyeballeyepiece circularly. The model has been used to evaluate CLs for drug delivery and deposition of tear components on CLs.
Introducción
Dos importantes áreas de interés dentro de la arena de lentes de contacto (CL) incluyen malestar y el desarrollo de nuevas aplicaciones CL. Elucidar los mecanismos subyacentes CL malestar es un tema que ha eludido el campo durante décadas. 8 El desarrollo de la novela, CL funcionales, tales como dispositivos de liberación de fármacos 1,3,9 y biosensores, 10-12 es un área de creciente interés, con los mercados potenciales sustanciales. En ambas circunstancias, un sofisticado modelo in vitro podría proporcionar información relevante para ayudar en la selección de materiales de lentes o características de diseño apropiado durante la fase de desarrollo. Por desgracia, la corriente en modelos in vitro para la evaluación de las NFT y otras aplicaciones relacionadas con el ojo son relativamente crudo y poco sofisticado. Tradicionalmente, se llevan a cabo en los estudios in vitro que evalúan CL deposición de la película lagrimal o la administración de fármacos en viales de volumen estáticas, grandes que contienen un volumen de fluido fijo, que GREAtly excede cantidades fisiológicas. Además, este modelo simple no tiene la componente de flujo de lágrima natural y el reflejo del parpadeo, ambos de los cuales son la definición de factores del entorno ocular.
El desarrollo de un "modelo" sofisticado, fisiológicamente relevante ojo requerirá un enfoque multidisciplinar y requieren sustancial en la validación in vivo. Por estas razones, el marco fundamental para nuestro modelo de ojo in vitro es altamente versátil, de tal manera que el modelo puede ser mejorado continuamente a través de las actualizaciones futuras y modulaciones. Hasta la fecha, el modelo es capaz de simular el volumen de lágrimas, el flujo de lágrimas, desgaste mecánico y la exposición al aire. El objetivo es crear un modelo in vitro que proporcionará resultados significativos, que es predictivo y conexión a in vivo y ex vivo observaciones.
Protocolo
Todos los experimentos se realizaron de acuerdo y cumpliendo con todas las directrices pertinentes señalados por la Universidad de Waterloo comité de ética de la investigación con animales. Los ojos bovinos son donados generosamente de un matadero local.
1. Modelo de ojos
- Diseño y producción de moldes 13
- Diseño de los modelos de ojo de acuerdo con las dimensiones fisiológicas promedio de los ojos humanos adultos. 13
- Deje un espacio de 250 m entre el globo ocular y el párpado las piezas del modelo de ojo. Diseñar los moldes respectivos utilizando el software de diseño (CAD) asistido por ordenador.
- Crear nuevo archivo o archivo .cad .sldprt con AutoCAD o SolidWorks. Crear modelos 3D del globo ocular / párpado humano. Crear moldes de los modelos y guardar los moldes como archivos .stl.
- Importar archivos .stl en el software de la impresora 3D (por ejemplo, para makeware replicator2). Especificar parámetros de la impresión (ubicación, poca densidad, escala, orientación, suavidad, etc. ) 13.
- Guarde el archivo como archivo de código G para las impresoras 3D para leer. Seleccionar materiales tales como PLA (ácido poliláctico), ABS (acrilonitrilo butadieno estireno), PC (policarbonato), o una combinación de los mismos, para imprimir los moldes 13.
- Instalar filamento deseada del material de elección. Importe el archivo de código G en la impresora 3D para leer. Imprimir el molde.
NOTA: Como alternativa, producir los moldes de los ojos utilizando un numérico por computadora (CNC) de la máquina controlada, si se desea una superficie más lisa en el modelo de ojo. Para la producción de moldes CNC, los materiales para moldes ya no se limitan a los plásticos térmicos, sino que se extienden a metal, cerámica, y polímeros químicamente resistentes tal como politetrafluoroetileno. - Abra la interfaz de software CNC que está conectado a un taladro de corte. La construcción de moldes en 3D de acuerdo con la parte frontal, superior, lateral y vistas en perspectiva de los moldes modelo globo ocular / párpado construidos previamente en la interfaz del software de control. Seleccione los parámetros adecuados para lamecanizado (tamaño de la broca, material de sustrato, el espesor del material) y proceder a cortar el molde.
- Síntesis de Oculares Uso de PDMS
- Usando una jeringa, mida 10 ml de volumen de PDMS base (polidimetilsiloxano) y llenarlo en un tubo de centrífuga de 15-50 ml. Añadir 10% w / v de la solución de elastómero en peso total de PDMS. Usando una varilla de agitación, mezclar bien las soluciones.
- Se vierte la solución de PDMS en los moldes del globo ocular y el párpado. Permitir que el PDMS se asienten a TA S / N (o por lo menos durante 12 horas) para iniciar la polimerización y para permitir que las burbujas se disuelven fuera del polímero.
NOTA: Asegúrese de que no hay burbujas que quedan en el PDMS que podrían aumentar o ampliar. - Posteriormente, colocar los moldes en un horno de 75 ° C (167 ° F) durante 1 hora, o 150 ° C (302 ° F) durante 5 min. Para un gel suave, permiten el PDMS se sientan a temperatura ambiente durante al menos 48 horas para polimerizar por completo.
- Poner las muestras en un congelador durante unos minutos; esto va a reducir el tamaño de PDMS y simplificarla eliminación de las muestras de los moldes. Extraer los oculares de los moldes utilizando una espátula fina.
- Para la entrega de la solución en el espacio entre el globo ocular y el párpado piezas, conectar un tubo de politetrafluoroetileno 1/16 "x 1/8" con un conector de tubo acoplador igual pierna 1/16 "y adjuntarlo a la pieza del párpado en el agujero de la tubería .
- Síntesis del globo del ojo de pieza utilizando agarosa
NOTA: La pieza globo ocular se puede sintetizar utilizando otros polímeros tales como agarosa. El siguiente procedimiento también puede ser modificado para producir piezas de ojo de una variedad de tipos de agar, tales como PDA (patata dextrosa agar) o SDA (Sabouraud dextrosa agar).- Para producir un gel 2% (2 g / 100 ml), medida 2 g de agarosa y se mezcla con 100 ml de agua ultrapura. Se lleva la solución a ebullición (100 ºC) tal que la agarosa se disuelva completamente. Deje que la solución se enfríe durante 5 min.
- Verter la solución en el molde globo ocular y permita que la solución se enfríe durante 30 min a TA. Retire las piezas del globo ocular con una espátula. Almacenar el agar globo ocular en un -20 ° C congelador para su uso posterior. Para los estudios de microbiología, esterilizar los moldes globo del ojo por tratamiento en autoclave y / o UV-irradiación.
- La incorporación de bovino Córnea en PDMS del globo del ojo
NOTA:. Este protocolo ha sido adaptado de Parekh et al 14- Realizar la disección y la incorporación de las córneas de bovino en condiciones estériles en una campana de flujo laminar. Adquirir los ojos y diseccionar ellos en el mismo día.
- Girar la campana de flujo por 10 min antes de su uso y desinfectar con alcohol etanol 70%. Asegúrese de que todos los materiales e instrumentos son estériles en autoclave a 273 ° F / 133 ° C durante 45 minutos, y se posicionan no menos de 4 pulgadas de la campana de flujo de entrada.
- Sumergir el ojo bovina en un vaso de precipitados que contiene una solución de povidona yodada diluida para 2 min. Enjuague el ojo en un vaso de precipitados que contiene solución salina tamponada con fosfato (PBS) pH 7,4. Utilizando unas pinzas colocan suavemente el ojo en una placa de Petri de vidrio, la cara de la córnea hacia arriba.
- Eliminar el exceso de músculo y tejido graso por el corte en los puntos de fijación escleral con tijeras de disección extremo romo. Desechar el exceso de tejido en un vaso estéril designada por los residuos animales.
- El uso de micro-tijeras, retirar la conjuntiva del ojo. Envolver el ojo con una gasa estéril, manteniendo una distancia de al menos 1 cm desde el limbo.
- El uso de un escalpelo, incisión de la esclerótica de aproximadamente 2 mm de la región de limbo y superficialmente con el fin de evitar la penetración de la coroides subyacente y el cuerpo vítreo. Extienda cuidadosamente la incisión de 360 ° con un bisturí o unas tijeras de disección sin deformar la córnea de su curvatura natural.
- Con unas pinzas finas, eliminar la córnea del ojo. Con unas pinzas, retire con cuidado cualquier tejido uveal adherirse córnea y enjuague con PBS.
- Almacenar la córnea a 31ºC en un recipiente estéril con la culturamedio (tal como el medio 199) que contiene 3% de suero bovino fetal para mantener la humedad del tejido y la nutrición celular.
- Antes de la experimentación, descansar la córnea extirpada en el globo ocular PDMS, y la abrazadera de las dos piezas juntas con un clip especializada.
2. Blink-plataforma
- Diseño y Producción de la Blink-plataforma
NOTA: El parpadeo de la plataforma se compone de tres partes funcionales: modelo de ojo (descrito en el apartado 1), sistema de engranajes, y el sistema electrónico.- Diseño y fabricación de la plataforma usando un abrir y cerrar de CAD y la impresión en 3D, de forma similar a la descrita en el modelo de ojo (sección 1.1). Diseñar el sistema de engranajes de tal manera que se traduce simple rotación de los motores en los movimientos laterales y de rotación de los oculares. 15
- Usando el piñón y el mecanismo de engranaje, traducir el movimiento de rotación de un motor paso a paso en el movimiento lateral de un piñón, que está conectado a las piezas de los párpados.
- Utilizando elsistema de engranaje conjugado, amplificar un movimiento de rotación de un motor paso a paso en tres (o más) movimientos de rotación de tres piezas diferentes del globo ocular.
- Alinear los dos sistemas de engranajes, uno para el párpado y uno para globo ocular, de modo que la distancia entre los dos son constantes. Montar el sistema electrónico con un microcontrolador, el blindaje del motor, y dos motores.
NOTA: Utiliza dos motores paso a paso para proporcionar los motores de rotación, lo que se traduce por el sistema de engranajes en un movimiento intermitente. - Conectar los dos motores paso a paso con un sistema que consiste en un protector del motor de apilado en el microcontrolador. Conectar y configurar los componentes electrónicos para trabajar con productos de software de código abierto.
- Programar el sistema para controlar los parámetros del motor tales como disparos por minuto (RPM), el número de rondas hacia adelante, hacia atrás número de rondas, y el estilo de girar.
NOTA: Consulte el "archivo de código Arduino" suplementaria para los detalles. - Descargar el software del sistema de la mafabrican- página web.
- Instalar el software y abrirlo. Escribir el código para el control de motores paso a paso en la configuración deseada. Conectar el sistema con una fuente para alimentar el sistema electrónico, de modo que los motores se mueven en la forma deseada tal como se define por el investigador.
NOTA: Consulte el "archivo de código Arduino" complementario.
- Asamblea con la microfluídica (solución de lágrimas artificiales)
- Tome el globo ocular sintetizado y piezas del párpado y el deslizamiento en sus correspondientes clip-ons para el ojo-modelo. Conectar el tubo que se une con una jeringa y se coloca en la bomba de microfluidos con la pieza de párpados (sección 1.2.5). Prueba de funcionamiento de la plataforma y comprobar si hay movimiento constante.
- El primer tubo y comprobar si hay un flujo constante de solución de lágrimas artificiales (ATS). La receta para el ATS se ha informado anteriormente. 16
- mover manualmente las partes del ojo-modelo juntos en un nivel plano, de manera que el globo ocular y el ojotapa están en contacto. Ajuste el caudal de la bomba de microfluidos a los valores deseados. Fijar las tasas de flujo fisiológico de 1-1,5 l / min. 17
- Arrancar la bomba y los actuadores para comenzar el experimento. Para los experimentos de liberación de fármacos, colocar la lente de contacto que contiene el fármaco en la pieza globo ocular.
- Deje que el flujo de fluido a través de goteo en una placa de 12 pocillos. En los intervalos de tiempo de ajuste deseado, cuantificar la concentración de analito o fármaco usando métodos de detección comunes, tales como espectroscopía de UV-Vis o fluorescencia. 1,4,18
- Para los estudios que evalúan la deposición de componentes de la lágrima en lentes de contacto, coloque la lente de contacto en la pieza "a ojo". Recoger el fluido de flujo a través, que puede ser desechado.
- Después de los intervalos de tiempo deseados, retirar la lente de contacto de la pieza de globo ocular y preparar la lente para su posterior análisis como la microscopía confocal.
Resultados
Los moldes ojo sintetizados obtenidos a partir de la tienda de la máquina y de la impresión 3-D se muestran en la Figura 1. Estos moldes se pueden utilizar con una variedad de polímeros, tales como PDMS y agarosa, para producir los oculares con las propiedades deseadas. El conjunto de señas de la plataforma de modelo de ojo con una bomba de jeringa de microfluidos se muestra en la Figura 2. La plataforma simula el desgaste mecánico a través de la rotación de la pieza de globo ocular, y la exposición al aire a través del lateral de entrada y salida de movimiento de la pieza de párpados. líquido lagrimal se infunde en el párpado desde una bomba de microfluidos en el caudal deseado, y el fluido de flujo a través se puede recoger en una placa de 12 pocillos.
El procedimiento para la disección de una lente de bovino, y el montaje en un ocular de PDMS se representa en la Figura 3. El exceso de tejidos se separan del ojo y se descartan, seguido por la eliminaciónde la conjuntiva. La eliminación de la córnea comienza con una incisión en la esclerótica cerca del limbo. La Figura 4 muestra la variedad de oculares que podría ser utilizado para diversos análisis in vitro. Las piezas del globo ocular montados mostrados son sintetizados a partir de PDMS, agar, y una córnea bovina ex-vivo montados en una pieza globo ocular PDMS.
La Figura 5 representa un estudio de evaluación de la liberación de un antibiótico, moxifloxacina, de Cs. 18 Cuando se mide en el modelo vial tradicional, la liberación del fármaco se produce dentro de la primera 2 h seguido por una fase de meseta. Por el contrario, el nuevo modelo de ojo muestra la liberación del fármaco a ser lento y sostenible durante un máximo de 24 h. 18 Un estudio de evaluación de la deposición de colesterol en la CL se muestra en la Figura 6. El colesterol en el estudio fue etiquetado con fluorescencia en forma de NBD -colesterol (7-nitrobenz-2-oxa-1,3-diazol-4-il-colesterol), y DEPOSition fue fotografiada usando escaneo láser microscopía confocal. Los resultados indican que existen diferencias sustanciales cuando se llevan a cabo los estudios de deposición en un vial en comparación con el modelo de ojo.

Figura 1. Los moldes ocular. (A) del globo del ojo pieza de molde de taller de máquinas. (B) del ojo del molde de la tapa de impresión 3-D. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Una plataforma ocular in vitro. (A) El movimiento circular simula el desgaste mecánico. (B) el movimiento lateral produce aire intermitenteexposición. (C) de infusión de líquido lacrimógeno dentro del párpado. (D) El cobro de la placa también. Haga clic aquí para ver una versión más grande de esta figura.
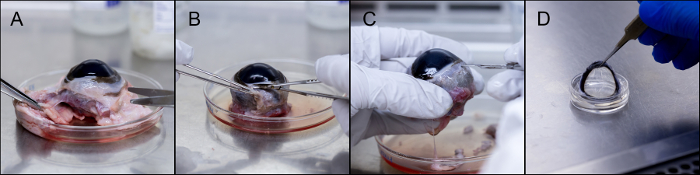
Figura 3. La disección y la incorporación de córnea bovina. (A) La eliminación del exceso de tejido. (B) La eliminación de la conjuntiva. (C) de la incisión en la región limbo. (D) La córnea puede ser extirpado almacena o se monta en un pedazo bola del ojo PDMS. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Muestra oculares. Muestra de ocular PDMS con una lente de contacto, una pieza ocular agar, y ex vivo córnea bovina ocular montado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. El suministro de fármacos in vitro usando la plataforma ocular en. La liberación de moxifloxacina de lentes de contacto desechables diarias a partir de (A) un gran volumen vial estática y (B) el modelo de ojo (Re-imprimir con permiso de la Asociación para la Investigación en Visión y Oftalmología). 18 Todos los datos se presentan como media ± desviación estándar. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 6. deposición de colesterol utilizando la plataforma ocular in vitro. Las imágenes confocales muestran una sección transversal de etafilcon A, nelfilcon A, nesofilcon A, B ocufilcón, delefilcon A, somofilcon A, Narafilcon A después de 4 h de incubación con NBD-colesterol en el vial y modelo de ojo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Hay tres pasos críticos dentro del protocolo que requieren una atención especial: diseño y producción de moldes (sección 1.1), conjunto de plataforma (sección 2.2.1-2.2.3), y el seguimiento de la ejecución experimental (sección 2.2.4-2.2.7 ). En términos del diseño y la producción de moldes (sección 1.1), la pieza de globo ocular debe ser diseñado de acuerdo con las dimensiones de una córnea humana. Sin embargo, se puede requerir múltiples prototipos del molde antes de una pieza globo ocular puede ser creado que se ajusta perfectamente una lente de contacto comercial (CL). Además, las 250 micras debe mantenerse cuando el globo ocular y el párpado pieza están en contacto para asegurar el fluido lagrimal fluye suavemente a través de todo el modelo de ojo cuando un CL está presente. Esta distancia podría ser cambiado en futuras versiones, pero no debe ser inferior a 150 micras para permitir la suficiente separación para adaptarse a una CL. El conjunto de plataforma (sección 2.2.1-2.2.3) requiere una cuidadosa atención de tal manera que el globo ocular y el párpado pieza entran en contact durante el movimiento de abrir y cerrar. Si los oculares no están en contacto perfecto, entonces simulación de un párpado cerrado y fricción mecánica falla. El operador debe observar la plataforma en movimiento durante algunos ciclos para asegurar que tanto el globo ocular y el párpado están en contacto, y que roce se produce según lo programado. La plataforma actual está diseñado para funcionar continuamente durante un mes, pero un operador siempre debe comprobar la estabilidad del sistema cada 24 horas cuando se ejecuta un experimento (sección 2.2.4-2.2.7). Esto es importante ya que la plataforma actual no posee un control de temperatura o humedad, y las fluctuaciones en estos parámetros podría secarse el CLS. Si esto ocurre, coloque el modelo de ojo en una cámara de humedad y temperatura controlada. Además, para los experimentos de administración de fármacos, el fluido de flujo a través recogido debe ser analizado o almacena al menos cada 2 horas para evitar la evaporación significativa de la muestra.
Actualmente existen dos limitaciones de la presentadamodelo de ojo. La primera limitación es en lo que respecta a la exposición al ambiente circundante. Actualmente, debido a que las piezas de ojo no están encerrados en una cámara controlada, cambios tales como la temperatura y la humedad en el área de trabajo influirán en varios aspectos de los experimentos. Por ejemplo, si el ambiente es demasiado seco, a continuación, el CLS se secan más rápido y podrían separarse de la pieza globo ocular, o el fluido de flujo continuo podrían evaporarse. Para abordar este problema, las futuras iteraciones albergarán el modelo de ojo en una cámara de temperatura y humedad controladas. La segunda limitación se refiere a la pieza complejidad globo ocular. En la actualidad, los oculares son simples, consistentes en PDMS o agarosa, ninguno de los cuales representa verdaderamente propiedades de la superficie de la córnea. El trabajo futuro se tratará de producir modelos de ojo que imita a estrechar las estructuras de la superficie de la córnea.
In vitro la investigación ocular es generalmente visto como la fase de prueba que precede a la investigación in vivo. Sin embargo,es importante tener en cuenta que la investigación in vitro también puede ser complementario a los datos in vivo, proporcionando una perspectiva crítica que de otra manera no se puede lograr a partir de estudios in vivo solo. Lamentablemente, la corriente de modelos in vitro CLS pruebas son rudimentarios y carecen de varios componentes clave para imitar adecuadamente el ambiente in vivo. Por ejemplo, en estudios in vitro CL se llevan a cabo en viales que contienen 2-5 ml de solución salina tamponada con fosfato, 1-6 que excede en gran medida el volumen de lágrimas fisiológica a 7,0 ± 2 l. 7 Por otra parte, dos factores importantes del entorno ocular, el flujo natural de lágrimas y el reflejo del parpadeo, están ausentes en el modelo simple vial estática. Las limitaciones del modelo vial convencional han sido reconocidos por los investigadores, y se han hecho intentos para crear único en modelos de ojo vitro que simulan el entorno ocular, mediante la inclusión de un componente de reposición lágrima microfluidos 20-24 y / o la exposición al aire intermitente 25,26. No es sorprendente que los resultados generados a partir de estos experimentos son muy diferentes que los obtenidos con el modelo vial convencional, y puede parecerse más a los datos in vivo. 20-25 Por lo tanto, el desarrollo de una intrincados en el modelo de ojo vitro para examinar CLS proporcionar nuevos conocimientos sobre la interacción de los materiales de la lente con la superficie ocular, y ayudar a facilitar el desarrollo de nuevos materiales y nuevas aplicaciones para NFT en las próximas décadas.
Podría decirse que uno de los aspectos más debatidos del modelo de ojo in vitro es si el ojo se asemeja a un sumidero infinito, lo cual es especialmente importante cuando se trata de la administración de fármacos a partir de Cs. En condiciones de inmersión infinitas, el volumen de la solución circundante es significativamente mayor que el volumen de saturación de drogas, de manera que la liberación del fármaco no se ve afectada por la solubilidad de la droga. 27 Los defensores del vial como un accemodelo de ojo ptable argumentan que la córnea, la conjuntiva, y los tejidos circundantes oculares juntos funcionan como un sumidero infinito. Aunque en teoría esto puede ser cierto, el fármaco debe disolverse en primer lugar en el fluido lagrimal. Este paso limitante de la velocidad probable es que no es una condición fregadero, y dependerá de tanto volumen de lágrimas y el flujo como simulado por nuestro modelo.
La identidad única del modelo presentado reside en su capacidad para emular la película lagrimal. Al adoptar un diseño de dos piezas, una sección globo ocular "de la córnea / esclerótica" y un "párpado", es posible crear una capa delgada uniformemente repartidas de la película lagrimal a través de la pieza globo ocular cuando ambas piezas entran en contacto. Para simular aún más la superficie ocular, el desgaste mecánico y la exposición al aire se incorpora en el modelo a través de dos actuadores mecánicos. Como la pieza párpado se desplaza lateralmente, que simula el cierre del ojo y la exposición al aire intermitente. La rotación del globo ocular simula el desgaste mecánico producido during parpadear. El sistema está acoplado con una bomba de microfluidos, que infunde el modelo de ojo con el fluido lagrimal, a un caudal fisiológica o cualquier otra velocidad de flujo deseada. La película lagrimal se forma cada vez que las dos piezas se ponen en contacto, y la rotura lagrimal se produce cuando las dos piezas separadas.
El objetivo es crear una plataforma universal de ensayos para evaluar CLs para diversos análisis in vitro. Con el fin de ser versátil, las piezas del globo ocular se pueden sintetizar a partir de diversos polímeros, tales como polidimetilsiloxano (PDMS) o agar. Para los estudios oculares simples, estos polímeros, que representan superficies hidrófobas e hidrófilas, respectivamente, serán suficientes. Sin embargo, ya que se requieren análisis más complejos, por ejemplo, estudios de penetración de fármacos oculares o de toxicidad, tendrá que ser modificado aún más las piezas de ojo. Estas modificaciones adicionales al modelo, como la inclusión de una córnea ex vivo como se muestra, son relativamente factible. Sin embargo, estudios adicionales de validaciónse requiere, y el trabajo futuro tendrá como objetivo mejorar la validez de este modelo comparándolo con modelos in vivo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean reconocer nuestra fuente de financiación CRSNG 20/20 Red para el Desarrollo de Materiales Avanzados oftálmicos.
Materiales
| Name | Company | Catalog Number | Comments |
| Arduino Uno R3 (Atmega328 - assembled) | Adafruit | 50 | Board |
| Stepper motor | Adafruit | 324 | Motor and Motor shield |
| Equal Leg Coupler 1.6mm 1/16" | VWR | CA11009-280 | 50 pcs of tube connector |
| Tubing PT/SIL 1/16"x1/8" | VWR | 16211-316 | Case of 50feet |
| PDMS | Dow Corning | Sylgard 184 Solar Cell Encapsulation | |
| Agarose, Type 1-A, low EEO | Sigma-Aldrich | A0169-25G | |
| PHD UltraTM | Harvard Apparatus | 703006 | MicroFluidic Pump |
| Bovine cornea | Cargill, Guelph/ON | ||
| Soldidworks | Dassault Systemes | Software | |
| 3-D printing | University of Waterloo - 3D Print Centre | ||
| Dissection tools | Fine Science Tools | General dissection tools | |
| Medium 199 | Sigma-Aldrich | Culture medium storage for cornea | |
| Fetal bovine serum | Thermo Fisher | Add to culture medium, 3% total volume |
Referencias
- Phan, C. M., Subbaraman, L. N., Jones, L. In vitro drug release of natamycin from beta-cyclodextrin and 2-hydroxypropyl-beta-cyclodextrin-functionalized contact lens materials. J Biomater Sci Polym Ed. 25, 1907-1919 (2014).
- Peng, C. C., Kim, J., Chauhan, A. Extended delivery of hydrophilic drugs from silicone-hydrogel contact lenses containing vitamin E diffusion barriers. Biomaterials. 31, 4032-4047 (2010).
- Hui, A., Willcox, M., Jones, L. In vitro and in vivo evaluation of novel ciprofloxacin-releasing silicone hydrogel contact lenses. Invest Ophthalmol Vis Sci. 55, 4896-4904 (2014).
- Boone, A., Hui, A., Jones, L. Uptake and release of dexamethasone phosphate from silicone hydrogel and group I, II, and IV hydrogel contact lenses. Eye Contact Lens. 35, 260-267 (2009).
- Lorentz, H., Heynen, M., Trieu, D., Hagedorn, S. J., Jones, L. The impact of tear film components on in vitro lipid uptake. Optom Vis Sci. 89, 856-867 (2012).
- Hall, B., Phan, C. M., Subbaraman, L., Jones, L. W., Forrest, J. Extraction versus in situ techniques for measuring surface-adsorbed lysozyme. Optom Vis Sci. 91, 1062-1070 (2014).
- Mishima, S., Gasset, A., Klyce, S. D., Baum, J. L. Determination of tear volume and tear flow. Invest Ophthalmol Vis Sci. 5, 264-276 (1966).
- Nichols, J. J., et al. The TFOS international workshop on contact lens discomfort: executive summary. Invest Ophthalmol Vis Sci. 54, 7-13 (2013).
- Peng, C. C., Burke, M. T., Carbia, B. E., Plummer, C., Chauhan, A. Extended drug delivery by contact lenses for glaucoma therapy. J Control Release. 162, 152-158 (2012).
- Faschinger, C., Mossbock, G. Continuous 24 h monitoring of changes in intraocular pressure with the wireless contact lens sensor Triggerfish. First results in patients. Der Ophthalmologe : Zeitschrift der Deutschen Ophthalmologischen Gesellschaft. 107, 918-922 (2010).
- Shaw, A. J., Davis, B. A., Collins, M. J., Carney, L. G. A technique to measure eyelid pressure using piezoresistive sensors. IEEE transactions on bio-medical engineering. 56, 2512-2517 (2009).
- Liao, Y. T., Yao, H. F., Lingley, A., Parviz, B., Otis, B. P. A 3-mu W CMOS glucose sensor for wireless contact-lens tear glucose monitoring. Ieee J Solid-St Circ. 47, 335-344 (2012).
- Coster, D. J. . Cornea. , (2002).
- Parekh, M., et al. A simplified technique for in situ excision of cornea and evisceration of retinal tissue from human ocular globe. Journal of visualized experiments : JoVE. , e3765 (2012).
- Way, S. Gear and pinion. US patent. , (1942).
- Lorentz, H., et al. Contact lens physical properties and lipid deposition in a novel characterized artificial tear solution. Molecular vision. 17, 3392-3405 (2011).
- Furukawa, R. E., Polse, K. A. Changes in tear flow accompanying aging. American journal of optometry and physiological optics. 55, 69-74 (1978).
- Bajgrowicz, M., Phan, C. M., Subbaraman, L., Jones, L. Release of ciprofloxacin and moxifloxacin from daily disposable contact lenses from an in vitro eye model. Invest Ophthalmol Vis Sci. , (2015).
- Luensmann, D., Zhang, F., Subbaraman, L., Sheardown, H., Jones, L. Localization of lysozyme sorption to conventional and silicone hydrogel contact lenses using confocal microscopy. Current eye research. 34, 683-697 (2009).
- Tieppo, A., Pate, K. M., Byrne, M. E. In vitro controlled release of an anti-inflammatory from daily disposable therapeutic contact lenses under physiological ocular tear flow. Eur J Pharm Biopharm. 81, 170-177 (2012).
- Ali, M., et al. Zero-order therapeutic release from imprinted hydrogel contact lenses within in vitro physiological ocular tear flow. J Control Release. 124, 154-162 (2007).
- White, C. J., McBride, M. K., Pate, K. M., Tieppo, A., Byrne, M. E. Extended release of high molecular weight hydroxypropyl methylcellulose from molecularly imprinted, extended wear silicone hydrogel contact lenses. Biomaterials. 32, 5698-5705 (2011).
- Kaczmarek, J. C., Tieppo, A., White, C. J., Byrne, M. E. Adjusting biomaterial composition to achieve controlled multiple-day release of dexamethasone from an extended-wear silicone hydrogel contact lens. J Biomater Sci Polym Ed. 25, 88-100 (2014).
- Mohammadi, S., Postnikoff, C., Wright, A. M., Gorbet, M. Design and development of an in vitro tear replenishment system. Ann Biomed Eng. 42, 1923-1931 (2014).
- Lorentz, H., Heynen, M., Khan, W., Trieu, D., Jones, L. The impact of intermittent air exposure on lipid deposition. Optom Vis Sci. 89, 1574-1581 (2012).
- Peng, C. C., Fajardo, N. P., Razunguzwa, T., Radke, C. J. In vitro spoilation of silicone-hydrogel soft contact lenses in a model-blink cell. Optom Vis Sci. 92, 768-780 (2015).
- Liu, P., et al. Dissolution studies of poorly soluble drug nanosuspensions in non-sink conditions. AAPS PharmSciTech. 14, 748-756 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados