Method Article
Gastroscopie peropératoire pour Tumor Localization en chirurgie laparoscopique pour adénocarcinome gastrique
Dans cet article
Résumé
In early gastric cancer, the aim of surgery is to precisely remove the distal stomach including the primary tumor. To do this, accurate localization of the tumor is crucial, especially in totally laparoscopic surgery. This protocol describes a procedure for intraoperative gastroscopy in totally laparoscopic subtotal gastrectomy.
Résumé
Détermination des marges de résection pour un cancer gastrique, qui ne sont pas exposés à la surface séreuse de l'estomac, est la procédure la plus importante au cours de la gastrectomie laparoscopique totalement (TLG). L'objectif de ce protocole est d'introduire une procédure de gastroscopie peropératoire, afin de marquer directement les tumeurs au cours de TLG pour le cancer gastrique dans le tiers médian de l'estomac. Les patients qui ont été diagnostiqués avec un adénocarcinome dans le tiers médian de l'estomac ont été inscrits dans cette série de cas. Avant la chirurgie, gastroscopie supplémentaire pour la localisation de la tumeur n'a pas été effectuée. Sous anesthésie générale, la mobilisation laparoscopique de l'estomac est réalisée en premier. Après la première partie du duodénum est mobilisé à partir du pancréas et serré, le chirurgien se déplace vers l'autre côté de la procédure gastroscopie. Sur l'introduction d'un gastroscope à travers la cavité orale dans l'estomac, 2 - 3 ml d'indigo carmin est administré par l'intermédiaire d'un injecteur endoscopique dans l'estomac mucouche SCLE à la marge proximale de l'estomac. L'emplacement de séreuse teinté dans la vue laparoscopique est utilisée pour guider subtotale distale gastrectomie, cependant, la gastrectomie totale est effectuée si la tumeur est trop près de la jonction gastro-oesophagienne. Un échantillon est prélevé après gastrectomie distale pour confirmer une longueur suffisante de la marge de résection de la tumeur avant la reconstruction. Dans notre série de cas, tous les patients avaient des marges de la tumeur et ne nécessitaient pas une résection supplémentaire. Il n'y avait aucune morbidité liée à la procédure de gastroscopie, et le temps nécessaire pour la procédure a progressivement diminué à environ cinq minutes. gastroscopie peropératoire pour la localisation de la tumeur est une méthode précise et tolérée pour les patients atteints de cancer gastrique subissant une gastrectomie distale totalement laparoscopique.
Introduction
La chirurgie laparoscopique a été devenu le traitement de choix pour le cancer gastrique précoce dans les pays d' Asie orientale, y compris la Corée et le Japon. 1 L'avantage de cette opération a été bien démontrée dans plusieurs essais cliniques pour le cancer gastrique au début (EGC). 2-4 La plupart des les procédures de ces essais ont été réalisés par laparoscopie, mais l'identification de l'emplacement de la tumeur, la résection de l'estomac, y compris la tumeur primaire, et la reconstruction ont été réalisées par l'intermédiaire de minilaparotomie. Par conséquent, la chirurgie nécessitant minilaparotomie a été étiqueté "gastrectomie laparoscopique assistée."
Récemment, cependant, les interventions chirurgicales ont évolué pour minimiser le traumatisme, l'amélioration de la qualité de vie postopératoire des patients. Depuis ce concept a également été appliqué dans la chirurgie laparoscopique pour le cancer gastrique, certains chirurgiens laparoscopiques expérimentés ont essayé d'éviter la minilaparotomie. Totalement gastrectomie laparoscopique (TLG) pour gastricancer du c exige que toutes les procédures sont effectuées à l'aide seulement des dispositifs laparoscopiques, sans nécessiter une minilaparotomie supplémentaire pour spécimen résection et anastomose. Puisque ce type de résultats de la chirurgie en moins de douleur et une récupération plus rapide par rapport à ouvrir ou à la chirurgie assistée par laparoscopie, qui exigent laparotomie, plus de chirurgiens préfèrent. 5,6 Cependant, un obstacle à TLG pour le cancer gastrique est la localisation de la tumeur sans visualisation directe ou à la palpation pour déterminer la zone de résection de l'estomac.
Tumeur absence à la marge de résection est très important pour atteindre le succès dans la chirurgie du cancer gastrique. S'il y a la participation de la tumeur à la marge de résection pendant gastrectomie distale pour cancer gastrique, la résection supplémentaire est nécessaire pour éviter de laisser la tumeur dans l'estomac restant. En chirurgie ouverte et assistée par laparoscopie, la tumeur primaire peut être facilement localisé par palpation ou la visualisation directe par une gastrostomie temporaire. Cependant, comme la premièrery tumeur est pas facilement détectée dans la vue laparoscopique, la détermination des marges de résection pour EGC dans TLG peut être difficile.
Plusieurs autres méthodes nécessitant une gastroscopie préopératoire supplémentaire pour déterminer les marges de résection ont été proposées. 7-9 Cependant, gastroscopie préopératoire supplémentaire peut être gênant pour les patients. Nous avons introduit une procédure de gastroscopie peropératoire pour marquer directement les tumeurs au cours TLG pour le cancer gastrique dans le tiers médian de l'estomac.
Dans ce protocole, nous avons appliqué la chirurgie laparoscopique pour les patients atteints de cancers gastriques précoces dans les études pré-opératoires, qui ne sont pas inclus dans l'indication absolue pour endoscopique dissection sous-muqueuse.
Protocole
Déclaration éthique: Cette procédure impliquant des sujets humains a été approuvé par l'Institutional Review Board (IRB) à l'hôpital universitaire Ajou.
1. Préparation pour la chirurgie
- Laisser une diète molle un jour avant la chirurgie, avec rien par la bouche après minuit avant la chirurgie.
Note: Ne pas insérer un tube nasogastrique avant et pendant la chirurgie. Ce protocole ne pas utiliser de tube pour dégonfler l'estomac. Au lieu de cela, le gaz intra-gastrique peut être aspiré par l'aiguille de ponction laparoscopique si l'estomac est distendu provoquant limitée à la chirurgie laparoscopique. - Après avoir placé le patient sur la table d'opération, administrer l'agent d'induction (thiopental de sodium, 100 mg).
- Après l'injection intraveineuse d'un myorelaxant (bromure de rocuronium, 1,0 mg / kg), insérer le tube endotracheal à travers la cavité buccale.
- Démarrez le gaz anesthésique (sévoflurane, 2 - 3%) par la sonde endotrachéale, puis suivre thepatient pour la stabilité pendant la chirurgie.
2. Procédure chirurgicale avant peropératoire gastroscopie
- Placer le patient en position de Trendelenburg inverse, et se tenir sur le côté droit du patient.
- Faire 10 mm incision dans la zone infraumbilical, et insérez le premier trocart dans la cavité abdominale.
- Dès que le trocart est inséré, raccorder le tube à gaz pour le dioxyde de carbone avec le trocart afin de créer un pneumopéritoine de 15 - 18 mm de Hg.
- Insérez un rigide 30 ° laparoscope par le trocart, et d'explorer la cavité abdominale sur un moniteur connecté au système laparoscopique.
- Insérez 4 trocarts supplémentaires (un 12 mm et trois 5 mm) que les ports de travail. Insérez trocart de 12 mm sur le côté supérieur droit de l'ombilic. Insérez trois 5 autres trocarts mm à côté supérieur gauche de l'ombilic et les deux quadrants externes supérieure de l'abdomen.
- Disséquer le ligament gastrocolic le long du côlon transverse vers le inferiou pôle de la rate avec des ciseaux endoscopiques à ultrasons.
- Ligaturer l'artère gastro-gauche et la veine provenant de vaisseaux spléniques à la racine avec un clip laparoscopique et réséquer les avec des ciseaux endoscopiques à ultrasons, après l'exposition de la frontière supérieure de la queue du pancréas.
- Avec des ciseaux endoscopiques à ultrasons, disséquer les ganglions lymphatiques peripyloric autour du pylore et de la tête du pancréas, et réséquer les vaisseaux gastro-épiploïques droit à leur origine.
- Avant la résection de la première partie du duodénum, serrer le duodénum par une pince laparoscopique pour empêcher la migration du gaz dans l'intestin grêle pendant la procédure gastroscopique (figure 1).
3. peropératoire gastroscopie
- Déplacer vers le côté gauche de la tête du patient pour effectuer gastroscopie peropératoire.
- Insérer un écran de gomme pour protéger les dents et les gencives pendant gastroscopie peropératoire.
- Tournez le head du patient vers le côté gauche pour l'insertion de la gastroscopie.
- Insérez le gastroscope dans l'estomac avec soin par la bouche et l'œsophage, pour éviter les blessures à la muqueuse de la cavité buccale, de l'œsophage et l'estomac.
- Insufflera l'estomac par injection de gaz à travers le gastroscope pour localiser la lésion primaire.
Note: La plupart des gastroscopes ont un bouton spécifique à injecter du gaz dans l'intestin au cours de la procédure. - Approximer la distance entre le bord proximal de la tumeur et de la jonction oeso - gastrique selon l'échelle marquée sur le gastroscope (figure 2), et effectuer une gastrectomie totale (comme décrit précédemment) si la distance est trop courte pour récupérer l'estomac proximal. 10
- Si gastrectomie totale est pas nécessaire, insérez un injecteur endoscopique à travers un petit trou du gastroscope, et injecter 2 - 3 cc de l'indigo carmin dans la paroi gastrique en utilisant un injecteur endoscopique dans une zone 2 - 3 cm proximal de la marge de la tumeur, ce qui évite les fuites ou intra extraluminal (figure 3A).
- Insérer l'aiguille de l'injecteur dans la paroi gastrique en oblique afin d'éviter la perforation de la paroi gastrique par l'aiguille. En outre, l'injection indigo carmin très lentement pour identifier les fuites intraluminal lors de l'injection.
- Après l'injection de colorant, le gaz de gonflage aspirée par le gastroscope pour rendre la procédure laparoscopique plus facile.
Note: La plupart des gastroscopes ont un bouton spécifique pour aspirer le gaz de gonflage pendant la procédure.
4. Procédure après peropératoire gastroscopie
- Retour vers le côté droit du patient après la procédure gastroscopique.
- Dans la vue laparoscopique, confirmer la partie proximale de la tumeur en identifiant séreuse coloration par un colorant bleu (figure 3B).
- Marquez la partie tachée à réséquer avec un clip endoscopique, évitant l'implication de la tumeur à la resection marge (figure 4A).
Note: Nous vous recommandons d'effectuer cette procédure dans les 5 - 10 min après le début de la chirurgie, parce que le colorant peut parfois être lavé au cours des procédures ultérieures. - Si le colorant ne peut pas être détectée dans la séreuse, immédiatement ré-injecter le colorant sous visualisation gastroscopie.
5. Procédure après peropératoire gastroscopie
- Réséquer le duodénum, et effectuer d' autres procédures de dissection des ganglions lymphatiques selon les directives de traitement japonais. 11
- Après dissection des ganglions lymphatiques, réséquer l'estomac au bon endroit au moins 3 cm proximal de la marge de la tumeur, guidée par le clip de marquage, en utilisant 2 agrafeuses endoscopiques.
- Dès que l'estomac distal est réséqué, insérer l'échantillon dans un sac endoscopique et la retirer de la cavité abdominale à travers une 2 - cm extension de 3 du site de trocart infraumbilical.
- Envoyer le tissu de la marge proximalepathologie pour une évaluation histologique intra-opératoire.
- Après la confirmation d' un tissu sans tumeur dans la partie proximale de l'estomac réséqué, effectuer une anastomose entre l'estomac restant et le jéjunum proximal avec des agrafeuses linéaires intracorporelle (figure 4B).
Résultats
Sur les 20 patients qui ont subi une gastroscopie peropératoire, 18 ont subi une gastrectomie distale par rapport au montant, guidée par les résultats à gastroscopie. Cependant, nous avons effectué une gastrectomie totale sur deux patients, parce que la marge de la tumeur proximale était trop près de la jonction gastro-oesophagienne, tel que déterminé sur gastroscopie peropératoire. La distance de la tumeur à la marge de résection proximale était de 3,5 cm et 2,5 cm de ces deux patients, respectivement (tableau 1).
durée opératoire moyenne totale pour gastrectomie distale était de 188 min. Le temps moyen pour la localisation de la tumeur avec gastroscopie peropératoire était de 8,4 min, et il a progressivement diminué , passant de 11,8 min (initiales 5 cas) à 4,6 min (5 derniers cas) (figure 5). reconstruction intracorporelle avec Billroth II anastomose suivi gastrectomie distale chez tous les patients. Il n'y avait pas de morbidité, sauf pour la stase gastrique et adiléus adhésif chez deux patients. Enfin, il n'y avait pas de complications liées à la gastroscopie peropératoire.
taille de la tumeur moyenne chez les patients ayant subi une gastrectomie distale était 2,89 (intervalle: 0,5 à 3,2) cm. EGC a été le diagnostic final chez 16 patients, mais on a présenté l'invasion musculaire et une autre invasion de la séreuse exposée. La distance moyenne de la tumeur à la marge de résection était de 3,3 (intervalle: 0,5 à 6,7) cm. Type histologique le plus fréquent était chevalière carcinome anneau (tableau 1).
| Non. | Âge, y | Sexe | LN un disséquer- ion | Resect- ion | recons- struction | Op b temps, min | GFS temps c, min | Emplacement | Figé pour PRM d | his- logie | Étape | La taille des tumeurs, cm | Longueur proximale de la tumeur, cm |
| 1 | 57 | mâle | D1 + | Sous-Total | Billroth-II | 235 | 15 | Postérieur | tumeur libre | chevalière cellule annulaire | Ia | 2.5 | 2.7 |
| 2 | 44 | femelle | D2 | Sous-Total | Billroth-II | 140 | 12 | Plus grand | tumeur libre | chevalière cellule annulaire | Ia | 1 | 6 |
| 3 | 51 | femelle | D2 | Sous-Total | Billroth-II | 195 | dix | Postérieur | tumeur libre | chevalière cellule annulaire | Ia | 1 | 7 |
| 4 | 34 | femelle | D2 | Sous-Total | Billroth-II | 235 | dix | Antérieur | tumeur libre | Pooly différen- déjà négociées | Ia | 1.5 | 6.7 |
| 5 | 56 | mâle | D2 | Sous-Total | Billroth-II | 225 | 12 | Plus grand | tumeur libre | chevalière cellule annulaire | Ia | 1.5 | 3 |
| 6 | 51 | mâle | D1 + | Sous-Total | Billroth-II | 200 | 13 | Moindre | tumeur libre | moyennement différen- déjà négociées | Ia | 2 | 4.1 |
| 7 | 46 | femelle | D1 + | Sous-Total | Billroth-II | 110 | 8 | Plus grand | tumeur libre | chevalière cellule annulaire | Ia | 2 | 4 |
| 8 | 68 | femelle | D2 | Sous-Total | Billroth-II | 200 | 7 | Moindre | tumeur libre | Pooly différen- déjà négociées | Ib | 5 | 2 |
| 9 | 42 | femelle | D1 + | Sous-Total | Billroth-II | 170 | 9 | Moindre | tumeur libre | chevalière cellule annulaire | Ib | 3.2 | 3.6 |
| dix | 50 | mâle | D1 + | Sous-Total | Billroth-II | 200 | 12 | Moindre | Tumor gratuitement | chevalière cellule annulaire | Ia | 2.5 | 0,5 |
| 11 | 31 | femelle | D1 + | Sous-Total | Billroth-II | 210 | 8 | Plus grand | tumeur libre | chevalière cellule annulaire | Ia | 1.2 | 1.3 |
| 12 | 56 | femelle | D2 | Sous-Total | Billroth-II | 175 | 7 | Moindre | tumeur libre | chevalière cellule annulaire | IIIa | 2.5 | 0,5 |
| 13 | 65 | mâle | D1 + | Sous-Total | Billroth-II | 150 | 5 | Moindre | tumeur libre | indifférenciée entiated | Ia | 0,5 | 5 |
| 14 | 36 | femelle | D1 + | Total | Roux-en-Y | 180 | conver- sion | Moindre | tumeur libre | chevalière cellule annulaire | IIa | 1.5 | 3.5 |
| 15 | 71 | femelle | D1 + | Sous-Total | Billroth-II | 190 | 5 | Plus grand | tumeur libre | chevalière cellule annulaire | Ia | 11 | 2.6 |
| 16 | 48 | femelle | D2 | Sous-Total | Billroth-II | 185 | 4 | Antérieur | tumeur libre | chevalière cellule annulaire | Ia | 6 | 1.3 |
| 17 | 36 | femelle | D1 + | Total | Roux-en-Y | 305 | conver- sion | Plus grand | tumeur libre | Pooly différen- tiATED | Ia | 7 | 2.5 |
| 18 | 46 | mâle | D1 + | Sous-Total | Billroth-II | 180 | 4 | Postérieur | tumeur libre | Pooly différen- déjà négociées | Ia | 0,5 | 3 |
| 19 | 51 | mâle | D1 + | Sous-Total | Billroth-II | 180 | 6 | Antérieur | tumeur libre | Eh bien différen- taited | Ia | 2 | 2.5 |
| 20 | 43 | femelle | D1 + | Sous-Total | Billroth-II | 120 | 5 | Plus grand | tumeur libre | chevalière cellule annulaire | Ia | 0,6 | 7 |
Tableau 1: Résultats chirurgicaux et pathologiques de patients ayant subi une peropératoire Gastroscope pour identifier la tumeur Localisation. S'il vous plaît cliquer ici pour télécharger ce tableau.
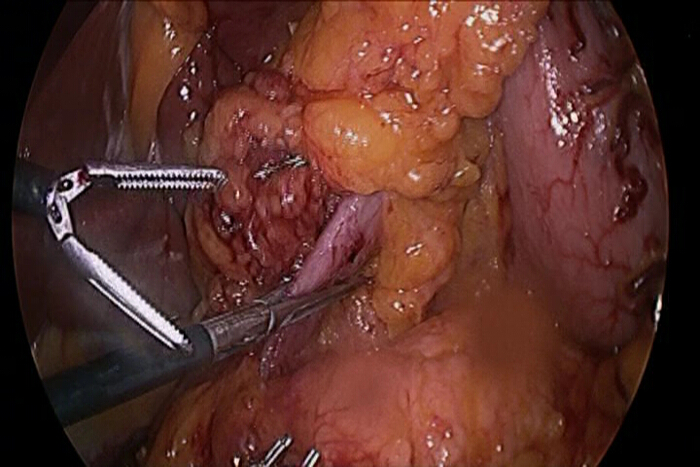
Figure 1:. Laparoscopique Clamp pour empêcher le gaz Passage dans le petit intestin Avant insertion du gastroscope pendant la chirurgie, le duodénum ou le jéjunum doit être serré avec un instrument laparoscopique. procédures gastroscopique nécessitent inévitablement l'insufflation de gaz dans la lumière de l'intestin pour visualiser précisément les lésions, et le gaz qui a passé dans l'intestin grêle ne peut pas être facilement aspiré lorsque la procédure se termine gastroscopique. Par conséquent, gonflé de l'intestin grêle peut interférer avec la procédure laparoscopique.ge.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2:. La mesure de la distance entre la tumeur et esophagogastric Junction La plupart des gastroscopes ont une échelle avec approximativement 5 cm gradations. Si la distance entre la marge de la tumeur et de la jonction gastro - oesophagienne est de 5 cm ou moins, il est trop difficile de retenir la partie proximale de l'estomac et le chirurgien doit effectuer une gastrectomie totale pour le cancer gastrique. S'il vous plaît cliquer ici pour voir une version plus grande cette figure.
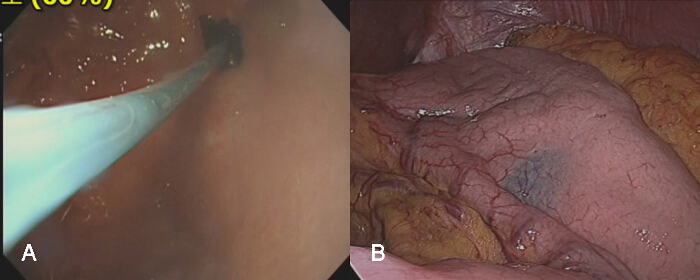
Figure 3: L' injection de colorant bleu dans la paroi gastrique. A) Un injecteur endoscopique peut être introduced à travers un petit canal sur le gastroscope. L'aiguille de l'injecteur endoscopique est exposé, et injecté dans la paroi gastrique dans une zone 2 - 3 cm proximal de la marge de la tumeur. Si l'aiguille est insérée dans la paroi gastrique avec force, il peut pénétrer dans la paroi gastrique, et le colorant sera injecté dans la cavité péritonéale. B) Cela rendrait l' identification de l'emplacement précis de la tumeur difficile dans la vue laparoscopique. Par conséquent, cette procédure d'injection doit être effectuée avec précaution. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
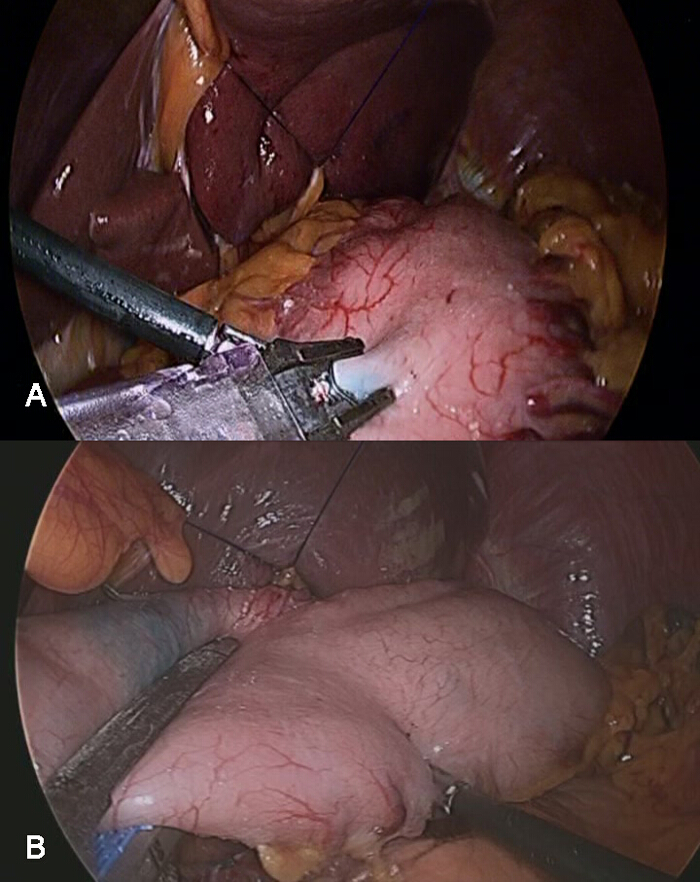
Figure 4: Résection laparoscopique guidée par la surface tachée de l'estomac Après dissection des ganglions lymphatiques, l'estomac doit être réséqué à la zone propre à CompleTel.y enlever la tumeur primaire. A) Un marqueur fait avec une pince laparoscopique, qui peut être utile pour déterminer la partie pour la résection, doit être appliquée 5 à 10 minutes après l' injection gastroscopique du colorant. B) la résection laparoscopique peut être complété par deux ou trois agrafeuses linéaires laparoscopiques. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5:. Changement dans le temps requis pour peropératoire gastroscopie et Tumor Localisation Le temps moyen pour la localisation de la tumeur avec gastroscopie peropératoire (8,4 min) a diminué progressivement de 11,8 min (initiales 5 cas) à 4,6 min (5 derniers cas).
Discussion
Dans ce protocole, nous avons introduit une procédure de gastroscopie peropératoire pour identifier avec précision et de manière fiable l'emplacement de la tumeur dans le tiers médian de l'estomac. Nous avons pu réaliser avec succès distal gastrectomie subtotale sur la base des conclusions de gastroscopie peropératoire.
A ce jour, diverses méthodes ont été appliquées pour identifier la localisation du cancer gastrique dans la vue laparoscopique. Les méthodes les plus couramment utilisées écrêtage gastroscopique préopératoire, et les chirurgiens pourraient détecter l'emplacement des clips à l' aide de l' échographie laparoscopique ou radiographie portable. 7,9 Ces techniques requises supplémentaires préopératoires gastroscopie un ou deux jours avant la chirurgie. ultrasonographie laparoscopique pour la détection peropératoire des clips nécessite des instruments et des compétences spécifiques et implique l'interprétation subjective. Une autre option, la radiologie portable peropératoire, peut montrer seulement une vue en deux dimensions; exposition supplémentaire à radiati sur peut être nocif pour les patients. Récemment, Jeong et collègue signalé gastroscopique autologue tatouage de sang avant la chirurgie. 8 Ils ont indiqué que cette procédure exige également préopératoire gastroscopie un jour avant la chirurgie, et par conséquent est peu pratique pour les patients. Un autre inconvénient de ce procédé est qu'il est impossible de reconnaître une injection incorrecte dans la paroi gastrique avant la chirurgie.
Contrairement à d'autres procédures, nous avons effectué une gastroscopie supplémentaire alors que les patients étaient sous anesthésie générale pendant la chirurgie. Par conséquent, les patients inscrits dans la présente étude ont évité le désagrément de la gastroscopie préopératoire supplémentaire. Le colorant injecté dans la couche musculaire a été facilement détectée pendant une intervention chirurgicale, parce que nous avons examiné la séreuse de 5 à 10 minutes après l'injection, et immédiatement clipsé au centre de la séreuse taché avant la diffusion du colorant. La localisation de la tumeur exacte a été détectée chez tous les patients avec notre procédure.
ntent "> L'étape critique de notre procédure est l'injection du colorant bleu dans la paroi gastrique sans fuite dans la zone extraluminal. Lorsque plus couramment utilisés colorants, comme le bleu de méthylène, fuite dans la région intrapéritonéale, il est à craindre pour l'apparition de adhérences postopératoires, méthémoglobinémie, et un œdème pulmonaire par chromotubation. Dans notre protocole, l'indigo carmin est utilisé au lieu du bleu de méthylène, parce qu'il est, un colorant peu coûteux relativement non toxique. Même ainsi, la fuite de colorant peut rendre la localisation précise des tumeurs difficiles. par conséquent, il est recommandé que le chirurgien expérimenté dans les procédures gastroscopie, telles que l'injection endoscopique, effectue cette procédure.Lorsque le colorant bleu et un instrument spécifique comme un injecteur endoscopique ne sont pas disponibles, notre procédure peut être modifiée. Dès que le chirurgien insère le gastroscope et gonfle l'estomac, l'aide-chirurgien comprime la zone où la tumeur primaire est prévu to se trouve, ce qui permet au chirurgien de déterminer la distance entre l'emplacement de la tumeur primaire et la lésion comprimé. Grâce à une communication entre le fonctionnement et le chirurgien assistant, la tumeur peut être localisé précisément.
Plusieurs limites de notre technique pour la localisation de la tumeur doit être envisagée. Tout d'abord, gastroscopie peropératoire peut exiger une courbe d'apprentissage pour les compétences endoscopiques spécifiques. Un rapport a suggéré que les chirurgiens surmonteront la courbe d' apprentissage des procédures gastroscopie après environ 80-90 cas. 12 Le chirurgien qui a participé à cette étude avaient une expérience suffisante (plus de 400 cas) pour surmonter la courbe d'apprentissage. Parfois, la gastroscopie peropératoire peut être difficile en raison du positionnement des patients sous anesthésie générale. Si l'anesthésiste prolonge la mâchoire du patient, le gastroscope peut être facilement passée à travers la gorge et dans l'œsophage. Deuxièmement, les dispositifs spécifiques pour ce procedure, comme le système gastroscopique, devrait être prêt dans la salle d'opération. Cependant, plusieurs procédures récemment suggérées pour la résection gastrique exigent également l' utilisation d'un gastroscope peropératoire. 13,14 À l'avenir, gastroscopie peropératoire sera plus fréquente dans la chirurgie gastrique, et le système gastroscopique sera essentiel dans la salle d'opération Troisièmement, les marges tumorales étaient seulement déterminé par les résultats endoscopiques dans ce protocole. Parfois, la marge de tumeurs superficiels extensifs peut être claire, même si une lésion élevée et décolorée peut être considérée comme une tumeur. Évolution des techniques récentes, telles que l' endoscopie infrarouge ou l' imagerie moléculaire in vivo, peut vérifier la marge de la tumeur; si elle est appliquée à la gastroscopie peropératoire, 15,16 la procédure dans ce protocole peut être plus précise et utile.
En conclusion, gastroscopie peropératoire pour la localisation de la tumeur est une méthode précise et tolérée chez les patients atteints de cancer gastrique subissenting gastrectomie distale totalement laparoscopique.
Déclarations de divulgation
The authors have no conflicts of interest or financial ties to disclose.
Remerciements
This study was supported by a grant from the National R&D Program for Cancer Control, Ministry of Health & Welfare, Republic of Korea (1320270).
matériels
| Name | Company | Catalog Number | Comments |
| Pentothal Sodium | JW pharmatheutical Co. | 644912100 | It was used as induction asgent |
| Rocumeron | Ilsung pharmatheutical Co. | 655402960 | It was used for general anesthestia as muscle relaxant. |
| SevoFRAN | Hana pharmatheutical Co. | 657801060 | It was used as general anesthetics |
| Endoscopy system | Olympus Corp. | CLV-260 | It was used for intraoperative GFS |
| Laparoscopic surgery system | Striker Endoscopy | 1488 HD 3-CHIP | It was a system for laparoscopic surgery |
| Ultrasonic scissor | Johnson and Johnson Medical Corp. | HAR23 | It was used during tissue dissection |
| Laparoscopic clip | Johnson and Johnson Medical Corp. | ER420 | It was used for ligation of the vessels. |
| Indigo carmine | Korea United Pharma | Carmine | It was injected into the gastric wall |
| Linear stapler | Johnson and Johnson Medical Corp. | ECHELON FLEX Powered Endopath Stapler | It was used for resection the stomach |
| Gastroscopic injector | TaeWoong Medical | Cobra injector | I was used for gastroscopic injection of blue dye |
Références
- Kim, Y. W., Yoon, H. M., Eom, B. W., Park, J. Y. History of minimally invasive surgery for gastric cancer in Korea. J Gastric Cancer. 12, 13-17 (2012).
- Kim, H. H., et al. Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report--a phase III multicenter, prospective, randomized Trial (KLASS Trial). Ann Surg. 251, 417-420 (2010).
- Kim, M. C., Kim, K. H., Kim, H. H., Jung, G. J. Comparison of laparoscopy-assisted by conventional open distal gastrectomy and extraperigastric lymph node dissection in early gastric cancer. J Surg Oncol. 91, 90-94 (2005).
- Kim, Y. W., et al. Improved quality of life outcomes after laparoscopy-assisted distal gastrectomy for early gastric cancer: results of a prospective randomized clinical trial. Ann Surg. 248, 721-727 (2008).
- Kinoshita, T., et al. Comparison of laparoscopy-assisted and total laparoscopic Billroth-I gastrectomy for gastric cancer: a report of short-term outcomes. Surg Endosc. 25, 1395-1401 (2011).
- Song, K. Y., et al. Is totally laparoscopic gastrectomy less invasive than laparoscopy-assisted gastrectomy?: prospective, multicenter study. J Gastrointest Surg. 12, 1015-1021 (2008).
- Hyung, W. J., et al. Intraoperative tumor localization using laparoscopic ultrasonography in laparoscopic-assisted gastrectomy. Surg Endosc. 19, 1353-1357 (2005).
- Jeong, O., Cho, S. B., Joo, Y. E., Ryu, S. Y., Park, Y. K. Novel technique for intraoperative tumor localization during totally laparoscopic distal gastrectomy: endoscopic autologous blood tattooing. Surg Endosc. 26, 1778-1783 (2012).
- Kim, H. I., et al. Intraoperative portable abdominal radiograph for tumor localization: a simple and accurate method for laparoscopic gastrectomy. Surg Endosc. 25, 958-963 (2011).
- Kim, H. I., Cho, I., Jang, D. S., Hyung, W. J. Intracorporeal esophagojejunostomy using a circular stapler with a new purse-string suture technique during laparoscopic total gastrectomy. J Am Coll Surg. 216, e11-e16 (2013).
- Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gast Can. 14, 113-123 (2011).
- Lee, H. H., Song, K. Y., Park, C. H., Jeon, H. M. Training of surgical endoscopists in Korea: assessment of the learning curve using a cumulative sum model. J Surg Educ. 69, 559-563 (2012).
- Cho, W. Y., et al. Hybrid natural orifice transluminal endoscopic surgery: endoscopic full-thickness resection of early gastric cancer and laparoscopic regional lymph node dissection--14 human cases. Endoscopy. 43, 134-139 (2011).
- Abe, N., et al. Endoscopic full-thickness resection with laparoscopic assistance as hybrid NOTES for gastric submucosal tumor. Surg Endosc. 23, 1908-1913 (2009).
- Hoetker, M. S., et al. Molecular in vivo imaging of gastric cancer in a human-murine xenograft model: targeting epidermal growth factor receptor. Gastrointest Endosc. 76, 612-620 (2012).
- Ishihara, R. Infrared endoscopy in the diagnosis and treatment of early gastric cancer. Endoscopy. 42, 672-676 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon