Method Article
Die intraoperative Gastroskopie für Tumorlokalisation in der laparoskopischen Chirurgie für Adenokarzinom des Magens
In diesem Artikel
Zusammenfassung
In early gastric cancer, the aim of surgery is to precisely remove the distal stomach including the primary tumor. To do this, accurate localization of the tumor is crucial, especially in totally laparoscopic surgery. This protocol describes a procedure for intraoperative gastroscopy in totally laparoscopic subtotal gastrectomy.
Zusammenfassung
Bestimmen Resektionsrändern für Magenkrebs, die auf die Serosa-Oberfläche exponiert sind nicht im Magen, ist das wichtigste Verfahren in völlig laparoskopischen Gastrektomie (TLG). Ziel dieses Protokolls ist es, ein Verfahren für die intraoperative Gastroskopie, einzuführen, um direkt Tumoren während TLG für Magenkrebs im mittleren Drittel des Magens markieren. Patienten, die mit einem Adenokarzinom im mittleren Drittel des Magens diagnostiziert wurden, wurden in diesem Fall Serie eingeschrieben. Vor der Operation wird eine zusätzliche Gastroskopie für Tumorlokalisation nicht durchgeführt. Unter Vollnarkose wird laparoskopische Mobilisierung des Magens zuerst ausgeführt. Nachdem der erste Abschnitt des Duodenums wird aus der Bauchspeicheldrüse mobilisiert und eingespannt, der Chirurg bewegt sich zu der anderen Seite für die gastroskopischen Verfahren. Auf das Einführen eines Gastroskop durch die Mundhöhle in den Magen, 2 - 3 ml Indigokarmin wird über einen endoskopischen Injektor in den Magen verabreicht muscle Schicht am proximalen Rand des Magens. Die Lage von gefärbten serosa in der laparoskopischen Ansicht wird verwendet distale subtotale Gastrektomie zu führen, jedoch Gastrektomie durchgeführt wird, wenn der Tumor an der gastroösophagealen Übergang zu nahe ist. Eine Probe wird nach distalen Gastrektomie abgetastet, um eine ausreichende Länge von Resektionsrandes auf Tumor vor der Rekonstruktion bestätigen. In unserem Fall Serie hatten alle Patienten tumorfrei Margen und benötigt keine zusätzliche Resektion. Es gab keine Morbidität zur Gastroskopie Verfahren bezogen, und die Zeit für das Verfahren erforderlich ist allmählich auf etwa 5 Minuten verringert. Die intraoperative Gastroskopie für Tumorlokalisation ist eine genaue und tolerierte Methode für Patienten mit Magenkrebs total laparoskopische distalen Gastrektomie unterzogen.
Einleitung
Die laparoskopische Chirurgie hat in der Behandlung der Wahl für Magenfrühkarzinomen ostasiatischen Ländern geworden, darunter Korea und Japan. 1 Der Vorteil dieser Operation wurde in mehreren klinischen Studien für Magenfrühkarzinomen (EGC) gut demonstriert. 2-4 Die meisten die Verfahren in diesen Studien wurden durch Laparoskopie durchgeführt, aber die Identifizierung des Tumorlokalisation, Resektion des Magens, einschließlich des Primärtumors und Rekonstruktion wurden via minilaparotomy durchgeführt. Daher wurde minilaparotomy hat Chirurgie erfordert Bezeichnung "gastrectomy Laparoskopie-assistierte."
Kürzlich haben jedoch chirurgische Verfahren entwickelt Trauma zu minimieren, für Patienten, die die postoperativen Verbesserung der Lebensqualität. Da dieses Konzept auch in der laparoskopischen Chirurgie für Magenkrebs, einige erfahrene laparoskopischen Chirurgen minilaparotomy zu vermeiden, haben angewendet wurde versucht. Völlig laparoskopische Gastrektomie (TLG) für gastric Krebs erfordert, dass alle Verfahren nur laparoskopischen Geräten vorgenommen verwenden, ohne dass eine zusätzliche minilaparotomy für die Proben Resektion und Anastomose erfordern. Da diese Art der Operation führt zu weniger Schmerzen und eine schnellere Erholung relativ zu öffnen oder Laparoskopie-assistierte Chirurgie, die Laparotomie benötigen, bevorzugen es mehr Chirurgen. 5,6 jedoch ein Hindernis für die TLG für Magenkrebs ist Tumorlokalisation ohne direkte Visualisierung oder Palpation den Bereich der Magen-Resektion zu bestimmen.
Tumor Abwesenheit am Resektionsrand ist sehr wichtig, den Erfolg bei Magenkrebs Operation zu erreichen. Bei Tumorbeteiligung an der Resektionsrand während distalen Gastrektomie für Magenkrebs ist, ist eine zusätzliche Resektion benötigt in den verbleibenden Magen verlassen Tumor zu vermeiden. In offenen und Laparoskopie-assistierte Chirurgie, kann der primäre Tumor leicht durch Palpation oder direkte Visualisierung durch eine temporäre Gastrostomie lokalisiert werden. Da jedoch die Primary Tumor ist in der laparoskopischen Ansicht, die Bestimmung Resektionsrändern für EGC in TLG schwierig sein kann nicht leicht erkannt.
Mehrere andere Verfahren zusätzliche präoperative Gastroskopie erfordern Resektionsrändern zu bestimmen , wurden vorgeschlagen. 7-9 jedoch weitere präoperative Gastroskopie kann für die Patienten unbequem sein. Wir führten ein Verfahren für die intraoperative Gastroskopie direkt Tumoren während TLG für Magenkrebs im mittleren Drittel des Magens zu markieren.
In diesem Protokoll verwendeten wir die laparoskopische Chirurgie für Patienten mit frühen Magenkrebs bei den präoperativen Untersuchungen, die in absoluter Indikation sind nicht für die endoskopische Submukosa-Dissektion enthalten.
Protokoll
Ethik-Erklärung: Dieses Verfahren am Menschen wurde vom Institutional Review Board (IRB) an Ajou University Hospital genehmigt.
1. Vorbereitung für Chirurgie
- Lassen Sie eine weiche Kost einen Tag vor der Operation, mit nichts durch den Mund nach Mitternacht vor der Operation.
Hinweis: Verwenden Sie keine Magensonde einsetzen, bevor und während der Operation. Dieses Protokoll verwendet keine Röhre um den Magen zu entleeren. Statt dass die intra-Magen-Gas kann durch Laparoskopie Punktionsnadel abgesaugt werden, wenn der Magen aufgetrieben wird eingeschränkte Sicht für die laparoskopische Chirurgie verursacht. - der Patient auf dem Operationstisch, zur Verwaltung der Induktionsmittel (Thiopental-Natrium, 100 mg) Nach der Platzierung.
- Nach intravenöser Injektion eines Muskelrelaxans (Rocuroniumbromid, 1,0 mg / kg), legen Sie die Endotrachealtubus durch die Mundhöhle.
- Starten Sie das Narkosegas (Sevofluran, 2 - 3%) über den Endotrachealtubus, dann überwachen the Patient für Stabilität während der Operation.
2. Chirurgische Verfahren vor intraoperative Gastros
- Der Patient wird in umgekehrter Trendelenburg-Position, und stehen auf der rechten Seite des Patienten.
- Machen Sie 10 mm Schnitt am infraumbilical Bereich und legen Sie die erste Trokar in die Bauchhöhle.
- Sobald der Trokar eingeführt wird, schließen Sie das Gasrohr für Kohlendioxid mit dem Trokar ein Pneumoperitoneum von 15 zu schaffen - 18 mm Hg.
- Legen Sie eine starre 30 ° Laparoskop durch den Trokar, und erkunden Sie die Bauchhöhle auf einem Monitor mit dem laparoskopischen System verbunden.
- Legen Sie 4 zusätzliche Trokare (ein 12 mm und drei 5 mm) als Arbeitsanschlüsse. Einsatz 12 mm Trokar an der rechten oberen Seite des Nabels. Legen Sie anderen drei 5 mm Trokare an der linken oberen Seite des Nabels und den beiden oberen äußeren Quadranten des Bauches.
- Präparieren Sie die gastro-Band entlang der Querkolon in Richtung der inferioder Pol der Milz mittels Ultraschall-endoskopische Schere.
- Ligieren der linken A. gastroepiploica mit Ursprung aus Milzgefäße an der Wurzel mit einer laparoskopischen Clip Vene und resect sie Ultraschall endoskopische Schere nach der Belichtung der oberen Grenze des Pankreasschwanz.
- Mit Ultraschall-endoskopische Schere, sezieren die peripyloric Lymphknoten rund um den Pförtner und dem Kopf der Bauchspeicheldrüse, und die gastroepiploica Schiffe auf ihren Ursprung resezieren.
- Vor Resektion des ersten Teils des Duodenums, klemmen das Duodenum mit einem laparoskopischen Klammer zu Migration von Gas in den Dünndarm während des gastroskopischen Verfahren verhindern (Abbildung 1).
3. Die intraoperative Gastros
- Bewegen Sie auf der linken Seite des Kopfes des Patienten intraoperative Gastroskopie durchzuführen.
- Setzen Sie einen Mundschutz, die Zähne und das Zahnfleisch während der intraoperative Gastroskopie zu schützen.
- Drehen Sie den head des Patienten auf der linken Seite zum Einführen des Gastroskop.
- Legen Sie die Gastroskop in den Magen vorsichtig durch den Mund und die Speiseröhre, eine Schädigung der Schleimhaut der Mundhöhle, die Speiseröhre und den Magen zu vermeiden.
- Insufflate den Magen durch Gas durch das Gastroskop Injizieren der primären Läsion zu lokalisieren.
Hinweis: Die meisten Gastroskopen eine bestimmte Taste haben Gas in den Darm während des Verfahrens zu injizieren. - Ungefähre den Abstand zwischen dem proximalen Rand des Tumors und der gastroösophagealen Übergang mit Hilfe der Skala auf dem Gastroskop markiert (Abbildung 2), und führen Sie den gesamten Magen (wie zuvor beschrieben) , wenn der Abstand zu kurz ist , den proximalen Magen zu retten. 10
- Wenn Gastrektomie nicht notwendig ist, legen Sie eine endoskopische Injektor durch ein kleines Loch des Gastroskop und injizieren 2 - 3 ccm Indigokarmin in die Magenwand eine endoskopische Injektor in einem Bereich 2 mit - 3 cm proximal vom Tumorrand, Vermeidung von intra- oder extraluminaler Leckage (3A).
- Führen Sie die Nadel des Injektors in die Magenwand schräg die Perforation der Magenwand von der Nadel zu vermeiden. Darüber hinaus injizieren Indigokarmin sehr langsam intraluminale Leckage während der Injektion zu identifizieren.
- Nach dem Farbstoff Injektion zu aspirieren Füllgas durch das Gastroskop das laparoskopische Verfahren zu erleichtern.
Hinweis: Die meisten Gastroskopen eine bestimmte Taste haben Füllgas während des Verfahrens zu aspirieren.
4. Verfahren nach intraoperative Gastros
- Rückkehr zur rechten Seite des Patienten nach der Gastroskopie Verfahren.
- In der laparoskopischen Ansicht, bestätigen den proximalen Teil des Tumors durch serosal Färbung durch blauen Farbstoff (3B) zu identifizieren.
- Markieren Sie den gefärbten Teil werden mit einem endoskopischen Clip reseziert, die Vermeidung Beteiligung der Tumor an der WiederAbschnitt Marge (4A).
Anmerkung: Wir empfehlen, dieses Verfahren innerhalb von 5 - 10 min nach der Operation beginnt, da der Farbstoff manchmal während der nachfolgenden Verfahren ausgewaschen werden kann. - Wenn der Farbstoff nicht in der Serosa detektiert werden kann, sofort wieder einzuspritzen, den Farbstoff unter gastroskopischen Visualisierung.
5. Verfahren nach intraoperative Gastros
- Reseziert Duodenum und führen auch andere Verfahren zur Lympknotendissektion nach den japanischen Behandlungsrichtlinien. 11
- Nach Lympknotendissektion, den Magen an der richtigen Stelle mindestens 3 cm proximal von der Tumorrand reseziert, durch den Markierungsklipp geführt, unter Verwendung von 2 endoskopische Heftern.
- Sobald das distale Magen reseziert, um die Probe in einem endoskopischen Tasche einsetzen und aus der Bauchhöhle durch ein 2 zurückziehen - cm Verlängerung der infraumbilical Trokar Website 3.
- Senden Sie das Gewebe aus dem proximalen Rand zuPathologie für die intraoperative histologische Auswertung.
- Nach Bestätigung der tumorfreien Gewebes in dem proximalen Abschnitt des resezierten Magen, eine Anastomose zwischen dem restlichen Magen und dem proximalen Jejunum mit intrakorporalen linear staplers (4B) durchführen.
Ergebnisse
Von 20 Patienten, die intraoperative Gastroskopie unterzogen, unterzog 18 distale subtotale Gastrektomie, durch die Ergebnisse bei der Gastroskopie geführt. Allerdings führten wir den gesamten Magen auf zwei Patienten, weil das proximale Tumorrand an der gastroösophagealen Übergang zu nahe war, als auf die intraoperative Gastroskopie bestimmt. Der Abstand vom Tumor zum proximalen Resektionsrand betrug 3,5 cm und 2,5 cm in diesen beiden Patienten (Tabelle 1).
Insgesamt mittlere Operationszeit für die distale Gastrektomie betrug 188 min. Die mittlere Zeit für Tumorlokalisation mit intraoperative Gastros betrug 8,4 min, und es verringert sich allmählich von 11,8 min (Anfangs 5 Fälle) bis 4,6 min (letzte 5 Fälle) (Abbildung 5). Intrakorporalen Rekonstruktion mit BII Anastomose gefolgt distalen Gastrektomie bei allen Patienten. Es gab keine Morbidität, mit Ausnahme von Magen-Stase und Anzeigehesive Ileus bei zwei Patienten. Schließlich gab es keine intraoperative Gastroskopie im Zusammenhang mit Komplikationen.
Die mittlere Tumorgröße bei Patienten, die distalen Gastrektomie unterzog betrug 2,89 (Bereich: 0,5-3,2) cm. EGC war die endgültige Diagnose bei 16 Patienten, aber man zeigte Muskelinvasion und andere zeigten serosal Invasion. Der mittlere Abstand vom Tumor bis zur Resektion Marge betrug 3,3 (Bereich: 0,5-6,7) cm. Die häufigsten histologischen Typ war Siegelringzellkarzinom (Tabelle 1).
| Nein. | Alter, y | Sex | LN ein sezieren- Ion | Resect- Ion | Reconstruction Aufbau | Op b Zeit, min | GVS - c, min | Ort | Gefrorene für PRM d | Histo- logie | Stufe | Die Tumorgröße, cm | Proximale Länge von Tumor, cm |
| 1 | 57 | männlich | D1 + | Zwischensumme | Billroth-II | 235 | 15 | Hintere | Tumor frei | Siegelring Zelle | Ia | 2.5 | 2.7 |
| 2 | 44 | weiblich | D2 | Zwischensumme | Billroth-II | 140 | 12 | Groß | Tumor frei | Siegelring Zelle | Ia | 1 | 6 |
| 3 | 51 | weiblich | D2 | Zwischensumme | Billroth-II | 195 | 10 | Hintere | Tumor frei | Siegelring Zelle | Ia | 1 | 7 |
| 4 | 34 | weiblich | D2 | Zwischensumme | Billroth-II | 235 | 10 | Vorder- | Tumor frei | Pooly Diffe- handelte | Ia | 1.5 | 6.7 |
| 5 | 56 | männlich | D2 | Zwischensumme | Billroth-II | 225 | 12 | Groß | Tumor frei | Siegelring Zelle | Ia | 1.5 | 3 |
| 6 | 51 | männlich | D1 + | Zwischensumme | Billroth-II | 200 | 13 | Geringer | Tumor frei | moderatly Diffe- handelte | Ia | 2 | 4.1 |
| 7 | 46 | weiblich | D1 + | Zwischensumme | Billroth-II | 110 | 8 | Groß | Tumor frei | Siegelring Zelle | Ia | 2 | 4 |
| 8 | 68 | weiblich | D2 | Zwischensumme | Billroth-II | 200 | 7 | Geringer | Tumor frei | Pooly Diffe- handelte | Ib | 5 | 2 |
| 9 | 42 | weiblich | D1 + | Zwischensumme | Billroth-II | 170 | 9 | Geringer | Tumor frei | Siegelring Zelle | Ib | 3.2 | 3.6 |
| 10 | 50 | männlich | D1 + | Zwischensumme | Billroth-II | 200 | 12 | Geringer | Tumor kostenlos | Siegelring Zelle | Ia | 2.5 | 0,5 |
| 11 | 31 | weiblich | D1 + | Zwischensumme | Billroth-II | 210 | 8 | Groß | Tumor frei | Siegelring Zelle | Ia | 1.2 | 1.3 |
| 12 | 56 | weiblich | D2 | Zwischensumme | Billroth-II | 175 | 7 | Geringer | Tumor frei | Siegelring Zelle | IIIa | 2.5 | 0,5 |
| 13 | 65 | männlich | D1 + | Zwischensumme | Billroth-II | 150 | 5 | Geringer | Tumor frei | Undiffer- renzierte | Ia | 0,5 | 5 |
| 14 | 36 | weiblich | D1 + | Gesamt | Roux-en-Y | 180 | Convergence sion | Geringer | Tumor frei | Siegelring Zelle | IIa | 1.5 | 3.5 |
| 15 | 71 | weiblich | D1 + | Zwischensumme | Billroth-II | 190 | 5 | Groß | Tumor frei | Siegelring Zelle | Ia | 11 | 2.6 |
| 16 | 48 | weiblich | D2 | Zwischensumme | Billroth-II | 185 | 4 | Vorder- | Tumor frei | Siegelring Zelle | Ia | 6 | 1.3 |
| 17 | 36 | weiblich | D1 + | Gesamt | Roux-en-Y | 305 | Convergence sion | Groß | Tumor frei | Pooly Diffe- tiated | Ia | 7 | 2.5 |
| 18 | 46 | männlich | D1 + | Zwischensumme | Billroth-II | 180 | 4 | Hintere | Tumor frei | Pooly Diffe- handelte | Ia | 0,5 | 3 |
| 19 | 51 | männlich | D1 + | Zwischensumme | Billroth-II | 180 | 6 | Vorder- | Tumor frei | Nun Diffe- taited | Ia | 2 | 2.5 |
| 20 | 43 | weiblich | D1 + | Zwischensumme | Billroth-II | 120 | 5 | Groß | Tumor frei | Siegelring Zelle | Ia | 0,6 | 7 |
Tabelle 1: Chirurgische und Pathologische Ergebnisse der Patienten , die Unterzog intraoperative Gastroskop Tumor Ort zu identifizieren. Bitte klicken Sie hier , um diese Tabelle zum Download bereit .
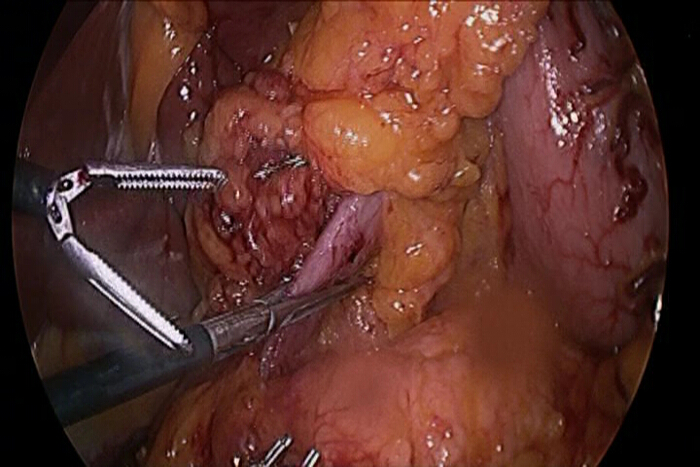
Abb . 1: Die laparoskopische Clamp zu Gaspassage in den Dünndarm verhindern Vor dem Einsetzen des Gastroskop während der Operation sollte das Duodenum oder Jejunum mit einem laparoskopischen Instrument geklemmt werden. Gastroskopischen Verfahren erfordern zwangsläufig die Insufflation des Gases in das Lumen des Darms genau die Läsionen sichtbar zu machen, und Gas, das in den Dünndarm passiert hat, kann nicht leicht sein, aspirierten wenn die gastroskopischen Verfahren beendet. Folglich aufgeblasen Dünndarm kann mit dem laparoskopischen Eingriff stören.ge.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 2:. Die Messung der Entfernung zwischen dem Tumor und Ösophagogastrischen Junction Die meisten Gastroskopen haben eine Skala mit ca. 5 cm Abstufungen. Wenn der Abstand zwischen dem Rand des Tumors und des gastroösophagealen Übergang ist 5 cm oder weniger, ist es zu schwierig , den proximalen Teil des Magens zu halten , und der Chirurg sollte insgesamt Gastrektomie für Magenkrebs führen. Bitte hier klicken , um eine größere Version zu sehen diese Figur.
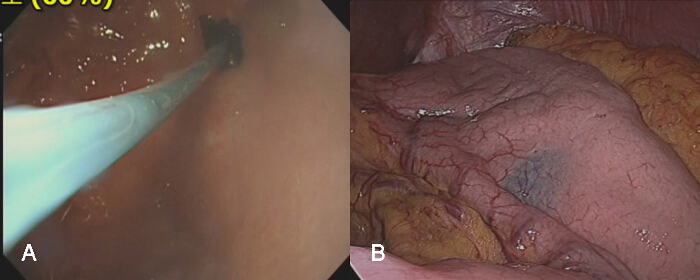
Abbildung 3: Die Injektion von blauen Farbstoff in die Magenwand. A) Eine endoskopische Injektor kann Einfüh seineinen kleinen Kanal auf dem Gastroskop ed durch. Die Nadel des Injektors endoskopischen freigelegt ist, und in die Magenwand in einem Bereich 2 injiziert - 3 cm proximal von der Tumorrand. Wenn die Nadel zwangsweise in die Magenwand eingeführt wird, kann es die Magenwand durchdringen, und der Farbstoff wird in die Bauchhöhle injiziert werden. B) Dies würde die Identifizierung des genauen Ort des Tumors schwierig in der laparoskopischen Ansicht machen. Daher sollte diese Injektionsverfahren sorgfältig durchgeführt werden. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
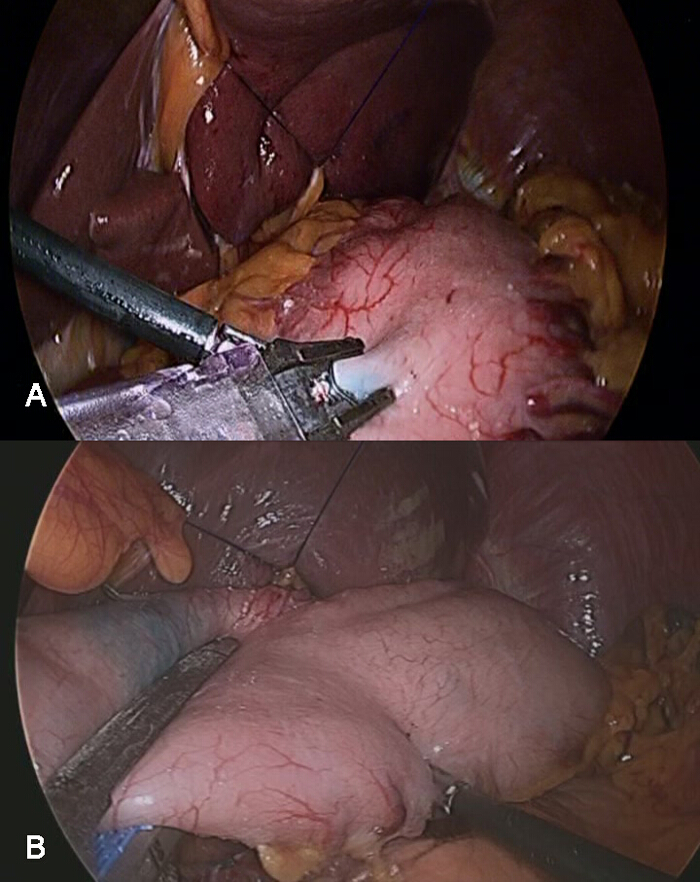
Abbildung 4: Die laparoskopische Resektion Geleitet von der eingefärbten Oberfläche des Magens nach Lympknotendissektion, sollte der Magen im richtigen Bereich reseziert werden , um COMPLETEL.y den Primärtumor entfernen. A) eine Markierung mit einem laparoskopischen Clip, der in die Bestimmung des Abschnitts zur Resektion nützlich sein kann, sollte 5 bis 10 min nach gastroskopischen Injektion des Farbstoffes. B) Die laparoskopische Resektion abgeschlossen werden kann , mit zwei angewendet werden oder drei laparoskopische lineare Heftern. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 5:. Änderung erforderliche Zeit für die intraoperative Gastroskopie und Tumorlokalisation Die mittlere Zeit für Tumorlokalisation mit intraoperative Gastroskopie (8,4 min) allmählich von 11,8 min (Anfangs 5 Fälle) bis 4,6 min (letzte 5 Fälle).
Diskussion
In diesem Protokoll haben wir ein Verfahren für die intraoperative Gastroskopie, um genau und zuverlässig Tumorlokalisation in dem mittleren Drittel des Magens identifizieren. Wir konnten erfolgreich distale subtotale Gastrektomie über die Ergebnisse der intraoperativen Gastros Basis durchführen.
Bis heute wurden verschiedene Verfahren angewandt, um die Lage der frühen Magenkrebs in der laparoskopischen Ansicht zu identifizieren. Die häufigsten Methoden der präoperativen gastroskopischen Clipping verwendet, und Chirurgen könnten die Position der Clips mit der laparoskopischen Sonografie oder tragbare Ebene Radiographie. 7,9 Diese Techniken erforderlich zusätzliche präoperative Gastroskopie ein oder zwei Tage vor der Operation erkennen. Die laparoskopische Sonografie für die intraoperative Detektion von Clips erfordert spezielle Instrumente und Fähigkeiten und eine subjektive Interpretation. Eine weitere Option kann die intraoperative tragbare Radiologie, zeigen nur eine zweidimensionale Ansicht; zusätzliche Exposition gegenüber radiati können sich an Patienten schädlich sein. Vor kurzem Jeong und Kollege berichtete gastroskopischen autologe Blut Tätowieren vor der Operation. 8 Sie berichteten , dass dieses Verfahren auch die präoperative Gastros einen Tag vor der Operation erfordert, und folglich ist unbequem für die Patienten. Ein weiterer Nachteil dieses Verfahrens ist, dass es unmöglich ist, eine falsche Injektion in die Magenwand vor der Operation zu erkennen.
Im Gegensatz zu anderen Verfahren, führten wir weitere Gastroskopie, während die Patienten unter Narkose während der Operation waren. Daher wird in der vorliegenden Studie wurden die Patienten vermieden, die Unannehmlichkeiten zusätzlicher präoperativen Gastroskopie. Der Farbstoff in die Muskelschicht injiziert wurde leicht während der Operation festgestellt, weil wir die Serosa in 5 bis 10 min nach der Injektion untersucht und eingeklipst unmittelbar auf die Mitte des gefärbten serosa vor dem Farbstoff Ausbreitung. Die genaue Tumorlokalisation wurde bei allen Patienten mit unserem Verfahren nachgewiesen werden.
ntent "> Der kritische Schritt unseres Verfahrens ohne Leckage in den extraluminalen Bereich Injektion des blauen Farbstoffes in die Magenwand ist. Wenn häufiger verwendeten Farbstoffe, wie Methylenblau, in die intraperitoneale Bereich auslaufen, besteht die Sorge für das Auftreten von postoperativen Adhäsionen, Methämoglobinämie, und Lungenödem durch Chromopertubation. In unserem Protokoll, Indigocarmin wird anstelle von Methylenblau blau~~POS=HEADCOMP verwendet, da es eine relativ nicht-toxisch, billig Farbstoff ist. Trotzdem kann die Leckage des Farbstoffes präzise Lokalisierung von Tumoren erschweren. Deshalb es wird empfohlen, dass ein Chirurg in gastroskopischen Verfahren erlebt, wie endoskopische Injektion, dieses Verfahren durchführen.Wenn blauen Farbstoff und ein spezifisches Instrument wie eine endoskopische Injektor nicht verfügbar sind, kann unser Verfahren geändert werden. Sobald der Operateur die Gastroskop einfügt und bläht den Magen, komprimiert der Assistenzarzt den Bereich, wo der Primärtumor t erwartet wird,o angeordnet werden, so dass der Operateur den Abstand zwischen dem Ort des Primärtumors und der Druck Läsion zu identifizieren. Durch die Kommunikation zwischen dem Betrieb und der Assistenzarzt, kann der Tumor präzise lokalisiert werden.
Mehrere Einschränkungen der Technik zur Tumorlokalisierung sollte berücksichtigt werden. Erstens kann die intraoperative Gastroskopie eine Lernkurve für spezielle endoskopische Fähigkeiten erfordern. Ein Bericht vorgeschlagen , dass Chirurgen würde die Lernkurve von gastroskopischen Verfahren nach etwa 80-90 Fälle überwinden. 12 Der Chirurg, der an dieser Studie teilgenommen ausreichende Erfahrung hatte (mehr als 400 Fälle) , die Lernkurve zu überwinden. Manchmal kann die intraoperative Gastros schwierig sein, aufgrund der Positionierung der Patienten unter Vollnarkose. Wenn der Anästhesist den Kiefer des Patienten erstreckt, kann die Gastroskop leicht durch den Hals und in die Speiseröhre eingeführt werden. Zweitens bestimmte Geräte für diese procEDURE, wie die Gastroskopie-System sollte im Operationssaal bereit. Aber auch mehrere vor kurzem vorgeschlagen Verfahren zur Magenresektion Verwendung eines intraoperativen Gastroskop erfordern. 13,14 In Zukunft wird die intraoperative Gastroskopie in Magen - Operation häufiger sein, und die Gastroskopie - System wird im OP Drittens Tumorränder wesentlich sein waren nur durch endoskopische Befunde in diesem Protokoll festgelegt. Manchmal kann die Marge von oberflächlich spreitendes Tumoren unklar, obwohl ein erhöhter und verfärbte Läsion angenommen werden kann, ein Tumor sein. Recent entwickelnde Techniken, wie beispielsweise Infrarot - Endoskopie oder molekulare in vivo Bildgebung, kann die Tumorrand überprüfen; wenn auf die intraoperative Gastroskopie angelegt, 15,16 das Verfahren dieses Protokoll kann genauer und nützlich sein.
intraoperative Gastroskopie für Tumorlokalisation Abschließend ist eine genaue und tolerierte Methode für Patienten mit Magenkrebs unterziehening total laparoskopische distalen Gastrektomie.
Offenlegungen
The authors have no conflicts of interest or financial ties to disclose.
Danksagungen
This study was supported by a grant from the National R&D Program for Cancer Control, Ministry of Health & Welfare, Republic of Korea (1320270).
Materialien
| Name | Company | Catalog Number | Comments |
| Pentothal Sodium | JW pharmatheutical Co. | 644912100 | It was used as induction asgent |
| Rocumeron | Ilsung pharmatheutical Co. | 655402960 | It was used for general anesthestia as muscle relaxant. |
| SevoFRAN | Hana pharmatheutical Co. | 657801060 | It was used as general anesthetics |
| Endoscopy system | Olympus Corp. | CLV-260 | It was used for intraoperative GFS |
| Laparoscopic surgery system | Striker Endoscopy | 1488 HD 3-CHIP | It was a system for laparoscopic surgery |
| Ultrasonic scissor | Johnson and Johnson Medical Corp. | HAR23 | It was used during tissue dissection |
| Laparoscopic clip | Johnson and Johnson Medical Corp. | ER420 | It was used for ligation of the vessels. |
| Indigo carmine | Korea United Pharma | Carmine | It was injected into the gastric wall |
| Linear stapler | Johnson and Johnson Medical Corp. | ECHELON FLEX Powered Endopath Stapler | It was used for resection the stomach |
| Gastroscopic injector | TaeWoong Medical | Cobra injector | I was used for gastroscopic injection of blue dye |
Referenzen
- Kim, Y. W., Yoon, H. M., Eom, B. W., Park, J. Y. History of minimally invasive surgery for gastric cancer in Korea. J Gastric Cancer. 12, 13-17 (2012).
- Kim, H. H., et al. Morbidity and mortality of laparoscopic gastrectomy versus open gastrectomy for gastric cancer: an interim report--a phase III multicenter, prospective, randomized Trial (KLASS Trial). Ann Surg. 251, 417-420 (2010).
- Kim, M. C., Kim, K. H., Kim, H. H., Jung, G. J. Comparison of laparoscopy-assisted by conventional open distal gastrectomy and extraperigastric lymph node dissection in early gastric cancer. J Surg Oncol. 91, 90-94 (2005).
- Kim, Y. W., et al. Improved quality of life outcomes after laparoscopy-assisted distal gastrectomy for early gastric cancer: results of a prospective randomized clinical trial. Ann Surg. 248, 721-727 (2008).
- Kinoshita, T., et al. Comparison of laparoscopy-assisted and total laparoscopic Billroth-I gastrectomy for gastric cancer: a report of short-term outcomes. Surg Endosc. 25, 1395-1401 (2011).
- Song, K. Y., et al. Is totally laparoscopic gastrectomy less invasive than laparoscopy-assisted gastrectomy?: prospective, multicenter study. J Gastrointest Surg. 12, 1015-1021 (2008).
- Hyung, W. J., et al. Intraoperative tumor localization using laparoscopic ultrasonography in laparoscopic-assisted gastrectomy. Surg Endosc. 19, 1353-1357 (2005).
- Jeong, O., Cho, S. B., Joo, Y. E., Ryu, S. Y., Park, Y. K. Novel technique for intraoperative tumor localization during totally laparoscopic distal gastrectomy: endoscopic autologous blood tattooing. Surg Endosc. 26, 1778-1783 (2012).
- Kim, H. I., et al. Intraoperative portable abdominal radiograph for tumor localization: a simple and accurate method for laparoscopic gastrectomy. Surg Endosc. 25, 958-963 (2011).
- Kim, H. I., Cho, I., Jang, D. S., Hyung, W. J. Intracorporeal esophagojejunostomy using a circular stapler with a new purse-string suture technique during laparoscopic total gastrectomy. J Am Coll Surg. 216, e11-e16 (2013).
- Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gast Can. 14, 113-123 (2011).
- Lee, H. H., Song, K. Y., Park, C. H., Jeon, H. M. Training of surgical endoscopists in Korea: assessment of the learning curve using a cumulative sum model. J Surg Educ. 69, 559-563 (2012).
- Cho, W. Y., et al. Hybrid natural orifice transluminal endoscopic surgery: endoscopic full-thickness resection of early gastric cancer and laparoscopic regional lymph node dissection--14 human cases. Endoscopy. 43, 134-139 (2011).
- Abe, N., et al. Endoscopic full-thickness resection with laparoscopic assistance as hybrid NOTES for gastric submucosal tumor. Surg Endosc. 23, 1908-1913 (2009).
- Hoetker, M. S., et al. Molecular in vivo imaging of gastric cancer in a human-murine xenograft model: targeting epidermal growth factor receptor. Gastrointest Endosc. 76, 612-620 (2012).
- Ishihara, R. Infrared endoscopy in the diagnosis and treatment of early gastric cancer. Endoscopy. 42, 672-676 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten