Uso de la calorimetría diferencial para medir los cambios en la entalpía
Visión general
Fuente: Laboratorio del Dr. Terry Tritt — Universidad de Clemson
Calorimetría diferencial de barrido (DSC) es un método de análisis termodinámico basado en método de flujo de calor, en donde un material de muestra (dentro de una sartén) y un recipiente vacío de referencia son sometidos a condiciones idénticas de temperatura. La diferencia de energía que es necesaria para mantener ambas las cazuelas a la misma temperatura, debido a la diferencia en la capacidad de calor de la muestra y el pan de la referencia, se registra como una función de la temperatura. Esta energía liberada o absorbida es una medida de la entalpía (ΔΗ) de la muestra con respecto a la bandeja de referencia.
Principios
El DSC se puede utilizar para medir la capacidad de calor de los sistemas materiales, así como el cambio de entalpía (ΔΗ) para los procesos de transformación dramática fase, reacciones químicas, ionizations, disoluciones en disolventes, formación de vacante y así sucesivamente. La entalpía estándar de formación se define como el cambio en entalpía, cuando un mol de una sustancia en el estado estándar están formados de elementales constituyentes en sus Estados estables. 1
La configuración de medida DSC consiste en un horno y un sensor integrado conectado a termopares con posiciones designadas para la muestra y la referencia. La temperatura de la muestra y la referencia son controlados independientemente usando hornos separados pero idénticos. La medición de la DSC se lleva a cabo en tres pasos: medición de línea de base con la bandeja vacía y referencia, medida de referencia estándar para probar la exactitud y la medida de la muestra.
Este video explica la preparación de la muestra y la técnica de medida de la entalpía de formación de un óxido por medio de la descomposición de un carbonato.
Procedimiento
1. línea base medida
- Controlador de medición unidad, sistema informático, termostato aproximadamente 60 minutos antes de comenzar la medición. Purga de gases deben estar conectados al sistema.
- Colocar los dos crisoles vacíos (con tapa) en el portamuestra. El material del crisol puede elegirse basándose en el rango de temperatura a medir.
- Mueva el horno posición de medida.
- Ajustar las condiciones de medición (gas, vacío).
- Inicie el programa de medición.
- Proceder a crear una medición basal en masa de muestra = 0.
- Recalibración de temperatura abierta, programas de sensibilidad abierta.
- Establecer el programa de temperatura, temperatura inicial, velocidad de calentamiento.
- Establecer las condiciones iniciales y la temperatura los valores umbral. Después de purgar el sistema con gas de argón/nitrógeno un par de veces, permitir que el gas fluya continuamente a través del sistema, ajuste el flujo a una tasa constante (p. ej. 50 mL/min).
- Iniciar la medición.
- Las mediciones DSC se comenzaron a temperatura ambiente después de una estabilización inicial a la temperatura inicial. La estabilización de la temperatura es paso importante para evitar cualquier desplazamiento debido a una diferencia en la capacidad térmica de la bandeja de la muestra y la referencia bandeja y contenido. Generalmente se utiliza una velocidad de calentamiento constante de 20 ° C/min, bajo atmósfera de gas argón. La gama de temperatura se determina según la muestra y la temperatura de interés.
2. estándar de la muestra medida para asegurar la exactitud del sistema de
- Abra la unidad de medida después de que el horno se haya enfriado.
- Retire el crisol vacío que es señalado como el recipiente de la muestra.
- Elegir el estándar según el rango de temperatura a medir.
- Pesar de la norma. Un disco finamente pulido zafiro sintético (carborundo, óxido de aluminio) se utiliza como capacidad calorífica y entalpía de transformación estándar. Zafiro es estable en un amplio rango de temperatura, y su capacidad calorífica se ha determinado con precisión en un amplio rango de temperatura.
- El inserto muestra estándar cuidadosamente en el crisol de la muestra con pinzas.
- Mueva el horno posición de medida.
- Ajustar las condiciones de medición (gas, vacío).
- Proceda como sigue para combinar la medición con la medición de la corrección:
- Uso muestra = masa x mg (masa de la muestra estándar).
- Abrir nueva calibración de la temperatura, abrir la sensibilidad
- Usar el mismo programa de temperatura (programa de temperatura se mantiene igual que el programa de temperatura de línea de base)
- Iniciar la medición.
- Establecer las condiciones iniciales y la temperatura los valores umbral. Después de purgar el sistema un par de veces, que la purga gas fluya continuamente a través del sistema, ajuste de la tasa de flujo.
- Condiciones de medición (velocidad de calentamiento por ejemplo. , gases, tipo de crisol) para la línea base y la posterior medición estándar deben ser el mismo.
- Con las misma sensibilidad y temperatura calibración archivos, el programa de inicio para medir la muestra estándar.
3. la muestra medida
- Pulir las superficies de la muestra. Coloque la superficie más plana del reborde de muestra hacia el fondo de la olla. Utilice un tamaño de muestra óptimo que se adapte a la cacerola, sin tocar la tapa. La muestra se pule finamente para obtener buen contacto térmico con el recipiente de muestra, puede determinarse con precisión la temperatura y los datos son menos ruidosos.
- Medir la muestra masa con precisión.
- Abra la unidad de medida después de que el horno se haya enfriado.
- Retire la muestra estándar del crisol.
- Limpie la placa con alcohol. Introduzca la muestra a medir en el crisol de sustitución de la norma.
- Siga el paso 3 para medir la muestra. Las condiciones de medición (por ejemplo calefacción tarifa, gases, tipo de crisol) para la medición de línea de base y la posterior estándar y medida de muestra deben ser la misma.
- Siga el paso 3 para completar la medida.
Resultados
Formación de ZnO por descomposición de ZnCO3
El cambio de entalpía por cada grado, a presión constante es equivalente a la capacidad calorífica de un material a presión constante dada por la ecuación 1. El cambio de entalpía se obtiene al calcular el área bajo la curva entre dos límites de temperatura dado por la ecuación 2.
 (Ecuación 1)
(Ecuación 1)
 (Ecuación 2)
(Ecuación 2)
Uso de software específico, el área bajo la curva se obtiene de cualquier medida de la capacidad de calor. El DSC proporciona un comparativo método exacto de medir la capacidad de calor y los cambios de entalpía.
A continuación se muestra un resultado representativo de la descomposición del carbonato del cinc (ZnCO3) formación de ZnO. Por el proceso de calcinación, ZnCO3 se descompone a ZnO, liberando dióxido de carbono. Con una composición a partir de Zn5(CO3)2(OH)6 un amplio pico exotérmico alrededor 281 ° C fue reportado por Liu et al. 2 después de la liberación de H2O y CO2 según la ecuación 3.
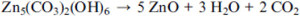 (Ecuación 3)
(Ecuación 3)
La entalpía de transformación de Zn5(CO3)2(OH)6 a ZnO puede estimarse calculando el área bajo la curva en el punto de descomposición dada por el siguiente pico exotérmico. Usando la ley de Hess de la suma de calor constante, puede estimarse la entalpía de formación de ZnO.
Aplicación y resumen
Un área de mayor aplicación de DSC es la transición vítrea (Tg) en polímeros amorfos, en la cual el material cambia de un estado vidrioso rígido a un estado líquido viscoso. Investigación farmacéutica en nano-partículas es también un campo emergente, donde el DSC se ha utilizado para cuantificar la fase amorfa o cristalina en nano-sólidos. Una revisión de las técnicas de DSC en las aplicaciones de nano-ciencia y biología ha sido proporcionada por Gill et al.. 3 nanoestructurados lípidos (NLC) tienen posibles aplicaciones en medicina y han sido considerados como portadores de la entrega de drogas.
Calorimetría es un método de análisis de propiedades térmicas de materiales para determinar el cambio de entalpía asociado a una reacción física o química de interés. Aparatos para medidas calorimétricas se utilizan con frecuencia para la cuantificación de fases cristalinas o amorfas. Más recientemente, las mediciones DSC se utilizan en los campos de la nano-ciencia y bioquímica para medir propiedades termodinámicas de bio-moléculas de tamaño nanométrico. La DSC puede utilizarse también para analizar los cambios químicos en una muestra oxidada. La entalpía de formación de diferentes óxidos metálicos es útil para cálculos metalúrgicos e industriales.
La estimación del calor de formación de óxidos generalmente requiere la combustión del metal específico en oxígeno dentro de un calorímetro, que puede conducir al daño de costosos sensores y termopares del equipo particular. La estimación del calor de formación de un óxido, mediante proceso de calcinación a través de la descomposición de un carbonato produciendo gas tóxico dióxido de carbono, da un método simple de estimación del calor de formación del óxido correspondiente. La estimación de la entalpía de transformación de carbonatos no es sólo aplicable para el modelado de proceso geoquímico, sino también útil para la investigación fundamental y aplicaciones industriales.
Referencias
- Robinson, J.W., Skelly Frame, E.M., Frame, GM. Undergraduate Instrumental Analysis. Marcel Decker, New York, NY. (2005).
- Liu, S., Li, C., Yu, J., Xiang, Q., Improved visible-light photocatalytic activity or porous carbon self-doped ZnO nanosheet-assembled flowers. CrystEngComm. 13, p 2533 (2011).
- Gill, P., Tohidu Moghadam, T., Ranjbar, B. Differential Scanning Calorimetry Techniques: Applications in Biology and Nanoscience. Biomolecular Techniques. 21, 167-193 (2010).
Divulgaciones
Tags
Saltar a...
Vídeos de esta colección:

Now Playing
Uso de la calorimetría diferencial para medir los cambios en la entalpía
General Chemistry
44.7K Vistas

Cristalería de laboratorio y usos comunes
General Chemistry
658.3K Vistas

Soluciones y concentraciones
General Chemistry
275.1K Vistas

Determinación de la densidad de un sólido y líquido
General Chemistry
556.8K Vistas

Determinación de la composición porcentual en masa de una solución acuosa
General Chemistry
383.8K Vistas

Determinación de la fórmula empírica
General Chemistry
183.7K Vistas

Determinación de las reglas de solubilidad de compuestos iónicos
General Chemistry
141.6K Vistas

Uso del medidor de pH
General Chemistry
346.7K Vistas

Introducción a la titulación
General Chemistry
425.4K Vistas

Ley del Gas ideal
General Chemistry
79.0K Vistas

Determinación espectrofotométrica de la constante de un equilibrio
General Chemistry
158.7K Vistas

Principio de le Châtelier
General Chemistry
265.8K Vistas

Depresión del punto de congelación para determinar un compuesto desconocido
General Chemistry
160.8K Vistas

Determinación de las leyes de la velocidad y el orden de la reacción
General Chemistry
196.3K Vistas

Complejos de coordinación
General Chemistry
91.7K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados