Method Article
Resonancia magnética nuclear de desplazamiento puro: una nueva herramienta para la metabolómica de las plantas
En este artículo
Resumen
Este artículo presenta el uso de PSYCHE y SAPPHIRE-PSYCHE en el perfil metabólico de las plantas e incluye procedimientos detallados para la preparación de muestras y el registro óptimo de los espectros de RMN de Pure Shift. Se discuten ejemplos a través de los cuales la ganancia en resolución lograda por el desacoplamiento homonuclear permite una comprensión más completa del sistema.
Resumen
La Resonancia Magnética Nuclear (RMN) es una de las herramientas más potentes utilizadas en metabolómica. Se erige como un método altamente preciso y reproducible que no solo proporciona datos cuantitativos, sino que también permite la identificación estructural de los metabolitos presentes en mezclas complejas.
El perfil metabólico porRMN 1 H ha demostrado ser útil en el estudio de diversos tipos de escenarios vegetales, que incluyen la evaluación de las condiciones del cultivo, los tratamientos de cosecha y poscosecha, el fenotipado metabólico, las rutas metabólicas, la regulación génica, la identificación de biomarcadores, la quimiotaxonimia, el control de calidad, la denominación de origen, entre otros. Sin embargo, la superposición de señales del gran número de resonancias con multiplicidades de acoplamiento J expandidas complica el análisis de espectros y su interpretación, y representa una limitación para el perfilado clásico de RMN de 1H.
En la última década, se han desarrollado nuevas técnicas de desacoplamiento homonuclear de banda ancha de RMN a través de las cuales las señales de múltiples plets colapsan en líneas de resonancia simples, comúnmente llamados métodos de desplazamiento puro, para superar el problema de resolución de espectros inherente a los espectros clásicos de RMN de 1H.
Aquí se presenta un protocolo paso a paso de la preparación del extracto de la planta y el procedimiento para registrar los espectros óptimos de Pure Shift PSYCHE y SAPPHIRE-PSYCHE en tres matrices de plantas diferentes: hojas de planta de vainilla , tubérculos de papa (S. tuberosum) y grosellas espinosas (P. peruviana). Se discute el efecto de la ganancia de resolución en la identificación metabólica, el análisis de correlación y los análisis multivariados, en comparación con los espectros clásicos.
Introducción
El conjunto completo de metabolitos que componen un organismo (sustratos, intermedios y productos finales de procesos biológicos) se acuñó en 1998 con el término metaboloma. Es bien sabido que el metaboloma está estrechamente relacionado con el fenotipo, y es de particular interés en las plantas, ya que refleja la interacción directa entre el genotipo y el medio ambiente 1,2. Por lo tanto, la caracterización del perfil metabolómico se ha vuelto de suma importancia en las plantas. A través de la identificación y cuantificación de biomarcadores (metabolitos clave) y patrones metabólicos, seha permitido la discriminación entre especies, cultivares, etapas de desarrollo, enfermedades patogénicas o condiciones ambientales (cambios diarios y estacionales, suelos, estrés hídrico, estrés mecánico, tratamientos de cosecha y poscosecha), entre otros3,4,5.
La espectrometría de masas (MS) y la espectroscopia de resonancia magnética nuclear (RMN) son las plataformas analíticas más utilizadas para este fin. A diferencia de las metodologías de EM, la RMN es una técnica altamente reproducible, no sesgada, cuantitativa, precisa y no destructiva que requiere una preparación mínima de la muestra, lo que la hace adecuada para estudios metabolómicos. Sin embargo, en comparación con los métodos de EM, la baja sensibilidad inherente es una limitación. En los últimos años y mediante el uso de imanes de alto campo, sondas criogénicas, dispositivos de microbobina y métodos de polarización nuclear dinámica (DNP), la sensibilidad de la RMN ha mejorado considerablemente. En el caso de este último método, por ejemplo, la ganancia de sensibilidad fue de dos a tres órdenes de magnitud 6,7. Hasta la fecha, casi el 20% de los estudios metabolómicos publicados están basados en RMN y el número está aumentando7.
A pesar de que la RMN de protones es el experimento más popular y sensible para la huella digital de la metabolómica de RMN, tiene algunos inconvenientes. En primer lugar, todas las señales de RMN de 1H detectadas en la muestra se distribuyen en una pequeña ventana correspondiente a la ventana de desplazamiento químico del protón, lo que da lugar a espectros abarrotados. En segundo lugar, el acoplamiento escalar homonuclear divide las señales en múltiples componentes (multiplicidad de señales), extendiendo la señal de protones a un rango de frecuencia más amplio, complicando aún más la lectura de los espectros al aumentar la aglomeración y la superposición de señales. Además, la metabolómica de RMN se emplea en el análisis de mezclas que generalmente contienen de 50 a 300 moléculas a una concentración observable de RMN, generando espectros complejos compuestos por 200 a 2000 picos.
La RMN de protones de desacoplamiento homonuclear, también conocida como desplazamiento puro, es un método que induce el colapso de una señal multiplete en un solo pico. Se erige como una excelente herramienta para aumentar la resolución de la señal en espectrosabarrotados 8,9,10 y, por lo tanto, representa una herramienta conveniente para la metabolómica de las plantas11.
En la última década, han surgido nuevas secuencias de pulsos Pure Shift, que aumentan tanto la sensibilidad como el rendimiento de desacoplamiento. Su gama de aplicaciones también se ha ampliado, desde la elucidación de la estructura molecular12,13, hasta la fluxómica14, la asignación de mezclas 15,16,17, las mediciones de difusión traslacional 18, la discriminación enantiomérica19, la distribución de unidades en copolímeros20, entre otras.
Históricamente, los experimentos de Broadband Pure Shift adolecen de baja sensibilidad y métodos de procesamiento complicados, lo que limita su alcance en la evaluación de extractos biológicos8. En 2014, Foroozandeh et al. publicaron un nuevo experimento de Pure Shift, PSYCHE (Pure Shift Yielded by Chirp Excitation), basado en la secuencia de pulsos anti-z-COSY que produjo un excelente desacoplamiento homonuclear y valores de sensibilidad mejorados21. Sin embargo, como PSYCHE es un experimento de interferograma 2D en el que se adquieren trozos de datos en el dominio del tiempo, sufre de artefactos periódicos de banda lateral que resultan de las distorsiones de modulación de acoplamiento J en los bordes del fragmento. En mezclas complejas, estos artefactos producen señales mayores que las asociadas con metabolitos presentes en concentraciones muy bajas, lo que dificulta el análisis11. Existen dos métodos para eliminar estos artefactos: TSE-PHYCHE22 y una modificación más reciente del experimento PSYCHE llamada SAPPHIRE-PSYCHE (Sideband Averaging by Periodic PHasa Incrementation of Residual J Evolution)23.
En 2019, demostramos por primera vez11 que el método SAPPHIRE-PSYCHE Pure Shift, que elimina artefactos casi sin penalización de sensibilidad23, podría emplearse para el análisis de mezclas biológicas complejas, como extractos de los frutos de Physalis peruviana, comúnmente conocidos como uchuvas11. Demostramos que estos métodos aumentan el rendimiento de los análisis de datos metabolómicos, como la asignación metabólica, el análisis de correlación y el análisis de coeficientes multivariados11. Desde entonces, se han abordado varios estudios metabolómicos de Pure Shift sobre diferentes matrices biológicas, como los corales blandos24, las plantas de hipérico25, la miel26,27, el té27, el aceite de menta26 y las nueces28, lo que demuestra su importancia como una nueva herramienta para el análisis metabolómico. Paradójicamente, la gran mayoría de estos estudios emplearon la secuencia de pulsos PSYCHE estándar y fácil de implementar, disponible en cualquier biblioteca de espectrómetros, en lugar de la secuencia de pulsos SAPPHIRE-PSYCHE, que ha demostrado tener un mejor rendimiento. Sin embargo, requiere una mejor comprensión de la secuencia de pulsos para una configuración adecuada.
El objetivo de este trabajo es ayudar a los nuevos usuarios a aplicar los métodos Pure Shift en el estudio de plantas, en particular, hojas de Vanilla sp (V. planifolia y V. pompona)29, tubérculos de papa (S. tuberosum)30 y uchuvas (P. peruviana)31. La preparación de la muestra, la configuración experimental de la RMN, la adquisición de datos y el análisis de los datos se describen en detalle. Además, el protocolo incluye notas clave para ayudar a los investigadores, nuevos en el campo, a configurar adecuadamente los experimentos PSYCHE y SAPPHIRE-PSYCHE en el perfil metabolómico de las plantas.
Protocolo
1. Preparación de la muestra
- Grosellas espinosas del Cabo
- Coloque 100-200 g de frutas frescas en un vaso de licuadora. Mantener a 4 °C durante 30 min, y luego homogeneizar en una batidora de laboratorio.
- Inmediatamente, transfiera el jugo a tubos de plástico de 50 ml, congélelos en nitrógeno líquido y liofilicelos hasta que se seque durante 4 a 5 días.
- Muele el material liofilizado hasta convertirlo en polvo fino con un molinillo eléctrico.
NOTA: El manejo del material seco debe realizarse rápidamente porque el polvo es altamente higroscópico. - Pesar 1 g del material molido y añadir 10 mL de agua ultrapura. Vórtice durante 1 min.
- Sonicar durante 20 min a 10 °C y, a continuación, centrifugar a 23.000 × g durante 20 min a 10 °C.
- Recuperar el sobrenadante y filtrarlo a través de un filtro de jeringa de politetrafluoroetileno (PTFE) de 13 mm y 0,45 μm.
- Liofilizar 1 mL del extracto filtrado hasta que se seque y luego volver a suspender el sólido obtenido en 0,9 mL de tampón de oxalato de sodio de 200 mM pH 4. Vórtice.
- Liofilizar la muestra resultante hasta que se seque y disolverla en 0,9 mL de óxido de deuterio que contenga 5 mM de sal sódica ácida 3-(trimetilsilil)propiónica-2,2,3,3-d4 (TMSP-d4).
- Llene el tubo de RMN con 0,6 ml de la muestra utilizando una micropipeta.
- Hojas de vainilla
- Recoge las hojas, límpialas con papel de seda húmedo y congélalas enteras en nitrógeno líquido.
- Romper las hojas en trozos pequeños y liofilizar durante 4 días hasta que se sequen.
- Muele la materia seca hasta convertirla en un polvo fino con un molinillo eléctrico.
- Pesar 50 mg de material molido y añadir 0,75 mL de tampón de fosfato pH 6,0 en óxido de deuterio que contenga 0,1% de TMSP (p/p) y 0,75 mL de metanol-d4. Vórtice durante 1 min.
- Sonicado durante 20 min a 25 °C.
- Centrifugar a 13.000 × g durante 10 min a 25 °C.
- Recuperar el sobrenadante (~1,3-1,4 mL) y filtrarlo a través de un filtro de jeringa de PTFE de 13 mm y 0,45 μm.
- Llene el tubo de RMN con 0,6 ml de la muestra filtrada con una micropipeta.
- Tubérculos de patata
- Pelar y cortar en rodajas de 4 a 8 tubérculos. Inmediatamente, coloque aproximadamente 125 g de material en bolsas verticales y congélelas en nitrógeno líquido.
NOTA: Para evitar la oxidación durante la manipulación, mantenga la patata húmeda. - Liofilizar durante 4 a 6 días hasta que se seque por completo.
- Muele la materia seca hasta convertirla en un polvo fino con un molinillo eléctrico.
- Pesar 160 mg de tubérculo molido y añadir 1,6 mL de agua desionizada. Vórtice durante 1 min.
- Sonicado durante 45 min a 10 °C.
- Centrifugar a 23.000 x g durante 20 min a 10 °C.
- Recuperar el sobrenadante (~1,5 -1,6 mL) y evaporarlo hasta la sequedad en un concentrador de vacío centrífugo refrigerado durante 16 h, a 10 °C.
- Añadir al sólido obtenido (20-25 mg) 0,9 mL de 100 mM de tampón de oxalato sódico pH 4, vórtice, y evaporar durante 16 horas a 10 °C.
- Disolver el sólido obtenido en 0,9 mL de óxido de deuterio conteniendo 3 mM de TMSP.
- Centrifugar a 23.000 x g durante 5 min a 10 °C y filtrar el sobrenadante directamente en el tubo de RMN a través de un filtro de jeringa de PTFE de 13 mm y 0,45 μm.
NOTA: En este caso, se realizó una filtración directa en el tubo de RMN para disminuir los pasos en la preparación de más de 1000 muestras.
- Pelar y cortar en rodajas de 4 a 8 tubérculos. Inmediatamente, coloque aproximadamente 125 g de material en bolsas verticales y congélelas en nitrógeno líquido.
2. Adquisición y procesamiento de datos de RMN
- Configuración inicial de RMN
- Transfiera las muestras al espectrómetro de RMN.
- Ajuste y haga coincidir la cabeza de la sonda.
- Bloquee y calce la muestra.
- Calibra el pulso duro de 90°. Calibre el pulso de 90° utilizando cualquiera de los procedimientos estándar.
- Ejecute un espectro de RMN de protones 1D estándar.
- Experimento PSYCHE
- Seleccione la secuencia de pulsos reset_psyche_1d de la biblioteca Topspin de Bruker (Figura S1). Utilice los siguientes parámetros estándar: ancho espectral de 5 kHz (SW2), al menos 1 o 2 segundos de retardo de recuperación de relajación (D1), 16 exploraciones ficticias (DS), 64 o 128 puntos de datos complejos por bloque (L31) y 64 o 128 exploraciones (NS) (Figura S1).
NOTA: L31 es el número de puntos digitales complejos adquiridos en cada bloque Pure Shift, es mejor establecerlo en una potencia de 2. 21 - Ajuste la excitación deseada del ángulo de inversión del pulso CHIRP (CNST61) y 10 kHz para el ancho de banda del pulso CHIRP (CNST60) (Figura S2).
NOTA: El experimento PSYCHE se basa en un esquema anti-z-COSY; en consecuencia, el ángulo de giro del pulso CHIRP debe ser pequeño para evitar artefactos de reacoplamiento (Figura 1). La intensidad absoluta aumenta con el ángulo de giro de la excitación. Los artefactos periódicos también se potencian, extendiéndose en el espectro y aumentando el "ruido" (Figura 1). El "ruido" se convierte en una combinación de ruido estándar y artefactos de chirrido. Un buen compromiso entre la sensibilidad y los artefactos de reacoplamiento bajos es establecer CNST61 = 20°. 19,22 - Ajuste la longitud del pulso duro (P1) al valor calibrado previamente y la longitud del pulso de la forma PSYCHE a 30 ms (P49) (Figura S2).
NOTA: Es muy importante calibrar el valor del pulso duro, ya que las potencias del pulso de forma se calcularán automáticamente a partir de este valor. - Elija el pulso de forma Crp_psyche.20 (SPNAM 37) para el elemento PSYCHE (Figura S2).
- Establezca la intensidad del gradiente de campo de pulso aplicado durante el elemento PSYCHE (GPZ0). Elija RECT.1 para el pulso de forma de gradiente (GPNAM 0) (Figura S2).
NOTA: Se aplica un gradiente de campo magnético débil durante el elemento PSYCHE, normalmente, entre el 1% y el 4% de la fuerza máxima del gradiente, dependiendo de la sonda. - Establezca el número de bloques a adquirir para reconstruir el FID de desplazamiento puro (TD1) (Figura S3).
NOTA: PSYCHE se adquiere como un experimento pseudo-2D donde TD1 es el número de bloques de interferograma Pure Shift. La resolución del espectro depende del tamaño de la ventana espectral (SW1) y del número total de puntos adquiridos, que es TD1 * 2 * L31. Normalmente, 16 o 32 bloques con 64 o 128 puntos complejos por bloque proporcionarán suficiente resolución digital. Como PSYCHE se registra en forma de interferograma, un mayor número de bloques aumenta la resolución digital, pero también el tiempo total de adquisición19. Los acoplamientos J homonucleares evolucionan durante cada bloque, lo que da como resultado un patrón de modulación J oscilante21,23. Después de la transformada de Fourier, esto genera artefactos periódicos de banda lateral que dependen de la longitud del bloque (Figura 2). Para reducir los artefactos, la duración del bloque debe ser corta, normalmente inferior a 16 ms (duración del bloque = 2*in0: Figura S1). Si la duración del bloqueo es alta, reduzca L31. - Procese los datos con el programa Proc_reset AU de Bruker y la transformada de Fourier.
NOTA: Recomendamos transformar el espectro utilizando el relleno de cero y una apodización de campana sinusoidal (Figura S4).
- Seleccione la secuencia de pulsos reset_psyche_1d de la biblioteca Topspin de Bruker (Figura S1). Utilice los siguientes parámetros estándar: ancho espectral de 5 kHz (SW2), al menos 1 o 2 segundos de retardo de recuperación de relajación (D1), 16 exploraciones ficticias (DS), 64 o 128 puntos de datos complejos por bloque (L31) y 64 o 128 exploraciones (NS) (Figura S1).
- Experimento SAPPHIRE-PSYCHE
- Seleccione la secuencia de impulsos SAPPHIRE-PSYCHE y ajuste los parámetros de la secuencia de impulsos. Los parámetros estándar serían los siguientes: anchura espectral de 5 kHz (SW3), al menos 1 ó 2 segundos de retardo de relajación (D1), 16 exploraciones ficticias (DS), 8 o 16 exploraciones por incremento (NS) y D2 a 14 ms (Figura S5).
NOTA: Esta secuencia no está en el repertorio de Bruker, sin embargo, la secuencia y los programas de procesamiento se pueden obtener del sitio web del Manchester NMR Methodology Group, (https://www.nmr.chemistry.manchester.ac.uk/?q=node/426)23. El retardo D2 garantiza que la relajación de T2 permanezca constante con cada incremento de modulación J. D2 debe ser mayor que 1/4 * SW1 + p16 + 2 * d16. 23 - Ajuste la excitación deseada del ángulo de inversión del pulso CHIRP (CNST20) y 10 kHz para el ancho de banda del pulso CHIRP (CNST21) (Figura S6).
NOTA: Al igual que en el experimento PSYCHE normal, el ángulo de cambio del pulso CHIRP debe ser corto para evitar artefactos de reacoplamiento. CNST20 = 20° es un buen compromiso entre la sensibilidad y los artefactos de reacoplamiento bajos 21,23,25. - Ajuste la longitud del pulso duro (P1) al valor calibrado previamente y la longitud del pulso de la forma PSYCHE a 30 ms (P40) (Figura S6).
NOTA: Es importante calibrar el valor del pulso duro, ya que las potencias del pulso de forma se calcularán automáticamente a partir de él. - Elija el pulso de forma PSYCHE_Saltire_10kHz_30m para el elemento PSYCHE (Figura S6).
- Establezca la intensidad del gradiente de campo de pulso aplicado durante el elemento PSYCHE (GPZ10). Elija RECT.1 para el pulso de forma de gradiente (GPNAM 10) (Figura S7).
NOTA: Se aplica un gradiente de campo magnético débil durante el elemento PSYCHE, normalmente, entre el 1% y el 4% de la fuerza máxima del gradiente, valor que depende de la sonda. - Establezca el número de incrementos de modulación SAPPHIRE J en F2 (TD2) (Figura S7).
NOTA: normalmente 8 incrementos aseguran una excelente supresión de los artefactos de banda lateral (Figura 2 y 3). El número total de escaneos del FID Pure Shift final es NS*TD2. 23 - Establezca las ventanas espectrales F1 y F2 (SW1 y SW2) (Figura S5).
NOTA: SW2 = SW3 / (2 * TD2) y SW3 / SW1 = TD2 * N, donde TD2 y N son números enteros pares23. El experimento SAPPHIRE-PSYCHE se adquiere como un pseudo 3D donde F2 codifica la modulación de fase del artefacto de acoplamiento J y F1 la adquisición del interferograma Pure Shift20. Dado que SAPPHIRE-PSYCHE elimina las bandas laterales de modulación J , la duración del bloque Pure Shift del interferograma podría ser más larga que la duración del bloque Pure Shift normal (duración del bloque Pure Shift = 1/SW1), normalmente entre 20 y 40 ms (Figura 2). Sin embargo, la adquisición de datos en fragmentos más largos conduce a evoluciones de acoplamiento J más altas, lo que requeriría más incrementos de modulación de fase de acoplamiento J para eliminar las bandas laterales más fuertes alcanzadas23. - Establezca el número de bloques Pure Shift (TD1) (Figura S7).
NOTA: Dado que SAPPHIRE-PSYCHE necesita compensar la modulación de fase de acoplamiento J del primer bloque, es necesario adquirir un bloque adicional. Normalmente, 17 (16+1) o 33 (32+1) bloques dan suficiente resolución digital23. - Procesar los datos ejecutando los programas pm_pshift y pm_fidadd AU seguidos de la transformada de Fourier23.
NOTA: Recomendamos transformar el espectro utilizando el relleno de cero y una apodización de campana sinusoidal (Figura S4).
- Seleccione la secuencia de impulsos SAPPHIRE-PSYCHE y ajuste los parámetros de la secuencia de impulsos. Los parámetros estándar serían los siguientes: anchura espectral de 5 kHz (SW3), al menos 1 ó 2 segundos de retardo de relajación (D1), 16 exploraciones ficticias (DS), 8 o 16 exploraciones por incremento (NS) y D2 a 14 ms (Figura S5).
Resultados
Análisis del espectro de RMN
Los experimentos PSYCHE aumentan la resolución de los espectros al colapsar las resonancias acopladas en singletes21, lo que a su vez reduce la superposición y facilita la asignación y el análisis de datos. Pure Shift NMR se puede aplicar a extractos de plantas. Aquí demostramos su uso en tres matrices diferentes: hojas de vainilla, tubérculos de papa y frutos de Physalis peruviana . La mejora de la resolución lograda en los espectros de estos extractos de plantas se ve claramente en las Figuras S8-S11.
Con el fin de evaluar el efecto de estas secuencias de pulsos en la resolución de la señal de RMN, se calculó el ancho de la línea en unidades de frecuencia al 10% de la altura máxima, W10, para varios tipos de resonancias, todo ello ejemplificado en espectros obtenidos con extractos de Vanilla sp - Pure Shift frente a la RMN clásica de 1H - Figura 4. En general, la expansión de las resonancias acopladas alcanzó valores de W10 de 1 a 60 Hz, mientras que los picos singlete variaron entre 1 y 10 Hz: el grupo metilo del ácido acético (1,97 ppm en la Figura 4) alcanzó un valor de W10 de 2,0 Hz en la RMN-1 Hclásica y de 2,1 Hz en el espectro SAPPHIRE-PSYCHE (S). La resonancia anomérica de la sacarosa (a 5,40 ppm), un doblete con un acoplamiento en J de 3,9 Hz, se extiende sobre una región equivalente a un W10 de 6,5 Hz, con cada pico individual representando 2,6 Hz de W10 (Figura 4). Este valor fue superior al del pico colapsado obtenido en el espectro SAPPHIRE-PSYCHE, W10 = 1,9 Hz (Figura 4). En el caso del ácido málico Hβ' (a 2,55 ppm), un doblete de dobletes con J = 7,8 Hz, 15,6 Hz, se extiende sobre 29,4 Hz (Figura 4), con valores de W10 calculados para cada pico individual entre 4,7 y 4,9 Hz. Esta señal multiplete colapsó por Pure Shift en una sola línea (a 2,55 ppm), expandiéndose sobre un valor W10 de 4,7 Hz (Figura 4).
La multiplicidad de señales se vuelve más compleja en hidrógenos altamente acoplados donde los picos constitutivos del multiplete ya no son fácilmente distinguibles, formando una señal casi continua. Este es el caso de los hidrógenos de ácido homocítrico, Hγ (a 2,24 ppm), Hδ (a 2,02 ppm) y Hδ' (a 1,91 ppm), Figura 4. Los multipletes Hγ, Hδ y Hδ'multiplets con W10 = 38,3 Hz, W10 = 41,5 Hz y W10 = 34,8 Hz, respectivamente, colapsaron a singletes de W10 = 7,8 Hz (Hγ, 2,24 ppm), W10 = 8,0 Hz (Hδ, 2,02 ppm) y W10 = 6,2 Hz (Hδ', 1,91 ppm), Figura 4. Esta resolución mejorada permitió una mejor discriminación de otras señales superpuestas correspondientes al ácido málico (Hβ, 2,77 ppm Hβ', 2,55 ppm), ácido homocítrico (Hα, 2,80 ppm y Hα', 2,63 ppm) y lactona de ácido homocítrico (Hα', 2,84 ppm y Hδ, 2,65 ppm) (Figura 4).
La mejora en la resolución de los espectros homonucleares desacoplados de SAPPHIRE-PSYCHE que permite una mejor discriminación entre señales se demuestra aún más en dos regiones altamente comprometidas, 4,85 - 5,08 ppm y 7,05 - 7,31 ppm, donde se pudieron identificar metabolitos importantes involucrados en la ruta metabólica de la fragancia de vainilla: glucósido A (ver estructura en la Figura 5), CH-2',6' (a 7,28 ppm), CH-2", 6" (a 7.18 ppm), CH-3',5' (a 7.09 ppm), CH-3",5" (a 7.07 ppm), CH2-7' (a 4.97 ppm y 5.05 ppm), CH2-7'' (a 4.89 ppm), CH-Glc (a 4.96 ppm) y CH'-Glc (a 4.93 ppm), glucósido B (ver estructura en la Figura 4), CH-2',6' (a 7.29 ppm), CH-2",6" (a 7.23 ppm), CH-3', 5' (a 7.09 ppm), CH-3", 5" (a 7.07 ppm), CH2-7' (a 4.99 ppm), CH2-7'' (a 4.91 ppm), alcohol hidroxibencílico (7.23 ppm) y glucósido de alcohol hidroxibencílico (7.10 y 4.51 ppm), Figura 4.
Los mismos resultados se observaron con los extractos de uchuva y en el análisis del tubérculo de papa. En estos dos casos, se han ampliado varias regiones abarrotadas en 1H-NMR regular, psique y zafiro-psique para realizar comparaciones (Figuras 6 y 7).
Está claro que los experimentos PSYCHE y SAPPHIRE-PSYCHE mejoraron claramente la resolución de la señal de los extractos de uchuva para sacarosa (4,04 ppm), β-fructosa (4,02 ppm y 3,99 ppm), β-glucosa (3,24 ppm), prolina (2,34 ppm, 2,07 ppm y 2,00 ppm), ácido glutámico (2,16 ppm) y glutamina (2,13 ppm) (Figura 6), como mostramos en el trabajo anterior11, así como lo hizo en el caso de S. tuberosum extractos: GABA (1,91 ppm, 2,33 ppm y 3,02 ppm), ácido piroglutámico (2,04 ppm, 2,41 ppm y 2,51 ppm), prolina (2,00 ppm, 2,07 ppm, 3,33 ppm y 3,42 ppm), glutamina (2,14 ppm y 2,46 ppm), valina (2,27 ppm), ácido cítrico (2,64 ppm y 2,76 ppm) y β-glucosa (3,25 ppm y 3,47 ppm), Figura 7.
La secuencia PSYCHE es relativamente fácil de usar y se ha implementado con éxito en una amplia gama de aplicaciones9. Para alcanzar el espectro desacoplado, la secuencia de pulsos adquiere pequeños trozos de FID reenfocando el acoplamiento J en el centro de cada bloque. Sin embargo, durante cada bloque se produce una pequeña evolución del acoplamiento J y se generan los artefactos periódicos de las bandas laterales que normalmente representan menos del 5 % de su pico principal21. La presencia de estos artefactos de modulación J , inherentes a los experimentos PSYCHE21, son evidentes en las zonas expandidas de la Figura 6 . En el análisis de compuestos puros, estos artefactos pueden descuidarse. En muestras biológicas, este puede no ser el caso, porque, como se muestra en la Figura 6 para prolina (4,13 ppm, 3,41 ppm y 3,33 ppm), asparagina (3,97 ppm), mioinositol (3,27 ppm), GABA (3,03 ppm) y ácido málico (2,67 ppm), y en la Figura 6 para ácido piroglutámico (2,04 ppm, 2,41 ppm y 2,51 ppm) y valina (2,27 ppm), Los metabolitos a concentraciones más altas generan artefactos tan grandes como algunas de las señales pertenecientes a los compuestos presentes a bajas concentraciones, comprometiendo de esta manera la precisión del perfil metabólico.
El experimento SAPPHIRE-PSYCHE es una modificación de la secuencia regular PSYCHE en la que estos artefactos periódicos se eliminan mediante una modulación de fase sistemática, lograda desplazando el punto de reenfoque J 23. En consecuencia, el experimento SAPPHIRE-PSYCHE permite asegurar un espectro Pure Shift mucho más limpio, como se muestra en la Figura 6 para la prolina (4,13 ppm, 3,41 ppm y 3,33 ppm), asparagina (3,97 ppm), mio-inositol (3,27 ppm), GABA (3,03 ppm) y ácido málico (2,67 ppm), en el caso de las uchuvas11, y en la Figura 7 para el ácido piroglutámico (2,04 ppm, 2,41 ppm, y 2,51 ppm) y valina (2,27 ppm), en el caso de las patatas.
Otro artefacto del que sufren todos los experimentos de Pure Shift son los generados por el fuerte efecto de acoplamiento. Algunos metabolitos primarios importantes, como el ácido cítrico (2,64 ppm y 2,76 ppm) y la glutamina (2,14 ppm y 2,46 ppm), exhiben fuertes artefactos de acoplamiento, como se muestra en el extracto de tubérculo de papa (Figura 7). Hasta la fecha, no existe una secuencia de pulsos que pueda eliminar convenientemente este problema; sin embargo, SAPPHIRE-PSYCHE funciona mejor que el PSYCHE normal 8,9,23.
Análisis de matrices de correlación
Una de las principales ventajas de la espectroscopia de RMN es que las concentraciones relativas de metabolitos en una mezcla son directamente proporcionales a las intensidades de sus señales. A continuación, se puede obtener una matriz de correlación por pares de metabolitos directamente de la matriz de correlación de espectros32.
La matriz de correlación 1H-RMN, comúnmente conocida como STOCSY32 (Espectroscopia Estadística de Correlación Total), suele representarse como un espectro pseudo-2D, donde cada pico cruzado es un coeficiente de correlación entre dos señales (Figura 8)11. STOCSY muestra una alta correlación entre las señales que pertenecen a la misma molécula, pero también con las señales de moléculas que pertenecen a la misma ruta metabólica11,32. Por lo tanto, los patrones de correlaciones proporcionan información sobre el estado fisiológico del sistema y, por lo tanto, pueden emplearse como una huella digital de etapa fisiológica33.
La principal limitación de STOCSY es la superposición de señales, que disminuye la correlación por pares11,32. Además, las correlaciones de multiplicidad del acoplamiento J conducen a patrones muy complejos, lo que complica aún más el análisis11,32. El uso de SAPPHIRE-PSYCHE STOCSY, que se muestra en la Figura 8, mejora los valores de correlación porque reduce las correlaciones de multiplicidad de acoplamiento J en un solo pico, reduciendo así la superposición11.
En la Figura 8 se han ampliado varias regiones. El ácido málico muestra patrones complejos de multipletas J asociados con Hα (4,41 ppm), Hβ (2,82 ppm) y Hβ' (2,67 ppm); en Pure Shift STOCSY, esas señales colapsan en picos de correlación simples (Figura 9A)11. Los mismos resultados se observan para la β-glucosa donde las correlaciones intermoleculares e intramoleculares (α-glucosa, α-fructosa y β-fructosa) están mejor representadas por SAPPHIRE-PSYCHE (Figura 9B)11. Algunos aminoácidos también muestran fuertes correlaciones intramoleculares en los extractos de uchuva. Sin embargo, su identificación en la RMN-Stocsy regular de 1H-Nmr se ve comprometida por la superposición en regiones superpobladas. Con Pure Shift STOCSY, se representan mejor las correlaciones intermoleculares e intramoleculares de prolina, alanina, glutamina y ácido glutámico (Figuras 9C y 9D)11.
Análisis multivariante
El análisis multivariante es una de las principales herramientas empleadas para abordar los datos metabolómicos34,35. Si bien la discriminación de la muestra por PCA (análisis de componentes principales) o PLS-DA (análisis discriminante de mínimos cuadrados parciales) podría lograrse fácilmente a través de espectros regulares de RMN-1H, la interpretación de la carga se aborda mejor a través de datos de desplazamiento puro 11,24,25,27,28.
En la Figura 10, se muestra el gráfico de puntuación PLS-DA obtenido utilizando SAPPHIRE-PSYCHE (Figura 10A) y espectros de protones regulares (Figura 10B) en la discriminación de seis ecotipos de extractos de P. peruviana 11. A pesar de que hay algunos estudios que afirman un mejor rendimiento de discriminación cuando se utilizan datos de Pure Shift24,25, nuestros resultados muestran que el rendimiento apenas se vio afectado por el desacoplamiento homonuclear11. En el caso del análisis de los datos de cargas, como se muestra en las Figuras 10C y 10D, el aumento de la resolución alcanzado con los datos de SAPPHIRE-PSYCHE simplificó el análisis y permitió una mejor identificación de los metabolitos específicos responsables de la discriminación de P. peruviana, a saber, α-glucosa, β-glucosa, α-fructosa, β-fructosa, sacarosa, ácido cítrico y alanina11. Esta ganancia de resolución también fue crítica cuando se combinó el análisis de coeficientes PLS con la correlación STOCSY, Figuras 10C y 10D11. La fuerte correlación entre α-glucosa (el vector STOCSY a 5,23 ppm está codificado por colores en el primer componente de PLS) y β-glucosa, α-fructosa y β-fructosa, todos metabolitos que evolucionan a partir de la misma vía metabólica, y su anticorrelación con respecto a la sacarosa, son evidentes11. Con el análisis STOCSY normal, la superposición extensa no permitió una descripción clara entre los coeficientes de correlación y produjo la pérdida de información de esta ruta metabólica en particular (Figura 10)11.
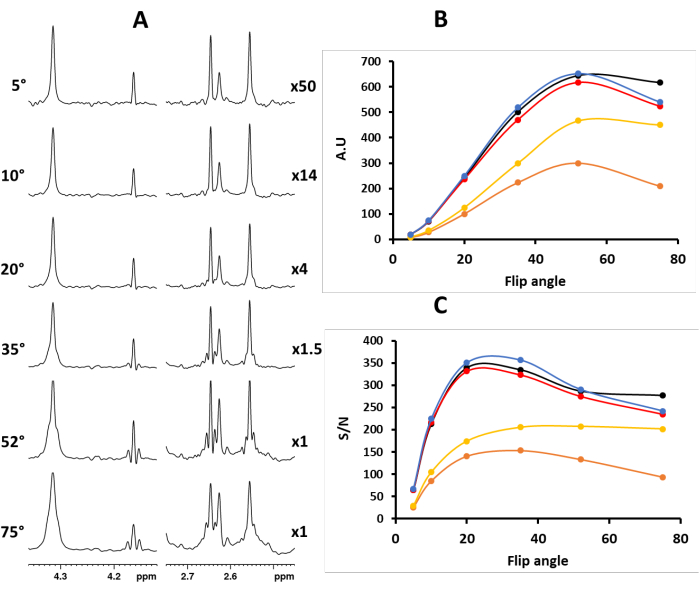
Figura 1. (A) Espectros PSYCHE de extractos de Vanilla planifolia utilizando diferentes ángulos de inversión de pulso CHIRP para el elemento PSYCHE: izquierda, valores de ángulo de inversión; derecha, factor de multiplicación de intensidad. Los gráficos (B) y (C) muestran las intensidades y la relación señal-ruido de cinco picos desacoplados (negro - 4,31 ppm, naranja - 4,16 ppm, rojo - 2,65 ppm, amarillo - 2,63 ppm y azul 2,56 ppm) en función del ángulo de inversión del pulso PSYCHE CHIRP, respectivamente. La relación señal-ruido (S/N) (más precisamente, relación señal/ruido + artefacto) se calculó utilizando la señal de máxima intensidad frente a la del ruido, valor calculado en un rango de 2 ppm: de 7,75 ppm a 9,75 ppm (Figura S12). Haga clic aquí para ver una versión más grande de esta figura.
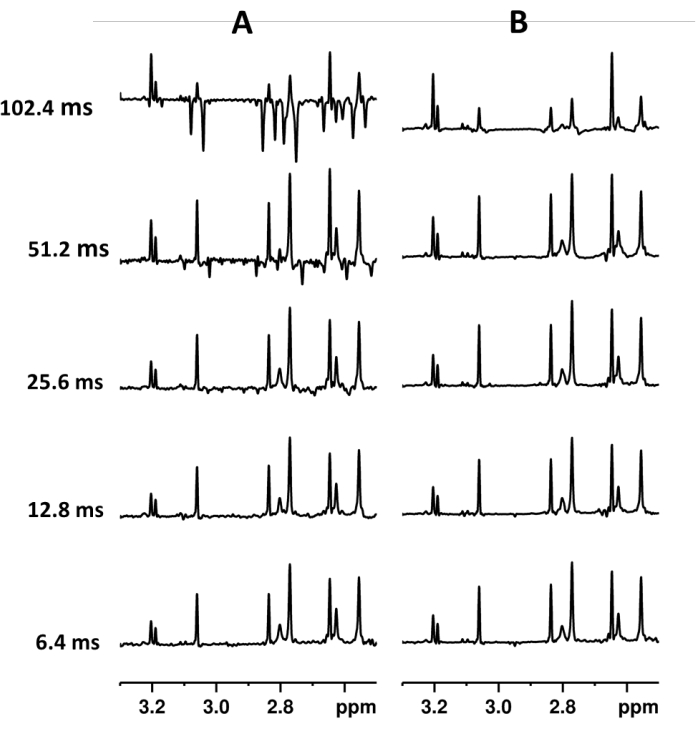
Figura 2. Espectros PSYCHE (A) y SAPPHIRE-PSYCHE (B) de extractos de Vanilla planifolia con diferente duración de bloque de Pure Shift en el interferograma. Los experimentos se adquirieron con el fin de mantener la misma resolución y sensibilidad digital. Parámetro PSYCHE (A) de abajo hacia arriba: 128 escaneos, 64 bloques de interferograma, longitud de bloque de 6,4 ms, tiempo total de adquisición 6h07min; 128 escaneos, 32 bloques de interferograma, longitud de bloque de 12,8 ms, tiempo total de adquisición 3h04min; 128 escaneos, 16 bloques de interferograma, longitud de bloque de 25,6 ms, tiempo total de adquisición 1h32min; 128 escaneos, 8 bloques de interferograma, longitud de bloque de 51,2 ms, tiempo total de adquisición de 46 min; 128 escaneos, 4 bloques de interferograma, longitud de bloque de 102,4 ms, tiempo total de adquisición 24min. Parámetro SAPPHIRE-PSYCHE (B) de abajo hacia arriba: 16 escaneos, 8 incrementos de modulación J , 65 bloques de interferograma, longitud de bloque de 6,4 ms, tiempo total de adquisición 6h19min; 16 escaneos, incrementos de modulación de 8 J , 33 bloques de interferograma, longitud de bloque de 12,8 ms, tiempo total de adquisición 3h13min; 16 escaneos, incrementos de modulación de 8 J , 17 bloques de interferograma, longitud de bloque de 25,6 ms, tiempo total de adquisición 1h40min; 16 exploraciones, incrementos de modulación de 8 J , 9 bloques de interferograma, longitud de bloque de 51,2 ms, tiempo total de adquisición de 53 min; 16 escaneos, incrementos de modulación de 8 J , 5 bloques de interferograma, longitud de bloque de 102,4 ms, tiempo total de adquisición de 30 minutos. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. (A) espectros de extractos de Vanilla planifolia con una longitud de trozo de 102,4 ms: arriba, escaneos PSYCHE 128, 4 incrementos de Pure Shift; parte superior media, 4 escaneos, 4 incrementos Pure Shift, 32 incrementos SAPPHIRE; parte inferior media, 8 escaneos, 4 incrementos Pure Shift, 16 incrementos SAPPHIRE; abajo, 16 escaneos, 4 incrementos Pure Shift, 16 incrementos SAPPHIRE. (B) espectros de extractos de Vanilla planifolia con una longitud de trozo de 51,2 ms: arriba, escaneos PSYCHE 128, 8 incrementos de Pure Shift; parte superior central, 4 escaneos, 9 incrementos Pure Shift, 32 incrementos SAPPHIRE; parte inferior media, 8 escaneos, 9 incrementos Pure Shift, 16 incrementos SAPPHIRE; abajo, 16 escaneos, 9 incrementos Pure Shift, 16 incrementos SAPPHIRE. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Regiones de expansión seleccionadas de losespectros 1 H RMN (1H) y SAPPHIRE-PSYCHE (S) V . planifolia (1,85 - 2,9 ppm) y V. pompona (4,85 - 7,31 ppm), mostrando asignaciones de señales. Haga clic aquí para ver una versión más grande de esta figura.
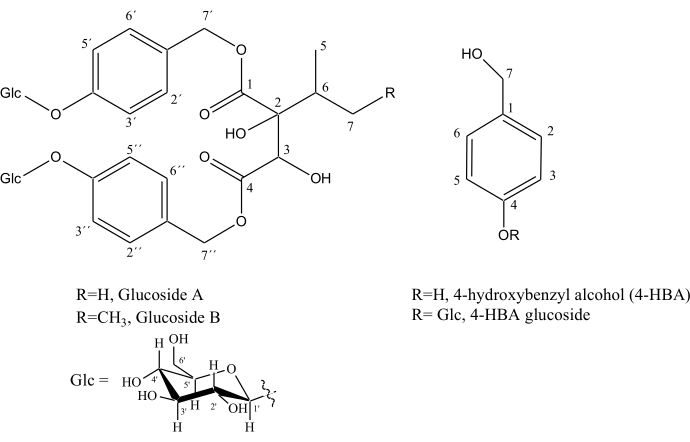
Figura 5. Estructuras de los precursores de la fragancia de vainilla: alcohol 4-hidroxibencílico (4-HBA), glucósido 4-HBA, glucósido A y glucósido B. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6. Regiones de expansión seleccionadas de los espectros de RMN(1H), PSIQUE (P) y ZAFIRO (S) de un extracto acuoso de uchuva (Bambamarca I, región andina peruana28) que muestran asignaciones de señales (Reimpreso con permiso de López et al.11). Haga clic aquí para ver una versión más grande de esta figura.
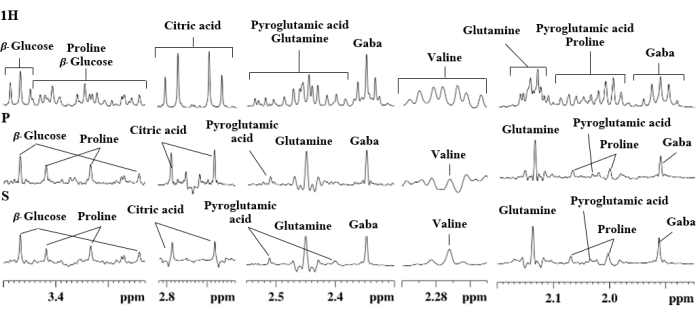
Figura 7. Regiones de expansión seleccionadas de los espectros de RMN(1H), PSIQUE (P) y ZAFIRO (S) de un extracto acuoso de papa que muestran asignación de señal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8. Regiones expandidas seleccionadas (3.20 ppm-4.30 ppm) de espectros bidimensionales de RMN STOCSY obtenidos con datos de seis extractos de uchuva que mostraron valores de correlación (r2) por encima de 0.85: (A) regular 1h NMR STOCSY y (B) SAPPHIRE-PSYCHE STOCSY. Reimpreso con permiso de Lopez et al.11 Haga clic aquí para ver una versión más grande de esta figura.
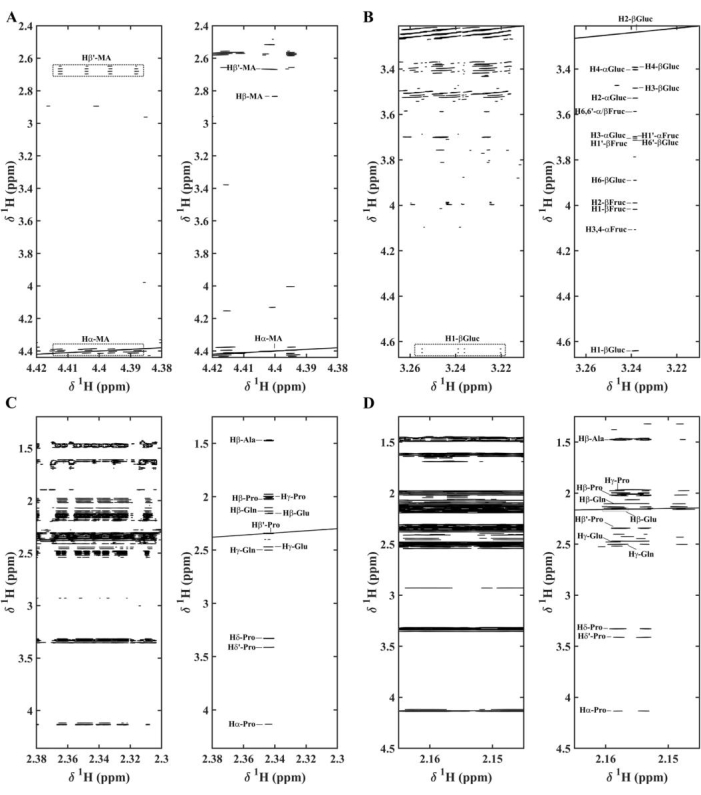
Figura 9. Representaciones STOCSY de espectros de RMN de seis extractos diferentes de uchuva que muestran correlaciones (r2), a la izquierda sin homodesacoplamiento y a la derecha con homodesacoplamiento para regiones: (A) 4,38-4,42 ppm y 2,40-4,42 ppm con r2 por encima de 0,80 para la señal de ácido málico (MA) (Hα-MA); (B) 3,21-3,27 ppm y 3,21-4,67 ppm con r2 por encima de 0,85 para la señal de β-glucosa (H2-β-Gluc); (C) 2,30-2,38 ppm y 1,25-4,36 con r2 por encima de 0,93 para la señal de prolina (Pro) (Hβ′-Pro); (D) 2,15-2,17 ppm y 1,25-4,5 ppm con r2 por encima de 0,90 para la señal de ácido glutámico (Glu) (Hβ-Glu); α-glucosa, α-fructosa β-fructosa se simbolizan como α-Gluc, α-Fruc y β-Fruc, respectivamente. Reimpreso con permiso de Lopez et al.11 Haga clic aquí para ver una versión más grande de esta figura.

Figura 10. PLS puntúa la parcela de extractos de uchuvas cultivados en seis regiones andinas diferentes11,28 (San Marcos: círculos rojos, Celendin III: triángulos marrones, Bambamarca I: estrellas azules, Celendin I: triángulos amarillos, Bambamarca II: cuadrados verdes, Celendin II: diamantes magenta) basados en (A) experimentos clásicos de RMN 1H y (B) SAPPHIRE-PSYCHE. Las elipses T2 de Hotel se establecieron con un nivel de confianza del 95%. Combinación de cargas PLS1 y 1D STOCSY para la correlación α-glucosa utilizando la señal STOCSY a 5,23 ppm como pico conductor. El coeficiente de determinaciones (r2) se ha codificado por colores y se ha proyectado sobre los coeficientes del primer componente de PLS: (A) 1D STOCSY obtenido con datos de SAPPHIRE-PSYCHE (arriba) y su expansión 3,15-4,17 ppm (abajo); (B) 1D STOCSY obtenido con datos de RMN 1H (arriba) y su expansión 3.15-4.17 ppm (abajo); α-glucosa, β-glucosa, α-fructosa, β-fructosa y sacarosa se simbolizan como α-G, β-G, α-F, β-F y S, respectivamente. El análisis PLS-DA y STOCSY se realizó utilizando la versión R2018a de MATLAB. (Reimpreso con permiso de López et al.11) Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La identificación estructural y cuantificación de metabolitos son cuestiones clave en la caracterización del metaboloma, datos que al ser sometidos a análisis multivariados permiten comprender mejor el sistema biológico en estudio. La preparación de muestras y la adquisición de datos son aspectos críticos que deben optimizarse para proporcionar resultados fiables.
En este artículo, describimos e ilustramos la preparación de muestras para el análisis de RMN de tres matrices de plantas diferentes. Al igual que con cualquier procedimiento de extracción, la cantidad de solvente por gramo de material y las propiedades físicas del solvente seleccionado determinarán la composición química del extracto final y la concentración de los metabolitos extraídos. En el caso del perfil metabolómico de RMN, el pH, la reproducibilidad entre extracciones de muestras independientes y la cantidad final de extracto en el tubo de RMN también son aspectos que deben optimizarse. La importancia de la reproducibilidad en metabolómica es evitar la introducción de varianzas no correlacionadas, lo que podría conducir a resultados poco fiables. En nuestra experiencia, se lograron condiciones óptimas de extracción con el material vegetal seco y molido. En el caso de las uchuvas, el producto seco era muy difícil de manejar (altamente higroscópico) por lo que las bayas frescas se homogeneizaron primero, antes de la liofilización.
En el caso de la adquisición de espectros, la configuración experimental de Pure Shift es de particular importancia, ya que los parámetros incorrectos pueden conducir a artefactos de fragmentación y reacoplamiento. La teoría detrás de los principios de los experimentos de Pure Shift, ampliamente revisada en otros lugares 8,9,10, es importante para comprender cómo configurar correctamente la secuencia de pulsos e implementarla como un experimento de rutina.
En resumen, la mayoría de los experimentos de Pure Shift se basan en reenfocar la evolución del acoplamiento J durante el registro de cambios químicos. Por lo general, esto se logra mediante un elemento de reenfoque de acoplamiento en J que invierte selectivamente los espines "pasivos", mientras que los espines "activos" no se ven afectados. PSYCHE y SAPPHIRE-PSYCHE se basan en un experimento anti-z-COSY en el que los giros "pasivos" se invierten estadísticamente.
El elemento PSYCHE, que consiste en dos pulsos de ángulo de inversión bajo de frecuencia barrida en presencia de un gradiente de campo pulsado débil, induce el promedio espacio-temporal de frecuencia, seleccionando los términos COSY anti-diagonales mientras suprime los términos cuánticos cero y de correlación cruzada. En consecuencia, para evitar los artefactos de reacoplamiento inherentes, el ángulo de inversión del pulso CHIRP debe ser corto (Figura 1). Por lo general, un ángulo de giro de 20° es un buen compromiso entre la sensibilidad y el rendimiento de desacoplamiento (Figura 1). Por lo tanto, la calibración de pulsos es fundamental para la calidad y la sensibilidad del espectro.
Los estudios metabolómicos suelen asociarse al registro de espectros en un gran número de muestras, lo que implica que la calibración del pulso debe ser rápida o automática. En nuestra experiencia, si las muestras se preparan exactamente de la misma manera, la variabilidad de la longitud del pulso duro entre las muestras es inferior a ± 0,2 μs. Normalmente calibramos entre 6 y 12 muestras y luego utilizamos el valor medio alcanzado para configurar todo el grupo de muestras. En el caso de que la variabilidad de la longitud del pulso de una muestra a otra sea mayor, la calibración automática de cada muestra debe realizarse utilizando el programa de automatización pulsal Topspin en el espectrómetro Bruker.
El segundo parámetro importante a considerar es la longitud de los bloques registrados durante la adquisición del interferograma escalonado21,23. La adquisición de interferogramas consiste en registrar el FID por pequeños trozos, coincidiendo siempre el punto de reenfoque de la evolución del acoplamiento J con el centro del trozo adquirido. El FID desacoplado se construye concatenando cada fragmento sucesivo 8,9,10. Para garantizar que la adquisición de bloques no trunque la evolución del desplazamiento químico, el inicio de cada registro de datos debe coincidir exactamente con el final del fragmento anterior.
Aunque este procedimiento nos permite obtener un espectro homodesacoplado, la pequeña evolución del acoplamiento J durante cada bloque genera artefactos periódicos de bandas laterales que dependen directamente de la longitud del fragmento. Por otro lado, la resolución digital espectral depende de la ventana espectral y de la duración total del FID desacoplado, que, a su vez, depende de la longitud del bloque y del número de bloques registrados. Por lo tanto, para reducir los artefactos periódicos sin sacrificar la resolución, la duración del bloque debe ser corta y el número total de bloques registrados debe ser alto. Estas condiciones, sin embargo, aumentarán en gran medida el tiempo total de adquisición experimental sin aumentar la sensibilidad (Figura 2). Típicamente, un experimento PSYCHE adquirido con 16 a 32 bloques de 10 a 16 ms de duración da suficiente resolución digital en un tiempo experimental razonable (30 min a 5 h) (Figura 2).
En el caso de SAPPHIRE-PSYCHE, un experimento que se adquiere como un pseudo 3D, una de las dimensiones indirectas codifica para la adquisición del interferograma Pure Shift y la otra para la modulación de fase de los artefactos periódicos a través del cambio sistemático del punto de reenfoque J en cada fragmento.
Como los artefactos periódicos son fuertemente suprimidos por SAPPHIRE, las longitudes de los bloques podrían ser más largas; sin embargo, los trozos muy largos afectan fuertemente la intensidad de las señales (Figuras 2 y 3). En SAPPHIRE, los incrementos de modulación J contribuyen a la sensibilidad del espectro, por lo tanto, el número total de exploraciones FID desacoplado resultante es igual a TD2 * NS (Figuras 2 y 3)23. En términos generales, ocho incrementos de modulación J aseguran una excelente supresión periódica de artefactos y más de ocho incrementos tienen muy poco efecto en la calidad del espectro, incluso si se utilizan longitudes de fragmentos largos (Figura 3)23. Los incrementos de Pure Shift de 33 o 17 con duraciones entre 20 y 40 ms garantizan una buena resolución digital espectral.
Una limitación de estas dos secuencias de pulso de Pure Shift, PSYCHE y SAPPHIRE-PSYCHE, es la cuantificación mediante la integración absoluta del estándar interno del metabolito. En la RMN-1H regular, la intensidad integrada es directamente proporcional a la concentración de cada metabolito. En PSYCHE, este ya no es el caso, porque una serie de fenómenos distorsionan las señales y afectan la integración. Por ejemplo, el valor integral total disminuye debido a la relajación de T2 durante la selección del espín de la secuencia de pulsos. Además, la evolución del acoplamiento J truncado durante la adquisición de fragmentos que genera artefactos de bandas laterales, interrumpe la forma Lorentziana de la señal. Por lo tanto, la integral ahora está comprendida por áreas debajo del pico principal y debajo de todas las bandas laterales, lo que complica la integración de la señal 8,9,21,23. La frecuencia y la magnitud de las bandas laterales están directamente relacionadas con la longitud del trozo, pero también con propiedades intrínsecamente moleculares como la relajación y la magnitud y multiplicidad del acoplamiento J: las magnitudes de acoplamiento J más altas y las multiplicidades más altas conducen a señales más distorsionadas. En el caso de SAPPHIRE, a pesar de que este experimento de RMN elimina eficientemente los artefactos de banda lateral, las intensidades de la señal se ven comprometidas por la evolución del acoplamiento J truncado. La suma de cada incremento modulado J genera un FID desacoplado promedio donde la disminución de la señal está directamente relacionada con la longitud del fragmento y la magnitud y multiplicidad del acoplamientoJ 23. Además, los ángulos de inversión del pulso CHIRP generan un artefacto de reacoplamiento que también afecta a cada señal de manera diferente, lo que complica aún más la cuantificación21. La magnitud del efecto de estas secuencias de pulsos en el análisis cuantitativo se evaluó en nuestro estudio anterior de uchuva, arrojando errores de alrededor del 10% al 30%11.
Finalmente, podemos concluir que Pure Shift es una excelente nueva herramienta para la metabolómica de las plantas, ya que aumenta drásticamente la resolución del espectro, permitiendo un análisis más fino de la matriz de correlación y una mejor interpretación de los análisis multivariados 11,24,25,27,28.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este estudio fue financiado por el Consejo Nacional de Ciencia, Tecnología e Innovación Tecnológica (CONCYTEC) - Programa Atracción de Investigadores Cienciactiva - Contrato # 008-2017-FONDECYT.
Materiales
| Name | Company | Catalog Number | Comments |
| 77500 Series Freezone 4.5 Liter benchtop | Labconco | 77500 | |
| Bruker Avance III 500 MHz equiped with a 5 mm TCI Z-gradient cryogenic probe | Bruker Corporation | ||
| Centrivap Refrigerated Centrifugal Concentrators Labconco 7310000 Series | Labconco | 7310000 | |
| Deuterium oxide | Sigma-Aldrich | 151882 | |
| Grinder machine MKM6003 | Bosch | MKM6003 | |
| Licuadora Blender 8011S model Hgb2wts3 | Waring | Hgb2wts3 | |
| Methanol-d4 | Sigma-Aldrich | 151947 |
Referencias
- Hall, R., Beale, M., Fiehn, O., Hardy, N., Sumner, L., Bino, R. Plant metabolomics: the missing link in functional genomics strategies. The Plant Cell. 14 (7), 1437-1440 (2002).
- Fiehn, O. Metabolomics-the link between genotypes and phenotypes. Plant Molecular Biology. 48 (1-2), 155-171 (2002).
- Schauer, N., Fernie, A. R. Plant metabolomics: towards biological function and mechanism. Trends in Plant Science. 11 (10), 508-516 (2006).
- Kim, H. K., Choi, Y. H., Verpoorte, R. NMR-based plant metabolomics: where do we stand, where do we go. Trends in Biotechnology. 29 (6), 267-275 (2011).
- Kumar, R., Bohra, A., Pandey, A. K., Pandey, M. K., Kumar, A. Metabolomics for Plant Improvement: Status and Prospects. Frontiers in Plant Science. 8, (2017).
- Dumez, J. -. N., et al. Hyperpolarized NMR of plant and cancer cell extracts at natural abundance. Analyst. 140 (17), 5860-5863 (2015).
- Emwas, A. -. H., et al. NMR Spectroscopy for Metabolomics Research. Metabolites. 9 (7), (2019).
- Zangger, K. Pure shift NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 86-87, 1-20 (2015).
- Foroozandeh, M., Morris, G. A., Nilsson, M. PSYCHE Pure Shift NMR Spectroscopy. Chemistry - A European Journal. 24 (53), 13988-14000 (2018).
- Castañar, L. Pure shift NMR: Past, present, and future. Magnetic Resonance in Chemistry. 56 (10), 874-875 (2018).
- Lopez, J. M., Cabrera, R., Maruenda, H. Ultra-Clean Pure Shift 1 H-NMR applied to metabolomics profiling. Scientific Reports. 9 (1), 1-8 (2019).
- Marcó, N., Gil, R. R., Parella, T. Isotropic/Anisotropic NMR Editing by Resolution-Enhanced NMR Spectroscopy. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 19 (9), 1024-1029 (2018).
- Kaltschnee, L., et al. Extraction of distance restraints from pure shift NOE experiments. Journal of Magnetic Resonance. 271, 99-109 (2016).
- Sinnaeve, D., et al. Improved Isotopic Profiling by Pure Shift Heteronuclear 2D J-Resolved NMR Spectroscopy. Analytical Chemistry. 90 (6), 4025-4031 (2018).
- Timári, I., et al. Real-Time Pure Shift HSQC NMR for Untargeted Metabolomics. Analytical Chemistry. 91 (3), 2304-2311 (2019).
- Zhao, Q., et al. Combination of pure shift NMR and chemical shift selective filters for analysis of Fischer-Tropsch waste-water. Analytica Chimica Acta. 1110, 131-140 (2020).
- Zhao, Q., et al. Pure Shift NMR: Application of 1D PSYCHE and 1D TOCSY-PSYCHE Techniques for Directly Analyzing the Mixtures from Biomass-Derived Platform Compound Hydrogenation/Hydrogenolysis. ACS Sustainable Chemistry & Engineering. 9 (6), 2456-2464 (2021).
- Foroozandeh, M., et al. Ultrahigh-Resolution Diffusion-Ordered Spectroscopy. Angewandte Chemie International Edition. 55 (50), 15579-15582 (2016).
- Castañar, L., Pérez-Trujillo, M., Nolis, P., Monteagudo, E., Virgili, A., Parella, T. Enantiodifferentiation through Frequency-Selective Pure-Shift 1H Nuclear Magnetic Resonance Spectroscopy. ChemPhysChem. 15 (5), 854-857 (2014).
- Lopez, J. M., Sánchez, L. F., Nakamatsu, J., Maruenda, H. Study of the Acetylation Pattern of Chitosan by Pure Shift NMR. Analytical Chemistry. , (2020).
- Foroozandeh, M., Adams, R. W., Meharry, N. J., Jeannerat, D., Nilsson, M., Morris, G. A. Ultrahigh-Resolution NMR Spectroscopy. Angewandte Chemie International Edition. 53 (27), 6990-6992 (2014).
- Foroozandeh, M., Adams, R. W., Kiraly, P., Nilsson, M., Morris, G. A. Measuring couplings in crowded NMR spectra: pure shift NMR with multiplet analysis. Chemical Communications. 51 (84), 15410-15413 (2015).
- Moutzouri, P., et al. Ultraclean pure shift NMR. Chemical Communications. 53 (73), 10188-10191 (2017).
- Santacruz, L., Hurtado, D. X., Doohan, R., Thomas, O. P., Puyana, M., Tello, E. Metabolomic study of soft corals from the Colombian Caribbean: PSYCHE and 1 H-NMR comparative analysis. Scientific Reports. 10 (1), 5417 (2020).
- Stark, P., Zab, C., Porzel, A., Franke, K., Rizzo, P., Wessjohann, L. A. PSYCHE-A Valuable Experiment in Plant NMR-Metabolomics. Molecules. 25 (21), 5125 (2020).
- Kakita, V. M. R., Rachineni, K., Hosur, R. V. Ultraclean Pure Shift NMR Spectroscopy with Adiabatic Composite Refocusing Pulses: Application to Metabolite Samples. ChemistrySelect. 4 (34), 9893-9896 (2019).
- Bo, Y., et al. High-resolution pure shift NMR spectroscopy offers better metabolite discrimination in food quality analysis. Food Research International. 125, 108574 (2019).
- Watermann, S., Schmitt, C., Schneider, T., Hackl, T. Comparison of Regular, Pure Shift, and Fast 2D NMR Experiments for Determination of the Geographical Origin of Walnuts. Metabolites. 11 (1), 39 (2021).
- Leyva-Zegarra, V., et al. NMR-based leaf metabolic profiling of V. planifolia and three endemic Vanilla species from the Peruvian Amazon. Food Chemistry. , 129365 (2021).
- Toubiana, D., et al. Morphological and metabolic profiling of a tropical-adapted potato association panel subjected to water recovery treatment reveals new insights into plant vigor. The Plant Journal. 103 (6), 2193-2210 (2020).
- Maruenda, H., Cabrera, R., Cañari-Chumpitaz, C., Lopez, J. M., Toubiana, D. NMR-based metabolic study of fruits of Physalis peruviana L. grown in eight different Peruvian ecosystems. Food Chemistry. 262, 94-101 (2018).
- Cloarec, O., et al. Statistical total correlation spectroscopy: an exploratory approach for latent biomarker identification from metabolic 1H NMR data sets. Analytical Chemistry. 77 (5), 1282-1289 (2005).
- Steuer, R. Review: on the analysis and interpretation of correlations in metabolomic data. Briefings in Bioinformatics. 7 (2), 151-158 (2006).
- Trygg, J., Holmes, E., Lundstedt, T. Chemometrics in Metabonomics. Journal of Proteome Research. 6 (2), 469-479 (2007).
- Worley, B., Powers, R. Multivariate Analysis in Metabolomics. Current Metabolomics. 1 (1), 92-107 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados