Method Article
الرنين المغناطيسي النووي النقي: أداة جديدة لعمليات التمثيل الغذائي النباتية
In This Article
Summary
تقدم هذه الورقة استخدام PSYCHE و SAPPHIRE-PSYCHE في التنميط الأيضي للنباتات وتتضمن إجراءات مفصلة لإعداد العينة والتسجيل الأمثل لأطياف الرنين المغناطيسي النووي Pure Shift. تتم مناقشة الأمثلة التي يسمح من خلالها الكسب في الدقة التي تم تحقيقها عن طريق الفصل النووي المتجانس بفهم أكثر شمولا للنظام.
Abstract
الرنين المغناطيسي النووي (NMR) هو أحد أقوى الأدوات المستخدمة في التمثيل الغذائي. إنها طريقة عالية الدقة وقابلة للتكرار لا توفر البيانات الكمية فحسب ، بل تسمح أيضا بالتحديد الهيكلي للمستقلبات الموجودة في المخاليط المعقدة.
أثبت التنميط الأيضي بواسطة 1H NMR فائدته في دراسة أنواع مختلفة من سيناريوهات النبات ، والتي تشمل تقييم ظروف المحاصيل ، وعلاجات الحصاد وما بعد الحصاد ، والتنميط الظاهري الأيضي ، ومسارات التمثيل الغذائي ، وتنظيم الجينات ، وتحديد المؤشرات الحيوية ، والتصنيف الكيميائي ، ومراقبة الجودة ، وتسمية المنشأ ، من بين أمور أخرى. ومع ذلك ، فإن تداخل الإشارة للعدد الكبير من الرنين مع تعدد اقتران J الموسع يعقد تحليل الأطياف وتفسيره ، ويمثل قيدا على التنميط الكلاسيكي 1HNMR.
في العقد الماضي ، تم تطوير تقنيات الفصل النووي المتجانسة ذات النطاق العريض NMR الجديدة التي من خلالها تنهار الإشارات المتعددة إلى خطوط رنين مفردة - تسمى عادة طرق التحول النقي - للتغلب على مشكلة دقة الأطياف المتأصلة في الأطياف الكلاسيكية 1H NMR.
هنا يتم تقديم بروتوكول خطوة بخطوة لتحضير المستخلصات النباتية وإجراء تسجيل أطياف Pure Shift PSYCHE و SAPPHIRE-PSYCHE المثلى في ثلاث مصفوفات نباتية مختلفة - أوراق نبات الفانيليا ، ودرنات البطاطس (S. tuberosum) ، وعنب الثعلب الرأس (P. peruviana). تمت مناقشة تأثير الكسب في الدقة في تحديد التمثيل الغذائي وتحليل الارتباط والتحليلات متعددة المتغيرات ، مقارنة بالأطياف الكلاسيكية.
Introduction
تمت صياغة المجموعة الكاملة من المستقلبات التي تتكون من كائن حي - ركائز ومواد وسيطة ومنتجات نهائية للعمليات البيولوجية - في عام 1998 بمصطلح التمثيل الغذائي. من المعروف أن الأيض يرتبط ارتباطا وثيقا بالنمط الظاهري ، وهو ذو أهمية خاصة في النباتات لأنه يعكس التفاعل المباشر بين النمط الجيني والبيئة1،2. ومن ثم ، أصبح توصيف المظهر التمثيلي ذو أهمية قصوى في النباتات. من خلال تحديد وقياس المؤشرات الحيوية (المستقلبات الرئيسية) وأنماط التمثيل الغذائي ، كان التمييز بين الأنواع والأصناف ومراحل التطور والأمراض المسببة للأمراض أو الظروف البيئية (التغيرات اليومية والموسمية ، والتربة ، والإجهاد المائي ، والإجهاد الميكانيكي ، والحصاد وعلاجات ما بعد الحصاد) ، من بين أمور أخرى ، ممكنا3،4،5.
يعد قياس الطيف الكتلي (MS) والتحليل الطيفي بالرنين المغناطيسي النووي (NMR) من أكثر المنصات التحليلية استخداما لهذا الغرض. على عكس منهجيات التصلب العصبي المتعدد ، يقف الرنين المغناطيسي النووي كتقنية قابلة للتكرار بدرجة كبيرة وغير متحيزة وكمية ودقيقة وغير مدمرة تتطلب الحد الأدنى من تحضير العينة ، مما يجعلها مناسبة لدراسات التمثيل الغذائي. ومع ذلك ، عند مقارنتها بطرق مرض التصلب العصبي المتعدد ، فإن الحساسية المنخفضة المتأصلة هي قيدة. في السنوات الأخيرة ومن خلال استخدام مغناطيسات عالية المجال ، ومجسات التبريد ، وأجهزة الملفات الدقيقة ، وطرق الاستقطاب النووي الديناميكي (DNP) ، تم تحسين حساسية الرنين المغناطيسي النووي بشكل كبير. في حالة النهج الأخير ، على سبيل المثال ، كان كسب الحساسية في مستوى اثنين إلى ثلاثة رتب من المقدار 6,7. حتى الآن ، ما يقرب من 20٪ من دراسات التمثيل الغذائي المنشورة تعتمد على الرنين المغناطيسي النووي والعدد يرتفع7.
على الرغم من أن Proton NMR هي التجربة الأكثر شيوعا وحساسية لبصمات التمثيل الغذائي بالرنين المغناطيسي النووي ، إلا أن لها بعض العيوب. أولا ، يتم توزيع جميع إشارات الرنين المغناطيسي النووي 1H المكتشفة في العينة في نافذة صغيرة تتوافق مع نافذة التحول الكيميائي للبروتون ، مما ينتج عنه أطياف مزدحمة. ثانيا ، يقسم الاقتران العددي المتجانس النواة الإشارات إلى مكونات متعددة (تعدد الإشارة) ، وينشر إشارة البروتون على نطاق تردد أوسع ، مما يعقد قراءة الأطياف عن طريق زيادة الازدحام وتداخل الإشارة. بالإضافة إلى ذلك ، يتم استخدام أيض الرنين المغناطيسي النووي في تحليل المخاليط التي تحتوي عادة على 50 إلى 300 جزيء بتركيز يمكن ملاحظة الرنين المغناطيسي النووي ، مما يولد أطياف معقدة تتكون من 200 إلى 2000 قمة.
الرنين المغناطيسي النووي لفصل البروتون المتجانس النووي ، المعروف أيضا باسم Pure Shift ، هو طريقة تحفز انهيار إشارة متعددة الأجزاء إلى ذروة واحدة. إنها أداة ممتازة لزيادة دقة الإشارة في الأطياف المزدحمة8،9،10 ، وبالتالي فهي تمثل أداة ملائمة لعمليات التمثيل الغذائيللنباتات 11.
في العقد الماضي ، ظهرت تسلسلات نبضية Pure Shift جديدة ، مما يزيد من أداء الحساسية والفصل. كما توسع نطاق تطبيقاتها ، من توضيح التركيب الجزيئي12،13 ، إلى الفلوكسوميكس14 ، وتخصيص الخليط15،16،17 ، وقياسات الانتشار الانتقالي18 ، والتمييز المتماثل19 ، وتوزيع الوحدة في البوليمرات المشتركة20 ، من بين أمور أخرى.
تاريخيا ، تعاني تجارب Broadband Pure Shift من حساسية منخفضة وطرق معالجة معقدة ، مما يحد من نطاقها في تقييم المستخلصاتالبيولوجية 8. في عام 2014 ، Foroozandeh et al. نشر تجربة Pure Shift جديدة ، PSYCHE (Pure Shift Yielded by Chirp Excitation) ، استنادا إلى تسلسل النبض المضاد ل z-COSY الذي أسفر عن فصل متجانس نواة ممتاز وتحسين قيم الحساسية21. ومع ذلك ، نظرا لأن PSYCHE هي تجربة مخطط تداخل ثنائية الأبعاد حيث يتم الحصول على أجزاء من بيانات المجال الزمني ، فإنها تعاني من القطع الأثرية الدورية للنطاق الجانبي التي تنتج عن تشوهات تعديل اقتران J عند حواف القطعة. في المخاليط المعقدة ، تنتج هذه القطع الأثرية إشارات أكبر من تلك المرتبطة بالمستقلبات الموجودة بتركيزات منخفضة جدا ، مما يعيق التحليل11. هناك طريقتان لإزالة هذه القطع الأثرية - TSE-PHYCHE22 وتعديل أحدث لتجربة PSYCHE يسمى SAPPHIRE-PSYCHE (متوسط النطاق الجانبي عن طريق زيادة PHase الدورية للتطور J المتبقي) 23.
في عام 2019 ، أظهرنا لأول مرة11 أن طريقة SAPPHIRE-PSYCHE Pure Shift ، التي تزيل القطع الأثرية بدون عقوبة حساسيةتقريبا 23 ، يمكن استخدامها لتحليل الخلائط البيولوجية المعقدة ، مثل مستخلصات ثمار Physalis peruviana ، والمعروفة باسم عنب الثعلبالرأس 11. أظهرنا أن هذه الأساليب تزيد من أداء تحليلات بيانات التمثيل الغذائي مثل التعيين الأيضي وتحليل الارتباط وتحليل المعاملات متعددةالمتغيرات 11. منذ ذلك الحين ، تمت معالجة العديد من دراسات التمثيل الغذائي Pure Shift على المصفوفات البيولوجية المختلفة ، مثل الشعاب المرجانيةالناعمة 24 ، ونباتات hypericum25 ، والعسل26،27 ، والشاي27 ، وزيت النعناع26 ، والجوز28 ، مما يدل على أهميته كأداة جديدة لتحليل التمثيل الغذائي. ومن المفارقات أن الغالبية العظمى من هذه الدراسات استخدمت تسلسل نبضات PSYCHE القياسي وسهل التنفيذ ، المتاح من أي مكتبة مطياف ، بدلا من تسلسل نبض SAPPHIRE-PSYCHE ، والذي ثبت أنه يعمل بشكل أفضل. ومع ذلك ، فإنه يتطلب فهما أفضل لتسلسل النبض من أجل الإعداد المناسب.
تهدف هذه الورقة إلى مساعدة المستخدمين الجدد على تطبيق طرق Pure Shift في دراسة النباتات ، على وجه الخصوص ، أوراق الفانيليا sp (V. planifolia و V. pompona)29 ، درنات البطاطس (S. tuberosum) 30 ، وعنب الثعلب الرأس (P. peruviana) 31. يتم وصف إعداد العينة والإعداد التجريبي للرنين المغناطيسي النووي والحصول على البيانات وتحليل البيانات بالتفصيل. علاوة على ذلك ، يتضمن البروتوكول ملاحظات رئيسية لمساعدة الباحثين ، الجدد في هذا المجال ، على إعداد تجارب PSYCHE و SAPPHIRE-PSYCHE بشكل صحيح في التنميط الأيضي للنباتات.
Protocol
1. تحضير العينة
- عنب الثعلب في كيب
- ضع 100-200 غرام من الفواكه الطازجة في إناء الخلاط. يحفظ في درجة حرارة 4 درجات مئوية لمدة 30 دقيقة ، ثم يتجانس في خلاط المختبر.
- على الفور ، انقل العصير إلى أنابيب بلاستيكية سعة 50 مل ، وقم بتجميدها في النيتروجين السائل وتجميدها حتى تجف لمدة 4 إلى 5 أيام.
- طحن المادة المجففة بالتجميد إلى مسحوق ناعم باستخدام مطحنة كهربائية.
ملاحظة: يجب أن يتم التعامل مع المواد الجافة بسرعة لأن المسحوق شديد الاسترطاب. - تزن 1 غرام من المادة الأرضية وأضف 10 مل من الماء عالي النقاء. دوامة لمدة 1 دقيقة.
- صوتي لمدة 20 دقيقة عند 10 درجات مئوية ، ثم جهاز الطرد المركزي عند 23,000 × جم لمدة 20 دقيقة عند 10 درجات مئوية.
- استرجع المادة الطافية وقم بتصفيتها من خلال مرشح حقنة بولي تترافلورو إيثيلين 13 مم (PTFE) 0.45 ميكرومتر.
- قم بتجميد 1 مل من المستخلص المصفى حتى يجف ثم أعد تعليق المادة الصلبة التي تم الحصول عليها في 0.9 مل من 200 ملي من محلول أكسالات الصوديوم 4. دوار.
- قم بتجميد العينة الناتجة حتى تجفف وتذويبها في 0.9 مل من أكسيد الديوتيريوم الذي يحتوي على 5 ملي مولار من ملح الصوديوم الحمضي 3-(trimethylsilyl)propionic-2،2،3،3-d 4 (TMSP-d4).
- املأ أنبوب الرنين المغناطيسي النووي ب 0.6 مل من العينة باستخدام ماصة دقيقة.
- أوراق الفانيليا
- اجمع الأوراق ونظفها بمناديل ورقية مبللة وقم بتجميدها بالكامل في النيتروجين السائل.
- قسم الأوراق إلى قطع صغيرة وقم بتجميدها لمدة 4 أيام حتى تجف.
- طحن المادة الجافة إلى مسحوق ناعم باستخدام مطحنة كهربائية.
- تزن 50 مجم من المادة المطحونة وأضف 0.75 مل من المخزن المؤقت للفوسفات درجة الحموضة 6.0 في أكسيد الديوتيريوم الذي يحتوي على 0.1٪ من TMSP (وزن / وزن) و 0.75 مل من الميثانول - د4. دوامة لمدة 1 دقيقة.
- صوتي لمدة 20 دقيقة عند 25 درجة مئوية.
- جهاز طرد مركزي عند 13,000 × جم لمدة 10 دقائق عند 25 درجة مئوية.
- استرجع المادة الطافية (~ 1.3-1.4 مل) وقم بتصفيته من خلال مرشح حقنة PTFE 0.45 ميكرومتر مقاس 13 مم.
- املأ أنبوب الرنين المغناطيسي النووي ب 0.6 مل من العينة المفلترة باستخدام ماصة دقيقة.
- درنات البطاطس
- قشر وقطع 4 إلى 8 درنات. على الفور ، ضع ما يقرب من 125 جراما من المواد في أكياس قائمة وقم بتجميدها في النيتروجين السائل.
ملحوظة: لتجنب الأكسدة أثناء المناولة ، حافظ على رطوبة البطاطس. - قم بالتجميد لمدة 4 إلى 6 أيام حتى يجف تماما.
- طحن المادة الجافة إلى مسحوق ناعم باستخدام مطحنة كهربائية.
- يزن 160 مجم من الدرنة الأرضية ويضاف 1.6 مل من الماء منزوع الأيونات. دوامة لمدة 1 دقيقة.
- سونيكات لمدة 45 دقيقة عند 10 درجات مئوية.
- جهاز طرد مركزي عند 23,000 × جم لمدة 20 دقيقة عند 10 درجات مئوية.
- استرجع المادة الطافية (~ 1.5 -1.6 مل) وتبخرها حتى تجف في مكثف فراغ طرد مركزي مبرد لمدة 16 ساعة ، عند 10 درجات مئوية.
- أضف إلى المادة الصلبة التي تم الحصول عليها (20-25 مجم) 0.9 مل من 100 ملي مولار أكسالات الصوديوم الأس الهيدروجيني 4 ، الدوامة ، وتتبخر لمدة 16 ساعة عند 10 درجات مئوية.
- قم بإذابة المادة الصلبة التي تم الحصول عليها في 0.9 مل من أكسيد الديوتيريوم الذي يحتوي على 3 ملي مولار من TMSP.
- جهاز طرد مركزي عند 23,000 × جم لمدة 5 دقائق عند 10 درجات مئوية وقم بتصفية المادة الطافية مباشرة في أنبوب الرنين المغناطيسي النووي من خلال مرشح حقنة PTFE 0.45 ميكرومتر مقاس 13 مم.
ملاحظة: في هذه الحالة ، تم إجراء الترشيح المباشر في أنبوب الرنين المغناطيسي النووي لتقليل الخطوات في تحضير أكثر من 1000 عينة.
- قشر وقطع 4 إلى 8 درنات. على الفور ، ضع ما يقرب من 125 جراما من المواد في أكياس قائمة وقم بتجميدها في النيتروجين السائل.
2. الحصول على بيانات الرنين المغناطيسي النووي ومعالجتها
- الإعداد الأولي للرنين المغناطيسي النووي
- نقل العينات إلى مطياف الرنين المغناطيسي النووي.
- ضبط ومطابقة المسبار.
- قفل العينة وحشوها.
- معايرة النبضة الصلبة بزاوية 90 درجة. معايرة النبضة بزاوية 90 درجة باستخدام أي من الإجراءات القياسية.
- قم بتشغيل طيف الرنين النووي للبروتون القياسي 1D.
- تجربة PSYCHE
- حدد تسلسل النبض reset_psyche_1d من مكتبة Bruker Topspin (الشكل S1). ويستعمل المعلمات المعيارية التالية: العرض الطيفي بقدرة kHz 5 (SW2)، وثانية واحدة أو ثانيتين على الأقل من تأخير استرداد الاسترخاء (D1)، و16 عملية مسح وهمية (DS)، و64 أو 128 نقطة بيانات معقدة لكل فدرة (L31)، و64 أو 128 عملية مسح (NS) (الشكل S1).
ملاحظة: L31 هو عدد النقاط الرقمية المعقدة التي تم الحصول عليها في كل كتلة Pure Shift ، ومن الأفضل ضبطها على قوة 2. 21 - اضبط إثارة زاوية قلب نبض CHIRP المطلوبة (CNST61) و 10 كيلو هرتز لعرض النطاق الترددي النبضي CHIRP (CNST60) (الشكل S2).
ملاحظة: تعتمد تجربة PSYCHE على مخطط مضاد ل z-COCOY. وبالتالي ، يجب أن تكون زاوية قلب نبض CHIRP صغيرة لتجنب إعادة اقتران القطع الأثرية (الشكل 1). تزداد الشدة المطلقة مع زاوية قلب الإثارة. يتم أيضا تحسين القطع الأثرية الدورية ، وتنتشر في الطيف وتزيد من "الضوضاء" (الشكل 1). تصبح "الضوضاء" مزيجا من الضوضاء القياسية والقطع الأثرية المقطعة. يتمثل الحل الوسط الجيد بين الحساسية وقطع الاقتران المنخفضة في ضبط CNST61 = 20 درجة. 19,22 - اضبط طول النبضة الصلبة (P1) على القيمة التي تمت معايرتها مسبقا وطول نبضة شكل PSYCHE إلى 30 مللي ثانية (P49) (الشكل S2).
ملاحظة: من المهم جدا معايرة قيمة النبضة الصلبة حيث سيتم حساب قوى نبضة الشكل تلقائيا من هذه القيمة. - اختر نبضة الشكل Crp_psyche.20 (SPNAM 37) لعنصر PSYCHE (الشكل S2).
- اضبط قوة تدرج مجال النبض المطبق أثناء عنصر PSYCHE (GPZ0). اختر RECT.1 لنبض الشكل المتدرج (GPNAM 0) (الشكل S2).
ملاحظة: يتم تطبيق تدرج المجال المغناطيسي الضعيف أثناء عنصر PSYCHE ، عادة ، بين 1٪ إلى 4٪ من القوة القصوى للتدرج ، اعتمادا على المسبار. - قم بتعيين عدد الكتل المراد الحصول عليها من أجل إعادة بناء Pure Shift FID (TD1) (الشكل S3).
ملاحظة: يتم الحصول على PSYCHE كتجربة زائفة ثنائية الأبعاد حيث TD1 هو عدد كتل مخطط التداخل Pure Shift. تعتمد استبانة الطيف على حجم النافذة الطيفية (SW1) والعدد الإجمالي للنقاط المكتسبة ، وهو TD1 * 2 * L31. عادة ما توفر 16 أو 32 كتلة مع 64 أو 128 نقطة معقدة لكل كتلة دقة رقمية كافية. نظرا لأن PSYCHE يتم تسجيله بطريقة مخطط التداخل ، فإن عددا أكبر من الكتل يزيد من الدقة الرقمية ، ولكن أيضا إجمالي وقت الاستحواذ19. تتطور وصلات J المتجانسة خلال كل كتلة مما يؤدي إلى نمط تعديل J متذبذب21،23. بعد تحويل فورييه ، يولد هذا قطعا ملموسة دورية للنطاق الجانبي تعتمد على طول الكتلة (الشكل 2). لتقليل القطع الأثرية ، يجب أن تكون مدة الكتلة قصيرة ، وعادة ما تكون أقل من 16 مللي ثانية (مدة الكتلة = 2 * in0: الشكل S1). إذا كانت مدة الكتلة عالية ، فقم بتقليل L31. - قم بمعالجة البيانات باستخدام برنامج Bruker's Proc_reset AU وتحويل فورييه.
ملاحظة: نوصي بتحويل الطيف باستخدام حشوة صفرية وتعبئة جرس جيبي (الشكل S4).
- حدد تسلسل النبض reset_psyche_1d من مكتبة Bruker Topspin (الشكل S1). ويستعمل المعلمات المعيارية التالية: العرض الطيفي بقدرة kHz 5 (SW2)، وثانية واحدة أو ثانيتين على الأقل من تأخير استرداد الاسترخاء (D1)، و16 عملية مسح وهمية (DS)، و64 أو 128 نقطة بيانات معقدة لكل فدرة (L31)، و64 أو 128 عملية مسح (NS) (الشكل S1).
- تجربة SAPPHIRE-PSYCHE
- حدد تسلسل نبض SAPPHIRE-PSYCHE وقم بتعيين معلمات تسلسل النبض. ستكون المعلمات المعيارية كما يلي: العرض الطيفي kHz 5 (SW3) ، 1 أو 2 ثانية على الأقل من تأخير الاسترخاء (D1) ، 16 مسح وهمي (DS) ، 8 أو 16 مسح لكل زيادة (NS) و D2 إلى ms 14 (الشكل S5).
ملاحظة: هذا التسلسل ليس في ذخيرة بروكر ، ومع ذلك ، يمكن الحصول على التسلسل وبرامج المعالجة من موقع Manchester NMR Methodology Group ، (https://www.nmr.chemistry.manchester.ac.uk/?q=node/426) 23. يضمن تأخير D2 أن يظل استرخاء T2 ثابتا مع كل زيادة في تعديل J. يجب أن يكون D2 أكبر من 1/4 * SW1 + p16 + 2 * d16. 23 - اضبط إثارة زاوية قلب نبض CHIRP المطلوبة (CNST20) و 10 كيلو هرتز لعرض النطاق الترددي النبضي CHIRP (CNST21) (الشكل S6).
ملاحظة: كما هو الحال في تجربة PSYCHE العادية ، يجب أن تكون زاوية قلب نبض CHIRP قصيرة لتجنب إعادة اقتران القطع الأثرية. CNST20 = 20 درجة هو حل وسط جيد بين الحساسية والقطع الأثرية منخفضة إعادةالاقتران 21،23،25. - اضبط طول النبضة الصلبة (P1) على القيمة التي تمت معايرتها مسبقا وطول نبضة شكل PSYCHE على 30 مللي ثانية (P40) (الشكل S6).
ملاحظة: من المهم معايرة قيمة النبضة الصلبة حيث سيتم حساب قوى نبضة الشكل تلقائيا منها. - اختر نبضة الشكل PSYCHE_Saltire_10kHz_30m لعنصر PSYCHE (الشكل S6).
- اضبط شدة تدرج مجال النبض المطبق أثناء عنصر PSYCHE (GPZ10). اختر RECT.1 لنبض الشكل المتدرج (GPNAM 10) (الشكل S7).
ملاحظة: يتم تطبيق تدرج المجال المغناطيسي الضعيف أثناء عنصر PSYCHE ، عادة ، بين 1٪ و 4٪ من القوة القصوى للتدرج ، وهي قيمة تعتمد على المسبار. - اضبط عدد زيادات تعديل SAPPHIRE J في F2 (TD2) (الشكل S7).
ملاحظة: عادة ما تضمن 8 زيادات قمعا ممتازا للقطع الأثرية للنطاق الجانبي (الشكل 2 و 3). العدد الإجمالي لعمليات المسح لجهاز Pure Shift FID النهائي هو NS*TD2. 23 - اضبط النوافذ الطيفية F1 و F2 (SW1 و SW2) (الشكل S5).
ملاحظة: SW2 = SW3 / (2 * TD2) و SW3 / SW1 = TD2 * N ، كانت TD2 و N هي أعداد صحيحةمتساوية 23. يتم الحصول على تجربة SAPPHIRE-PSYCHE كثلاثي الأبعاد زائف حيث يقوم F2 بتشفير تعديل طور القطعة الأثرية J-coupling و F1 اكتساب مخطط التداخل Pure Shift20. نظرا لأن SAPPHIRE-PSYCHE يزيل النطاقات الجانبية لتعديل J ، فإن مدة كتلة Pure Shift في مخطط التداخل يمكن أن تكون أطول من PSYCHE العادية (مدة كتلة Pure Shift = 1 / SW1) ، عادة ما بين 20 إلى 40 مللي ثانية (الشكل 2). ومع ذلك ، يؤدي الحصول على بيانات الأجزاء الأطول إلى تطورات أعلى في اقتران J ، الأمر الذي يتطلب المزيد من زيادات تعديل طور اقتران J لإزالة النطاقات الجانبية الأقوى التي تم الوصولإليها 23. - اضبط عدد كتل Pure Shift (TD1) (الشكل S7).
ملاحظة: نظرا لأن SAPPHIRE-PSYCHE يحتاج إلى تعويض تعديل طور اقتران J للكتلة الأولى ، يجب الحصول على كتلة إضافية. عادة ما تعطي 17 (16 + 1) أو 33 (32 + 1) كتلة دقة رقمية كافية23. - معالجة البيانات المنفذة لبرامج pm_pshift و pm_fidadd AU متبوعة بتحويل فورييه23.
ملاحظة: نوصي بتحويل الطيف باستخدام حشوة صفرية وتعبئة جرس جيبي (الشكل S4).
- حدد تسلسل نبض SAPPHIRE-PSYCHE وقم بتعيين معلمات تسلسل النبض. ستكون المعلمات المعيارية كما يلي: العرض الطيفي kHz 5 (SW3) ، 1 أو 2 ثانية على الأقل من تأخير الاسترخاء (D1) ، 16 مسح وهمي (DS) ، 8 أو 16 مسح لكل زيادة (NS) و D2 إلى ms 14 (الشكل S5).
النتائج
تحليل طيف الرنين المغناطيسي النووي
تزيد تجارب PSYCHE من دقة الأطياف عن طريق انهيار الرنين المقترن إلى المفردات21 ، مما يقلل بدوره من التداخل ويسهل التخصيص وتحليل البيانات. يمكن تطبيق Pure Shift NMR على المستخلصات النباتية. نوضح هنا استخدامه في ثلاث مصفوفات مختلفة: أوراق الفانيليا ، ودرنات البطاطس ، وفاكهة Physalis peruviana . يتضح تحسين الدقة الذي تم تحقيقه في أطياف هذه المستخلصات النباتية من الأشكال S8-S11.
من أجل تقييم تأثير تسلسلات النبضات هذه في دقة إشارة الرنين المغناطيسي النووي ، تم حساب عرض الخط بوحدات التردد عند 10٪ من الحد الأقصى للارتفاع ، W10 ، لعدة أنواع من الرنين ، وكلها متجلى في الأطياف التي تم الحصول عليها باستخدام مستخلصات الفانيليا sp - التحول النقي ضد الكلاسيكية 1H NMR - الشكل 4. بشكل عام ، وصل توسع الرنين المقترن إلى قيم W10 من 1 إلى 60 هرتز ، بينما تراوحت القمم المفردة بين 1 إلى 10 هرتز: وصلت مجموعة الميثيل من حمض الأسيتيك (1.97 جزء في المليون في الشكل 4) إلى قيمة W10 تبلغ 2.0 هرتز في 1H-NMR الكلاسيكي و 2.1 هرتز في طيف SAPPHIRE-PSYCHE (S). يمتد الرنين الشاذ للسكروز (عند 5.40 جزء في المليون) ، وهو مزدوج مع اقتران J يبلغ 3.9 هرتز ، على منطقة مكافئة ل W10 من 6.5 هرتز ، مع كل ذروة فردية تمثل 2.6 هرتز من W10 (الشكل 4). كانت هذه القيمة أعلى من تلك الخاصة بالذروة المنهارة التي تم الحصول عليها في طيف SAPPHIRE-PSYCHE ، W10 = 1.9 هرتز (الشكل 4). في حالة حمض الماليك Hβ '(عند 2.55 جزء في المليون) ، يمتد مزدوج من الزوجيات مع J = 7.8 هرتز ، 15.6 هرتز ، على 29.4 هرتز (الشكل 4) ، مع قيم W10 محسوبة لكل ذروة فردية بين 4.7 و 4.9 هرتز. انهارت هذه الإشارة المتعددة بواسطة Pure Shift إلى خط واحد (عند 2.55 جزء في المليون) ، وتمتدت على قيمة W10 تبلغ 4.7 هرتز (الشكل 4).
يصبح تعدد الإشارة أكثر تعقيدا في الهيدروجينات عالية الاقتران حيث لم يعد من السهل تمييز القمم التأسيسية للمضاعفات ، مما يشكل إشارة شبه مستمرة. هذا هو الحال بالنسبة للهيدروجين الحمضي المتماثل ، Hγ (عند 2.24 جزء في المليون) ، Hδ (عند 2.02 جزء في المليون) ، و Hδ '(عند 1.91 جزء في المليون) ، الشكل 4. انهارت المضاعفات Hγ و Hδ و Hδ ب W10 = 38.3 هرتز ، W10 = 41.5 هرتز ، و W10 = 34.8 هرتز ، على التوالي ، إلى مفردات W10 = 7.8 هرتز (Hγ ، 2.24 جزء في المليون) ، W10 = 8.0 هرتز (Hδ ، 2.02 جزء في المليون) و W10 = 6.2 هرتز (Hδ '، 1.91 جزء في المليون) ، الشكل 4. سمحت هذه الدقة المحسنة بتمييز أفضل للإشارات المتداخلة الأخرى المقابلة لحمض الماليك (Hβ ، 2.77 جزء في المليون Hβ '، 2.55 جزء في المليون) ، وحمض المتجانس (Hα ، 2.80 جزء في المليون و Hα '، 2.63 جزء في المليون) ، ولاكتون حمض الهوموسيتريك (Hα '، 2.84 جزء في المليون و Hδ ، 2.65 جزء في المليون) (الشكل 4).
يتضح التحسن في الدقة في الأطياف المنفصلة عن النواة المتجانسة SAPPHIRE-PSYCHE التي تسمح بتمييز أفضل بين الإشارات في منطقتين معرضتين للخطر للغاية ، 4.85 - 5.08 جزء في المليون و 7.05 - 7.31 جزء في المليون ، حيث يمكن تحديد مستقلبات مهمة تشارك في مسار التمثيل الغذائي لعطر الفانيليا: جلوكوزيد أ (انظر الهيكل في الشكل 5) ، CH-2 '، 6' (عند 7.28 جزء في المليون) ، CH-2 "، 6 "(عند 7.18 جزء في المليون) ، CH-3 '، 5 "(عند 7.09 جزء في المليون) ، CH-3 "، 5" (عند 7.07 جزء في المليون) ، CH2-7 '(عند 4.97 جزء في المليون و 5.05 جزء في المليون) ، CH2-7 '' (عند 4.89 جزء في المليون) ، CH-Glc (عند 4.96 جزء في المليون) و CH'-Glc (عند 4.93 جزء في المليون) ، جلوكوزيد B (انظر الهيكل في الشكل 4) ، CH-2 '، 6' (عند 7.29 جزء في المليون) ، CH-2 "، 6" (عند 7.23 جزء في المليون) ، CH-3 '، 5 '(عند 7.09 جزء في المليون) ، CH-3 "، 5" (عند 7.07 جزء في المليون) ، CH2-7 '(عند 4.99 جزء في المليون) ، CH2-7 '' (عند 4.91 جزء في المليون) ، كحول هيدروكسي بنزيل (7.23 جزء في المليون) وهيدروكسي بنزيل كحول جلوكوزيد (7.10 و 4.51 جزء في المليون) ، الشكل 4.
لوحظت نفس النتائج مع مستخلصات عنب الثعلب في تحليل درنات البطاطس. في هاتين الحالتين ، تم توسيع العديد من المناطق المزدحمة على 1H-NMR و PSYCHE و SAPPHIRE-PSYCHE العادية للمقارنات (الشكلان 6 و 7).
من الواضح أن تجارب PSYCHE و SAPPHIRE-PSYCHE حسنت بوضوح دقة إشارة مستخلصات عنب الثعلب من أجل السكروز (4.04 جزء في المليون) ، β الفركتوز (4.02 جزء في المليون و 3.99 جزء في المليون) ، β جلوكوز (3.24 جزء في المليون) ، البرولين (2.34 جزء في المليون ، 2.07 جزء في المليون ، و 2.00 جزء في المليون) ، حمض الجلوتاميك (2.16 جزء في المليون) ، والجلوتامين (2.13 جزء في المليون) (الشكل 6) ، كما أظهرنا في العمل السابق11 ، كما فعلت في حالة S. حدبة مقتطفات: GABA (1.91 جزء في المليون ، 2.33 جزء في المليون ، و 3.02 جزء في المليون) ، حمض البيروجلوتاميك (2.04 جزء في المليون ، 2.41 جزء في المليون ، و 2.51 جزء في المليون) ، البرولين (2.00 جزء في المليون ، 2.07 جزء في المليون ، 3.33 جزء في المليون ، و 3.42 جزء في المليون) ، الجلوتامين (2.14 جزء في المليون و 2.46 جزء في المليون) ، فالين (2.27 جزء في المليون) ، حامض الستريك (2.64 جزء في المليون و 2.76 جزء في المليون) ، و β جلوكوز (3.25 جزء في المليون و 3.47 جزء في المليون) ، الشكل 7.
تسلسل PSYCHE سهل الاستخدام نسبيا وقد تم تنفيذه بنجاح في مجموعة واسعة من التطبيقات9. للوصول إلى الطيف المنفصل ، يكتسب تسلسل النبض أجزاء صغيرة من FID يعيد تركيز اقتران J في منتصف كل كتلة. ومع ذلك ، يحدث تطور صغير في اقتران J خلال كل كتلة ويولد القطع الأثرية الدورية للنطاقات الجانبية التي تمثل عادة أقل من 5٪ من ذروتها الأصلية21. يتضح وجود هذه القطع الأثرية لتعديل J ، المتأصلة في تجارب PSYCHE21 ، في المناطق الموسعة في الشكل 6 . في تحليل المركبات النقية ، يمكن إهمال هذه القطع الأثرية. في العينات البيولوجية ، قد لا يكون هذا هو الحال ، لأنه ، كما هو موضح في الشكل 6 للبرولين (4.13 جزء في المليون ، 3.41 جزء في المليون ، و 3.33 جزء في المليون) ، والأسباراجين (3.97 جزء في المليون) ، وميو-إينوزيتول (3.27 جزء في المليون) ، و GABA (3.03 جزء في المليون) ، وحمض الماليك (2.67 جزء في المليون) ، وفي الشكل 6 لحمض البيروجلوتاميك (2.04 جزء في المليون ، و 2.41 جزء في المليون ، و 2.51 جزء في المليون) والفالين (2.27 جزء في المليون) ، تولد المستقلبات بتركيزات أعلى قطع أثرية كبيرة مثل بعض الإشارات التي تنتمي إلى مركبات موجودة بتركيزات منخفضة مما يضر بهذه الطريقة بدقة التنميط الأيضي.
تجربة SAPPHIRE-PSYCHE هي تعديل لتسلسل PSYCHE المنتظم حيث تتم إزالة هذه القطع الأثرية الدورية عن طريق تعديل الطور المنهجي ، والذي يتم تحقيقه عن طريق تحويل نقطة إعادة التركيز J 23. وبالتالي ، تسمح تجربة SAPPHIRE-PSYCHE بضمان طيف Pure Shift أنظف بكثير ، كما هو موضح في الشكل 6 للبرولين (4.13 جزء في المليون ، 3.41 جزء في المليون ، و 3.33 جزء في المليون) ، الأسباراجين (3.97 جزء في المليون) ، ميو إينوزيتول (3.27 جزء في المليون) ، GABA (3.03 جزء في المليون) ، وحمض الماليك (2.67 جزء في المليون) ، في حالة عنب الثعلبكيب 11 ، وفي الشكل 7 لحمض البيروجلوتاميك (2.04 جزء في المليون ، 2.41 جزء في المليون ، و 2.51 جزء في المليون) وفالين (2.27 جزء في المليون) ، في حالة البطاطس.
قطعة أثرية أخرى تعاني منها جميع تجارب Pure Shift هي تلك الناتجة عن تأثير الاقتران القوي. تظهر بعض المستقلبات الأولية المهمة مثل حامض الستريك (2.64 جزء في المليون و 2.76 جزء في المليون) والجلوتامين (2.14 جزء في المليون و 2.46 جزء في المليون) ، قطع أثرية قوية للاقتران ، كما هو موضح في مستخلص درنات البطاطس (الشكل 7). حتى الآن ، لا يوجد تسلسل نبضي يمكنه القضاء على هذه المشكلة بسهولة. ومع ذلك ، فإن أداء SAPPHIRE-PSYCHE أفضل من PSYCHEالعادي 8،9،23.
تحليل مصفوفة الارتباط
تتمثل إحدى المزايا الرئيسية للتحليل الطيفي بالرنين المغناطيسي النووي في أن التركيزات النسبية للمستقلبات في الخليط تتناسب طرديا مع شدة إشاراتها. بعد ذلك ، يمكن الحصول على مصفوفة ارتباط زوجي للمستقلب مباشرة من مصفوفة ارتباط الأطياف32.
عادة ما يتم تمثيل مصفوفة الارتباط 1H-NMR ، والمعروفة باسم STOCSY32 (التحليل الطيفي للارتباط الكلي الإحصائي) ، على أنها طيف زائف ثنائي الأبعاد ، حيث تكون كل ذروة متقاطعة معامل ارتباط بين إشارتين (الشكل 8) 11. يعرض STOCSY ارتباطا عاليا بين الإشارات التي تنتمي إلى نفس الجزيء ، ولكن أيضا مع إشارات من الجزيئات التي تتعلق بنفس المسار الأيضي11،32. ومن ثم ، توفر أنماط الارتباطات معلومات حول الحالة الفسيولوجية للنظام ، وبالتالي يمكن استخدامها كبصمة للمرحلة الفسيولوجية33.
القيد الرئيسي ل STOCSY هو تداخل الإشارة ، مما يقلل من الارتباط الزوجي11،32. علاوة على ذلك ، تؤدي ارتباطات تعدد اقتران J إلى أنماط معقدة للغاية ، مما يزيد من تعقيد التحليل11،32. يعزز استخدام SAPPHIRE-PSYCHE STOCSY ، الموضح في الشكل 8 ، قيم الارتباط لأنه يقلل من ارتباطات تعدد اقتران J إلى ذروة واحدة ، وبالتالي تقليل11 المتداخلة.
تم توسيع العديد من المناطق في الشكل 8. يظهر حمض الماليك أنماطا معقدة من J متعددة الطبقات مرتبطة ب Hα (4.41 جزء في المليون) ، و Hβ (2.82 جزء في المليون) ، و Hβ ′ (2.67 جزء في المليون) ؛ في Pure Shift STOCSY تنهار هذه الإشارات إلى قمم ارتباط مفردة (الشكل 9 أ) 11. لوحظت نفس النتائج بالنسبة للجلوكوز β حيث تم تصوير الارتباطات بين الجزيئات وداخل الجزيئات (α-الجلوكوز و α-الفركتوز و β-الفركتوز) بشكل أفضل بواسطة SAPPHIRE-PSYCHE (الشكل 9 ب) 11. بعض الأحماض الأمينية أيضا عرض ارتباطات قوية داخل الجزيئات في مقتطفات عنب الثعلب كيب. ومع ذلك ، فإن تحديدهم في 1 H-NMR STOCSY العادييتعرض للخطر بسبب التداخل في المناطق المزدحمة. مع Pure Shift STOCSY ، يتم تصوير البرولين والألانين والجلوتامين وحمض الجلوتاميك بشكل أفضل الارتباطات بين الجزيئات وداخل الجزيئات (الشكلان 9C و 9D) 11.
تحليل متعدد المتغيرات
يعد التحليل متعدد المتغيرات أحد الأدوات الرئيسية المستخدمة في معالجة بيانات التمثيل الغذائي34،35. في حين أن تمييز العينة بواسطة PCA (تحليل المكون الرئيسي) أو PLS-DA (التحليل التمييزي الجزئي للمربعات الصغرى) يمكن تحقيقه بسهولة من خلال أطياف H-NMR العادية 1، فإن تفسير التحميل يتم معالجته بشكل أفضل من خلال بيانات التحولالنقي 11،24،25،27،28.
في الشكل 10 ، نعرض مخطط درجة PLS-DA الذي تم الحصول عليه باستخدام SAPPHIRE-PSYCHE (الشكل 10 أ) وأطياف البروتون العادية (الشكل 10 ب) في التمييز بين ستة أنماط بيئية من P. peruviana مقتطفات11. على الرغم من وجود بعض الدراسات التي تدعي أداء تمييزا أفضل عند استخدام بيانات Pure Shift24،25 ، إلا أن نتائجنا تظهر أن الأداء بالكاد تأثر بفصل النواة المتجانسة11. في حالة تحليل بيانات التحميل ، كما هو موضح في الشكلين 10C و 10D ، فإن الدقة المتزايدة التي تم تحقيقها باستخدام بيانات SAPPHIRE-PSYCHE سهلت التحليل وسمحت بتحديد أفضل للمستقلبات المحددة المسؤولة عن المتصورة بيروفيانا التمييز ، وهي α-الجلوكوز ، β-الجلوكوز ، α-الفركتوز ، β-الفركتوز ، السكروز ، حامض الستريك ، والألانين11. كان اكتساب الدقة هذا أمرا بالغ الأهمية أيضا عند الجمع بين تحليل معاملات PLS وارتباط STOCSY ، الشكلان 10C و 10D11. العلاقة القوية بين الجلوكوز α (متجه STOCSY عند 5.23 جزء في المليون مرمز بالألوان على مكون PLS الأول) و β- الجلوكوز و α الفركتوز و β- الفركتوز - جميع المستقلبات التي تتطور من نفس المسار الأيضي - وارتباطها المضاد فيما يتعلق بالسكروز ، واضحة11. مع تحليل STOCSY العادي ، لم يسمح التداخل الواسع بتصوير واضح بين معاملات الارتباط وأدى إلى فقدان معلومات مسار التمثيل الغذائي هذه (الشكل 10) 11.
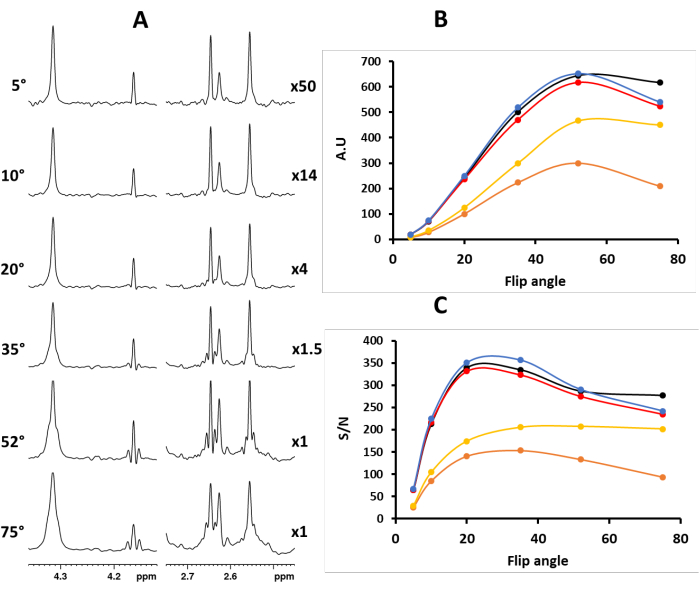
الشكل 1. (أ) أطياف PSYCHE لمستخلصات الفانيليا بلانيفوليا باستخدام زوايا قلب نبضية CHIRP مختلفة لعنصر PSYCHE: قيم زاوية الوجه اليسرى ؛ صحيح ، عامل ضرب الشدة. (ب) و (ج) تظهر الرسوم البيانية شدة وإشارة إلى ضوضاء لخمس قمم منفصلة (أسود - 4.31 جزء في المليون ، برتقالي - 4.16 جزء في المليون ، أحمر - 2.65 جزء في المليون ، أصفر - 2.63 جزء في المليون ، وأزرق 2.56 جزء في المليون) كدالة لزاوية الوجه لنبض PSYCHE CHIRP ، على التوالي. تم حساب نسبة الإشارة إلى الضوضاء (S / N) (بتعبير أدق ، نسبة الإشارة إلى الضوضاء + القطعة الأثرية) باستخدام إشارة الشدة القصوى مقابل إشارة الضوضاء ، القيمة المحسوبة على نطاق 2 جزء في المليون : من 7.75 جزء في المليون إلى 9.75 جزء في المليون (الشكل S12). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
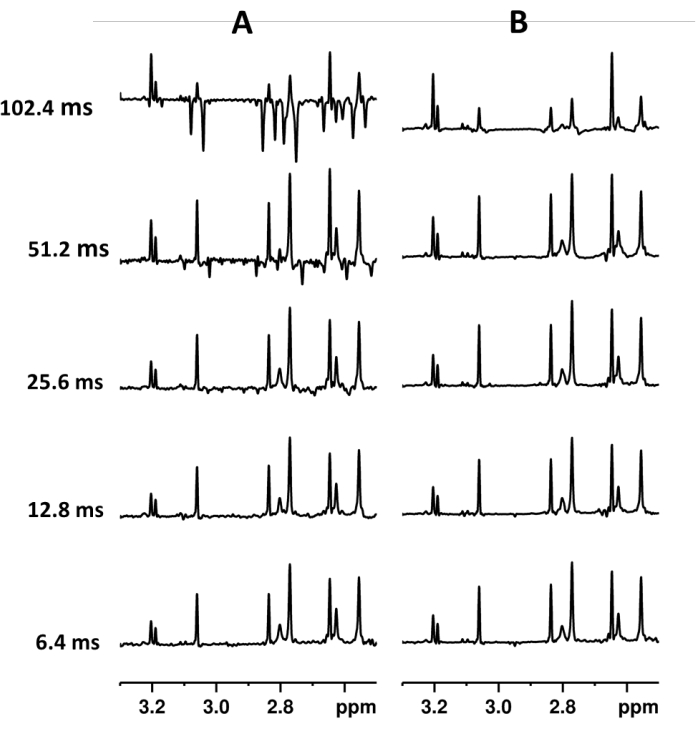
الشكل 2. أطياف PSYCHE (A) و SAPPHIRE-PSYCHE (B) من مستخلصات الفانيليا بلانيفوليا مع مدة كتلة Pure Shift مختلفة من interferogram. تم الحصول على التجارب من أجل الحفاظ على نفس الدقة والحساسية الرقمية. معلمة PSYCHE (A) من الأسفل إلى الأعلى: 128 عملية مسح ضوئي ، 64 كتلة مخطط تداخل ، طول كتلة 6.4 مللي ثانية ، إجمالي وقت الاستحواذ 6h07min ؛ 128 عملية مسح ضوئي ، 32 كتلة مخطط تداخل ، طول كتلة 12.8 مللي ثانية ، إجمالي وقت الاستحواذ 3h04min ؛ 128 مسحا ضوئيا، 16 كتلة مخطط تداخلي، طول كتلة 25.6 مللي ثانية، إجمالي وقت الاستحواذ 1 ساعة و 32 دقيقة؛ 128 مسحا ضوئيا ، 8 كتل مخطط تداخل ، طول كتلة 51.2 مللي ثانية ، إجمالي وقت الاستحواذ 46 دقيقة ؛ 128 عملية مسح ضوئي ، 4 كتل مخطط تداخل ، طول كتلة 102.4 مللي ثانية ، إجمالي وقت الاستحواذ 24 دقيقة. معلمة SAPPHIRE-PSYCHE (B) من الأسفل إلى الأعلى: 16 عملية مسح ، زيادات تعديل 8 J ، 65 كتلة مخطط تداخل ، طول كتلة 6.4 مللي ثانية ، إجمالي وقت الاستحواذ 6 ساعات و 19 دقيقة ؛ 16 عملية مسح ضوئي، 8 زيادات في تعديل J ، 33 فدرة مخطط تداخلي، طول فدرة 12,8 مللي ثانية، إجمالي وقت الاقتناء 3 ساعات و13 دقيقة؛ 16 عملية مسح ضوئي ، 8 زيادات تعديل J ، 17 كتلة مخطط تداخل ، طول كتلة 25.6 مللي ثانية ، إجمالي وقت الاستحواذ 1 ساعة و 40 دقيقة ؛ 16 عملية مسح ضوئي ، زيادات تعديل 8 J ، 9 كتل مخطط تداخل ، طول كتلة 51.2 مللي ثانية ، إجمالي وقت الاستحواذ 53 دقيقة ؛ 16 عملية مسح ضوئي، 8 زيادات تعديل J ، 5 كتل مخطط تداخلي، طول كتلة 102.4 مللي ثانية، إجمالي وقت الاستحواذ 30 دقيقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3. (أ) أطياف مستخلصات الفانيليا بلانيفوليا بطول قطعة 102.4 مللي ثانية: أعلى ، مسح PSYCHE 128 ، 4 زيادات Pure Shift ؛ الجزء العلوي الأوسط ، 4 عمليات مسح ، 4 زيادات Pure Shift ، 32 زيادات من الياقوت ؛ الجزء السفلي الأوسط ، 8 عمليات مسح ، 4 زيادات Pure Shift ، 16 زيادات من الياقوت ؛ أسفل ، 16 عملية مسح ضوئي ، 4 زيادات Pure Shift ، 16 زيادات من الياقوت. (ب) أطياف مستخلصات الفانيليا بلانيفوليا بطول قطعة 51.2 مللي ثانية: أعلى ، مسح PSYCHE 128 ، 8 زيادات Pure Shift ؛ الجزء العلوي الأوسط ، 4 عمليات مسح ، 9 زيادات Pure Shift ، 32 زيادات من الياقوت ؛ الجزء السفلي الأوسط ، 8 عمليات مسح ، 9 زيادات Pure Shift ، 16 زيادات من الياقوت ؛ أسفل ، 16 عملية مسح ضوئي ، 9 زيادات Pure Shift ، 16 زيادات من الياقوت. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. مناطق تمدد مختارة من 1H NMR (1H) و SAPPHIRE-PSYCHE (S) أطياف V. planifolia (1.85 - 2.9 جزء في المليون) و V. pompona (4.85 - 7.31 جزء في المليون) ، تظهر تخصيصات الإشارة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
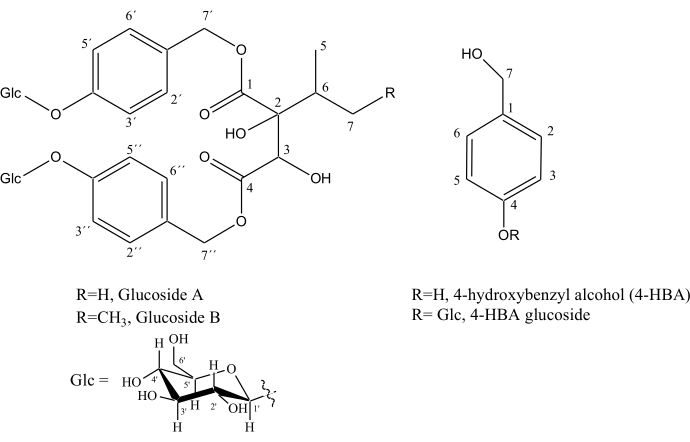
الشكل 5. هياكل سلائف عطر الفانيليا: 4-هيدروكسي بنزيل كحول (4-HBA) ، 4-HBA glucoside ، جلوكوزيد A ، والجلوكوزيد B. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 6. مناطق تمدد مختارة من أطياف 1H NMR (1H) و PSYCHE (P) و SAPPHIRE (S) لمستخلص مائي من عنب الثعلب الرأس (Bambamarca I منطقة الأنديز البيروفية28) تظهر تخصيصات الإشارة (أعيد طبعها بإذن من Lopez et al.11 ). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
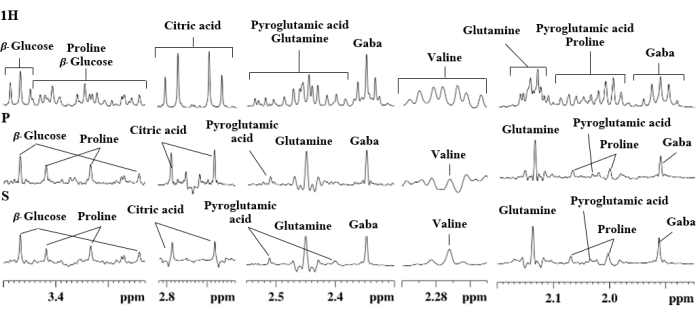
الشكل 7. مناطق تمدد مختارة من أطياف 1H NMR (1H) و psyche (P) و SAPPHIRE (S) لمستخلص مائي من البطاطس يظهر تعيين الإشارة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 8. تم الحصول على مناطق موسعة مختارة (3.20 جزء في المليون -4.30 جزء في المليون) من أطياف الرنين المغناطيسي النووي STOCSY ثنائية الأبعاد مع بيانات من ستة مستخلصات عنب الثعلب في كيب تظهر قيم الارتباط (ص2) فوق 0.85: (أ) منتظم 1ساعة NMR stocsy و (ب) SAPPHIRE-PSYCHE STOCSY. أعيد طبعه بإذن من لوبيز وآخرون 11 الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
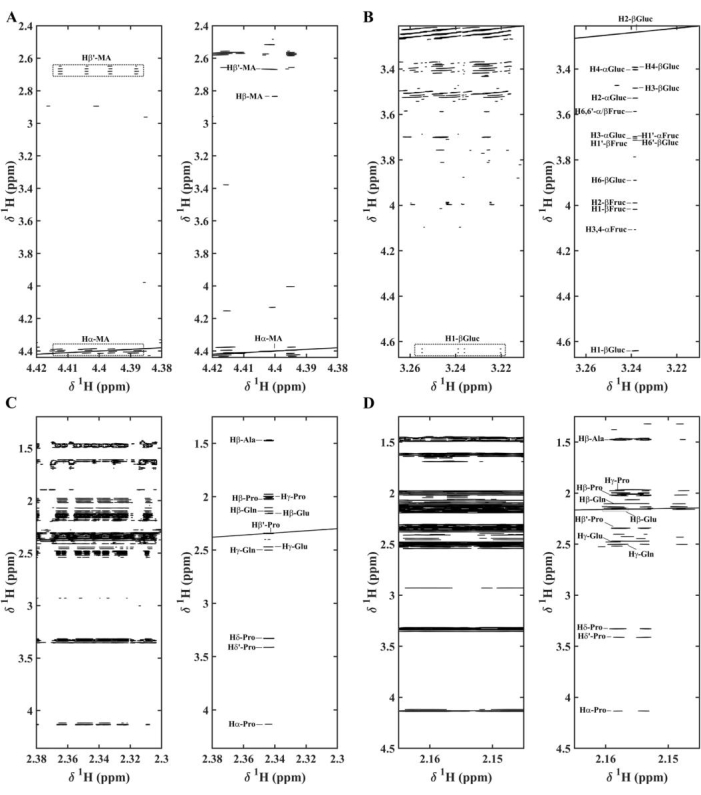
الشكل 9. تمثيلات STOCSY لأطياف الرنين المغناطيسي النووي لستة مستخلصات مختلفة من عنب الثعلب في كيب تظهر ارتباطات (ص2) ، في اليسار دون اقتران homodecoupling وفي اليمين مع homodecoupling للمناطق: (A) 4.38-4.42 جزء في المليون و 2.40-4.42 جزء في المليون مع r2 فوق 0.80 لإشارة حمض الماليك (MA) (Hα-MA) ؛ (ب) 3.21-3.27 جزء في المليون و3.21-4.67 جزء في المليون مع r2 فوق 0.85 لإشارة β-غلوكوز (H2-β-Gluc)؛ (ج) 2.30-2.38 جزء في المليون و 1.25-4.36 مع r2 فوق 0.93 لإشارة البرولين (Pro) (Hβ′′-Pro)؛ (د) 2.15-2.17 جزء في المليون و1.25-4.5 جزء في المليون مع r2 فوق 0.90 لإشارة حمض الجلوتاميك (Glu) (Hβ-Glu)؛ يرمز إلى α-الجلوكوز و α-الفركتوز و β-الفركتوز على أنها α-Glocu و α-Fruc و β-Fruc ، على التوالي. أعيد طبعه بإذن من لوبيز وآخرون 11 الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 10. يسجل PLS قطعة أرض من مستخلصات عنب الثعلب في الرأس المزروعة في ست مناطق مختلفة في الأنديز11،28 (سان ماركوس: دوائر حمراء ، سيليندين الثالث: مثلثات بنية ، بامباماركا الأول: نجوم زرقاء ، سيليندين الأول: مثلثات صفراء ، بامباركا الثاني: مربعات خضراء ، سيليندين الثاني: الماس الأرجواني) بناء على (أ) تجارب الرنين المغناطيسي النووي الكلاسيكية 1H و (ب) تجارب الياقوت والنفس. تم تعيين علامات الحذف T2 الخاصة ب Hotelling على مستوى ثقة 95٪. مزيج من أحمال PLS1 و 1D STOCSY لارتباط α الجلوكوز باستخدام إشارة STOCSY عند 5.23 جزء في المليون كذروة للسائق. تم ترميز معامل التحديدات (r2) بالألوان وإسقاطها على معاملات مكون PLS الأول: (أ) 1D STOCSY التي تم الحصول عليها باستخدام بيانات SAPPHIRE-PSYCHE (أعلى) وتوسعها 3.15-4.17 جزء في المليون (أسفل) ؛ (ب) 1D STOCSY الذي تم الحصول عليه ببيانات الرنين المغناطيسي النووي 1H (أعلى) وتوسعته 3.15-4.17 جزء في المليون (أسفل)؛ يرمز إلى α-الجلوكوز و β-الجلوكوز و α-الفركتوز و β-الفركتوز والسكروز على أنها α-G و β-G و α-F و β-F و S ، على التوالي. تم إجراء تحليل PLS-DA و STOCSY باستخدام MATLAB الإصدار R2018a. (أعيد طبعه بإذن من لوبيز وآخرون 11) الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يعد تحديد التمثيل الغذائي الهيكلي والكمية من القضايا الرئيسية في توصيف التمثيل الغذائي ، وهي البيانات التي عند تعرضها لتحليلات متعددة المتغيرات تسمح بفهم النظام البيولوجي قيد الدراسة بشكل أفضل. يعد إعداد العينات والحصول على البيانات من الجوانب الحاسمة التي تحتاج إلى تحسين من أجل تقديم نتائج موثوقة.
في هذه المقالة ، نصف ونوضح إعداد العينة لتحليل الرنين المغناطيسي النووي لثلاث مصفوفات نباتية مختلفة. كما هو الحال مع أي إجراء استخلاص ، فإن كمية المذيب لكل جرام من المادة والخصائص الفيزيائية للمذيب المحدد ستحدد التركيب الكيميائي للمستخلص النهائي وتركيز المستقلبات المستخرجة. في حالة التنميط الأيضي بالرنين المغناطيسي النووي ، فإن الأس الهيدروجيني ، وقابلية التكاثر بين استخراج العينات المستقلة ، والكمية النهائية من المستخلص في أنبوب الرنين المغناطيسي النووي هي أيضا جوانب تحتاج إلى تحسين. تكمن أهمية التكاثر في التمثيل الغذائي في تجنب إدخال تباين غير مرتبط ، مما قد يؤدي إلى نتائج غير موثوقة. في تجربتنا ، تم تحقيق ظروف الاستخراج المثلى مع المواد النباتية الجافة والمطحونة. في حالة عنب الثعلب في كيب ، كان من الصعب جدا التعامل مع المنتج الجاف (شديد الاسترطاب) لذلك تم تجانس التوت الطازج أولا ، قبل الترشيح.
في حالة اكتساب الأطياف ، يكون الإعداد التجريبي ل Pure Shift ذا أهمية خاصة ، حيث يمكن أن تؤدي المعلمات الخاطئة إلى تقطيع القطع الأثرية وإعادة اقترانها. النظرية الكامنة وراء مبادئ تجارب Pure Shift ، التي تمت مراجعتها على نطاق واسع في مكان آخر8،9،10 ، مهمة لفهم كيفية تكوين تسلسل النبض بشكل صحيح وتنفيذه كتجربة روتينية.
باختصار ، تعتمد معظم تجارب Pure Shift على إعادة تركيز تطور اقتران J أثناء تسجيل التحول الكيميائي. يتم تحقيق ذلك عادة عن طريق عنصر إعادة التركيز J-coupling الذي يعكس بشكل انتقائي الدورات "السلبية" ، بينما تظل الدورات "النشطة" غير متأثرة. يعتمد PSYCHE و SAPPHIRE-PSYCHE على تجربة مضادة ل z-COSY حيث يتم عكس الدورات "السلبية" إحصائيا.
يؤدي عنصر PSYCHE ، الذي يتكون من نبضتين بزاوية قلب منخفضة التردد في وجود تدرج مجال نبضي ضعيف ، إلى متوسط التردد الزماني المكاني ، واختيار مصطلحات COSY المضادة للقطر مع قمع مصطلحات الارتباط الكمي والمتقاطع الصفري. وفقا لذلك ، لتجنب القطع الأثرية المتأصلة في إعادة الاقتران ، يجب أن تكون زاوية قلب نبض CHIRP قصيرة (الشكل 1). عادة ما تكون زاوية الوجه 20 درجة حلا وسطا جيدا بين الحساسية وأداء الفصل (الشكل 1). لذلك ، تعد معايرة النبض أمرا بالغ الأهمية لجودة وحساسية الطيف.
عادة ما ترتبط الدراسات الأيضية بتسجيل الأطياف على عدد كبير من العينات ، مما يعني أن معايرة النبض يجب أن تكون سريعة أو تلقائية. في تجربتنا ، إذا تم تحضير العينات بنفس الطريقة تماما ، فإن تباين طول النبضة الصلبة بين العينات أقل من ± 0.2 ميكرو ثانية. نقوم عادة بمعايرة ما بين 6 و 12 عينة ثم نستخدم متوسط القيمة التي تم تحقيقها لإعداد مجموعة العينات بأكملها. في حالة تقلب طول النبضة من عينة إلى أخرى أعلى ، يجب إجراء المعايرة التلقائية لكل عينة باستخدام برنامج أتمتة النبضات Topspin على مطياف بروكر.
المعلمة المهمة الثانية التي يجب مراعاتها هي طول الكتل المسجلة أثناء اكتساب مخطط التداخل التدريجي21،23. يتكون اكتساب Interferogram من تسجيل FID بواسطة أجزاء صغيرة ، مع تزامن نقطة إعادة التركيز لتطور اقتران J دائما مع مركز القطعة المكتسبة. يتم إنشاء FID المنفصل عن طريق تسلسل كل جزء متتالي8،9،10. للتأكد من أن اكتساب الكتلة لا يقتطع تطور التحول الكيميائي ، يجب أن تتطابق بداية كل تسجيل بيانات تماما مع نهاية القطعة السابقة.
على الرغم من أن هذا الإجراء يسمح لنا بالحصول على طيف متقارن ، إلا أن تطور اقتران J الصغير خلال كل كتلة يولد قطعا أثرية دورية تعتمد بشكل مباشر على طول القطعة. ومن ناحية أخرى، تعتمد الاستبانة الرقمية الطيفية على النافذة الطيفية وعلى المدة الإجمالية للفدرة المنفصلة، والتي تتوقف بدورها على طول الفدرة وعدد الفدرات المسجلة. لذلك ، لتقليل القطع الأثرية الدورية دون التضحية بالدقة ، يجب أن تكون مدة الكتلة قصيرة ، ويجب أن يكون العدد الإجمالي للكتل المسجلة مرتفعا. ومع ذلك ، ستزيد هذه الشروط بشكل كبير من إجمالي وقت الاستحواذ التجريبي دون زيادة الحساسية (الشكل 2). عادة ما تعطي تجربة PSYCHE المكتسبة من 16 إلى 32 كتلة من 10 إلى 16 مللي ثانية دقة رقمية كافية في وقت تجريبي معقول (30 دقيقة إلى 5 ساعات) (الشكل 2).
في حالة SAPPHIRE-PSYCHE ، وهي تجربة يتم الحصول عليها كثلاثي الأبعاد الزائفة ، يقوم أحد الأبعاد غير المباشرة بترميز اكتساب مخطط التداخل Pure Shift والآخر لتعديل الطور للقطع الأثرية الدورية من خلال التحول المنهجي لنقطة إعادة التركيز J في كل قطعة.
نظرا لأن القطع الأثرية الدورية يتم قمعها بشدة بواسطة SAPPHIRE ، يمكن أن تكون أطوال الكتلة أطول. ومع ذلك ، فإن الأجزاء الطويلة جدا تؤثر بشدة على شدة الإشارات (الشكلان 2 و 3). في SAPPHIRE ، تساهم زيادات تشكيل J في حساسية الطيف ، وبالتالي ، فإن العدد الإجمالي لعمليات المسح FID المنفصلة الناتجة يساوي TD2 * NS (الشكلان 2 و 3) 23. بشكل عام ، تضمن ثماني زيادات في تعديل J قمعا دوريا ممتازا للقطع الأثرية وأكثر من ثماني زيادات لها تأثير ضئيل جدا على جودة الطيف ، حتى إذا تم استخدام أطوال القطع الطويلة (الشكل 3) 23. تضمن زيادات Pure Shift بمقدار 33 أو 17 بمدد تتراوح بين 20 إلى 40 مللي ثانية دقة رقمية طيفية جيدة.
أحد قيود كل من تسلسل نبض Pure Shift ، PSYCHE و SAPPHIRE-PSYCHE ، هو القياس الكمي عن طريق التكامل القياسي المطلق للمستقلب الداخلي. في 1H-NMR العادي ، تتناسب الكثافة المتكاملة طرديا مع تركيز كل مستقلب. في PSYCHE ، لم يعد هذا هو الحال ، لأن عددا من الظواهر تشوه الإشارات وتؤثر على التكامل. على سبيل المثال ، تتضاءل القيمة التكاملية الإجمالية بسبب استرخاء T2 أثناء اختيار دوران تسلسل النبض. أيضا ، فإن تطور اقتران J المقطوع أثناء اكتساب القطعة التي تولد قطعا أثرية للنطاقات الجانبية ، يعطل شكل لورنتزيان للإشارة. ومن ثم ، فإن التكامل يتألف الآن من مناطق تحت الذروة الرئيسية وتحت جميع النطاقات الجانبية ، مما يعقد تكامل الإشارة8،9،21،23. يرتبط تردد وحجم النطاقات الجانبية ارتباطا مباشرا بطول القطعة ولكن أيضا بالخصائص الجزيئية الجوهرية مثل الاسترخاء وحجم اقتران J وتعدده: تؤدي مقادير اقتران J الأعلى والتعددية الأعلى إلى إشارات أكثر تشويه. في حالة SAPPHIRE ، على الرغم من أن تجربة الرنين المغناطيسي النووي هذه تزيل القطع الأثرية للنطاق الجانبي بكفاءة ، إلا أن شدة الإشارة تتعرض للخطر بسبب تطور اقتران J المقطوع. يولد مجموع كل زيادة معدلة J متوسط FID منفصل حيث يرتبط تناقص الإشارة ارتباطا مباشرا بطول القطعة وحجم وتعدد اقترانJ 23. علاوة على ذلك ، تولد زوايا قلب نبض CHIRP قطعة أثرية لإعادة الاقتران تؤثر أيضا على كل إشارة بشكل مختلف ، مما يزيد من تعقيد القياسالكمي 21. تم تقييم حجم تأثير تسلسلات النبضات هذه في التحليل الكمي في دراستنا السابقة لعنب الثعلب في كيب أسفرت عن أخطاء تتراوح من 10٪ إلى 30٪ 11.
أخيرا ، يمكننا أن نستنتج أن Pure Shift هي أداة جديدة ممتازة لعمليات التمثيل الغذائي النباتية ، لأنها تزيد بشكل كبير من دقة الطيف ، مما يسمح بتحليل مصفوفة ارتباط أدق وتفسير أفضل للتحليلات متعددة المتغيرات11،24،25،27،28.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم تمويل هذه الدراسة من قبل المجلس الوطني للعلوم ، Tecnología e Innovación Tecnológica (CONCYTEC) - Programa Atracción de Investigadores Cienciactiva - Contract # 008-2017-FONDECYT.
Materials
| Name | Company | Catalog Number | Comments |
| 77500 Series Freezone 4.5 Liter benchtop | Labconco | 77500 | |
| Bruker Avance III 500 MHz equiped with a 5 mm TCI Z-gradient cryogenic probe | Bruker Corporation | ||
| Centrivap Refrigerated Centrifugal Concentrators Labconco 7310000 Series | Labconco | 7310000 | |
| Deuterium oxide | Sigma-Aldrich | 151882 | |
| Grinder machine MKM6003 | Bosch | MKM6003 | |
| Licuadora Blender 8011S model Hgb2wts3 | Waring | Hgb2wts3 | |
| Methanol-d4 | Sigma-Aldrich | 151947 |
References
- Hall, R., Beale, M., Fiehn, O., Hardy, N., Sumner, L., Bino, R. Plant metabolomics: the missing link in functional genomics strategies. The Plant Cell. 14 (7), 1437-1440 (2002).
- Fiehn, O. Metabolomics-the link between genotypes and phenotypes. Plant Molecular Biology. 48 (1-2), 155-171 (2002).
- Schauer, N., Fernie, A. R. Plant metabolomics: towards biological function and mechanism. Trends in Plant Science. 11 (10), 508-516 (2006).
- Kim, H. K., Choi, Y. H., Verpoorte, R. NMR-based plant metabolomics: where do we stand, where do we go. Trends in Biotechnology. 29 (6), 267-275 (2011).
- Kumar, R., Bohra, A., Pandey, A. K., Pandey, M. K., Kumar, A. Metabolomics for Plant Improvement: Status and Prospects. Frontiers in Plant Science. 8, (2017).
- Dumez, J. -. N., et al. Hyperpolarized NMR of plant and cancer cell extracts at natural abundance. Analyst. 140 (17), 5860-5863 (2015).
- Emwas, A. -. H., et al. NMR Spectroscopy for Metabolomics Research. Metabolites. 9 (7), (2019).
- Zangger, K. Pure shift NMR. Progress in Nuclear Magnetic Resonance Spectroscopy. 86-87, 1-20 (2015).
- Foroozandeh, M., Morris, G. A., Nilsson, M. PSYCHE Pure Shift NMR Spectroscopy. Chemistry - A European Journal. 24 (53), 13988-14000 (2018).
- Castañar, L. Pure shift NMR: Past, present, and future. Magnetic Resonance in Chemistry. 56 (10), 874-875 (2018).
- Lopez, J. M., Cabrera, R., Maruenda, H. Ultra-Clean Pure Shift 1 H-NMR applied to metabolomics profiling. Scientific Reports. 9 (1), 1-8 (2019).
- Marcó, N., Gil, R. R., Parella, T. Isotropic/Anisotropic NMR Editing by Resolution-Enhanced NMR Spectroscopy. Chemphyschem: A European Journal of Chemical Physics and Physical Chemistry. 19 (9), 1024-1029 (2018).
- Kaltschnee, L., et al. Extraction of distance restraints from pure shift NOE experiments. Journal of Magnetic Resonance. 271, 99-109 (2016).
- Sinnaeve, D., et al. Improved Isotopic Profiling by Pure Shift Heteronuclear 2D J-Resolved NMR Spectroscopy. Analytical Chemistry. 90 (6), 4025-4031 (2018).
- Timári, I., et al. Real-Time Pure Shift HSQC NMR for Untargeted Metabolomics. Analytical Chemistry. 91 (3), 2304-2311 (2019).
- Zhao, Q., et al. Combination of pure shift NMR and chemical shift selective filters for analysis of Fischer-Tropsch waste-water. Analytica Chimica Acta. 1110, 131-140 (2020).
- Zhao, Q., et al. Pure Shift NMR: Application of 1D PSYCHE and 1D TOCSY-PSYCHE Techniques for Directly Analyzing the Mixtures from Biomass-Derived Platform Compound Hydrogenation/Hydrogenolysis. ACS Sustainable Chemistry & Engineering. 9 (6), 2456-2464 (2021).
- Foroozandeh, M., et al. Ultrahigh-Resolution Diffusion-Ordered Spectroscopy. Angewandte Chemie International Edition. 55 (50), 15579-15582 (2016).
- Castañar, L., Pérez-Trujillo, M., Nolis, P., Monteagudo, E., Virgili, A., Parella, T. Enantiodifferentiation through Frequency-Selective Pure-Shift 1H Nuclear Magnetic Resonance Spectroscopy. ChemPhysChem. 15 (5), 854-857 (2014).
- Lopez, J. M., Sánchez, L. F., Nakamatsu, J., Maruenda, H. Study of the Acetylation Pattern of Chitosan by Pure Shift NMR. Analytical Chemistry. , (2020).
- Foroozandeh, M., Adams, R. W., Meharry, N. J., Jeannerat, D., Nilsson, M., Morris, G. A. Ultrahigh-Resolution NMR Spectroscopy. Angewandte Chemie International Edition. 53 (27), 6990-6992 (2014).
- Foroozandeh, M., Adams, R. W., Kiraly, P., Nilsson, M., Morris, G. A. Measuring couplings in crowded NMR spectra: pure shift NMR with multiplet analysis. Chemical Communications. 51 (84), 15410-15413 (2015).
- Moutzouri, P., et al. Ultraclean pure shift NMR. Chemical Communications. 53 (73), 10188-10191 (2017).
- Santacruz, L., Hurtado, D. X., Doohan, R., Thomas, O. P., Puyana, M., Tello, E. Metabolomic study of soft corals from the Colombian Caribbean: PSYCHE and 1 H-NMR comparative analysis. Scientific Reports. 10 (1), 5417 (2020).
- Stark, P., Zab, C., Porzel, A., Franke, K., Rizzo, P., Wessjohann, L. A. PSYCHE-A Valuable Experiment in Plant NMR-Metabolomics. Molecules. 25 (21), 5125 (2020).
- Kakita, V. M. R., Rachineni, K., Hosur, R. V. Ultraclean Pure Shift NMR Spectroscopy with Adiabatic Composite Refocusing Pulses: Application to Metabolite Samples. ChemistrySelect. 4 (34), 9893-9896 (2019).
- Bo, Y., et al. High-resolution pure shift NMR spectroscopy offers better metabolite discrimination in food quality analysis. Food Research International. 125, 108574 (2019).
- Watermann, S., Schmitt, C., Schneider, T., Hackl, T. Comparison of Regular, Pure Shift, and Fast 2D NMR Experiments for Determination of the Geographical Origin of Walnuts. Metabolites. 11 (1), 39 (2021).
- Leyva-Zegarra, V., et al. NMR-based leaf metabolic profiling of V. planifolia and three endemic Vanilla species from the Peruvian Amazon. Food Chemistry. , 129365 (2021).
- Toubiana, D., et al. Morphological and metabolic profiling of a tropical-adapted potato association panel subjected to water recovery treatment reveals new insights into plant vigor. The Plant Journal. 103 (6), 2193-2210 (2020).
- Maruenda, H., Cabrera, R., Cañari-Chumpitaz, C., Lopez, J. M., Toubiana, D. NMR-based metabolic study of fruits of Physalis peruviana L. grown in eight different Peruvian ecosystems. Food Chemistry. 262, 94-101 (2018).
- Cloarec, O., et al. Statistical total correlation spectroscopy: an exploratory approach for latent biomarker identification from metabolic 1H NMR data sets. Analytical Chemistry. 77 (5), 1282-1289 (2005).
- Steuer, R. Review: on the analysis and interpretation of correlations in metabolomic data. Briefings in Bioinformatics. 7 (2), 151-158 (2006).
- Trygg, J., Holmes, E., Lundstedt, T. Chemometrics in Metabonomics. Journal of Proteome Research. 6 (2), 469-479 (2007).
- Worley, B., Powers, R. Multivariate Analysis in Metabolomics. Current Metabolomics. 1 (1), 92-107 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved