Method Article
Monitoreo de la transmisión de célula a célula de los agregados de la proteína Prion-como en Drosophila Melanogaster
En este artículo
Resumen
Acumulación de evidencia apoya la idea de que agregados de proteína patógena asociada a enfermedades neurodegenerativas entre células con propiedades similares a los priones. Aquí, describimos un método que permite la visualización de la propagación de célula a célula del prion-como los agregados en el organismo modelo Drosophila melanogaster.
Resumen
Agregación de la proteína es una característica central de la mayoría las enfermedades neurodegenerativas, como esclerosis lateral amiotrófica (ELA), enfermedad de Alzheimer (EA), enfermedad de Parkinson (EP) y la enfermedad de Huntington (HD). Agregados de proteína están estrechamente asociados con neuropatología en estas enfermedades, aunque no se conoce el mecanismo exacto por el cual la agregación de la proteína aberrante interrumpe homeostasis celular normal. Surgiendo datos proporcionar fuerte apoyo para la hipótesis de patógenos agregados en TDA, PD, y ALS tienen muchas similitudes a los priones, que son sólo proteínas agentes infecciosos responsables de las encefalopatías espongiformes transmisibles. Priones autoreplicarse por plantillas la conversión de forma nativa doblado versiones de la misma proteína, causando la propagación del fenotipo de agregación. Cómo los priones y las proteínas del prión-como en AD, PD, HD y ALS se mueven de una celda a otra es actualmente un área de intensa investigación. Aquí, se describe un modelo de Drosophila melanogaster que permite monitoreo de transmisión del prión-como, célula a célula de agregados de la huntingtina (Htt) asociados con el HD. Este modelo se aprovecha de potentes herramientas para manipular la expresión de transgenes en muchos diversos tejidos de Drosophila y utiliza una proteína citoplásmica fluorescencia etiquetada transferencia directamente de prion-como del informe de agregados Htt mutantes. Lo importante, el enfoque se describe aquí puede utilizarse para identificar nuevos genes y vías que median la separarse de agregados de proteína entre célula diversos tipos en vivo. Información obtenida de estos estudios será ampliar la limitada comprensión de los mecanismos patogénicos que subyacen a las enfermedades neurodegenerativas y revelar nuevas oportunidades para la intervención terapéutica.
Introducción
La hipótesis del prión afirma que el agente infeccioso responsable de las encefalopatías espongiformes transmisibles (p. ej., enfermedad de Creutzfeldt - Jakob en los seres humanos, scrapie en ovejas, la caquexia crónica en ciervos y alces y "enfermedad de las vacas locas" en bovinos ) está exclusivamente compuesto de proteína y desprovista de ácidos nucleicos1. En enfermedades por prión, la proteína priónica celular (PrPC) asume un pliegue (PrPSc) no nativos, estable que es altamente beta ricos en hoja y puede uno mismo-propagar por conversión y reclutar moléculas monoméricas de PrPC en amiloide estable agregados. Agregados de PrPSc utilizan este mecanismo uno mismo-repliegue para difundir entre las diferentes células en un organismo e incluso entre los organismos individuales2.
Agregación y mal plegamiento de la proteína también es una característica central de la mayoría de las enfermedades neurodegenerativas (enfermedad de Alzheimer (EA), enfermedad de Parkinson (EP), enfermedad de Huntington (EH) y esclerosis lateral amiotrófica (ELA))3. Formación de asambleas de cellular intra o extra proteína agregada en estas enfermedades está íntimamente relacionada con la citotoxicidad4 y progresa a lo largo de caminos altamente reproducibles y específica de la enfermedad a través del cerebro en tiempo5, 6. estos patrones de propagación sugieren que agregados patógenos asociados con estos trastornos tienen propiedades similares a los priones. Ahora existe fuerte apoyo para transmisión del prión-como de agregados asociados a AD, PD, HD y la ELA - transmite de célula a célula y la plantilla el cambio conformacional de la forma monomérica de la misma proteína en células previamente inafectados7, 8.
La mayoría de los estudios que investigan propagación de prion-como de agregados de proteínas hasta la fecha se han realizado utilizando modelos de cultivo de células de mamífero, donde transferencia de agregados en el citoplasma de las células ingenuas desde el espacio extracelular o desde otra celda citoplasma9,10,11,12,13,14,la15, o por inyección de material que contiene el agregado en cerebros de ratón y control agregado apariencia fuera la inyección sitio16,17,18,19,20,21,22, 23. más recientemente, se han utilizado animales transgénicos para demostrar que agregados intracelulares se extensión a otras células en el cerebro intacto24,25,26,27, 28,29,30. Aquí, describimos un método para la visualización directa de la transferencia total entre las células individuales del cerebro intacto de Drosophila melanogaster. En primer lugar se desarrollaron modelos de Drosophila de HD/polyglutamine (poliQ) enfermedades hace casi dos décadas31,32 y han proporcionado muchos conocimientos invaluables en los mecanismos patogénicos que subyacen a estos trastornos 33. HD es un trastorno neurodegenerativo hereditario causado por una mutación dominante autosómica en el gen que codifica para la proteína huntingtina (Htt)34. Esta mutación da lugar a la ampliación de un tramo de la poliQ cerca N-terminal de Htt, más allá de un umbral patógeno de ~ 37 glutaminas, haciendo que la proteína misfold y agregado35,36. Proteínas de Htt de tipo salvaje que contienen < 37 glutaminas en este tramo lograr su pliegue natural, pero puede ser inducidas a agregado al contacto físico directo con un Htt agregada "la semilla"12,27,37. Aprovechamos este homotípicos, nucleada agregación de Htt de tipo salvaje como una lectura para transferencia-como prión y entrada citoplasmática de agregados de Htt mutantes procedentes de otras células.
Determinar los mecanismos por los que agregados-como prión viajes entre células pueden conducir a la identificación de nuevas dianas terapéuticas para enfermedades neurodegenerativas incurable. Tomamos ventaja del ciclo de vida rápido, facilidad de uso y maleabilidad genética de Drosophila melanogaster para definir mecanismos moleculares para la propagación de célula a célula de agregados Htt mutantes. Nuestra estrategia experimental emplea dos sistemas de expresión binaria disponibles en Drosophila, la bien establecida Gal4 específicos aguas arriba activar secuencia (Gal4-UAS) sistema38 y el recientemente desarrollado QF-QUAS sistema39. Estos dos sistemas independientes de acoplamiento permite restringir la expresión de los transgenes de Htt mutantes y el salvaje-tipo poblaciones celulares distintas dentro de la misma mosca40. Usando este acercamiento, examinamos prion-como separarse del mutante Htt mediante el control de la redistribución de los citoplásmico Htt de tipo salvaje de su estado soluble, normalmente difuso a un estado agregado, consecuencia directa del contacto físico con una forma mutante Htt agregado "semilla." Conversión de tipo salvaje Htt por mutante Htt puede confirmarse mediante bioquímica o transferencia de técnicas biofísicas que informe las interacciones proteína-proteína, como la energía de resonancia de fluorescencia (FRET)9,27,41 .
Lo importante, también podemos acceder a un gran número de herramientas genéticas en Drosophila para identificar genes o vías que median la propagación del prión-como de agregados de proteína. Recientemente hemos utilizado este enfoque para desvelar un papel clave para el receptor scavenger superficial, Draper42,43, en la transferencia agregados Htt mutantes de axones neuronales a glia fagocitaria cercana en Drosophila central sistema nervioso (CNS)27. Así, el enfoque basado en la proyección de imagen y genética que se describe aquí puede revelar importante información biológica básica sobre un fenómeno de enfermedad relevante en simple-to-use pero organismo modelo de gran alcance, Drosophila.
Protocolo
1. acoplamiento Gal4 y QF-mediada por Htt Transgene expresión en Drosophila
- Recopilar o generar transgénicos Drosophila melanogaster líneas que contienen tejidos específicos Gal4 o QF "controladores", así como líneas que contienen el tipo salvaje o mutantes Htt los transgenes aguas abajo de Gal4-UAS38 o39de QF-QUAS. Asegúrese de que las proteínas que se expresan de estos transgenes son fusionados a proteínas fluorescentes o epitopo etiquetados para permitir la diferenciación de los productos de transgen mutantes y el salvaje-tipo Htt en la mosca de la misma. Vea la figura 1.
Nota: Normalmente utilizamos fragmentos del exón 1 del Htt gene humano27. Sin embargo, en lugar de ello pueden generarse moscas transgénicas para expresar otros genes o fragmentos Htt largo si lo desea. - Plan de la estrategia genética que los transgenes de Htt mutantes y el salvaje-tipo se expresará en poblaciones celulares distintas, no superpuestos.
- Si se produce cualquier superposición de expresión, mutantes y el salvaje-tipo Htt proteínas sintetizadas en las células del mismo Co total y evitar la detección de eventos del prión. Para evitar esto, utilice los represores específicos Gal4 y QF, Gal80 y QS40, respectivamente (figura 1). Selección de controladores de Gal4 o QF con desarrollo controlado puede ayuda para restringir la expresión del mutante Htt a las células del poste-mitotic, eliminando la posibilidad ésa División de célula puede contribuir a separarse total de célula a célula.
- Usando condiciones de cultivo estándar, mate las moscas para generar progenie que expresan mutante población Htt QF (o Gal4) en un "donante" de la célula y la población de células de tipo salvaje Htt Gal4 (o QF) en un "recipiente". Vea la figura 1 para un diagrama esquemático que muestra una posible combinación genética.
Nota: Los controladores QF y Gal4 que se utilizaron para generar los datos mostrados en las figuras 1-4 y en nuestra anterior publicación27 incluyen el controlador de (ORN) la neurona olfativa del receptor DA1, Or67d-QF y el controlador de pan-glial, repo-Gal4. - Generar moscas control en paralelo que expresan Htt de tipo salvaje en ambas poblaciones de células etiquetadas de QF y Gal4.
- Recoger la progenie del genotipo deseado y los animales según corresponda la edad.

Figura 1 . Enfoque genético para acoplados expresión de los transgenes Htt mutantes y el salvaje-tipo utilizando los sistemas de expresión binaria QF-QUAS y Gal4-UAS. En "A la célula," se expresa una proteína Htt mutante mCherry etiquetados con un tramo de longitud patógenos poliQ (Q91) usando un conductor del QF situado aguas abajo de un promotor específico de tejido un («PA"). En "células B" un Htt de tipo salvaje YFP-marcados con etiqueta que contenga un tramo normal poliQ (Q25) se expresa a través de un conductor de Gal4 controlado por el promotor específico de tejido B ("PB"). En las figuras 2-4, Or67d-QF fue utilizado para conducir QUAS-HttQ91-mCherry expresión en DA1 ORNs y repo-Gal4 solía expresar UAS-HttQ25-YFP en glia los27. Importante, HttQ91-mCherry sólo se expresa en células de QF-expresión en virtud de la secuencia QUAS colocado aguas arriba del transgén. Asimismo, HttQ25-YFP sólo se expresa través de Gal4, que reconoce específicamente a la UAS. Si se detecta cualquier superposición en la distribución en los tejidos de los conductores de QF y Gal4, se pueden introducir los transgenes que codifican QS en células de expresión de Gal4 y Gal80 en células expresando QF. Adición de etiquetas de proteína fluorescente tipo salvaje y mutante Htt permite la diferenciación de las dos proteínas durante la proyección de imagen y la capacidad de medir traste entre pares donador/aceptor apropiado (por ejemplo, PPC/YFP o YFP/mCherry). Haga clic aquí para ver una versión más grande de esta figura.
2. micro-disección y fijación de cerebros de adultos de Drosophila
Nota: Este procedimiento de disección ha sido modificado de una anterior publicación44y puede utilizarse para preparar sesos para proyección de imagen señal de fluorescencia directa de fusiones de la proteína Htt-fluorescente. Modificaciones al procedimiento que se puede hacer para la inmunotinción los cerebros se discuten en la sección siguiente.
- Recoger los siguientes materiales y coloque en hielo: solución salina tamponada con fosfato que contiene 0.03% Tritón X-100 (PBS/T); tubos de microcentrífuga con 970 μl de solución de fijación 4% paraformaldehido (PFA) preparado mediante la adición de 200 μL 20% PFA a 770 μl PBS/T; un plato de vidrio transparente que contiene bien; una pipeta de transferencia desechable; dos pinzas de disección (un Nº 3 y Nº 5).
- Anestesiar las moscas adultas con CO2 y transferirlos a un pocillo de la placa de cristal sobre el hielo.
- Utilizando una pipeta de transferencia, añada una pequeña cantidad (~ 500 μl) de PBS frío/T para el bien que contengan las moscas, así como un pozo vacío. Evitar la introducción de muchas burbujas, que pueden interferir con la disección.
- Coloque el plato de vidrio sobre una superficie plana debajo de un microscopio de disección y ajustar el aumento hasta que el cuerpo de la mosca llena el campo de visión y está en foco.
- Coloque un par de fuentes de luz de cuello de cisne para que la luz es iluminar ambos lados del plato de vidrio. Anclar un pañuelo doblado laboratorio bajo el plato de vidrio para descartar partes del cuerpo/cutícula durante la disección.
- Usando los fórceps no. 3 en la mano no dominante, transferir una sola mosca en el PBS/T. bien con inmovilizar la mosca por que ase el asimiento de su abdomen con el lado ventral hacia arriba.
- Manteniendo la mosca totalmente sumergida en PBS/T, retire la cabeza mosca con las pinzas del nº 5 en la mano dominante. Inserte una punta de este fórceps bajo la cutícula en el pequeño espacio adyacente a la probóscide de un lado de la cabeza de mosca. Garantizar el agarre en la cabeza por pellizcar las pinzas para asir el asimiento del ojo de ambos lados.
- Retire la cabeza de la mosca de su cuerpo las dos pinzas aparte. Deseche el cuerpo mosca sobre un tejido de laboratorio colocado cerca. Mantener la presión sobre las pinzas de la mano dominante para que la cabeza de la mosca no se pierda.
- Coloque la punta de las pinzas no. 3 en el no dominante una mano en el mismo pequeño espacio debajo de la cutícula en el otro lado de la probóscide. Una vez colocado, el sujetador de pinzas para sujetar los ojos en la misma ubicación en ambos lados de la cabeza.
- Una vez seguro el agarre en la cutícula, suavemente tire el fórceps en 180°. Esta acción romperá la cabeza cutícula sin dañar el cerebro. Deseche el residuo de la cutícula en un tejido de laboratorio.
- Aunque ideal, la cutícula de la cabeza no se puede quitar completamente en un solo paso. En este caso, eliminar la cutícula pieza por pieza hasta que el cerebro está completamente expuesto. Tenga cuidado de no para dañar el cerebro, evitando el contacto directo con el fórceps.
- Saque el cerebro disecado de PBS/T ahold acaparamiento de una tráquea conectado, o aspirando el cerebro en el espacio entre las puntas del fórceps por acción capilar.
Nota: Tráquea es opcional, ya que tiende a no ocultar a los lóbulos antenales en la superficie anterior del cerebro donde normalmente tenemos imagen. Sin embargo, si la tráquea interfiere con la proyección de imagen, retirar con cuidado para que el cerebro no se daña por esta manipulación. - Transferir el cerebro de mosca en uno de los tubos de microcentrífuga con solución fijadora en el hielo. Asegúrese de que el cerebro se desprende de la pinza y se sumerge en la solución fijadora.
- Una vez que todos los cerebros han sido disecados, someter a un "corto-fix" colocando los tubos cerrados en un nutator para ~ 5 min a temperatura ambiente en la oscuridad.
Nota: Este paso de fijación corto garantiza que los cerebros son más fáciles de manejar en los pasos posteriores y no se adhieren a las paredes del tubo de microcentrífuga. - Quite la mayor parte de la solución de fijación con una pipeta P1000 y deséchelo.
- Evite los cerebros del tubo de aspiración durante este y cualquier paso de lavado posterior. Establece la P1000 en un volumen más bajo (p. ej., 650 μL) y eliminar el sobrenadante en dos pasos. Además, mantenga los tubos de microcentrífuga en línea con una fuente de luz (por ejemplo, lámparas de techo) mientras aspirando para visualizar mejor el cerebro.
- Añadir 1 mL de PBS fresco/T a los cerebros. Lavar rápidamente (< 1 min) en la oscuridad, aspirar el sobrenadante de los cerebros y deseche.
- Repetir el lavado con PBS/T en la oscuridad a temperatura ambiente según el siguiente cronograma: 2 lavados rápidos (< 1 min), 1 X 5 min, 3 X 20 min y lavar de 1 X 1 h. Asegure las tapas en los tubos de microcentrífuga y colocar los tubos en un nutator entre lavados.
- Si se desea tinción DAPI, reemplazar el lavado final de 1 h con 1 X 30 min de incubación con DAPI de 250 ng/mL diluido en PBS/T, seguido por 2 X rápido y 1 X 20 min lavados.
- Después del último lavado, eliminar la mayoría del sobrenadante de tampón de lavado, cuidando de no para perturbar el cerebro y añadir 30 μl de reactivo antifade basados en glicerol a los cerebros. Incubar a 4 ° C en la oscuridad sin movimiento durante al menos 1 h y hasta las 24 horas.
3. modificaciones a la sección 2 para adulto Immunostaining cerebros
Nota: Use este protocolo para proteínas no fluorescente de la proyección de imagen o para fusiones de proteína fluorescente con fluorescencia débil.
- Aumentar la concentración de Triton X-100 en PBS/T por 10 veces (PBS + 0.3% Tritón X-100) para cada paso. Esto asegura que existe suficiente detergente para permeabilizar las membranas celulares y permitir que los anticuerpos a los espacios intracelulares.
- Fijar los cerebros en el 4% PFA en PBS/T por 20 min a temperatura ambiente.
- Después de realizar todos los lavados, Incube los cerebros de recién preparado solución amortiguadora de bloqueo (PBS/T + 5% de suero normal de cabra (NGS)) durante 30 min a temperatura ambiente en la oscuridad.
- Retire y deseche la solución amortiguadora de bloqueo. Agregar 0,5 mL de solución de anticuerpo primario por el tubo preparado como mezcla principal por dilución de anticuerpos primarios según corresponda en solución amortiguadora de bloqueo fresca (véase Tabla de materiales para los anticuerpos utilizados y diluciones). Incubar los cerebros de anticuerpos primarios en un nutator durante al menos 24 h a 4 ° C en la oscuridad.
- Retirar la solución de anticuerpo primario de los cerebros con una P1000 y reserva en un tubo nuevo. Añadir 1 mL de PBS/T para lavar el cerebro.
Nota: La solución de anticuerpo primario reservados puede almacenarse a 4 ° C hasta por cuatro semanas. Hemos exitosamente reciclamos anticuerpos primarios hasta dos veces en experimentos posteriores. - Lavar el cerebro rápidamente (< 1 min) en PBS/T, aspirar el sobrenadante de cerebros y deseche. Repita este lavado rápido una vez más.
- Continuar el lavado con 1 mL de PBS/T en la temperatura según el siguiente cronograma: 1 X 5 min, 3 X 20 min y lavar de 1 X 1 h. Asegure las tapas en los tubos de microcentrífuga y colocar los tubos en un nutator durante el lavado.
- Después del último lavado, eliminar la mayor parte del sobrenadante de PBS/T y añadir 0,5 mL de solución de anticuerpo secundario preparado como mezcla principal por dilución de los anticuerpos según corresponda en solución amortiguadora de bloqueo fresca (véase Tabla de materiales para los anticuerpos utilizados y diluciones). Incubar los cerebros en los anticuerpos secundarios durante 24 h a 4 ° C en la oscuridad.
- Repita los pasos de lavado en los puntos 3.5, 3.6 y 3.7 después de la incubación con los anticuerpos secundarios.
- Después del último lavado, eliminar la mayor parte de la solución de lavado y asegúrese de que todos los cerebros se encuentran en la parte inferior del tubo. Añadir 30 μl de reactivo de antifade a los cerebros. Incubar a 4 ° C en la oscuridad sin movimiento durante 16-24 h.
4. todo el cerebro montaje
- Colocar un portaobjetos de vidrio bajo un microscopio de disección y una etiqueta con información de identificación.
Nota: Como alternativa, el cerebro puede montarse directamente sobre un vidrio de cubierta a ambos lados del cerebro durante la proyección de imagen. Un protocolo que describe este procedimiento ha sido previamente publicado45. - Quitar el cerebro de cada tubo de microcentrífuga utilizando una punta de la pipeta romas (preparado usando una cuchilla de afeitar para quitar la parte inferior ~ 1 cm frente a una punta de 1-200 μL) y la transferencia en el centro de la diapositiva. Transferencia como reactivo antifade poco con el cerebro como sea posible.
- Utilice pinzas para colocar los cerebros en la orientación deseada (p. ej., dorsal apuntando hacia la parte superior de la diapositiva y la superficie anterior hacia arriba para la proyección de imagen del lóbulo antenal). Cuando el cerebro de la orientación, considerar la trayectoria de la luz del microscopio a utilizar para la proyección de imagen les.
- Quite exceso reactivo antifade la diapositiva usando la esquina puntiaguda de un pañuelo doblado laboratorio sin afectar a los cerebros. Deje la diapositiva de ~ 5-10 min en la oscuridad para permitir que el cerebro se adhieran al portaobjetos.
- Rodean los cerebros de mosca con cuatro pequeños pedazos de cristal quebrado de la cubierta en cada lado de los cerebros para formar un cuadrado que es ~ 19 mm x 19 mm. Coloque un borde de un vidrio de cubierta de 22 x 22 mm Nº 1.5 a las afueras de uno de estos pequeños pedazos de vidrio y baje con cuidado el cubreobjetos sobre el cerebro para realizar el montaje en puente.
- Lentamente dispensar reactivos antifade fresca para llenar la superficie debajo del cubreobjetos, teniendo cuidado de no disturbar el cubreobjetos o el cerebro. Limpie cualquier exceso de preservador de fluorescencia usando la esquina puntiaguda de un pañuelo doblado laboratorio sin directamente en contacto con el cubreobjetos.
- Añadir una gota de esmalte de uñas transparente, de secado rápido a cada una de las cuatro esquinas del cubreobjetos. Deje que se seque para ~ 10 minutos. Luego, sellar los cuatro bordes del cubreobjetos con esmalte de uñas para incluir completamente el cerebro.
- Cerebros de la imagen inmediatamente o guardar a 4 ° C hasta que esté listo.
- Si la proyección de imagen de la fluorescencia intrínseca de fusiones de la proteína Htt-fluorescentes, imágenes de los cerebros dentro de 24 h para la mejor señal.
5. la proyección de imagen y cuantificación de la transmisión del prión-como de agregados
- Imágenes de los cerebros montados usando un microscopio confocal equipado con un 40 X o 60/63 X objetivo de aceite para recoger imágenes de rodaja z a través de la región del cerebro donde se expresan los conductores Gal4 y QF seleccionados (figura 2A, B).
- Excitar la proteína fluorescente fusiones o proteínas immunolabeled con láseres apropiados (p. ej., 488 nm para GFP/YFP/FITC o 552 nm para mCherry/Cy3). Ventanas de detección set que capturan fluorescente máxima señal mientras elimina la diafonía canal utiliza un sistema de detección espectral o banda largos pasan filtros de emisión específicos para cada fluoróforo.
Nota: Estar atentos cuando imágenes agregados de proteína. Es fácil para los pixeles en el centro de cada agregado se sature, especialmente en agregados más grandes. Trate de reducir la saturación en la imagen, pero ser conscientes del riesgo de perder señal de pequeños agregadas especies (figura 2B, C, D). Demasiada saturación aumentará el fondo de la imagen, haciendo más difícil identificar puncta aislado. Prueba diferente configuraciones para optimizar antes de tomar las imágenes finales de cada conjunto de datos de imágenes.
- Excitar la proteína fluorescente fusiones o proteínas immunolabeled con láseres apropiados (p. ej., 488 nm para GFP/YFP/FITC o 552 nm para mCherry/Cy3). Ventanas de detección set que capturan fluorescente máxima señal mientras elimina la diafonía canal utiliza un sistema de detección espectral o banda largos pasan filtros de emisión específicos para cada fluoróforo.
- Analizar los datos mediante la cuantificación de cada orificio ya sea manualmente moviendo a través de z-sectores individuales (por ejemplo,C de la figura 2y figura 4A) o después de hacer las rebanadas confocales en 3 dimensiones (figura 3 A, B).
Nota: Esto puede hacerse en Image J u otros software de procesamiento de imágenes.- Si los agregados están bien separados y no hay fluorescencia del Fondo mínimo, utilizar software de análisis de imagen para identificar, cuantificar y analizar los agregados como distintos "objetos" o "superficies" en una reconstrucción 3D de la pila confocal (sistemáticamente Figura 3 B).
Nota: Acciones de Software descritos son específicos para el instrumento y el software que se utiliza aquí (véase la Tabla de materiales).- Visualizar una serie de z confocal en modo de visualización 3D. Utilice al asistente de "Análisis" para encontrar los puntos individuales en un canal seleccionado (por ejemplo, el canal rojo para mCherry HttQ91 agregados en la figura 3). Ajuste el umbral y filtros a una representación exacta de los agregados de tamaño heterogéneo como objetos individuales de la imagen.
- Permiten "Dividir objetos" bajo "Binario de procesamiento pre-filtro" para separar los agregados estrechamente asociadas que aberrantemente se fusionan por el algoritmo de software. Tenga en cuenta que el número total de objetos y sus mediciones asociadas se divulga bajo "Medidas".
Nota: Este método para cuantificar agregados Htt mutantes no es favorable al Protocolo de immunostaining porque el centro de los agregados amiloides, es impenetrable a los anticuerpos. Como resultado, los agregados aparecen en el microscopio como anillo-como las estructuras, y software de análisis de imagen no puede exactamente identificar y distinguir estas "manchas" individuales.
- Cuantificar los agregados de tipo salvaje Htt manualmente moviendo a través del z-stack y puntuación agregados de tipo salvaje Htt, asegurándose de que no hay agregados son doble-anotó si aparecen en más de una rebanada (figura 4A).
Nota: Este método de cuantificación manual puede utilizarse cuando el número de agregados en cada pila confocal es razonable (p. ej., 20-50). También es útil cuando el software de análisis de imagen no puede distinguir los puncta de señal circundante en el mismo canal (por ejemplo, señal de Htt de tipo difuso en las células cercanas) (figura 2B, C y figura 4 A). cuantificación de agregados de tipo salvaje Htt puede también ser difícil porque muchas de las estructuras normales del cerebro aparecen punteadas (p. ej., procesos de la célula y la sinapsis). Co-localización de tipo salvaje y mutantes Htt señales puede ser utilizado como un criterio de selección; sin embargo, es posible que algunos Htt mutante "semillas" caen por debajo del límite de detección de la confocal. Una proteína diferente Htt que no agregan en las células del receptoras (e.g., GFP) puede utilizarse para etiquetar sin relación las estructuras en el cerebro.
- Si los agregados están bien separados y no hay fluorescencia del Fondo mínimo, utilizar software de análisis de imagen para identificar, cuantificar y analizar los agregados como distintos "objetos" o "superficies" en una reconstrucción 3D de la pila confocal (sistemáticamente Figura 3 B).
- Utilizar software de análisis de imagen para realizar más caracterización de agregados individuales. Por ejemplo, determinar la distribución de tamaño de los agregados (figura 3C), porcentaje colocalización entre mutante y el salvaje-tipo Htt proteínas (figura 4A), o medir directamente las interacciones proteína-proteína mediante FRET ( Figura 4 B).
- Determinar la distribución de tamaño de orificio individual utilizando un algoritmo de detección de punto o superficie que identifica con precisión todos los agregados visibles en un canal en particular. Utilice el software de análisis de imagen para tomar las medidas pertinentes de los puntos o superficies, por ejemplo obtener 'diámetro agregado' (Fig. 3 C), 'volumen', o información de 'intensidad' de 'Medidas' en el Asistente de "Análisis" de software descrito en el paso 5.2.1.
Nota: En la figura 3C, se presenta la distribución de los diámetros de los puncta HttQ91 mCherry identificados en un solo glomérulo DA1. - Determinar el porcentaje colocalización entre HttQ25-YFP y agregados HttQ91 mCherry moviendo manualmente la rebanada por rebanada a través de una z-pila confocal (método más preciso). Sin embargo, tenga cuidado de no para contar dos veces cualquier agregados. Para evitar esto, contar agregados en un particular segmento de z solamente si el plano de enfoque es a través del centro del agregado (figura 4A).
- Calcular la eficacia de traste para hacer HttQ25-YFP inducida con señal de HttQ91 mCherry colocalized con el método de aceptor photobleaching.
- En primer lugar, eliminar el potencial de la diafonía entre los canales de YFP y mCherry estableciendo ventanas de detección de señales mCherry y YFP que no producen ninguna señal en el otro canal. Estos parámetros, tomar una 'antes de imagen' de los puncta HttQ25-YFP y su señal de HttQ91-mCherry asociado ( figura 4B).
- Entonces, photobleach el mCherry señal ajustando el laser rojo (p. ej., 552 nm) al 100% de intensidad y análisis hasta que la señal se ha ido. Volver a la configuración utilizada para el 'antes 'de imagen y toma una imagen de después del mismo orificio (figura 4B).
- Calcular las medidas de intensidad de fluorescencia para cada punctum antes y después de photobleaching usando software de análisis de imagen.
- Calcular la eficacia de traste restando fluorescencia del donador YFP medida en el 'antes de imagen' (YFPinicial) de fluorescencia de YFP donante de la imagen' después' (YFPfinal). Dividir este valor por YFPfinaly multiplicar por 100.
Nota: Se puede calcular eficiencia traste pixel por pixel o global para cada agregado de HttQ25-YFP (figura 4B). Aceptor photobleaching es una técnica particularmente útil para el cálculo de eficiencia de traste cuando la señal mCherry asociada con cada punctum HttQ25-YFP es suficientemente alta para producir dequenching de YFP detectable después de photobleaching mCherry.
- Determinar la distribución de tamaño de orificio individual utilizando un algoritmo de detección de punto o superficie que identifica con precisión todos los agregados visibles en un canal en particular. Utilice el software de análisis de imagen para tomar las medidas pertinentes de los puntos o superficies, por ejemplo obtener 'diámetro agregado' (Fig. 3 C), 'volumen', o información de 'intensidad' de 'Medidas' en el Asistente de "Análisis" de software descrito en el paso 5.2.1.
Resultados
Los métodos descritos aquí producen datos robustos demostrando a-como prión transferencia de agregados de la proteína Htt de población de una célula a otra en la mosca intacta del CNS. Conversión de tipo salvaje Htt de difuso a punteado se observa por fluorescencia directa de esta proteína de fusión YFP en glia receptor como resultado de la expresión HttQ91-mCherry en donantes ORNs (A-C de lafigura 2y figura 4A, B). Informes precisos de eventos del prión-como transferencia entre estas poblaciones dos celulares requiere una cuidadosa selección de moscas transgénicas y controladores Gal4/QF para producir niveles de fuerte expresión de los transgenes de Htt mutantes y el salvaje-tipo sin ningún solapamiento durante el desarrollo o en la edad adulta. Además, diseño pensativo de los proteína fluorescente-Htt fusión transgenes puede habilitar potente análisis aguas abajo. Por ejemplo, el mutante y el salvaje-tipo Htt agregados pueden ser cuantificado como objetos punteados o bien manualmente (figura 2C y figura 4) o utilizando software de análisis de imagen (figura 3A, B), puede ser medido y caracteriza más como población total (figura 3C), pueden evaluarse para colocalización entre mutante y el salvaje-tipo proteínas (figura 4A) y puede analizarse para traste27 (figura 4 B). Estos análisis requieren fusión de Htt mutante y el salvaje-tipo a etiquetas de proteína fluorescente con propiedades de fluorescencia suficientemente separados, pero con suficiente traslape espectral para traste entre pares donador y aceptor (p. ej., PPC/YFP9 o YFP/mCherry27).
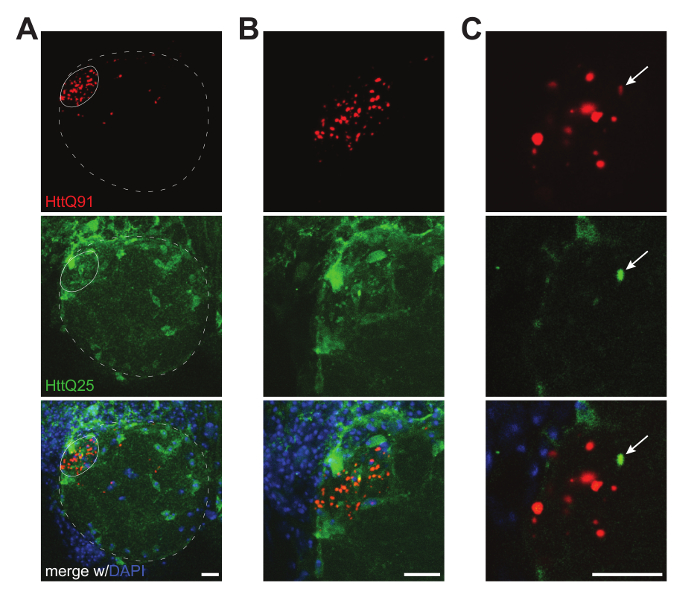
Figura 2 . Imágenes confocales de prion-como conversión de glial HttQ25-YFP por neuronales agregados mCherry HttQ91. (A) máxima proyección de intensidad de ~ 30 μm de rebanadas confocales muestra un lóbulo antenal de una mosca macho expresando mCherry HttQ91 (rojo) en axones de DA1 ORN en glia con repo-Gal4 QF Or67d y HttQ25-YFP (verde). Los límites aproximados del lóbulo antenal y DA1 glomérulo, donde terminan axones DA1 ORN, están indicados por las líneas sólidas y punteadas, respectivamente. (B) máxima proyección de intensidad de ~ 20 μm de rebanadas confocales mostrando una vista magnificada de la región glomerular DA1 de a. (C) A sola 0.35 μm confocal rebanada mostrando un solo orificio de HttQ25-YFP y sus asociados (señal) HttQ91 mCherry indicado por la flecha en cada canal). La señal en el canal rojo fue realzada para visualizar colocalización entre señales mCherry HttQ91 y HttQ25-YFP. Todas las imágenes fueron adquiridas con un objetivo de aceite de 40 X 1.4NA. Barras de la escala = 10 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 3 . Análisis tridimensional de HttQ91 mCherry agregados en axones DA1 ORN. (A) A 3D representación de agregados mCherry HttQ91 expresado en el glomérulo de DA1 a través Or67d-QF utilizando la misma información que se muestra en la figura 2B. (B) una captura de pantalla que muestra los objetos individuales o "manchas" identificadas a partir de los datos en bruto (A) usando un paquete de software de análisis de imagen. El software había identificado 56 objetos de diferentes tamaños en este canal o imagen. Se midió el lugar indicado por la flecha en (B) para tener un diámetro de ~ 1,2 μm. las flechas apuntan hacia lugares donde dos objetos inexacto se fusionan en un mismo lugar por el software, probablemente debido a la proximidad cercana de la puncta individual. Para superar esto, debe analizarse en el software de configuración de umbral diferentes o combinados puntos deben estar separados manualmente si es posible. Barras de la escala = 10 μm. (C) histograma muestra la distribución de los diámetros medidos por el software para el HttQ91-mCherry "puntos" se muestra en (B). Haga clic aquí para ver una versión más grande de esta figura.
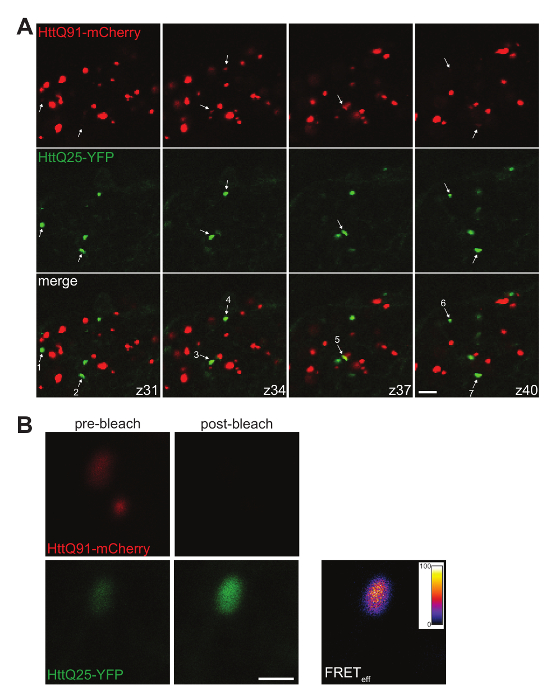
Figura 4 . Co-localización y traste análisis de inducida por agregados de YFP HttQ25. (A) A montaje de 4 0,35 μm confocal z-sectores individuales de un cerebro de mosca masculino expresando HttQ91 mCherry en DA1 ORNs usando QF Or67d y HttQ25-YFP en glia con repo-Gal4. Las señales fueron ajustadas para que incluso pequeños HttQ91-mCherry agregados son visibles y agregados HttQ25-YFP inducidos sobresalen alrededor de señal difuso. Las rebanadas se muestra cada uno separadas por ~ 1.0 μm (segmento número indicado en la esquina inferior derecha de las imágenes fusionadas) por lo que pueden observarse múltiples agregados. Las flechas indican HttQ25-YFP puncta que estaban decididos a estar en o cerca de enfoque en ese particular rodaja z moviendo manualmente a través de la pila de z. De los siete puncta HttQ25-YFP indicadas aquí, seis han asociado perceptible HttQ91 mCherry señal (es decir, el 86% de los agregados de HttQ25-YFP Co localizar con HttQ91 mCherry). Tenga en cuenta que la señal de mCherry asociada a HttQ25-YFP puncta a menudo es más débil que la mayoría de los puncta mCherry-positivo en el glomérulo de DA1. Barra de escala = 5 μm. (B) A HttQ25-YFP/HttQ91-mCherry-co-localizada punctum antes (paneles de la izquierda) y después de photobleaching de mCherry (aceptador) (paneles de la derecha). El aumento en fluorescencia de YFP (donante) se utilizó para producir una imagen de eficiencia (effdel traste) traste pixel por pixel con el plug-in AccPbFRET para ImageJ46. Este agregado particular tiene un total de trasteeff de 61%. Barra de escala = 1 μm. haga clic aquí para ver una versión más grande de esta figura.
Discusión
Sigue aumentando el número de pacientes que sufren de enfermedades neurodegenerativas, hay una necesidad urgente de aumentar la comprensión de la patogenia molecular de estas enfermedades que se pueden desarrollar mejores terapias. Aquí, describimos los métodos que permiten monitoreo de transmisión del prión-como de agregados de proteínas patogénicas entre diferentes tipos de células en el organismo modelo Drosophila melanogaster. Recientemente hemos utilizado esta metodología para demostrar la transmisión del prión-como de mutantes Htt agregados en vivo y para identificar un receptor fagocítico que media la propagación de estos agregados de las neuronas glia27. Nuestro enfoque explota varias ventajas del uso de Drosophila para estudiar enfermedades genéticas humanas: su corto ciclo de vida y vasta herramientas genéticas, que pueden acelerar el descubrimiento de información biológica básica terapéuticamente relevante.
Los métodos que Describimos aquí ofrecen dos grandes ventajas sobre otros animales existentes y modelos de cultura para la transmisión del prión-como la célula: (1) el adición agente causal (por ejemplo, mutante Htt) se produce en una célula en un tejido intacto y (2) expresión de la versión normalmente plegado de la misma proteína (p. ej., tipo salvaje Htt) en una población separada de la célula proporciona un "reportero" accesible para-como prión. Expresión de mutante y el salvaje-tipo Htt proteínas en poblaciones de la célula no superpuestas en el mismo organismo hemos logrado mediante el uso de sofisticadas herramientas genéticas que están bien establecidos en Drosophila40. Porque muchos diferentes tejidos específicos Gal4 y QF conductores están fácilmente disponibles, examinar-como prión transferencia entre esencialmente cualquier tipos de distintas células en el cuerpo de la mosca es factible.
Un componente fundamental del enfoque es lograr expresión segregado del mutante y el salvaje-tipo Htt proteínas en diferentes poblaciones celulares en el mismo animal. Cualquier superposición de expresión debe eliminarse para que la agregación de Htt de tipo salvaje en células receptores con precisión informes de penetración citoplasmática de prion-como los agregados procedentes de donantes de células9,12,27, 41. Esto puede lograrse mediante la introducción de herramientas genéticas adicionales (e.g., Gal80 y QS represores40) para aliviar este problema. Una vez que el genotipo ideal es diseñado y seleccionado, se debe establecer un método sistemático para la cuantificación de puncta. Esto dependerá en gran medida el número de células que están etiquetados, el número de agregados que aparecen y la relación señal a ruido de la muestra. Criterios como la colocalización o traste positivo pueden ser utilizados para el análisis de los datos, como hemos indicado en la figura 4. Sin embargo, restringir la selección de tipo salvaje Htt agregados basados en estas características pueden provocar subestimación de eventos de transferencia-como prión, ya que algunas semillas agregadas de Htt mutantes podrían caer por debajo del límite de detección del microscopio confocal.
En vivo lo aquí descrito no es exclusivo de prion-como comportamiento de los agregados asociados a HD o incluso otras enfermedades de la poliQ. Moscas transgénicas se pueden desarrollar para examinar prion-como separarse de alfa-sinucleína en la EP, tau en AD y SOD1 o TDP-43 en ALS utilizando el mismo paradigma experimental. Cada una de estas proteínas, un mutante agregación propensos debe expresarse en células de un donante y una versión soluble de la misma proteína que sólo agregados cuando nucleadas deben expresarse en células del receptoras. Este paradigma experimental también puede ser útil para investigar la idea emergente que proteínas patógenas asociadas con diversas enfermedades pueden interactuar a través de un mecanismo siembra transversal47. Por último, las innumerables herramientas genéticas en Drosophila se pueden aplicar para investigar e identificar los mecanismos moleculares subyacentes de citoplasma a citoplasma que se separa de los agregados de proteína patógena asociadas a estas enfermedades mortales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a los miembros de los laboratorios Kopito, Luo y Pearce para muchas discusiones útiles durante el desarrollo de estos métodos. También agradecemos a Brian Temsamrit para la lectura crítica de este manuscrito. Este trabajo fue financiado por los fondos de la Universidad de las Ciencias y las confianzas caritativas de W.W. Smith.
Materiales
| Name | Company | Catalog Number | Comments |
| Phosphate buffered saline (PBS), 10X, pH 7.4 | ThermoFisher Scientific | AM9625 | Dilute to 1X |
| Triton X-100 | Sigma-Aldrich | T9284-1L | |
| Kimwipes | Thomas Scientific | 2904F24 | |
| 20% paraformaldehyde (PFA) | Electron Microscopy Sciences | 15713-S | |
| Normal Goat Serum (NGS), filtered | Lampire Biological Laboratories | 7332500 | Aliquot and freeze upon receipt |
| Chicken anti-GFP | Aves Labs | GFP-1020 | Use at 1:500 dilution |
| Rabbit anti-DsRed | Clontech | 632496 | Use at 1:2000 dilution; can recognize DsRed-based fluorescent proteins (e.g. mCherry, mStrawberry, tdTomato, etc.) |
| Mouse anti-Bruchpilot | Developmental Studies Hybridoma Bank | nc82 | Use at 1:100 dilution; will label active pre-synaptic structures thoughout the fly brain |
| FITC anti-chicken | ThermoFisher Scientific | SA1-7200 | Use at 1:250 dilution |
| Alexa Fluor 568 anti-rabbit | Life Technologies | A11011 | Use at 1:250 dilution |
| Alexa Fluor 647 anti-mouse antibody | Life Technologies | A21235 | Use at 1:250 dilution |
| Slowfade Gold Antifade Reagent | Life Technologies | S36936 | |
| Microscope Slides (25 x 75 x 1.0 mm) | Fisher Scientific | 12-550-143 | |
| Cover Glass (22 x 22 mm) | Globe Scientific | 1404-15 | |
| Dumont Biology Grade Forceps, Style 3 | Ted Pella | 503 | use in non-dominant hand |
| Dumont Biology Grade Forceps, Style 5 | Ted Pella | 505 | use in dominant hand |
| LAS X image analysis software | Leica | ||
| Imaris image analysis software | Bitplane |
Referencias
- Prusiner, S. B. Biology and genetics of prions causing neurodegeneration. Annu Rev Genet. 47, 601-623 (2013).
- Haïk, S., Brandel, J. P. Infectious prion diseases in humans: Cannibalism, iatrogenicity and zoonoses. Infect Genet Evol. 26, 303-312 (2014).
- Balch, W. E., Morimoto, R. I., Dillin, A., Kelly, J. W. Adapting Proteostasis for Disease Intervention. Science. 319 (5865), 916-919 (2008).
- Stroo, E., Koopman, M., Nollen, E. A., Mata-Cabana, A. Cellular Regulation of Amyloid Formation in Aging and Disease. Front Neurosci. 11, 64(2017).
- Brundin, P., Melki, R., Kopito, R. Prion-like transmission of protein aggregates in neurodegenerative diseases. Nat Rev Mol Cell Biol. 11 (4), 301-307 (2010).
- Jucker, M., Walker, L. C. Self-propagation of pathogenic protein aggregates in neurodegenerative diseases. Nature. 501 (7465), 45-51 (2013).
- Stopschinski, B. E., Diamond, M. I. The prion model for progression and diversity of neurodegenerative diseases. Lancet Neurol. 16 (4), 323-332 (2017).
- Walker, L. C., Jucker, M. Neurodegenerative diseases: expanding the prion concept. Annu Rev Neurosci. 38, 87-103 (2015).
- Holmes, B. B., et al. Heparan sulfate proteoglycans mediate internalization and propagation of specific proteopathic seeds. Proc Natl Acad Sci U S A. 110 (33), 3138-3147 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proc Natl Acad Sci U S A. 108 (9), 3548-3553 (2011).
- Nonaka, T., et al. Prion-like properties of pathological TDP-43 aggregates from diseased brains. Cell Rep. 4 (1), 124-134 (2013).
- Ren, P. H., et al. Cytoplasmic penetration and persistent infection of mammalian cells by polyglutamine aggregates. Nat Cell Biol. 11 (2), 219-225 (2009).
- Trevino, R. S., et al. Fibrillar structure and charge determine the interaction of polyglutamine protein aggregates with the cell surface. J Biol Chem. 287 (35), 29722-29728 (2012).
- Volpicelli-Daley, L. A., et al. Exogenous alpha-synuclein fibrils induce Lewy body pathology leading to synaptic dysfunction and neuron death. Neuron. 72 (1), 57-71 (2011).
- Zeineddine, R., et al. SOD1 protein aggregates stimulate macropinocytosis in neurons to facilitate their propagation. Mol Neurodegener. 10, 57(2015).
- Ayers, J. I., Fromholt, S. E., O'Neal, V. M., Diamond, J. H., Borchelt, D. R. Prion-like propagation of mutant SOD1 misfolding and motor neuron disease spread along neuroanatomical pathways. Acta Neuropathol. 131 (1), 103-114 (2016).
- Clavaguera, F., et al. Brain homogenates from human tauopathies induce tau inclusions in mouse brain. Proc Natl Acad Sci U S A. 110 (23), 9535-9540 (2013).
- de Calignon, A., et al. Propagation of tau pathology in a model of early Alzheimer's disease. Neuron. 73 (4), 685-697 (2012).
- Eisele, Y. S., et al. Induction of cerebral beta-amyloidosis: intracerebral versus systemic Abeta inoculation. Proc Natl Acad Sci U S A. 106 (31), 12926-12931 (2009).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Meyer-Luehmann, M., et al. Exogenous induction of cerebral beta-amyloidogenesis is governed by agent and host. Science. 313 (5794), 1781-1784 (2006).
- Mougenot, A. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol Aging. 33 (9), 2225-2228 (2012).
- Rey, N. L., et al. Widespread transneuronal propagation of alpha-synucleinopathy triggered in olfactory bulb mimics prodromal Parkinson's disease. J Exp Med. 213 (9), 1759-1778 (2016).
- Babcock, D. T., Ganetzky, B. Transcellular spreading of huntingtin aggregates in the Drosophila brain. Proc Natl Acad Sci U S A. 112 (39), 5427-5433 (2015).
- Kim, D. K., et al. Anti-aging treatments slow propagation of synucleinopathy by restoring lysosomal function. Autophagy. 12 (10), 1849-1863 (2016).
- Liu, L., et al. Trans-synaptic spread of tau pathology in vivo. PLoS One. 7 (2), 31302(2012).
- Pearce, M. M., Spartz, E. J., Hong, W., Luo, L., Kopito, R. R. Prion-like transmission of neuronal huntingtin aggregates to phagocytic glia in the Drosophila brain. Nat Commun. 6, 6768(2015).
- Pearce, M. M. Prion-like transmission of pathogenic protein aggregates in genetic models of neurodegenerative disease. Curr Opin Genet Dev. 44, 149-155 (2017).
- Pecho-Vrieseling, E., et al. Transneuronal propagation of mutant huntingtin contributes to non-cell autonomous pathology in neurons. Nat Neurosci. 17 (8), 1064-1072 (2014).
- Wu, J. W., et al. Neuronal activity enhances tau propagation and tau pathology in vivo. Nat Neurosci. 19 (8), 1085-1092 (2016).
- Jackson, G. R., et al. Polyglutamine-expanded human huntingtin transgenes induce degeneration of Drosophila photoreceptor neurons. Neuron. 21 (3), 633-642 (1998).
- Warrick, J. M., et al. Expanded polyglutamine protein forms nuclear inclusions and causes neural degeneration in Drosophila. Cell. 93 (6), 939-949 (1998).
- McGurk, L., Berson, A., Bonini, N. M. Drosophila as an In Vivo Model for Human Neurodegenerative Disease. Genetics. 201 (2), 377-402 (2015).
- The Huntington's Disease Collaborative Research Group. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Bates, G. P., et al. Huntington disease. Nat Rev Dis Primers. 1, 15005(2015).
- Scherzinger, E., et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils: implications for Huntington's disease pathology. Proc Natl Acad Sci U S A. 96 (8), 4604-4609 (1999).
- Chen, S., Berthelier, V., Yang, W., Wetzel, R. Polyglutamine aggregation behavior in vitro supports a recruitment mechanism of cytotoxicity. J Mol Biol. 311 (1), 173-182 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q system: a repressible binary system for transgene expression, lineage tracing, and mosaic analysis. Cell. 141 (3), 536-548 (2010).
- Riabinina, O., Potter, C. J. The Q-System: A Versatile Expression System for Drosophila. Methods Mol Biol. 1478, 53-78 (2016).
- Costanzo, M., et al. Transfer of polyglutamine aggregates in neuronal cells occurs in tunneling nanotubes. J Cell Sci. 126 (16), 3678-3685 (2013).
- Freeman, M. R., Delrow, J., Kim, J., Johnson, E., Doe, C. Q. Unwrapping glial biology: Gcm target genes regulating glial development, diversification, and function. Neuron. 38 (4), 567-580 (2003).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50 (6), 869-881 (2006).
- Wu, J. S., Luo, L. A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc. 1 (4), 2110-2115 (2006).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Roszik, J., Szöllosi, J., Vereb, G. AccPbFRET: an ImageJ plugin for semi-automatic, fully corrected analysis of acceptor photobleaching FRET images. BMC Bioinformatics. 9, 346(2008).
- Spires-Jones, T. L., Attems, J., Thal, D. R. Interactions of pathological proteins in neurodegenerative diseases. Acta Neuropathol. 134 (2), 187-205 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados