Method Article
Protocolo La autorradiografía de receptores para la visualización localizada de Receptores de la Angiotensina II
En este artículo
Resumen
Here we present a protocol to describe the localization of angiotensin II Type 1 receptors in the rat brain by quantitative, densitometric, in vitro receptor autoradiography using an iodine-125 labeled analog of angiotensin II.
Resumen
Este protocolo describe los patrones de unión al receptor de la angiotensina II (Ang II) en el cerebro de rata usando un radioligando específico para los receptores de Ang II para llevar a cabo el mapeo receptor autorradiográfica.
Las muestras de tejido se cosechan y se almacenaron a -80 ° C. Un criostato se utiliza para la sección coronal del tejido (cerebro) y el deshielo de montaje en las secciones sobre portaobjetos cargados. Las secciones de tejido de diapositivas montadas se incuban en 125 I-SI-Ang II a marcar radiactivamente los receptores de Ang II. Diapositivas adyacentes están separadas en dos conjuntos: "unión no específica '(NSP) en presencia de una concentración de saturación del receptor de no radiomarcado Ang II, o un AT 1 subtipo de receptor de Ang II (AT 1 R) antagonista selectivo del receptor de Ang II y 'unión total' sin AT 1 R antagonista. Una concentración de saturación de AT 2 subtipo de receptor de Ang II (AT 2 R) antagonista (PD123319, 10 M) también está presente en la incubatien tampón de limitar 125I-SI-Ang unión a la AT 1 R subtipo II. Durante un 30 min pre-incubación a ~ 22 ° C, las diapositivas de NSP están expuestos a 10 M PD123319 y losartan, mientras que "la unión total 'portaobjetos se expusieron a 10 mM PD123319. Los portaobjetos se incubaron después con 125 I-SI-Ang II en presencia de PD123319 de 'la unión total', y PD123319 y losartán para NSP en tampón de ensayo, seguido por varios lavados '' en tampón, y agua para eliminar la sal y la no radioligando específicamente unido. Los portaobjetos se secan con secadores, luego se expuso a una película de autorradiografía usando una película especializado y casete. La película se desarrolla y las imágenes se escanea en un ordenador para densitometría visual y cuantitativa usando un sistema de imagen propia y una hoja de cálculo. Un conjunto adicional de diapositivas están teñidas con tionina para las comparaciones histológicos.
La ventaja de utilizar autorradiografía del receptor es la capacidad de visualizarAng II receptores in situ, dentro de una sección de una muestra de tejido, y anatómicamente identificar la región del tejido comparándola con una sección de referencia histológico adyacente.
Introducción
La enfermedad cardiovascular sigue siendo la principal causa de muerte y discapacidad en los Estados Unidos, causando más de un 30% de las muertes en los EE.UU. en 2011 1. Las estadísticas más recientes de la American Heart Association indican que más de una de cada tres personas tiene uno o más tipo de enfermedad cardiovascular. la investigación cardiovascular sigue haciendo avances contra la comprensión de esta enfermedad, pero a medida que las generaciones comienzan envejecer es imprescindible para continuar estos esfuerzos. El sistema renina-angiotensina (RAS) desempeña un papel central en la regulación del sistema cardiovascular principalmente mediante la promoción de la aterosclerosis, la inflamación, la vasoconstricción sistémica y la activación del sistema nervioso simpático (Figura 1) 2-8.
El RAS es un sistema hormonal que se activa cuando las células yuxtaglomerulares del riñón secretan renina en el torrente sanguíneo en respuesta a la disminución de la presión arterial, aumento de sympatestimulación hetic o disminución del flujo de sodio por la mácula densa. La renina metaboliza angiotensinógeno (sintetizado en el hígado) para formar la angiotensina I (Ang I). a continuación, Ang I es metabolizada por la enzima convertidora de angiotensina (ACE), un ectoenzyme en el lado luminal de las células endoteliales vasculares, principalmente en los pulmones y riñones, para formar angiotensina II (Ang II), el principal péptido efector de la RAS. Ang II es capaz de activar dos subtipos de receptores; el receptor de tipo 1 (AT 1 R) y el receptor de tipo 2 (AT 2 R), tanto que regulan el sistema cardiovascular, mantener la homeostasis de líquidos y electrolitos y ahora se consideran para afectar la función cognitiva y enfermedades neurodegenerativas procesos de 8,9. A RAS local específica del cerebro se informó de sintetizar de forma independiente Ang II. En el cerebro, el angiotensinógeno proteína precursora se sintetiza en astroglia 10 convertido a Ang I por una enzima 3 renina-como, posiblemente prorrenina unido al receptor prorrenina11, y posteriormente convertida a Ang II por la enzima convertidora de la angiotensina que se expresa abundantemente en la superficie extracelular de las neuronas en el cerebro 12. Este intrabrain generada Ang II es el agonista para el cerebro AT1 y 2 receptores que están aislados de transmisión sanguínea Ang II.
Mientras que el AT 1 R juega un papel fisiológico importante, es mejor conocida por sus efectos fisiopatológicos en todo el cuerpo, que afecta principalmente al sistema cardiovascular y los riñones (Figura 2). Cuando Ang II se une a la AT 1 R, que causa vasoconstricción; aumento de la resistencia al flujo de la sangre y el aumento de la presión arterial. También promueve la síntesis y secreción de aldosterona y vasopresina, lo que aumenta la retención de sodio y agua. Estos efectos también pueden inducir daño cerebral isquémico y deterioros cognitivos y está relacionado con la enfermedad de Parkinson, enfermedad de Alzheimer, y Diabetes, además de ser identificado recientemente a afectar el aprendizaje y la memoria 13 a 15. Hay un bucle de retroalimentación en el RAS en que AT 1 R sobre las células yuxtaglomerulares en el riñón inhibe la secreción de renina. Curiosamente, el AT 2 R generalmente contra-regula la acción de AT 1 R, causando vasodilatación, el crecimiento de neuritas, la regeneración axonal, anti-proliferación, y cerebroprotection entre muchos otros 16-20. El AT 2 R también ha sido identificado como un objetivo para anti-hipertensión y recientemente, fármacos contra el cáncer 21. La determinación de la localización y la densidad de los receptores de Ang II en diversos tejidos y la forma en que se ven afectados por diversos tratamientos y estados de enfermedad utilizando autorradiografía cuantitativa del receptor densitométrico ayudará a descubrir el papel del SRA juega en enfermedades específicas.
autorradiografía del receptor se ha utilizado durante más de 30 años como un método eficaz para indicar la presencia de angiotensina II receptores y otros componentes de las RAS en el cerebro y otros tejidos de la rata, ratón, cobaya, perro y humano bajo una variedad de condiciones experimentales 22-34. La importancia de la localización de los receptores de Ang II dentro del cerebro es que se puede aplicar la neuroanatomía funcional a las acciones de Ang II en el cerebro, por ejemplo, la presencia de AT 1 R en el núcleo paraventricular del hipotálamo (PVN) sugiere una función de Ang II en el cerebro para estimular la vasopresina, oxitocina o la liberación de la hormona liberadora de corticotropina (CRH), o la activación del sistema nervioso simpático. Por lo tanto, los fármacos que bloquean el AT 1 R podrían disminuir algunos de estos efectos mediados por PVN asociados con respecto a la actividad de los RAS cerebrales. Trabajo en curso sugiere que el uso de antagonistas AT 1 R puede disminuir postraumático Trastorno de estrés (TEPT) inducida por la liberación de CRH y mejorar los síntomas de trastorno de estrés postraumático (Hurt et al., Presentado para su publicación). El PVN, subfornicalórgano (OFS), y la amígdala son conocidos por regulación de la homeostasis, el apetito / sed, sueño, la memoria, las reacciones emocionales, y son las áreas objetivo de este estudio de demostración. Estas regiones se examinaron mediante la recopilación de secciones coronales de un cerebro en portaobjetos de microscopio, y el tratamiento de las secciones con inhibidores específicos junto con un radioligando específico para los receptores de Ang II. En este estudio, todos los materiales y reactivos, junto con los vendedores sugeridas están en la lista, yodo-125 se usó para radiomarcar un antagonista de Ang II receptor, sarcosina 1, isoleucina 8 Ang II (SI Ang II), que luego se purificó como el mono 125 I -SI Ang II usando métodos de HPLC como se describió anteriormente 35. El uso de esta alta actividad específica de radioligando permite la visualización de áreas de densidad baja, moderada y alta receptor después de la exposición de las secciones radiomarcados a película de rayos x. Al calibrar la película con las normas de pasta cerebrales que contienen cantidades conocidas de yodo-125, la cantidad específicade la unión en un área de receptores de angiotensina II puede ser cuantificado. En estudios experimentales, la unión en los cerebros de sujetos experimentales receptor de Ang II puede ser comparada a la de los cerebros de los sujetos control. Esto puede indicar si las acciones de Ang II se alteran en respuesta a una condición genética, anormalidad fenotípica, estado de la enfermedad o el tratamiento de drogas. Este conocimiento puede ser aplicado al desarrollo de terapias para tratar enfermedades asociadas con la desregulación de la RAS. Las técnicas alternativas que identifican los sitios de unión al receptor, pero con reducida resolución anatómica, son ensayos que utilizan preparaciones de membrana de tejido derivados de homogeneizados de tejido, que son incubados con el radioligando en un intervalo de concentraciones para evaluar la afinidad de unión de radioligando como la constante de disociación (K D vinculantes ) y capacidad de unión máxima (Bmax) del tejido de interés.
El protocolo descrito aquí puede ser dividido en 5 grandes components: Preparación de secciones de tejido de los receptores de autorradiografía; La autorradiografía del receptor; Exposición de la película y el Desarrollo; Histología; y Análisis de Imágenes densitométrico.
Protocolo
Todos los animales procedimientos llevados a cabo para este estudio fueron aprobados por el Comité de Cuidado y Uso de Animales Institucional de la Universidad Nova Southeastern de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio, 8ª edición (The National Academies Press, Washington, DC, 2011 ).
1. Preparación de secciones de tejido de los receptores de autorradiografía
- Después del sacrificio, la cosecha tejidos cerebrales frescas, y se envuelven en papel de aluminio y colocar en un congelador a -20ºC tan pronto como sea posible. Para mantener la forma correcta, colocar en un molde cerebro cerebro que simula el interior del cráneo, envolver en papel de aluminio y colocar en un - 20 ° C congelador. Después de 30 minutos, colocar los tejidos en una bolsa de almacenamiento en el congelador se puede sellar y se mueven a un congelador -80 ° C para el almacenamiento a largo plazo.
- Obtener una muestra de tejido fresco congelado de interés de la descongelación del congelador -80 ° C, y la transferencia a un criostato se establece en un mínimo de -10 ° C y una máxima de 18 ° C, para evitar.
- Colocar la muestra sobre el tejido se montan con un glicol y medio de inclusión a base de resina, solamente la incorporación de una pequeña parte de la muestra en el medio. Para el cerebro, el cerebro está montado verticalmente para permitir el corte en el plano coronal.
- , El soporte para el tejido en el microtomo dentro del criostato y apretar firmemente en su lugar. Asegúrese de que el lado izquierdo y derecho del cerebro se encuentran en las mismas coordenadas antero-posterior y que el eje dorso-ventral es atlas del cerebro perpendicular al uso común.
- Comenzar a cortar en el espesor deseado (20 micras recomendado) y descongelar montar las secciones en portaobjetos de microscopio en una dirección vertical a tener una mayor área de superficie de espacio en la diapositiva. Recoger las secciones sobre portaobjetos en series secuenciales de cinco, es decir, el primer conjunto de diapositivas están etiquetados 1-1, 1-2, 1-3, 1-4, y 1-5 (Figura 3).
- Después de llenar una serie de diapositivas con las secciones, permiten que las diapositivas se sequen al aire para un máximo de 1 hora, a continuación, colocar el SLIdes en una caja de plástico de diapositivas en una bolsa de almacenamiento en el congelador de auto-sellado, y se almacena a -20 ° C.
2. Receptor autorradiografía
PRECAUCIÓN: La radiactividad. Usar vestimenta protectora para manejar la radiactividad. Eliminación se dependía de la creación, y debe seguir las directrices de la corrupción correctamente (vida media de 60 días) o ser recogido por una empresa certificada.
- Retire las diapositivas "-1" y "-2" de interés desde el congelador a -20ºC y montar en sujeciones de filtro (Figura 5). Montar las diapositivas "-1" en conjunto para el tratamiento "no específica", y los "-2" se desliza para el tratamiento "total". Tarros 'no específicos' contendrán 10 mM finales concentraciones de PD123319 un AT 2 antagonista de R, y losartán un AT 1 antagonista de R, en tampón medio de ensayo (AM5) (Tabla 1), el "total" tarros de unión contendrán solamente 10 M PD123319 en AM5.
- Invertir la diapositivapinzamientos para Colocar los portaobjetos en los frascos de Coplin pre-incubación llenos de 35 a 40 ml de AM5, e inhibidores respectivos durante 30 minutos a temperatura ambiente. Iniciar juegos posteriores en su baño de pre-incubación a intervalos de 4 min.
- Transferir inmediatamente los portaobjetos de la solución de incubación pre a los anuncios publicitarios de la incubación de diapositivas, que contiene 10 ml de AM5, además de una concentración predeterminada de 125 I-SI-Ang II (calculado en la Figura 4) con los inhibidores respectivos, por 60 a 90 min en la sala temperatura. Si hay suficiente radioligando, 10 muestras se pueden colocar (espalda contra espalda) en sujeciones de filtro modificados y se incubaron con 125I-SI-Ang II en frascos de Coplin.
- Colocar los portaobjetos de nuevo en las sujeciones de filtro (si es necesario), mancha, y enjuagar suavemente por arremolinándose por 1-2 seg en 400 ml de agua destilada en dos recipientes separados.
- Transferir los portaobjetos secuencialmente en cuatro jarras Coplin que contienen 35-40 ml de AM5 por exactamente 1 min cada uno (como se ilustra en la Figura 4 </ Strong>).
- Después del último enjuague 1 min, agitar suavemente las secciones de 1-2 segundos en cuatro cambios de agua destilada enfriada con hielo.
- Seque los portaobjetos con aire frío (Precaución: el aire caliente se volatiliza el compuesto radiactivo) utilizando cuatro secador de pelo creados desde diferentes ángulos de 4 minutos (Figura 5), hasta que todas las secciones estén secas, a continuación, colocar sobre una toalla de papel.
- Monte desliza hacia arriba con los tejidos en un cartón para la aposición a película de rayos X usando cinta de doble cara.
- Monte al menos uno, 125 de calibración de yodo de diapositivas estándar en cada uno de cartón (Figura 6).
Nota: Los estándares de calibración consisten en pasta de cerebro mezclado a fondo con 125 yodo unido a un compuesto que contiene un anillo de fenol, compactado por centrifugación en una jeringa de tuberculina de 1 ml, que son criostato seccionada en el mismo grosor que las secciones de cerebro y descongelar montados en microscopio diapositivas. Alternativamente, 125 patrones de calibración I enresina de plástico se seccionaron a 20 micras de espesor se puede obtener comercialmente. La resina de plástico en estas normas protege parcialmente la película de la radiación de tal manera que una equivalencia de tejido de ~ 40% debe tenerse en cuenta en la calibración.
3. Exposición y Desarrollo de Cine
- Proceder a un cuarto oscuro con una placa de rayos X de la correa de recogida y autorradiografía película. Abra el casete y colocar el cartón con desliza en el interior (Figura 6).
- Apagar las luces y encender la luz de seguridad. Abra cuidadosamente la caja de la película X-Ray, retire una película, y colocar el lado brillante película de arriba (con el borde dentado en la esquina inferior derecha) en la parte superior de las diapositivas de la casete. Cierre cuidadosamente el casete, y girar las barras de cierre para sellar la luz (Figura 6). Exponer las diapositivas de varios días a varias semanas a -20 ° C.
- En el cuarto oscuro, abrir el cassette y proceder con el desarrollo de la película process.
- Colocar los portaobjetos en las bandejas de forma consecutiva; desarrollador de 2 min, en agua que contiene 5% de ácido acético glacial durante 30 segundos, y el fijador de 5 min. Las películas se la coloca en una bandeja con agua corriente durante 20 minutos, después se colocan en Photoflo por no más de 10 seg y se cuelgan.
Nota: El tiempo de exposición se determina empíricamente y puede implicar múltiples películas con diferentes tiempos de exposición: el tiempo suficiente para obtener señales medibles de las zonas con baja unión, pero no tan largo como para saturar la película de áreas con alta unión. Una vez que se obtienen las exposiciones aceptables, a continuación, proceder al siguiente paso.
- Colocar los portaobjetos en las bandejas de forma consecutiva; desarrollador de 2 min, en agua que contiene 5% de ácido acético glacial durante 30 segundos, y el fijador de 5 min. Las películas se la coloca en una bandeja con agua corriente durante 20 minutos, después se colocan en Photoflo por no más de 10 seg y se cuelgan.
4. Histología
- Preparar la mancha tionina y reactivos de tinción (Tabla 2, Figura 7).
- Colocar los portaobjetos "-3" en el bastidor deslizante, y la transferencia en orden secuencial comenzando con agua desionizada durante 1 min, a continuación, tionina solución de tinción durante 10 minutos seguido de tres sumerge en deionaguas zados, y un lavado de 30 segundos en agua desionizada.
- Tras el agua, coloque la parrilla corrediza en lavados de etanol de la siguiente manera; 50%, 70% y 90% durante 30 segundos, seguido de dos lavados con etanol al 100% durante 1 min cada uno. Por último, colocar la parrilla corrediza en xileno durante 3 min, luego transferir a una segunda solución de xileno durante 5 min.
- Retire una diapositiva a la vez desde el último baño de xileno, y cubrir el borde superior de la diapositiva con una base de resina en medio de montaje disolvente orgánico, y colocar una 24 mm x 60 mm cubreobjetos sobre el portaobjetos. Permitir que se desliza a lo suficientemente seco para ~ 48 horas y luego escanear en el equipo a 2.400 dpi en escala de grises.
5. Análisis de Imágenes Densitométricas
- Coloque el lado brillante película hacia abajo, con el borde dentado en la esquina inferior izquierda y escanear con un escáner patentada capaz de transmitir la información de densidad de la película sin ningún tipo de distorsión en el ordenador del sistema de formación de imágenes.
- Abra el archivo sys exposición patentadaTEM y utilizar las barras de calibración para establecer patrones de calibración para el análisis densitométrico futuro de las imágenes de la película (Figuras 9 - 12).
- medir áreas de interés, ya sea estableciendo una plantilla o empíricamente describiendo las áreas de interés. Los datos se recogieron y se separó el basado en la película, ya sea de control o de tipo salvaje (sección), y la región. Asegúrese de incluir la densidad (fmol / g), área de lectura, y el área total proyectada en las mediciones (Figura 9).
- Ajuste bares área de escaneo, asegurando que la región de interés se encuentra entre los parámetros de relieve (Figura 10).
- Exportar datos en una hoja de cálculo (Tabla 4). Multiplicar los tiempos densidad del área total del objetivo, y se divide por el área de escaneado con el fin de obtener el valor de la unión de esa área específica. Una vez que esto se hace para todos los valores medidos, el sustrato La no específica establecida de total para dar el p de unión específicaresentirse de. Promedios también pueden llevarse a cabo para estos valores.
Resultados
La visión general de la vía metabólica del sistema renina-angiotensina se muestra en la Figura 1 y el enfoque directo sobre los subtipos de receptores de la angiotensina II (AT 1 R y AT 2 R) se describe en la Figura 2. La Figura 3 muestra la transferencia de cerebro coronal secciones en portaobjetos de microscopio, que luego se ejecutan a través de un procedimiento de autorradiografía del receptor usando una concentración de 125 I-siang II predeterminado como se ve en la Figura 4. la figura 5 ilustra la etapa de secado para las diapositivas de la autorradiografía del receptor que se fija después sobre un cartón como ve en la Figura 6, y posteriormente desarrollado Tabla. 2 se enumeran los reactivos usados para el procedimiento de tinción con tionina para las secciones de tejido de deslizamiento montado descritos en la Figura 7. unidades estándar de calibración para la cuantificación se determinó based en la fecha de la prueba como se ve en la Tabla 3. La Figura 8 muestra el establecimiento de una curva estándar relativa 125 I concentración (fmol / g de tejido) a la película de la exposición (densidad de optometría relativa). La figura 11 ilustra la distinción entre "NSP ' y los grupos "total", así como las etiquetas de tejido, mientras que la Figura 10 describe el ajuste del umbral a un valor cercano a cero para obtener un valor medio exacto para toda el área de escaneado (área píxeles Scan). la tabla 4 muestra la cuantificación proceso de obtención de la unión específica restando basa en el "no específica" de los valores "Total". "No específica" de unión que contiene losartán y / o PD123319 es creada por la cantidad de radioligando unido a la no-AT 1, o los receptores AT2. Todo el radioligando unido a los receptores AT1 en presencia de PD123319 produce el "total" de unión. F igura 11 muestra las áreas medidas finales de la PVN en total adyacentes de unión frente a no-específica a una sección teñida tionina para la confirmación anatómica del PVN.
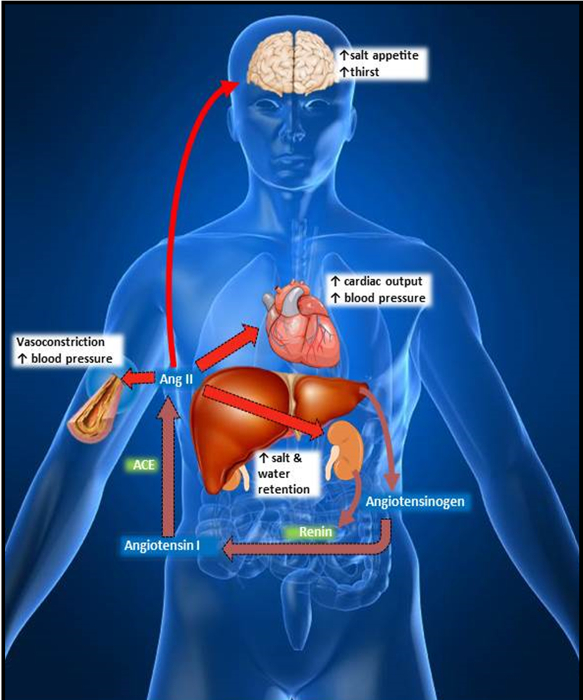
Figura 1:. Ruta metabólica del sistema renina-angiotensina-aldosterona (RAS) en el cuerpo, el hígado libera el angiotensinógeno zimógeno, que se escinde por la renina de riñón secretada, formando la angiotensina I. La angiotensina la enzima convertidora (ACE) convierte Ang I en angiotensina II ( Ang II), el precursor principal de la enfermedad cardiovascular. Ang II produce vasoconstricción, y aumenta la presión arterial, gasto cardíaco, apetito por la sal, la sed y la retención de agua. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2:. Funciones de la angiotensina tipo 1 y 2 receptores (AT 1 R, 2R) a 1 R afecta patológicamente enfermedades cardiovasculares, actúa directamente para aumentar la sed y el apetito por la sal, y ejerce muchas otras actividades celulares periféricos, así como el centro efectos psicológicos. A 2 R es un antagonista fisiológico del receptor AT1, ayudando en la eficacia de la AT 1 R 36 Antagonistas con ello, tener efectos beneficiosos sobre la estructura vascular. Por favor, haga clic aquí para ver una versión más grande de esta figura.
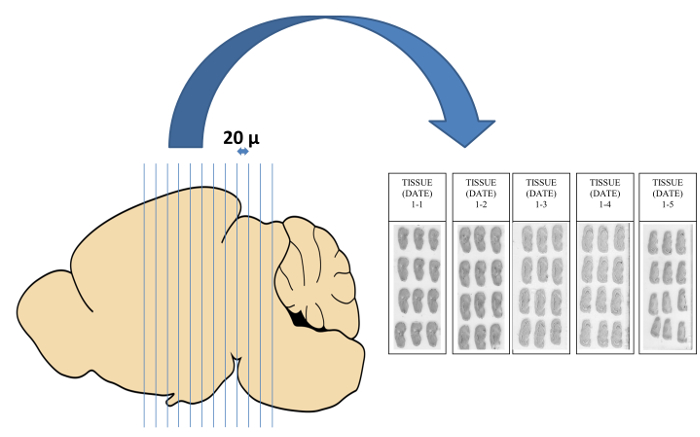
Figura 3: Cryosectioning de cerebro en portaobjetos de microscopio en 20 m de espesor. Dependiendo de la temperatura del criostato, las secciones a veces mostrar pliegues, grietas, curling, o llegar a ser compactado en la hoja microtomo o portacuchillas. En tales casos, la sección se descarta y se hizo una nota para indicar que un extra de 20 micras se separarán esta sección de la sección anterior. Las secciones deben ser recogidos en las diapositivas en una dirección vertical con el fin de maximizar el área total que se necesita para llenar una diapositiva y, por tanto, recoger la mayor cantidad de secciones en cada diapositiva. Por favor, haga clic aquí para ver una versión más grande de esta figura.
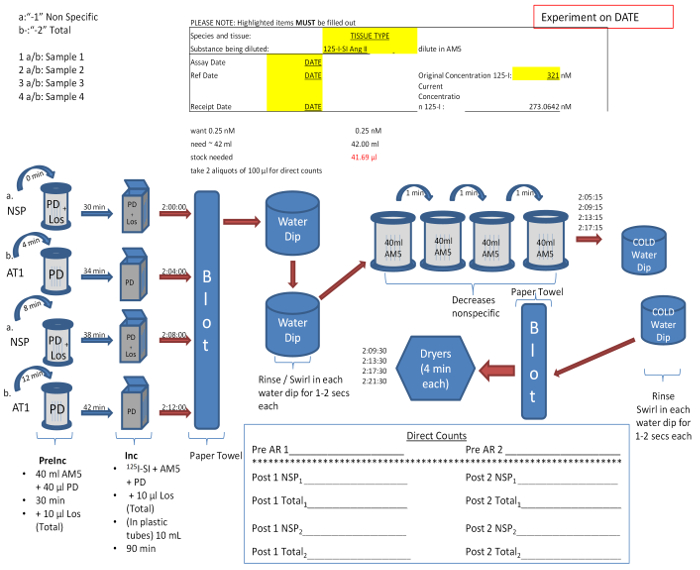
Figura 4:. Muestra de diseño y protocolo experimental para los receptores de autorradiografía Differentiación de "total" (-2) y "no específica" (-1) se relaciona directamente con la presencia y ausencia de antagonista del subtipo de receptor. Protocolo puede variar en función del número de diapositivas, y aumentará en incrementos de 2 para cada par de correderas totales y no específicas. la concentración de radioligando, determinado previamente se obtiene por dilución del caldo en AM5. Esta solución se distribuye uniformemente a los recipientes de incubación. Conteos directos son tomadas antes y después de la incubación para determinar la concentración exacta del radioligando. Por favor, haga clic aquí para ver una versión más grande de esta figura.
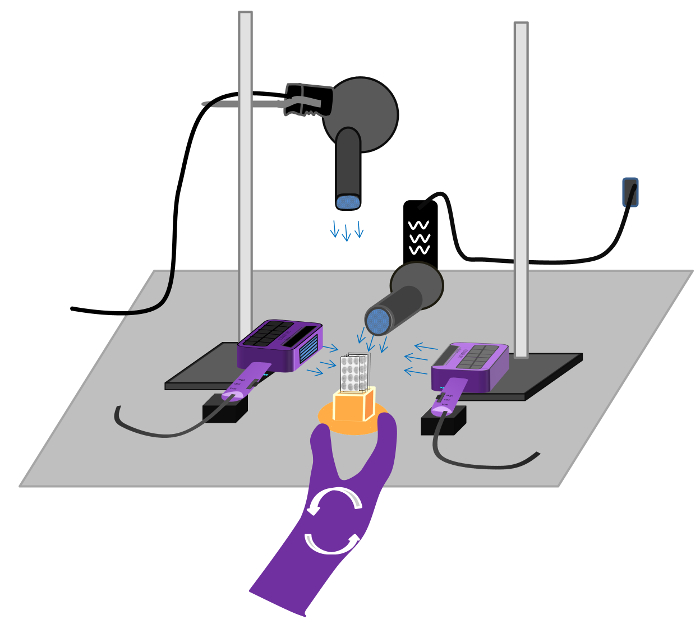
Figura 5:. Configuración para la estación de secado en la autorradiografía de receptores Los tiempos de secado variará en función de la eficiencia del golpesecador, así como la capacidad para secar el exceso de agua después de las últimas enjuagues. Los portaobjetos se seca una vez que la sección pasa de transparente a blanco. Si las diapositivas no están completamente secos después del radioligando se puede difundir fuera del receptor de producir una imagen borrosa que no es específico para los sitios de unión al receptor. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 6:.. La exposición de diapositivas tratados a una película de rayos X con un videocasete especializada se recomienda Slide puesta a punto de seguir un patrón donde se facilita la comparación de ambos grupos por favor haga clic aquí para ver una versión más grande de esta figura.
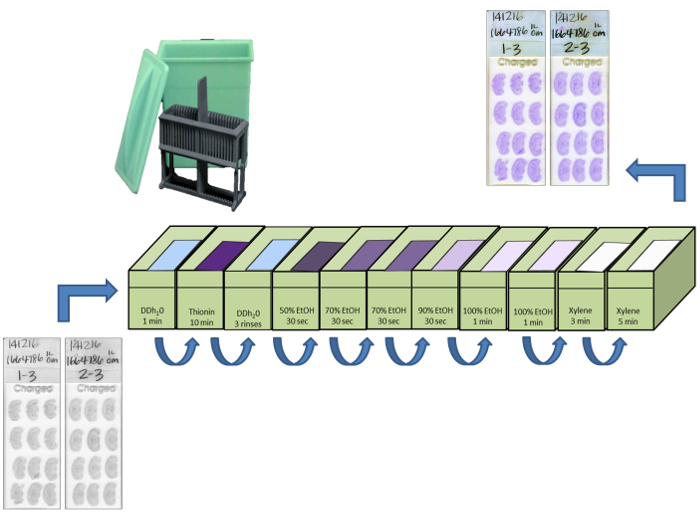
Figura 7: Configuración para tionina tinción. Los portaobjetos se cargan en un soporte de portaobjetos y se sumergieron en soluciones secuenciales. Timing permite para la tinción efectiva de la sustancia de Nissl (retículo endoplásmico rugoso) de las neuronas. Una aplicación de medio de montaje a las diapositivas siguientes deshidratación permite la fijación del cubreobjetos al portaobjetos, preservando las secciones para análisis comparativo. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 8:. Ajuste del patrón de calibración Cada película contiene sus patrones de calibración individuales, basados en la pasta cerebro y la hora en que se realiza el experimento . Una línea de regresión que describe los mejores valores de ajuste es generado por un programa de sistema de imagen propia para los estándares de pasta de cerebro medidos. Esto convierte el valor relativo densidad optométrica (ROD) a partir de los estándares de calibración (ETS Cal, en óvalo rojo) a las unidades de unión de radioligando, en este ejemplo las unidades (fmol / g, un círculo rojo) son radioligando fmol unida por gramo de mojado el peso del tejido (fmol / g). La medición de las normas de pasta de cerebro se hace con la herramienta circular y se coloca en el medio de la muestra se muestra a la derecha en pseudocolor mediante el icono de vista de la imagen (en el círculo en rojo). El círculo para medir el estándar de calibración no tiene que cubrir toda la muestra, sino más bien medir un área aún de la norma. Por favor, haga clic aquí para ver una versión más grande de esta figura.
/53866fig9.jpg "/>
Figura 9:. Identificación de los grupos de número de muestra, no específica / total y regiones para lecturas de la muestra Debido a múltiples cerebros, regiones del cerebro, y múltiples grupos experimentales se cuantifican conjuntamente, es crucial para diferenciar entre todos los factores. El sujeto indica la muestra del cerebro y también puede indicar grupo; la sección indica si es inespecífica (NSP) o total, mientras que la región permite la identificación de múltiples regiones del cerebro que están siendo muestreados. La barra de herramientas muestra (rectángulo rojo) describe diferentes herramientas de muestreo, por ejemplo, círculo, cuadrado, plantilla, a mano alzada, goma de borrar; que puede ser usado para delinear la zona a medir. Los valores obtenidos ROD dentro del área de la herramienta de muestreo se registran en la hoja de cálculo como unidades convertidas de unión, fmol / g (círculo rojo). Además, el área total de la exploración dentro de la herramienta de muestreo se registra en la columna "Scan área de píxeles", mientras que el total de target área (el número de píxeles que superan el valor umbral (que se describe en la Figura 10 leyenda) se registra en la columna "Total Área TGT-pixel". Por favor, haga clic aquí para ver una versión más grande de esta figura.
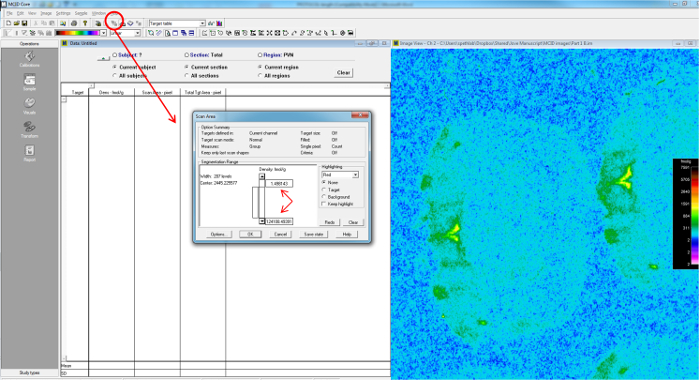
Figura 10: Determinación del umbral de muestras que se mide con base en los estándares del área de escaneado es única para cada película, y depende de las normas establecidas.. Con la herramienta de umbral (círculo rojo) para establecer los valores de umbral para el rango de densidad para el área de escaneado en fmol / g permitirá las áreas medidas (delimitada por las flechas diagonales) para caer entre un rango de 0, hasta un punto en el la curva de calibración comienza a asíntota lo que indica que la película está a punto de una exposición máxima, más allá del cual adicional 125 haré que no seguirá aumentando la densidad de la película. Sólo píxeles con densidad de la película mayor que el valor umbral más bajo se registran en la columna total TGT Area-pixel la ". Píxeles con valores menores que el valor umbral se les asigna un valor tan cerca de cero como sea posible para la determinación de los valores medios de la totalidad área de escaneado "Scan Area-pixel". Haga clic aquí para ver una versión más grande de esta figura.

Figura 11: Imágenes representativas de autorradiografía del receptor de unión a secciones coronales de una hembra ratas espontáneamente hipertensas (SHR) en ~ 1,8 mm caudal al bregma, mostrando el núcleo paraventricular del hipotálamo (PVN) y la cama núcleo del tracto olfatorio accesorio (BAOT ). (A </ strong>) unión de AT 1 R vinculante (Red-PVN, Amarillo- BAOT) total. (B) que se une con losartán (antagonista AT1R) y PD123319 (antagonista AT2R) no específica. De unión (C) total de AT 1 R unión con el establecimiento de un umbral arbitrario tal como para delinear la forma de la (relleno negro) PVN que supera el valor umbral, dentro del área de escaneado que se registra como Área Total TGT). (D) tionina manchada sección para la confirmación de las estructuras anatómicas que muestran alta unión total, y para la comparación con otras regiones del cerebro u otros grupos experimentales. Haga clic aquí para ver una versión más grande de esta figura.
| reactivos | Cantidad |
| NaCl | 8.76gramo |
| Na 2 EDTA | 1,86 g |
| bacitracina | 141 mg |
| 500 mM dibásico Na 2 PO 4 | 100 ml |
| Destilada Agua desionizada | 900 ml |
| Ajustar el pH a 7,1 a 7,2 con NaOH o HCl | |
Tabla 1: medio de ensayo (AM5) componentes químicos del tampón usado en la preparación del tejido..
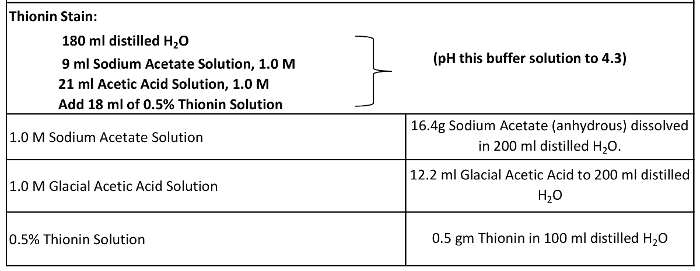
Tabla 2:. Tionina Stain Reactivos La mancha tionina se compone de agua destilada, 1,0 M de acetato de sodio y una solución de 1.0 M ácido acético glacial, con ajuste a un pH de 4,3 antes de la adición de un 0,5% tionina solución.
| Días pasados fecha de referencia | |||||||||
| Lote | fmol / g de peso húmedo | Ref Fecha | 1 | 2 | 3 | 4 | 5 | ||
| Estándar | nCi / mg | fmol / g | dpm / g | fmol / g | FOM / g | fmol / g | fmol / g | fmol / g | fmol / g |
| número | 30-mayo | 30-mayo | 30-mayo | 30-mayo | 31-mayo | 1-Jun | 2 de junio | 3 de junio | 4 de junio |
| 1 | 9,706 | 4,463 | 21547320 | 4,463 | 4.411 | 4.361 | 4.311 | 4.261 | 4,212 |
| 2 | 5.838 | 2,684 | 12960360 | 2,684 | 2,653 | 2,623 | 2.593 | 2.563 | 2,533 |
| 3 | 2,798 | 1.286 | 6,211,560 | 1.286 | 1272 | 1.257 | 1.243 | 1.228 | 1,214 |
| 4 | 1.451 | 667 | 3,221,220 | 667 | 659 | 652 | 644 | 637 | 630 |
| 5 | 787 | 362 | 1,747,140 | 362 | 358 | 354 | 350 | 345 | 342 |
| 6 | 385 | 177 | 854.700 | 177 | 174 | 173 | 171 | 169 | 167 |
Tabla 3:. Los cálculos diario proporción de caída de estándares de calibración tendrá que ser creado en base a las fechas en las que se realizó el experimento Una hoja de cálculo tasa de descomposición diario para los estándares de calibración. Esta hoja de cálculo se basa en constante con una vida media (t ½) de 60 días la velocidad de primer orden. N = N 0 * e kt, donde N = la concentración de 125 I, en el tiempo t en relación con la concentración en el tiempo 0 (N 0), y k = ln2 / t 1/2.
| Núcleo paraventricular del hipotálamo | ||||||
| Sección | Objetivo | Densidad-fmol / g | área de escaneado | Área total Target | Total* | |
| Total | 1 | 996 | 4.383 | 4.383 | 996 | |
| Total | 2 | 921 | 3,362 | 3,362 | 921 | |
| Total | 3 | 818 | 3.445 | 3.445 | 818 | La unión específica |
| Total | 4 | 710 | 2.906 | 2.906 | 710 | 967 |
| PROMEDIO | 861 | 3.524 | 3.524 | 861 | 895 | |
| 763 | ||||||
| Sección | Objetivo | Densidad-fmol / g | área de escaneado | Área total Target | No específica * | 678 |
| NSP | 1 | 53 | 3.072 | 1.737 | 30 | 826 |
| NSP | 2 | 52 | 2,959 | 1.455 | 26 | |
| NSP | 3 | 86 | 3,180 | 2,035 | 55 | |
| NSP | 4 | 53 | 3.293 | 1,995 | 32 | |
| PROMEDIO | 61 | 3,126 | 1,805.5 | 36 | ||
| Cama Núcleo del accesorio Olfactoria del tracto | ||||||
| Sección | Objetivo | Dens-fmol / g | área de escaneado | Área total Target | Total* | |
| Total | 1 | 439 | 3,632 | 3,632 | 439 | |
| Total | 2 | 435 | 3,632 | 3,632 | 435 | |
| Total | 3 | 355 | 3,632 | 3.620 | 354 | |
| Total | 4 | 435 | 3,632 | 3.631 | 435 | La unión específica |
| Total | 5 | 342 | 3,632 | 3.630 | 342 | 414 |
| Total | 6 | 334 | 3,632 | 3.606 | 331 | 393 |
| PROMEDIO | 390 | 3,632 | 3,625 | 389 | 321 | |
| 394 | ||||||
| 315 | ||||||
| Sección | Objetivo | Dens-fmol / g | área de escaneado | Área total Target | No específica * | 320 |
| NSP | 1 | 49 | 3,632 | 1.846 | 25 | 360 |
| NSP | 2 | 64 | 3,632 | 2.362 | 42 | |
| NSP | 3 | 53 | 3,632 | 2,275 | 33 | |
| NSP | 4 | 64 | 3,632 | 2.339 | 41 | |
| NSP | 5 | 51 | 3,632 | 1.879 | 26 | |
| NSP | 6 | 41 | 3,632 | 966 | 11 | |
| PROMEDIO | 54 | 3,632 | 1.945 | 30 | ||
| * Total y no especíica son unidades de densidad de fmol / g. | ||||||
| Total = densidad * Área total del objetivo / área de escaneado | ||||||
| No específica = densidad * Área total del objetivo / área de escaneado | ||||||
| Total de superficie de detección es el píxel que excedieron el valor umbral, establecen tan cerca de 0,00 fmol / g como sea posible. | ||||||
| Píxeles que no exceda el umbralValor recibir un valor de 0 para la evaluación de la densidad total. | ||||||
| Píxeles que no superen el valor umbral reciben un valor de 0 para la evaluación de la densidad no específica. | ||||||
| La unión específica es total para no específico menos unión expresado en unidades de densidad de fmol / g. | ||||||
Tabla 4: Análisis cuantitativo de núcleo paraventricular del hipotálamo y los núcleos de la tracto olfativo accesorio exporta datos de imágenes de software como una hoja de cálculo en fmol / g, área de lectura, y el área total del objetivo en píxeles.. La unión "no específica" se sustrae de "total" de unión con el fin de obtener el AT específicos 1 cuantitativa de unión.
Discusión
El protocolo descrito identifica la visualización de "total" y "no específica" de unión del radioligando en las secciones adyacentes de las secciones coronal de un cerebro de roedores previamente cosechado y almacenado a -80 ° C, y puede ser fácilmente aplicable a prácticamente todos los tejidos que ha resuelto anatómicamente subestructuras que muestran cantidades diferenciales de los receptores o sitios de unión de radioligando. Los procedimientos descritos en el protocolo son simples y el análisis es fundamental para la correcta interpretación de los resultados. El espesor de 20 micras se determinó que era óptima; si la sección es demasiado gruesa la unión no específica se incrementará, por lo que es difícil resolver la unión del radioligando a su objetivo. Si la sección más delgada se corta, se hace difícil de cortar con éxito y guardar secciones secuenciales sin distorsión. La temperatura óptima de corte puede variar ligeramente debido a la naturaleza del tejido y el espesor de las secciones y is por lo general se determina empíricamente. Una vez que se hace contacto entre la hoja y el tejido, la orientación de la muestra puede ser revisado y reajustado al mover la muestra de tejido de vuelta lejos de la hoja, y la reorientación de la bola de montaje. Al cortar un cerebro de roedores es fundamental para asegurar los lados izquierdo y derecho del cerebro se encuentran en las mismas coordenadas antero-posterior y que el eje dorso-ventral es atlas del cerebro perpendicular al uso común. juegos de diapositivas están pre-etiquetados con el fin de realizar estudios sobre las secciones adyacentes de los tejidos. Las primeras series de 5 diapositivas están etiquetados 1-1, 1-2, 1-3, 1-4 y 1-5. La primera sección de corte va en diapositiva 1-1 en la esquina superior izquierda (esto es la esquina superior derecha de la diapositiva cuando se trata lado poroso hacia abajo); la segunda sección de corte va en diapositiva 1-2, etc. La quinta sección de corte va en diapositiva 1-5. La sección sexta corte va en diapositiva 1-1 a la izquierda de la primera sección. Una vez llenado el primer conjunto de diapositivas, iniciar otra serie de 5 deslizadoES, marcada por 2-1, 2-2, 2-3, 2-4 y 2-5. Este ciclo se continúa en la medida de nuevo en el cerebro como sea necesario. El "4" y "-5" diapositivas se mantienen como una copia de seguridad o para radiomarcar un receptor diferente.
El protocolo de autorradiografía del receptor depende de la radioligando utilizado y las características de los receptores de ser analizada para determinar las concentraciones de tampones, sales y los inhibidores. Para la medición del subtipo AT1 de los receptores de Ang II en este procedimiento, un ligando marcado de alta afinidad de yodo-125, I-125 Sar 1 Ile 8 -Ang II (125 I-SI-Ang II); radiomarcado por Robert C. Speth, Ph.D. (Péptido Radioyodación recurso compartido, la Universidad de Georgetown), que también está disponible en el comercio) se disuelve en tampón AM5 (Tabla 1); un tampón de fosfato de sodio con cloruro de sodio, EDTA y bacitracina. AM5 proporciona una buena protección del radioligando de metalopeptidasas y peptida bacitracina sensibleses proporcionar un pH fisiológico y la concentración de NaCl para optimizar características de unión. Pre-incubación en AM5 expone las secciones de tejido a peptidasa inhibidores para minimizar la degradación del radioligando, y también se disocia endógeno Ang II de los receptores de Ang II. antagonistas de losartán y de PD123319, AT1R y AT2R, respectivamente, que saturan se añaden sus receptores diana a concentraciones (10 mM) para evitar que el radioligando de la unión a estos receptores para evaluar la unión no específica y limitar la unión al receptor AT1 específica, respectivamente. La concentración deseada de 125 I-SI-Ang II para el ensayo y se determina la dilución requerida de la solución madre se determinó a partir de una hoja de cálculo de la velocidad de desintegración de radioisótopos (ver protocolo de la Tabla 3). De manera óptima una concentración de radioligando que se aproxima al K D se utiliza lo que ocuparía 50% de los receptores presentes. Sin embargo, debido a radioligandos pueden ser costosos e inferior concentraciones.g. 10-20% de la concentración K D se puede utilizar. Esto tiene una ventaja potencial de aumentar la relación señal a ruido mediante la reducción de la unión no específica más de unión específica. Sin embargo, se requieren tiempos de exposición más largos para desarrollar una imagen de la unión. Como se señaló anteriormente (sección 3.4), si la exposición obtenida es mayor o menor expuesto, las diapositivas pueden ser re-expuestos a una nueva película para un más corto y / o tiempo más largo para alcanzar la exposición deseada.
análisis de imágenes densitométrico se puede hacer por un sistema de imágenes de propiedad que ofrece una extensa compendio de las solicitudes de autorradiografía, así como otras aplicaciones. Los estándares de calibración están en fmol / g de peso de tejido húmedo (suponiendo un peso específico de uno para el tejido). Cada conjunto de serie, junto con un fondo va a generar una curva estándar. Existen varios algoritmos de ajuste de curvas con y sin ponderación disponibles para generar una curva estándar a partir de la relación d optométricaLos valores ensity (ROD) para los diferentes patrones de calibración. Selección de la curva que mejor representa los datos se realiza empíricamente como la subrutina de ajuste de curva no proporciona los valores de error relativos de las diferentes curvas estándar. En varillas de hasta ~ 0.6, la curva estándar es pseudolineal. Sin embargo, la película comienza a saturar más allá de este punto la formación de una curva que asíntotas alrededor de 0,8 a 0,9 unidades de varilla. Si las normas que están entre corchetes las muestras están por encima de las unidades de 0,9 ROD, se recomienda volver a exponer la película por un período de tiempo más corto para obtener valores más fiables de fmol / g unión de las muestras más cercanas a la gama pseudolineal de la norma curva. Los valores derivados en este extremo de la curva estándar se traducirá en pequeñas diferencias en ROD por diferencias significativamente mayor en la unión del radioligando. Por lo tanto la capacidad de detectar los cambios en disminuye la unión ya que la película se aproxima a su punto de saturación.
Para las mediciones de regiones específicas,Las medidas recomendadas son "densidad" en fmol / g, 'Área de escaneo' en píxeles, y "Total Área Objetivo 'en píxeles (Figura 9). Es importante fijar un valor umbral tan cerca de cero como sea posible (Figura 10), ya que las variaciones en la densidad de la película o el aspecto arbitraria de la curva estándar derivada de los patrones de calibración a veces puede dar valores de menos de cero. Si estos valores se promediaron para todos los píxeles en el área de escaneado no obtendría un valor artificialmente bajo. Los criterios utilizados para identificar las áreas con la unión puede ser muy subjetiva, por lo que es mejor para emparejar estrechamente el control y experimentales cerebros tanto como sea posible para reducir la incidencia de errores subjetivos. Otro reto es decidir cuántas secciones para promediar para obtener una lectura final. Una buena indicación de las secciones para analizar puede determinarse siguiendo una Aceptada atlas del cerebro de rata, además de los cortes histológicos teñidos. El tamaño de la zona de muestreo también puede ser unaproblema. Para compensar, una plantilla puede establecerse para corregir cualquier discrepancia de tamaño. El tratamiento de las secciones también podría afectar a una superficie de la estructura que ha de alta vinculante y deben ser considerados durante el análisis. Esto requiere un uso alternativo de la herramienta 'umbral' en el sistema de imágenes de propiedad para establecer un intervalo de densidad inferior o igual a un valor arbitrario de modo que represente las características anatómicas de la región del cerebro que se muestrea tal como el núcleo paraventricular del hipotálamo dentro de una herramienta de muestreo que abarca la región de interés (Figura 11, panel C). También es posible incluir la medida del área en la determinación de la cantidad de unión. Esto se puede hacer multiplicando el valor para los tiempos de unión específica el número de píxeles que se midieron. Píxeles pueden ser convertidos a unidades métricas por imágenes de una regla en dos planos, o un rectángulo de dimensiones conocidas. El número de píxeles que corresponden a lalongitud o área del rectángulo a continuación, se pueden expresar en unidades métricas. En 2400 dpi de resolución, ~ 9.000 píxeles = 1 mm 2 en nuestro sistema.
Aunque el uso de ligandos radiactivos ya no es una técnica ampliamente utilizada; es una de las pocas formas de visualizar la distribución física de los receptores en el tejido especímenes a sí mismos como funcional (capaces de unirse a su ligando innata). Además, se puede cuantificar el número de receptores para permitir la evaluación de los cambios en la expresión del receptor funcional entre los grupos de tratamiento, entre las diferentes regiones del cerebro u otras estructuras, entre las diferentes cepas de animales, o animales de diferentes edades, etc. Los métodos alternativos están disponibles para caracterizar aspectos neuroanatómicos de la expresión del receptor AT 1, sin embargo, tienen un valor limitado. La hibridación in situ de mRNA de los receptores AT1 no siempre corresponde con el receptor AT1 expresión o distribución en elcerebro. Mientras que las técnicas inmunológicas pueden aproximar las diferencias en la expresión del receptor en base a la intensidad de la tinción de secciones de tejido, no es posible generar una curva estándar para la tinción para permitir una determinación numérica de la expresión del receptor. autorradiografía del receptor también proporciona un nivel de especificidad por los receptores (u otros objetivos que se unen específicamente radioligandos) que no puede ser garantizado usando técnicas inmunológicas. En 2009, una serie de artículos se publicaron 37-43 que puso en duda la validez de 49 anticuerpos que estaban siendo utilizados para evaluar 18 receptores acoplados a proteínas G diferentes y un canal receptor de potencial transitorio (TRP). En esencia, los anticuerpos etiquetados bandas idénticas en transferencias de Western de tipo salvaje y ratones knockout para los receptores en cuestión. Posteriormente, varios grupos han hecho observaciones similares utilizando comercialmente disponible AT1 y 2 anticuerpos del receptor 44-49. El uso de un bacterial cromosoma artificial que genera una molécula indicadora, por ejemplo, proteína fluorescente verde, impulsado por el AT 1 promotor es un medio indirecto de la determinación de la presencia o ausencia de AT 1 en las células que expresan el receptor en el ratón (pero no rata) cerebros en base a su tener un promotor funcional al receptor 1 de 50. Es posible contar "células positivas" en regiones del cerebro microscópicamente identificados, pero no para cuantificar cambios en la intensidad de la expresión del receptor AT 1 en estas regiones. Por lo tanto en este momento las técnicas sólo validado que disponibles para medir directamente la expresión del receptor de Ang II son radioligando métodos de unión. Y, si se necesita resolución anatómica de funcional a 1 proteína del receptor a un nivel microscópico, autorradiografía del receptor es la única técnica disponible para tal medición directa.
autorradiografía del receptor no está exento de limitaciones. La principal concern es el del cumplimiento de los requisitos para utilizar los materiales radiactivos en un contexto de investigación. Es necesario contar con un programa de seguridad radiológica con las directrices estrictas para garantizar la seguridad de los investigadores que trabajan con materiales radiactivos y la disposición segura de los materiales radiactivos. Esto aumenta el costo de la investigación que utiliza materiales radiactivos a un punto que impide su uso en muchos entornos de investigación. Además, el costo de radioligandos puede ser sustancial. Por lo tanto un experimento de autorradiografía del receptor en el que se incuban un gran número de secciones de tejido de deslizamiento montado en envases de radioligando se puede usar cientos, si no miles de dólares de radioligando. Otra limitación es que los tejidos deben ser congeladas antes de seccionar en un criostato, se almacenan por un período de tiempo, y rápidamente se enjuagaron y se secaron después de la incubación con radioligando, todo lo cual puede poner en peligro la capacidad de los receptores o proteína de interés de unirse radioligando . Para ligandos que tienen culo rápidaociation cinética / disociación, puede que no sea posible conservar la unión del radioligando al receptor durante el tiempo necesario para enjuagar radioligando unido no específicamente. Además, con bajas cantidades de largos períodos de exposición de la película de unión de radioligando - un mes o más - puede ser necesaria antes de una imagen medible se puede formar en la película. Otro reto es que la adición de yodo-125 a un ligando puede afectar a la capacidad del ligando para unirse a su receptor o proteína diana debido al impedimento estérico. El uso de una molécula más pequeña, por ejemplo, tritio (3 H) elimina el problema de impedimento estérico, pero tritio tiene tal energía baja y baja actividad específica (en relación con yodo-125) que es extremadamente difícil generar una imagen de película para la mayoría poblaciones de receptores. A la luz de estos problemas, hay muchas situaciones en las que autorradiografía del receptor no es capaz de identificar los receptores u otras estructuras moleculares de interés.
A pesar de su limitations, autorradiografía del receptor se pueden identificar las estructuras específicas dentro de un tejido, por ejemplo, las regiones del cerebro alterados en respuesta a las variables experimentales en comparación con un cerebro normal de control. Este conocimiento puede ayudar a determinar el papel de la AT 1 R para Ang II u otro receptor o enzimas en la patología de la enfermedad. Este conocimiento tiene implicaciones farmacológicas valiosas, ya que indica las zonas de objetivo para las terapias potenciales.
Divulgaciones
Robert Speth has licensed antibodies to angiotensin II receptors to a commercial vendor and receives royalties from the sale of said antibodies. The other authors have nothing to disclose.
Agradecimientos
This work was supported by NIH Grant HL-113905
Materiales
| Name | Company | Catalog Number | Comments |
| 500 ml Plastic Beakers | Fisher | 02-591-30 | |
| 24 mm x 60 mm Coverslips | Fisher | 22-050-25 | |
| Autoradiography Imaging Film 24 mm x 30 cm | Carestream-Biomax MR Film | 891-2560 | |
| Bacitracin (from Bacillus licheniformis) | Sigma | B-0125 | |
| Cardboard Sheet 8 x 11 | Crescent Illustration Board #201 | 201 | |
| Coplin Jars | Fisher Scientific | E94 | |
| Commercial hair dryers | Conair | Model SD6X | |
| Disposable Culture Tubes | Fisher | 14-961-26 | |
| EDTA (Disodium salt, Dihydrate) | USB Corporation | 15-699 | |
| Ethanol | Fisher | 16-100-210 | |
| Formulary Substitute for D-19 Developer | Photographers Formulary, Inc. | 01-0036 | |
| Glacial Acetic Acid | Fisher | A38 SI-212 | |
| Histoprep/OCT | Fisher | SH75-125D | |
| Film Fixer | Kodak | 5160320 | |
| Photo flo | Kodak | 1464502 | |
| Losartan | Fisher/Tocris | 37-985-0 | |
| MCID™ Core 7.0 | MCID | N/A | |
| NaCl | Fisher | S271 | |
| Peel-A-Way slide grips | VWR | 48440-003 | |
| Permount | Fisher | SP15-100 | |
| PD123319 | Fisher | 13-615-0 | |
| Premium Charged Slides, Fine Ground Edge | Premiere Microscope Slides | 9308W | |
| 125I Ligands | Perkin Elmer | NEX- 248 | |
| 125SI-Ang II | George Washington University | Radioiodinated by Dr. Speth | |
| Slide Mailers | Fisher Scientific | HS15986 | |
| Sodium Dibasic Phosphate Anhydrous (Na2PO4) | Fisher | RDCS0750500 | |
| Sodium Acetate (Anhydrous) | Fisher | BP333-500 | |
| Thionin | Fisher | T409-25 | |
| X-Ray Casette (10 x 12) | Spectronics Corporation | Four Square | |
| Xylene | Fisher | X3P-1GAL |
Referencias
- Mozaffarian, D., et al. Heart disease and stroke statistics--2015 update: a report from the American Heart Association. Circulation. 131 (4), 29-322 (2015).
- Peart, W. S. The Renin-Angiotensin System. Pharmacol Rev. 17, 143-182 (1965).
- Ganten, D., et al. Angiotensin-forming enzyme in brain tissue. Science. 173 (3991), 64-65 (1971).
- Ganten, D., Fuxe, K., Phillips, M. I., Mann, J. F. E., Ganten, U., Ganong, W. F., Martini, L. . Frontiers in Neuroendocrinology. , 61-99 (1978).
- Fyhrquist, F., Metsarinne, K., Tikkanen, I. Role of angiotensin II in blood pressure regulation and in the pathophysiology of cardiovascular disorders. J Hum Hypertens. 9, 19-24 (1995).
- von Bohlenund und Halbach, O., Albrecht, D. The CNS renin-angiotensin system. Cell Tissue Res. 326 (2), 599-616 (2006).
- Speth, R., Giese, M. Update on the renin-angiotensin system. J Pharmacol Clin Toxicol. 1 (1), 1004 (2013).
- de Kloet, A. D., Liu, M., Rodriguez, V., Krause, E. G., Sumners, C. Role of neurons and glia in the CNS actions of the renin-angiotensin system in cardiovascular control. Am J Physiol Regul Integr Comp Physiol. , (2015).
- Saavedra, J. M., Sanchez-Lemus, E., Benicky, J. Blockade of brain angiotensin II AT1 receptors ameliorates stress, anxiety, brain inflammation and ischemia: Therapeutic implications. Psychoneuroendocrinology. 36 (1), 1-18 (2011).
- Stornetta, R. L., Hawelu-Johnson, C. L., Guyenet, P. G., Lynch, K. R. Astrocytes synthesize angiotensinogen in brain. Science. 242, 1444-1446 (1988).
- Li, W., Peng, H., Seth, D. M., Feng, Y. The Prorenin and (Pro)renin Receptor: New Players in the Brain Renin-Angiotensin System. Int.J.Hypertens. 2012, 290635 (2012).
- Strittmatter, S. M., Kapiloff, M. S., Snyder, S. H. [3H]captopril binding to membrane associated angiotensin converting enzyme. Biochem. Biophys. Res. Commun. 112, 1027-1033 (1983).
- Bild, W., Hritcu, L., Stefanescu, C., Ciobica, A. Inhibition of central angiotensin II enhances memory function and reduces oxidative stress status in rat hippocampus. Prog Neuropsychopharmacol Biol Psychiatry. 43, 79-88 (2013).
- Wright, J. W., Harding, J. W. Brain renin-angiotensin-A new look at an old system. Progress in Neurobiology. 95 (1), 49-67 (2011).
- Tashev, R., Stefanova, M. Hippocampal asymmetry in angiotensin II modulatory effects on learning and memory in rats. Acta Neurobiol Exp (Wars). 75 (1), 48-59 (2015).
- Reudelhuber, T. L. The continuing saga of the AT2 receptor: a case of the good, the bad, and the innocuous. Hypertension. 46 (6), 1261-1262 (2005).
- Carey, R. M. Cardiovascular and renal regulation by the angiotensin type 2 receptor: the AT2 receptor comes of age. Hypertension. 45 (5), 840-844 (2005).
- Valero-Esquitino, V., et al. Direct angiotensin type 2 receptor (AT2R) stimulation attenuates T-cell and microglia activation and prevents demyelination in experimental autoimmune encephalomyelitis in mice. Clin Sci (Lond). 128 (2), 95-109 (2015).
- Chen, J., et al. Neuronal over-expression of ACE2 protects brain from ischemia-induced damage. Neuropharmacology. 79, 550-558 (2014).
- Kalra, J., Prakash, A., Kumar, P., Majeed, A. B. Cerebroprotective effects of RAS inhibitors: Beyond their cardio-renal actions. J Renin Angiotensin Aldosterone Syst. , (2015).
- Zhao, Y., et al. Activation of intracellular angiotensin AT(2) receptors induces rapid cell death in human uterine leiomyosarcoma cells. Clin Sci (Lond). 128 (9), 567-578 (2015).
- Gehlert, D. R., Speth, R. C., Wamsley, J. K. Quantitative autoradiography of angiotensin II receptors in the SHR brain. Peptides. 7 (6), 1021-1027 (1986).
- Mendelsohn, F. A., Quirion, R., Saavedra, J. M., Aguilera, G., Catt, K. J. Autoradiographic localization of angiotensin II receptors in rat brain. Proc Natl Acad Sci U S A. 81 (5), 1575-1579 (1984).
- Gehlert, D. R., Speth, R. C., Wamsley, J. K. Autoradiographic localization of angiotensin II receptors in the rat brain and kidney. Eur J Pharmacol. 98 (1), 145-146 (1984).
- Speth, R. C., et al. Angiotensin II receptor localization in the canine CNS. Brain Res. 326 (1), 137-143 (1985).
- Santos, R. A. S., et al. Angiotensin-(1-7) is an endogenous ligand for the G protein-coupled receptor Mas. Proc Natl Acad Sci U S A. 100 (14), 8258-8263 (2003).
- Karamyan, V. T., Gembardt, F., Rabey, F. M., Walther, T., Speth, R. C. Characterization of the brain-specific non-AT(1), non-AT(2) angiotensin binding site in the mouse. Eur J Pharmacol. 590 (1-3), 87-92 (2008).
- Karamyan, V. T., Speth, R. C. Distribution of the non-AT1, non-AT2 angiotensin-binding site in the rat brain: preliminary characterization. Neuroendocrinology. 88 (4), 256-265 (2008).
- Karamyan, V. T., Stockmeier, C. A., Speth, R. C. Human brain contains a novel non-AT1, non-AT2 binding site for active angiotensin peptides. Life Sci. 83 (11-12), 421-425 (2008).
- Miller-Wing, A. V., et al. Central angiotensin IV binding sites: distribution and specificity in guinea pig brain. J Pharmacol Exp Ther. 266 (3), 1718-1726 (1993).
- Castren, E., Kurihara, M., Saavedra, J. M. Autoradiographic localization and characterization of angiotensin II binding sites in the spleen of rats and mice. Peptides. 8 (4), 737-742 (1987).
- MacGregor, D. P., et al. Angiotensin II receptor subtypes in the human central nervous system. Brain Res. 675 (1-2), 231-240 (1995).
- Plunkett, L. M., Correa, F. M. A., Saavedra, J. M. Quantitative autoradiographic determination of angiotensin-converting enzyme binding in rat pituitary and adrenal glands with 125I-351/A, a specific inhibitor. Regul Pept. 12, 263-272 (1985).
- Armando, I., et al. Increased angiotensin II AT(1) receptor expression in paraventricular nucleus and hypothalamic-pituitary-adrenal axis stimulation in AT(2) receptor gene disrupted mice. Neuroendocrinology. 76 (3), 137-147 (2002).
- Speth, R. C., Harding, J. W., Wang, D. H. . Angiotensin Protocols Vol. 51 Methods in Molecular Medicine. , 275-295 (2001).
- Widdop, R. E., Jones, E. S., Hannan, R. E., Gaspari, T. A. Angiotensin AT2 receptors: cardiovascular hope or hype. Br J Pharmacol. 140 (5), 809-824 (2003).
- Michel, M. C., Wieland, T., Tsujimoto, G. How reliable are G-protein-coupled receptor antibodies. Naunyn Schmiedebergs Arch.Pharmacol. 379 (4), 385-388 (2009).
- Jensen, B. C., Swigart, P. M., Simpson, P. C. Ten commercial antibodies for alpha-1-adrenergic receptor subtypes are nonspecific. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 409-412 (2009).
- Jositsch, G., et al. Suitability of muscarinic acetylcholine receptor antibodies for immunohistochemistry evaluated on tissue sections of receptor gene-deficient mice. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 389-395 (2009).
- Hamdani, N., van der Velden, J. Lack of specificity of antibodies directed against human beta-adrenergic receptors. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 403-407 (2009).
- Bodei, S., Arrighi, N., Spano, P., Sigala, S. Should we be cautious on the use of commercially available antibodies to dopamine receptors. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 413-415 (2009).
- Lu, X., Bartfai, T. Analyzing the validity of GalR1 and GalR2 antibodies using knockout mice. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 417-420 (2009).
- Everaerts, W., et al. Where is TRPV1 expressed in the bladder, do we see the real channel. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 421-425 (2009).
- Adams, J. M., McCarthy, J. J., Stocker, S. D. Excess dietary salt alters angiotensinergic regulation of neurons in the rostral ventrolateral medulla. Hypertension. 52 (5), 932-937 (2008).
- Herrera, M., Sparks, M. A., Alfonso-Pecchio, A. R., Harrison-Bernard, L. M., Coffman, T. M. Lack of specificity of commercial antibodies leads to misidentification of Angiotensin type 1 receptor protein. Hypertension. 61 (1), 253-258 (2013).
- Rateri, D. L., et al. Endothelial Cell-Specific Deficiency of Ang II Type 1a Receptors Attenuates Ang II-Induced Ascending Aortic Aneurysms in LDL Receptor(-/-) Mice. Circ Res. 108 (5), 574-583 (2011).
- Benicky, J., Hafko, R., Sanchez-Lemus, E., Aguilera, G., Saavedra, J. M. Six Commercially Available Angiotensin II AT(1) Receptor Antibodies are Non-specific. Cell Mol Neurobiol. 32 (8), 1353-1365 (2012).
- Elliott, K. J., Kimura, K., Eguchi, S. Lack of specificity of commercial antibodies leads to misidentification of angiotensin type-1 receptor protein. Hypertension. 61 (4), 31 (2013).
- Hafko, R., et al. Commercially available angiotensin II At(2) receptor antibodies are nonspecific. PLoS One. 8 (7), 69234 (2013).
- Gonzalez, A. D., et al. Distribution of angiotensin type 1a receptor-containing cells in the brains of bacterial artificial chromosome transgenic mice. Neuroscience. 226, 489-509 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados