Method Article
Rezeptor-Autoradiographie-Protokoll für die Lokalisierte Visualisierung von Angiotensin II-Rezeptoren
In diesem Artikel
Zusammenfassung
Here we present a protocol to describe the localization of angiotensin II Type 1 receptors in the rat brain by quantitative, densitometric, in vitro receptor autoradiography using an iodine-125 labeled analog of angiotensin II.
Zusammenfassung
Dieses Protokoll beschreibt Rezeptorbindungsmuster für Angiotensin II (Ang II) im Gehirn der Ratte ein Radioligand spezifisch für Ang II-Rezeptoren Rezeptor unter Verwendung von Autoradiographie-Mapping durchzuführen.
Gewebeproben werden geerntet und bei -80 ° C gelagert. ist ein Kryostat das Gewebe (Gehirn) und Auftauen montieren die Schnitte auf geladene Objektträger zu koronalen Abschnitt verwendet. Die Objektträger angebrachten Gewebeschnitte werden in 125 I-SI-Ang II inkubiert Ang II - Rezeptoren radioaktiv zu markieren. Benachbarte Objektträger werden in zwei Gruppen unterteilt: "unspezifische Bindung" (NSP) in Gegenwart eines Rezeptor sättigenden Konzentration von nicht-radioaktiv markierten Ang II oder ein AT1 - Ang II - Rezeptor - Subtyp (AT 1 R) selektive Ang II - Rezeptor - Antagonist und ohne AT 1 R - Antagonisten "Gesamtbindung". Einer sättigenden Konzentration von AT 2 Ang II - Rezeptor - Subtyp (AT 2 R) Antagonist (PD123319, 10 uM) ist auch in der incubatiauf Puffer 125 I-SI-Ang II - Bindung an den AT 1 R Subtyp zu begrenzen. Während eines 30 min Vorinkubation bei ~ 22 ° C, NSP Rutschen ausgesetzt sind 10 uM PD123319 und Losartan, während "Gesamtbindung" Dias 10 uM PD123319 ausgesetzt sind. Die Objektträger werden dann mit 125 I-SI-Ang II in Gegenwart von PD123319 für "Gesamtbindung" und PD123319 und Losartan für NSP in Assay - Puffer, gefolgt von mehreren "wäscht" in Puffer inkubiert und Wasser zu entfernen Salz und nicht spezifisch gebundene Radioligand. Die Folien werden mit Schlag-Trockner getrocknet und dann einer Autoradiographie Film belichtet eine spezielle Folie und Kassette. Der Film wird entwickelt und die Bilder werden in einen Computer gescannt für visuelle und quantitative Densitometrie ein proprietäres Bilderzeugungssystem und eine Tabelle verwendet wird. Ein zusätzlicher Satz von Dias werden für die histologische Vergleiche Thionin-gefärbt.
Der Vorteil der Rezeptor-Autoradiographie unter Verwendung ist die Fähigkeit, zu visualisierenAng II - Rezeptoren in situ, in einem Abschnitt einer Gewebeprobe, und anatomisch den Bereich des Gewebes zu identifizieren , indem es zu einem benachbarten histologischen Bezugsabschnitt zu vergleichen.
Einleitung
Kardiovaskuläre Erkrankungen weiterhin die häufigste Ursache für Tod und Behinderung in den Vereinigten Staaten zu sein, im Jahr 2011 1 mehr als 30% der Todesfälle in den USA verursacht. Aus den jüngsten Statistiken von der American Heart Association zeigen , dass mehr als eine Person in drei hat ein oder mehr Art von kardiovaskulären Erkrankungen. Kardiovaskuläre Forschung weiterhin Fortschritte gegen das Verständnis dieser Krankheit zu machen, aber als Generationen beginnen immer älter es ist zwingend notwendig, diese Bemühungen fortzusetzen. Das Renin-Angiotensin - System (RAS) spielt eine zentrale Rolle bei der Regulation des kardiovaskulären Systems in erster Linie von Atherosklerose, Entzündung, systemische Vasokonstriktion, und die Aktivierung des sympathischen Nervensystems (Figur 1) 2-8 fördern.
Der RAS ist ein Hormonsystem, das aktiviert wird, wenn juxtaglomerulären Zellen der Niere in den Blutstrom Renin in Reaktion absondern, um Blutdruck verringert, erhöht sympathetic Stimulation oder verminderte Natriumfluss durch die Macula densa. Renin-Angiotensinogen metabolisiert (in der Leber synthetisiert) Angiotensin I zu bilden (Ang I). Ang I wird dann durch das Angiotensin-Converting-Enzym (ACE), ein Ektoenzym auf der luminalen Seite des vaskulären endothelialen Zellen metabolisiert, hauptsächlich in den Lungen und Nieren, Angiotensin II zu bilden (Ang II), das Haupt Effektor Peptid der RAS. Ang II ist in der Lage aktivierenden zwei Rezeptorsubtypen; der Typ 1 - Rezeptor (AT 1 R) und der Typ - 2 - Rezeptor (AT 2 R), die beide die das kardiovaskuläre System zu regulieren, beibehalten Flüssigkeits- und Elektrolyt Homöostase und sind nun die kognitive Funktion zu beeinträchtigen , und neurodegenerative Krankheitsprozessen 8,9 betrachtet. Eine lokale, gehirnspezifische RAS wird berichtet, Ang II unabhängig zu synthetisieren. Im Gehirn wird das Vorläuferprotein Angiotensinogen in Astroglia 10 durch ein Renin-ähnliches Enzym zu Ang I 3 möglicherweise Prorenin umgewandelt synthetisiert, gebunden an den Rezeptor Prorenin11 und überführt anschließend durch das Angiotensin-Converting - Enzym zu Ang II , die reichlich auf der extrazellulären Oberfläche von Neuronen im Gehirn 12 exprimiert wird. Diese intrabrain erzeugt Ang II ist der Agonist für das Gehirn AT 1 und AT 2 Rezeptoren , die von durch Blut übertragbaren Ang II isoliert sind.
Während die AT 1 R eine wichtige physiologische Rolle spielt, ist es für seine pathophysiologischen Wirkungen im ganzen Körper besser bekannt ist , in erster Linie das Herz - Kreislauf - System und die Nieren (Abbildung 2) zu beeinflussen. Wenn Ang II an den R AT 1 bindet, verursacht es eine Vasokonstriktion; zunehmende Resistenz des Blutdrucks, um den Blutfluss und erhöht. Es fördert auch die Synthese und Sekretion von Aldosteron und Vasopressin, zu einer erhöhten Natrium- und Wasserretention führt. Diese Effekte können auch ischämischer Hirnschädigung und kognitiven Störungen induzieren und an der Parkinson-Krankheit, Alzheimer-Krankheit und Diabetes sowie kürzlich Lernen und Gedächtnis beeinflussen 13-15 identifiziert. Es gibt eine Rückkopplungsschleife in der RAS daß AT 1 R auf den juxtaglomerulären Zellen in der Niere inhibiert Renin - Sekretion. Interessanterweise im Allgemeinen die AT 2 R Gegen regelt die Wirkung von AT 1 R, was zu Vasodilatation, Neuritenwachstum, axonalen Regeneration, Anti-Proliferation und cerebroprotection unter vielen anderen 16-20. Der R AT 2 hat auch als Ziel für Anti-Bluthochdruck und vor kurzem, anti-Krebsmittel 21 identifiziert. Die Bestimmung der Lokalisierung und Dichte von Ang II-Rezeptoren in verschiedenen Geweben und wie werden sie durch verschiedene Behandlungen und Krankheitszuständen mit quantitativen densitometrischen Rezeptor Autoradiographie die Rolle spielt, die RAS in bestimmten Krankheiten aufdecken helfen beeinflusst.
Rezeptor-Autoradiographie wurde seit über 30 Jahren als wirksames Verfahren zum Anzeigen der Anwesenheit von Angiotensin I verwendetI - Rezeptoren und andere Komponenten der RAS im Gehirn und anderen Geweben der Ratte, Maus, Meerschweinchen, Hund und Mensch unter einer Vielzahl von experimentellen Bedingungen 22-34. Die Bedeutung Ang II - Rezeptoren der Lokalisierung innerhalb des Gehirns ist , dass eine funktionelle Neuroanatomie zu den Aktionen der Ang II im Gehirn anwenden kann, beispielsweise auf das Vorhandensein von AT 1 R in paraventricularis Nukleus des Hypothalamus (PVN) eine Funktion von Ang II im Gehirn zu stimulieren Vasopressin, Oxytocin oder Corticotropin-Releasing-Hormon (CRH) Freisetzung oder Aktivierung des sympathischen Nervensystems. So Medikamente, die den AT 1 R blockieren könnten mit Überaktivität des Gehirns RAS assoziiert einige dieser PVN-vermittelte Effekte zu verringern. Unfertige legt nahe , dass die Verwendung von AT 1 R - Antagonisten posttraumatische Belastungsstörung (PTSD) -induzierte Freisetzung von CRH verringern und lindern die Symptome von PTSD (Hurt et al., Zur Veröffentlichung eingereicht). Der PVN, subfornicalOrgel (SFO) und Amygdala zur Regulierung der Homöostase, Appetit / Durst, Schlaf, Gedächtnis, emotionale Reaktionen bekannt, und sind die Zielgebiete dieser Demonstration Studie. Diese Regionen wurden durch Sammeln Koronalschnitte eines Gehirns auf Mikroskop-Objektträger untersucht, und Behandeln der Schnitte mit spezifischen Inhibitoren zusammen mit einem spezifischen Radioligand für Ang II-Rezeptoren. In dieser Studie wurden alle Materialien und Reagenzien zusammen mit vorgeschlagen Anbieter aufgelistet sind, wurde Jod-125 verwendet , um einen Ang II - Rezeptor - Antagonist radioaktiv zu markieren, Sarcosin 1, Isoleucin 8 Ang II (SI Ang II), die dann als mono 125 I gereinigt wurde -SI Ang II Methoden unter Verwendung von HPLC wie zuvor 35 beschrieben. Die Verwendung dieser hohen spezifischen Aktivität Radioligand ermöglicht die Visualisierung von Bereichen mit niedriger, mittlerer und hoher Rezeptordichte nach dem Belichten der radiomarkierten Abschnitte Röntgenfilm. Durch den Film mit Gehirn Paste Standards kalibriert bekannten Mengen von Jod-125 enthält, die spezifische MengeRezeptor Ang II in einem Bereich Bindung kann quantifiziert werden. In experimentellen Untersuchungen kann die Ang II-Rezeptor in den Gehirnen von Versuchspersonen Bindung in den Gehirnen von Kontrollpersonen, die verglichen werden. Dies kann angeben, ob die Wirkungen von Ang II in Reaktion auf eine genetisch bedingte Erkrankung verändert sind, phänotypische Abnormalität, Krankheitszustand oder medikamentöse Behandlung. Dieses Wissen kann dann zur Entwicklung von Therapien angewendet werden, Krankheiten, die mit Dysregulation des RAS verbunden zu behandeln. Alternative Techniken , die Rezeptor identifizieren Bindungsstellen, aber mit reduzierter anatomischen Auflösung sind Bindungsassays , die Gewebemembran - Zubereitungen verwenden aus Gewebehomogenisate abgeleitet, die mit dem Radioligand über einen Bereich von Konzentrationen Radioligand - Bindungsaffinität als die Dissoziationskonstante (K D zu bewerten inkubiert ) und die maximale Bindungskapazität (B max) des Gewebes von Interesse.
Das hier beschriebene Protokoll kann in fünf Haupt Co gebrochen werdenmponents: Vorbereiten Gewebeschnitten für Receptor Autoradiographie; Rezeptor-Autoradiographie; Filmbelichtung und Entwicklung; Histologie; und Densitometrische Bildanalyse.
Protokoll
Alle Tierverfahren für diese Studie durchgeführt von der Institutional Animal Care und Use Committee von Nova Southeastern University in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von Labortieren genehmigt wurden, 8. Auflage (The National Academies Press, Washington, DC, 2011 ).
1. Vorbereiten Gewebeschnitten für Receptor Autoradiographiestift
- Nach dem Opfer, Ernte frische Hirngewebe und in Alufolie wickeln und in einen -20 ° C Gefrierschrank so schnell wie möglich. Um die richtige Form beibehalten, legen Gehirne in einem Gehirnform, die das Innere des Schädels simuliert, in Alufolie wickeln und in eine - 20 ° C Gefrierschrank. Nach 30 min Ort Gewebe in einem verschließbaren Gefrierkombination Aufbewahrungstasche und für die Langzeitlagerung zu einem -80 ° C Gefrierschrank bewegen.
- Besorgen Sie sich die frisch gefrorene Gewebeprobe von Interesse aus dem -80 ° C Gefrierschrank und Transfer zu einem Kryostaten auf ein Minimum von -10 ° C und maximal 18 ° C eingestellt, Auftauen zu vermeiden.
- Legen Sie die Probe auf die Gewebehalterung mit einem Glykol und Harzbasis Einbettmediums nur ein kleiner Teil der Probe in das Medium eingebettet wird. Für Gehirn ist das Gehirn vertikal montiert in der koronalen Ebene zu ermöglichen sectioning.
- Legen Sie das Gewebe montieren auf dem Mikrotom innerhalb des Kryostaten und ziehen Sie sie fest an ihrem Platz. Sicherstellen, dass die linken und rechten Seite des Gehirns sind in den gleichen antero-posterior-Koordinaten, und die dorso-ventralen Achse senkrecht zu häufig verwendeten Gehirn Atlanten.
- Beginnen mit der gewünschten Dicke Schneiden (20 & mgr; m empfohlen) und Auftauen die Schnitte auf Objektträger in vertikaler Richtung Halterung eine größere Oberfläche des Raumes in der Folie zu haben. Sammeln Schnitte auf Objektträger in aufeinanderfolgende Gruppen von fünf, dh der erste Satz von Schiebern versehen sind 1-1, 1-2, 1-3, 1-4 und 1-5 (Figur 3).
- Nach einer Reihe von Folien mit Abschnitten Befüllen lufttrocknen lassen Folien für bis zu 1 Stunde, dann die sli platzierendes in einem Kunststoff-Gleitkastens in einer selbstdichtenden Gefrierschrank Aufbewahrungstasche, und bei -20 ° C.
2. Receptor Autoradiographiestift
ACHTUNG: Die Radioaktivität. Verwenden Sie Schutzkleidung Radioaktivität zu behandeln. Die Entsorgung wird bei Einrichtung abhängig und müssen Richtlinien folgen richtig (Halbwertszeit 60 Tage) oder abgeholt werden von einem zertifizierten Unternehmen zu zerfallen.
- Entfernen Sie die "-1" und "-2" Dias von Interesse aus dem -20 ° C Gefrierschrank und montieren in Schiebegriffe (Abbildung 5). Montieren Sie die "-1" Dias zusammen für "nicht-spezifische" Behandlung, und die "-2" Folien für 'total' Behandlung. "Nicht-spezifische" Gläser enthalten 10 uM Endkonzentrationen von PD123319 einem AT 2 R - Antagonisten, und Losartan ein AT 1 R - Antagonisten, in Testmedium Puffer (AM5) (Tabelle 1), die "Gesamt" Bindung Gläser werden nur 10 enthalten uM PD123319 in AM5.
- Kehren Sie die Rutschegreift die Dias in die Vorinkubation Färbetrog mit 35-40 ml AM5 und entsprechende Inhibitoren für 30 Minuten bei Raumtemperatur gefüllt zu platzieren. Starten Sie nachfolgende Sätze in ihrer Vorinkubation Bad in 4-Minuten-Intervallen.
- Objektträger sofort aus der pre Inkubationslösung übertragen an die Inkubation slide mailers 10 ml AM5 enthält, sowie eine vorbestimmte Konzentration von 125 I-SI-Ang II (berechnet in Abbildung 4) mit den jeweiligen Inhibitoren für 60-90 min bei Raum Temperatur. Wenn ausreichend Radioligand ist, kann 10 Folien platziert werden in modifizierten Schiebegriffe (Rücken an Rücken) und mit 125 I-SI-Ang II in Färbetrog inkubiert.
- Platz gleitet zurück in die Schiebegriffe (falls erforderlich), Fleck, und spülen Sie vorsichtig zur Verwirbelung 1-2 sec in 400 ml destilliertem Wasser in zwei getrennten Behältern.
- Die Objektträger nacheinander in vier Coplin Gläser mit 35-40 ml AM5 für genau 1 min jeweils (wie in Abbildung 4 dargestellt </ Strong>).
- Nach der letzten 1 Minute Spülen, vorsichtig schwenken die Abschnitte für 1-2 sec in vier Änderungen eiskaltem destilliertem Wasser.
- Föhnen Sie die Folien mit kühler Luft (Achtung: heiße Luft verflüchtigt sich die radioaktive Verbindung) unter Verwendung von vier Haartrockner aus verschiedenen Winkeln für 4 min (Abbildung 5) eingerichtet, bis alle Abschnitte trocken sind, dann legen Sie auf einem Papiertuch.
- Berg Träger mit Gewebe auf einen Karton für Apposition zu einem Röntgenfilm mit doppelseitigem Klebeband nach oben zeigt.
- Berg mindestens eine, 125 Jod Kalibrierstandard Schieber auf jedem Karton (Abbildung 6).
Hinweis: Kalibrierstandards von Hirn Paste bestehen gründlich mit 125 Jod an eine Verbindung gebunden gemischt , um einen Phenolring enthält, verdichtet durch Zentrifugation in einer 1 ml Tuberkulin - Spritze, die mit der gleichen Dicke wie die Gehirnschnitte geschnitten Kryostaten und auftauen montiert auf Mikroskop Dias. Alternativ Standards 125 I KalibrierungKunststoffharz bei 20 & mgr; m Dicke geschnitten können kommerziell erhalten werden. Das Kunststoffharz in diesen Standards schirmt den Film partiell vor der Strahlung, so dass eine Gewebeäquivalenz von ~ 40% sollten in die Kalibrierungs berücksichtigt werden.
3. Film Belichtung und Entwicklung
- Fahren Sie mit einer Dunkelkammer mit einem Riemen-zurück Röntgenkassette und Autoradiographie Film. Öffnen Sie die Kassette und legen Sie den Karton mit Dias innen (Abbildung 6).
- Schalten Sie das Licht aus, und schalten Sie den Dunkelkammerlicht. Öffnen Sie vorsichtig die Schachtel mit den X-Ray Film, ein Film zu entfernen, und legen Sie den Film glänzenden Seite nach oben (mit dem gezackten Rand auf der unteren rechten Ecke) oben auf den Schlitten in der Kassette. Schließen Sie die Kassette vorsichtig und verdrehen Sie die Verriegelungsstangen Licht (Abbildung 6) heraus zu versiegeln. Belichten der Objektträger für mehrere Tage bis mehrere Wochen bei -20 ° C.
- In der Dunkelkammer, öffnen Sie die Kassette und fahren Sie mit dem Filmentwicklungs process.
- Legen Sie die Dias in die Fächer nacheinander; Entwickler für 2 min, Wasser 5% Eisessig für 30 Sekunden enthält, und Fixiermittel für 5 min. Die Filme werden die in eine Schale gelegt mit Wasser 20 Minuten lang läuft, dann nicht länger als 10 Sekunden in Photoflo gestellt und gehängt.
Anmerkung: Die Belichtungszeit wird empirisch bestimmt und mehrere Filme mit unterschiedlichen Belichtungszeiten beinhalten kann: lange genug messbare Signale von den Bereichen mit geringer Bindungs zu erhalten, aber nicht so lange, wie der Film durch Bereiche mit hoher Bindungs zu sättigen. Sobald akzeptablen Belichtungen erhalten werden, dann mit dem nächsten Schritt fort.
- Legen Sie die Dias in die Fächer nacheinander; Entwickler für 2 min, Wasser 5% Eisessig für 30 Sekunden enthält, und Fixiermittel für 5 min. Die Filme werden die in eine Schale gelegt mit Wasser 20 Minuten lang läuft, dann nicht länger als 10 Sekunden in Photoflo gestellt und gehängt.
4. Histologie
- Bereiten Sie die Thionin - Farbstoff und Färbereagenzien (Tabelle 2, Abbildung 7).
- Legen Sie die "-3" Folien in der Folienträger, und die Übertragung in der angegebenen Reihenfolge mit entsalztem Wasser beginnt für 1 min, dann Thionin-Farbstoff-Lösung für 10 min, gefolgt von drei Einbrüche in deionized Wasser und einer 30 sec waschen in VE-Wasser.
- Im Anschluss an das Wasser, legen Sie die Dia-Rack in Ethanol wäscht wie folgt; 50%, 70% und 90% für 30 sec, gefolgt von zwei Waschungen Ethanol bei 100% für je 1 min. Schließlich legen Sie die Objektträgergestell in Xylol für 3 Minuten, dann übertragen auf einen zweiten Xylol-Lösung für 5 min.
- Jeweils einen Objektträger in einer Zeit aus dem letzten Xylolbad und decken die obere Kante des Schlittens mit einer Harzbasis in einem organischen Lösungsmittel Eindeckmediums, und legen Sie eine 24 mm x 60 mm Deckglas auf die Folie. Lassen Sie Folien ausreichend trocken für ~ 48 Stunden und dann scannen in den Computer bei 2.400 dpi Graustufen.
5. Densitometrische Bildanalyse
- Legen Sie den Film glänzende Seite nach unten, mit dem gezackten Rand auf der unteren linken Ecke und scannen eine proprietäre Scanner der Lage, die Filmdichte Informationen ohne jegliche Verzerrung in dem Abbildungssystem Computer zu übertragen.
- Öffnen Sie die proprietäre Bildgebungs sysTEM- und verwenden die Kalibrierungsbalken Kalibrierstandards für zukünftige densitometrische Analyse der Bilder auf dem Film (- 12 Figuren 9) herzustellen.
- Messen Sie Bereiche von Interesse entweder durch eine Vorlage zur Gründung oder empirisch umreißt die Bereiche von Interesse. Die Daten werden die gesammelten und basierend auf dem Film getrennt, entweder Kontrolle oder Wildtyp (Abschnitt) und Region. Stellen Sie sicher , Dichte (fmol / g) enthalten, Scan - Bereich und die gesamte Zielgebiet in Messungen (Abbildung 9).
- Stellen Sie den Scanbereich Bars indem sichergestellt wird, dass Region von Interesse fällt zwischen den Parametern der Hervorhebung (Abbildung 10).
- Exportieren von Daten in eine Tabelle (Tabelle 4). Multiplizieren Sie die Dichte mal die Gesamtzielbereich, dann teilen Sie durch den Scan-Bereich, um den Wert für die Bindung von diesem spezifischen Bereich zu erhalten. Sobald dies für alle Messwerte durchgeführt wird, das Substrat die etablierte unspezifische von insgesamt die spezifische Bindung p zu ergebenübel nehmen. Mittelwerte können auch für diese Werte durchgeführt werden.
Ergebnisse
Der Überblick über den Stoffwechselweg des Renin-Angiotensin - System ist in Abbildung 1 und den direkten Fokus auf die Angiotensin - II - Rezeptor - Subtypen (AT 1 R und AT 2 R) dargestellt ist in Abbildung 2 beschrieben. Abbildung 3 zeigt die Übertragung von koronalen Hirn Schnitte auf Objektträger, die in Figur 4 gesehen werden dann mit einer vorbestimmten 125 I-siang II - Konzentration durch einen Rezeptor - Autoradiographie Prozedur ausgeführt werden. 5 veranschaulicht für die Folien in dem Rezeptor - Autoradiographie der Trocknungsschritt , der auf einen Karton dann angebracht werden als gesehen in Figur 6 und anschließend entwickelt. in Tabelle 2 sind die Reagenzien für die Thionin Färbeverfahren für die Objektträger angebrachten Gewebeschnitten in Figur beschrieben. 7 verwendeten Kalibrierungsstandardeinheiten zur Quantifizierung bestimmt based am Tag des Tests , wie in Tabelle gesehen 3. Abbildung 8 zeigt den Aufbau einer Standardkurve in Bezug 125 I - Konzentration (fmol / g Gewebe) Exposition zu filmen (relative Dichte optometrischer). 11 stellt die Unterscheidung zwischen "NSP" und "gesamt" Gruppen, sowie die Gewebeetiketten, während Abbildung 10 beschreibt die Einstellung der Schwelle zu einem in der Nähe von Null - Wert einen genauen Mittelwert für den gesamten abgetasteten Fläche (Scanbereich-Pixel) zu erhalten. Tabelle 4 zeigt die Quantifizierung Verfahren spezifisch für den Erhalt auf Subtrahieren der "unspezifischen" von "total" Werte Bindung beruht. " Die nicht-spezifische" Bindung , welche enthält Losartan und / oder PD123319 wird durch die Menge an Radioligand gebunden an nicht-AT 1 oder AT 2 Rezeptoren erstellt. Alle Radioligand an AT 1 Rezeptoren gebunden in Gegenwart von PD123319 ergibt die "Gesamt" bindend. F ild 11 zeigt die endgültige Messbereiche des PVN insgesamt gegen unspezifische Bindung benachbart zu einem Thionin gefärbt Schnitt für die anatomischen Bestätigung des PVN.
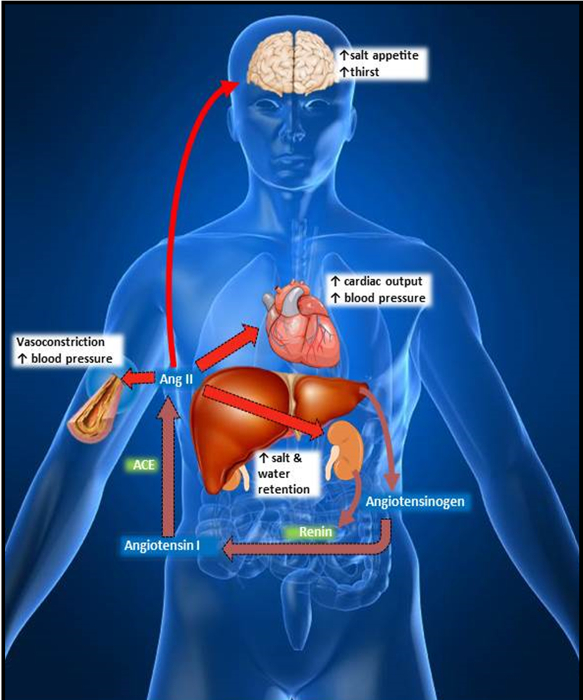
Abb . 1: Stoffwechselweg des Renin - Angiotensin - Systems (RAS) im Körper die Leber löst die Zymogen Angiotensinogen, die durch nieren sezerniert Renin gespalten wird, Angiotensin I. Angiotensin - Converting - Enzym bilden (ACE) wandelt Ang I in Angiotensin II ( Ang II), der Hauptvorläufer von kardiovaskulären Erkrankungen. Ang II verursacht Vasokonstriktion, und erhöht den Blutdruck, die Herzleistung, Salz Appetit, Durst und Wassereinlagerungen. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 2:. Funktionen des Angiotensin Typ 1 und 2 - Rezeptoren (AT 1 R, AT 2 R) AT pathologisch 1 R kardiovaskuläre Erkrankungen betroffen sind , wirkt direkt Durst und Salz den Appetit zu steigern, und übt viele andere periphere Zellaktivitäten sowie zentrale psychologische Effekte. AT 2 R ist ein physiologischer Antagonist des AT - 1 - Rezeptor, in der Wirksamkeit von AT 1 R unterstützen Antagonisten 36 dadurch mit positiven Auswirkungen auf die Gefäßstruktur. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
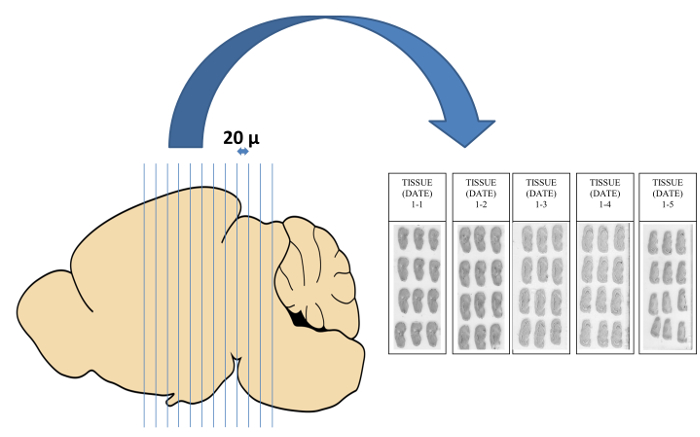
Abbildung 3: Cryosectioning of brain auf Mikroskop bei 20 & mgr; m Dicke gleitet. In Abhängigkeit von der Temperatur des Kryostaten, die Abschnitte werden manchmal angezeigt Falten, Risse, Kräuseln oder kompaktiert werden auf der Mikrotomklinge oder Messerhalter. In solchen Fällen wird der Abschnitt verworfen und eine Notiz gemacht, um anzuzeigen, dass eine zusätzliche 20 um diesen Abschnitt aus dem vorherigen Abschnitt trennt. Die Schnitte werden auf Objektträger in vertikaler Richtung gesammelt werden , um die gesamte Fläche zu maximieren benötigt , um eine Folie zu füllen und somit die größte Menge von Abschnitten auf jeder Folie sammeln. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
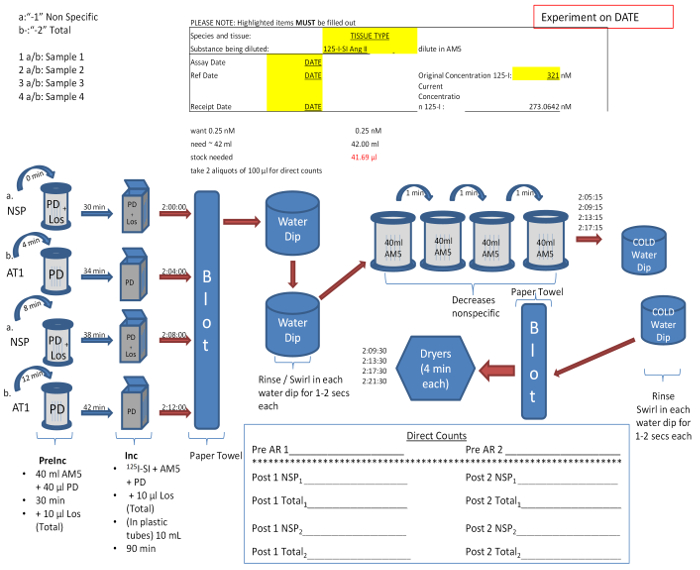
Abbildung 4:. Beispiel of Experimental Design & Protokoll für Receptor Autoradiographie Differentiation der "Gesamt" (-2) und "unspezifische" (-1), bezieht sich direkt auf die Anwesenheit und Abwesenheit von Rezeptor-Subtyp-Antagonisten. Protokoll kann auf der Grundlage der Anzahl der Folien variieren und wird in Schritten von 2 für jedes Paar von gesamten und nichtspezifischen Folien erhöhen. Radioligand-Konzentration, die zuvor durch Verdünnung des Bestands in AM5 erhalten wird, bestimmt. Diese Lösung wird dann auf die Inkubationsbehälter gleichmäßig verteilt. Direkte Zählungen werden vor und nach der Inkubation die genaue Konzentration des Radioliganden zu etablieren. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
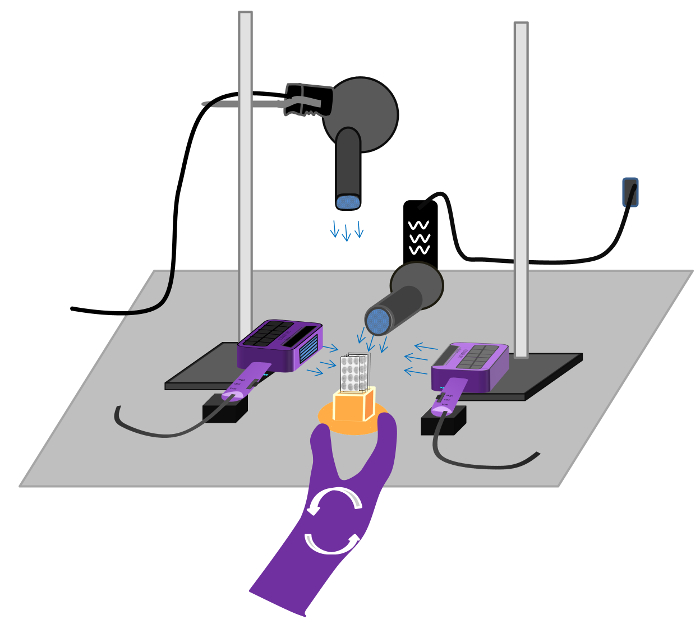
Abb . 5: Konfiguration für Trocknungsstation in Rezeptor - Autoradiographie Die Trocknungszeiten werden auf die Effizienz des Blasens variierenTrockner sowie die Fähigkeit, überschüssiges Wasser nach den letzten Spülungen auslöschen entfernt. Folien werden getrocknet werden, sobald der Abschnitt von klar zu weiß wird. Wenn Dias nicht vollständig getrocknet werden , dann kann der Radioligand diffundieren weg von dem Rezeptor eine Fuzzy - Bild erzeugt wird, die nicht spezifisch für den Rezeptor ist Bindungsstellen. Bitte hier klicken um eine größere Version dieser Figur zu sehen.

Abbildung 6:.. Machen behandelt Folien Röntgenfilm eine spezielle Kassette mit Folien - Set-up wird empfohlen, ein Muster zu folgen , wo Vergleich beider Gruppen erleichtert Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
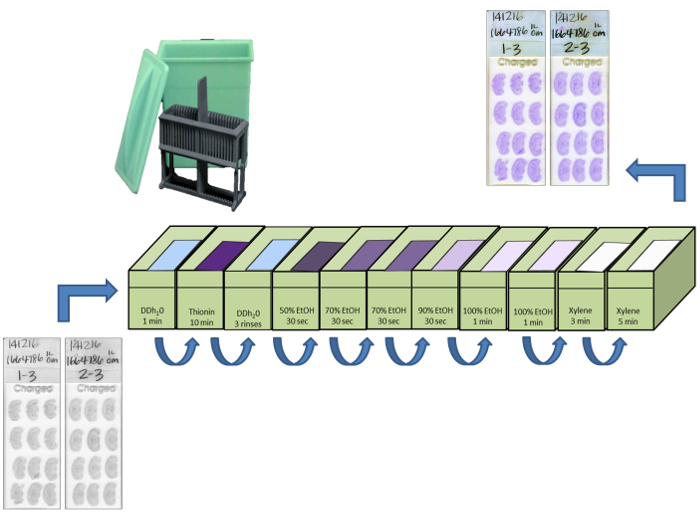
Abbildung 7: Set-up für die Thionin - Färbung. Die Objektträger werden in eine Folie Halter geladen und eingetaucht in aufeinanderfolgende Lösungen. Zeit ermöglicht eine effektive Färbung der Nissl Substanz (rauen endoplasmatischen Retikulum) von Neuronen. Eine Eindeckmediums Anwendung auf die Folien ab Entwässerung ermöglicht mit dem Schlitten des Deckglases für die Befestigung, die Abschnitte für eine vergleichende Analyse zu erhalten. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Fig . 8: Einstellen der Kalibrierungsstandard Jeder Film enthält seine individuellen Kalibrierungsstandards, basierend auf dem Gehirn Paste und dem Zeitpunkt , an dem das Experiment durchgeführt wurde . Eine Regressionslinie die besten Werte für die Anpassungs beschreibt, wird durch ein eigenes Bildsystem Programm für die gemessenen Hirn Paste Standards erzeugt. Dieser wandelt die relative optometrischer Dichte (ROD) Wert von den Kalibrierungsstandards (cal stds, in rot oval) auf die Anteile von Radioligand-Bindung, in diesem Beispiel die Einheiten (fmol / g, rot eingekreist) sind fmol Radioligand gebunden pro Gramm nasser Gewebegewicht (fmol / g). Die Messung der Gehirn Paste Standards ist mit dem kreisförmigen Werkzeug getan und in der Mitte der Probe auf der rechten Seite in Pseudo Symbol unter Verwendung der Bildansicht platziert (rot eingekreist). Der Kreis zur Messung der Kalibrierungsstandard muss nicht die gesamte Probe abdecken, sondern eine gleichmäßige Fläche der Standard messen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
/53866fig9.jpg "/>
Abb . 9: Identifizieren von Gruppen von Probennummer, nicht-spezifische / total, und Regionen für Probenmessungen Da mehrere Gehirn, Hirnregionen und mehrere Versuchsgruppen zusammen quantifiziert werden, ist es entscheidend , zwischen all den Faktoren zu unterscheiden. Das Thema zeigt die Gehirnprobe und auch Gruppe anzeigen kann; der Abschnitt zeigt an, ob es nicht-spezifische (NSP) oder insgesamt, während die Region, um die Identifizierung von mehreren Hirnregionen ermöglicht, die abgetastet werden. Die Probe Werkzeugleiste (rotes Rechteck) beschreibt verschiedene Sampling - Tools, zum Beispiel, Kreis, Quadrat, Schablone, freihändig, Radiergummi; die verwendet werden können Bereich abgrenzen gemessen werden. Die ROD-Werte im Bereich des Probennahmewerkzeug erhalten werden auf der Tabelle aufgezeichnet, wie konvertierte Einheiten der Bindung, fmol / g (rot eingekreist). Darüber hinaus wird die gesamte Scanbereich innerhalb des Sampling-Werkzeug in der "Scan-Bereich-Pixel" Spalte, während die Gesamt t aufgezeichnetarget Bereich (die Anzahl der Pixel , die den Schwellenwert (beschrieben in 10 Legende überschreiten) in der "Total Tgt Area-Pixel" Spalte aufgezeichnet wird. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
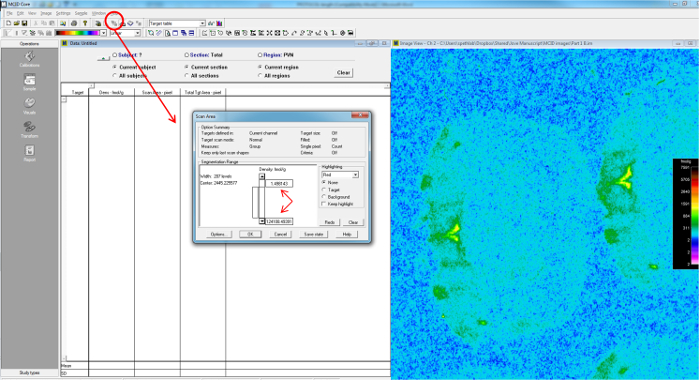
Abbildung 10: Bestimmung der Schwelle für die Proben auf der Basis der Standards gemessen werden , der Scan - Bereich ist einzigartig für jeden Film, und ist abhängig von den Normen festgelegt.. Mit dem Thresholding Werkzeug (rot eingekreist) Schwellenwerte für die Dichtebereich einzustellen für den Scan-Bereich in fmol / g wird für die Bereiche ermöglichen, gemessen (abgegrenzt durch diagonale Pfeile) zwischen einem Bereich von 0 bis fallen, bis zu einem Punkt, an dem die Kalibrierungskurve beginnt Asymptote anzeigt, dass der Film eine maximale Belichtung nähert, über die hinaus weitere 125 Ich werde keine weitere Erhöhung der Filmdichte führen. Nur Pixel mit Filmdichte größer als der untere Schwellenwert werden in der "Total Tgt Area-Pixelspalte aufgezeichnet. Pixel mit Werten, die kleiner als der Schwellenwert sind, für die Bestimmung der Mittelwerte des Gesamt Wert so nahe wie möglich bei Null zugewiesen Scan - Bereich "Scan Area-Pixel". Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 11: Repräsentative Bilder von Rezeptor - Autoradiographie Koronalschnitte eines weiblichen spontan hypertensiven Ratten (SHR) bei ~ 1,8 mm kaudal Bregma Bindung, die Anzeige des paraventricularis Kern des Hypothalamus (PVN) und dem Bett Kern des akzessorischen olfaktorischen - Darm - Trakt (Baot ). (A </ strong>) Gesamt Bindung von AT 1 R - Bindung (Red- PVN, Gelb- Baot). (B) Nicht-spezifische Bindung mit Losartan (AT1R - Antagonisten) und PD123319 (AT2R Antagonist). (C) Gesamt Bindung von AT 1 R Bindung mit einer beliebigen Schwelle einstellen, wie die Form des PVN (schwarze Füllung) zur Abgrenzung der den Schwellenwert überschreitet innerhalb des Scan - Bereichs, der als Gesamt Tgt Bereich aufgezeichnet wird). (D) Thionin gefärbten Abschnitt für anatomische Bestätigung der Strukturen zeigt hohe Gesamtbindung und zum Vergleich mit anderen Hirnregionen oder anderen Versuchsgruppen. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
| Reagenzien | Menge |
| NaCl | 8,76G |
| Na 2 EDTA | 1,86 g |
| Bacitracin | 141 mg |
| 500 mM dibasisches Na 2 PO 4 | 100 ml |
| Destilliertes deionisiertes Wasser | 900 ml |
| PH-Wert auf 7,1 bis 7,2 mit NaOH oder HCl | |
Tabelle 1: Assay Medium (AM5) Chemische Bestandteile des Puffers in Gewebepräparation verwendet..
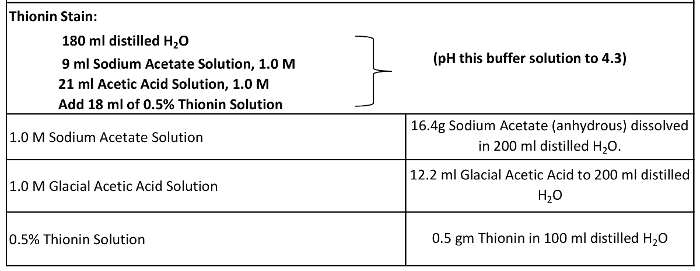
Tabelle 2:. Thionin Färbereagenzien Der Thionin - Farbstoff besteht aus destilliertem Wasser, 1,0 M Natriumacetat und 1,0 M Eisessig - Lösung auf einen pH - Wert von 4,3 vor der Zugabe einer 0,5% Thionin - Lösung titriert hergestellt.
| Tage nach Stichtag | |||||||||
| Stapel | fmol / g Frischgewicht | Ref Datum | 1 | 2 | 3 | 4 | 5 | ||
| Standard | nCi / mg | fmol / g | dpm / g | fmol / g | BFM / g | fmol / g | fmol / g | fmol / g | fmol / g |
| Nummer | 30-May | 30-May | 30-May | 30-May | 31-May | 1-Jun | 2-Juni | 3-Juni | 4-Juni |
| 1 | 9706 | 4463 | 21547320 | 4463 | 4411 | 4361 | 4311 | 4261 | 4212 |
| 2 | 5838 | 2684 | 12960360 | 2684 | 2653 | 2623 | 2593 | 2563 | 2533 |
| 3 | 2798 | 1286 | 6211560 | 1286 | 1272 | 1257 | 1243 | 1228 | 1214 |
| 4 | 1451 | 667 | 3221220 | 667 | 659 | 652 | 644 | 637 | 630 |
| 5 | 787 | 362 | 1747140 | 362 | 358 | 354 | 350 | 345 | 342 |
| 6 | 385 | 177 | 854700 | 177 | 174 | 173 | 171 | 169 | 167 |
Tabelle 3:. Täglich Decay Rate Berechnungen für Kalibrierstandards Eine tägliche Zerfallsrate - Tabelle für die Kalibrierungsstandards müssen anhand der Daten erstellt werden , auf dem das Experiment durchgeführt wurde. Diese Tabelle basiert auf der Geschwindigkeitskonstante erster Ordnung mit einer Halbwertszeit (t ½) von 60 Tagen. N = N 0 * e kt, wobei N die Konzentration von 125 I, zum Zeitpunkt t in Bezug auf die Konzentration , bei der Zeit 0 (N 0) = und k = ln2 / t 1/2.
| Paraventricularis Nucleous des Hypothalamus | ||||||
| Abschnitt | Ziel | Dichte-fmol / g | Scanbereich | Gesamtzielbereich | Gesamt* | |
| Gesamt | 1 | 996 | 4383 | 4383 | 996 | |
| Gesamt | 2 | 921 | 3362 | 3362 | 921 | |
| Gesamt | 3 | 818 | 3445 | 3445 | 818 | Spezifische Bindung |
| Gesamt | 4 | 710 | 2906 | 2906 | 710 | 967 |
| DURCHSCHNITTLICH | 861 | 3524 | 3524 | 861 | 895 | |
| 763 | ||||||
| Abschnitt | Ziel | Dichte-fmol / g | Scanbereich | Gesamtzielbereich | Unspezifische * | 678 |
| NSP | 1 | 53 | 3072 | 1737 | 30 | 826 |
| NSP | 2 | 52 | 2959 | 1455 | 26 | |
| NSP | 3 | 86 | 3180 | 2035 | 55 | |
| NSP | 4 | 53 | 3293 | 1.995 | 32 | |
| DURCHSCHNITTLICH | 61 | 3126 | 1,805.5 | 36 | ||
| Bed Nucleus des Zubehör Olfactory Tract | ||||||
| Abschnitt | Ziel | Dens-fmol / g | Scanbereich | Gesamtzielbereich | Gesamt* | |
| Gesamt | 1 | 439 | 3632 | 3632 | 439 | |
| Gesamt | 2 | 435 | 3632 | 3632 | 435 | |
| Gesamt | 3 | 355 | 3632 | 3620 | 354 | |
| Gesamt | 4 | 435 | 3632 | 3631 | 435 | Spezifische Bindung |
| Gesamt | 5 | 342 | 3632 | 3630 | 342 | 414 |
| Gesamt | 6 | 334 | 3632 | 3606 | 331 | 393 |
| DURCHSCHNITTLICH | 390 | 3632 | 3625 | 389 | 321 | |
| 394 | ||||||
| 315 | ||||||
| Abschnitt | Ziel | Dens-fmol / g | Scanbereich | Gesamtzielbereich | Unspezifische * | 320 |
| NSP | 1 | 49 | 3632 | 1.846 | 25 | 360 |
| NSP | 2 | 64 | 3632 | 2362 | 42 | |
| NSP | 3 | 53 | 3632 | 2275 | 33 | |
| NSP | 4 | 64 | 3632 | 2339 | 41 | |
| NSP | 5 | 51 | 3632 | 1.879 | 26 | |
| NSP | 6 | 41 | 3632 | 966 | 11 | |
| DURCHSCHNITTLICH | 54 | 3632 | 1.945 | 30 | ||
| * Gesamt und Nicht speciic sind Dichteeinheiten von fmol / g. | ||||||
| Total = Dichte * Gesamtzielbereich / Scan-Bereich | ||||||
| Unspezifische = Dichte * Gesamtzielbereich / Scan-Bereich | ||||||
| Gesamtzielbereich ist Pixel, die den Schwellenwert überschritten wird, eingestellt, wie nahe an 0,00 fmol / g wie möglich. | ||||||
| Pixel, die nicht mehr als die SchwelleWert erhalten einen Wert von 0 für die Beurteilung der Gesamtdichte. | ||||||
| Pixel nicht den Schwellenwert überschreitet erhalten einen Wert von 0 für die Beurteilung der Nicht-spezifische Dichte. | ||||||
| Spezifische Bindung ist die Gesamt minus Unspezifische als Dichteeinheiten von fmol / g ausgedrückt Bindung. | ||||||
Tabelle 4: Quantitative Analyse von paraventricularis Kern des Hypothalamus und Bett Kern der akzessorischen olfaktorischen Trakt Imaging Software exportiert die Daten als Tabelle in fmol / g, Scan - Bereich und die gesamte Zielbereich in Pixeln.. " Die nicht-spezifische" Bindung wird von 'total' abgezogen Bindung, um die spezifische AT 1 quantitative Bindung zu erhalten.
Diskussion
Das beschriebene Protokoll identifiziert die Visualisierung von "total" und "nicht-spezifische" Bindung des Radioliganden in benachbarten Abschnitten der koronalen Abschnitte eines Nagetier Gehirn zuvor geerntet und bei -80 ° C gelagert, und jedes Gewebe leicht auf praktisch sein kann, dass hat anatomisch Unterbauten, die Differential-Display Mengen an Rezeptoren oder Radioligand-Bindungsstellen aufgelöst. Die Verfahren im Protokoll beschrieben sind einfach und die Analyse ist entscheidend für die korrekte Interpretation der Ergebnisse. Die 20 & mgr; m Dicke wurde als optimal bestimmt wird; wenn der Abschnitt zu dick ist die unspezifische Bindung erhöht, so dass es schwierig ist, die Bindung des Radioliganden an sein Target zu lösen. Wenn der Abschnitt dünner geschnitten wird, wird es schwierig, erfolgreich zu schneiden und sequentieller Abschnitte ohne Verzerrung speichern. Die optimale Schnitttemperatur variiert leicht aufgrund der Art des Gewebes und der Dicke der Abschnitte und is in der Regel empirisch ermittelt. Sobald der Kontakt zwischen der Klinge und dem Gewebe hergestellt ist, kann die Ausrichtung der Probe überprüft und neu ausgerichtet, indem die Gewebeprobe bewegt zurück weg von der Klinge, und Neuausrichten der Befestigungskugel. Wenn ein Nagetier Gehirn Schneiden ist es wichtig, die linken und rechten Seite des Gehirns sind in den gleichen antero-posterior-Koordinaten, und die dorso-ventralen Achse senkrecht zu gewährleisten Atlanten auf häufig verwendete Gehirn. Slide-Sets werden in der Reihenfolge vorge markierten Studien über benachbarten Abschnitten von Gewebe zu leiten. Die ersten Sätze von 5 Folien sind gekennzeichnet 1-1, 1-2, 1-3, 1-4 und 1-5. Der erste Schnitt Abschnitt geht auf Folie 1-1 in der oberen linken Ecke (dies ist die rechte obere Ecke der Folie ist, wenn es vereist Seite nach unten); der zweite Schnitt Abschnitt geht auf Folie 1-2 usw. Der fünfte Schnitt Abschnitt 1-5 auf Folie geht. Der sechste Schnitt Abschnitt geht auf Folie 1-1 auf der linken Seite des ersten Abschnitts. Nachdem der erste Satz von Dias gefüllt ist, starten Sie einen weiteren Satz von 5 geschobenes markierte 2-1, 2-2, 2-3, 2-4 und 2-5. Dieser Zyklus wird so weit zurück in das Gehirn wie nötig fortgesetzt. Die "-4" und "-5" Objektträger werden als Backup aufbewahrt oder einen anderen Rezeptor radioaktiv zu markieren.
Die Rezeptor-Autoradiographie Protokoll hängt von dem Radioligand verwendet und die Eigenschaften der Rezeptoren befragt werden, um die Konzentrationen von Puffern, Salzen und Inhibitoren zu bestimmen. Zur Messung der AT1 - Subtyp des Ang - II - Rezeptoren in diesem Verfahren ein hochaffiner Jod-125 markiertem Liganden, 125 I-Sar 1 Ile 8 -Ang II (125 I-SI-Ang II); radiomarkierten von Robert C. Speth, Ph.D. (Peptid Radioiodierung Shared Resource, Georgetown University), die auch im Handel erhältlich ist) in AM5 Puffer (Tabelle 1) gelöst; ein Natriumphosphatpuffer mit Natriumchlorid, EDTA und Bacitracin. AM5 bietet einen guten Schutz des Radioliganden von Metallpeptidasen und Bacitracin empfindlichen peptidases einen physiologischen pH und NaCl-Konzentration Bereitstellen Bindungseigenschaften zu optimieren. Vorinkubation in AM5 macht die Gewebeschnitte Inhibitoren Peptidase Radioligand Abbau zu minimieren, und auch dissoziiert endogene Ang II von den Ang II-Rezeptoren. Losartan und PD123319, AT1R und AT2R Antagonisten jeweils sättigen, dass ihre Zielrezeptoren werden in Konzentrationen zugegeben (10 & mgr; M), um den Radioliganden von der Bindung an diese Rezeptoren zu verhindern bzw. zu beurteilen unspezifische Bindung und begrenzen spezifische, an den AT1-Rezeptor-Bindung. Die gewünschte Konzentration an 125 I-SI-Ang II für den Assay bestimmt wird , und die erforderliche Verdünnung der Stammlösung wird aus einer Tabelle des Radioisotops Abklingrate (siehe Protokoll Tabelle 3) ermittelt. Optimal eine Konzentration von Radioligand den K D annähert verwendet wird , die derzeit 50% der Rezeptoren besetzen würde. Da jedoch Radioliga kann teuer niedrigere Konzentrationen e sein.B. 10-20% der K D - Konzentration kann verwendet werden. Dies hat einen potentiellen Vorteil, das Signal-Rausch-Verhältnis zu erhöhen, indem nicht-spezifische Verringerung mehr als spezifische Bindungs binden. Allerdings sind längere Belichtungszeiten erforderlich, um ein Bild der Bindung zu entwickeln. Wie oben (Abschnitt 3.4) festgestellt, ob der erhaltene Belichtungs über- oder unterbelichtet ist, können die Objektträger in einen neuen Film für eine kürzere und / oder längere Zeit zu erreichen, um die gewünschte Belichtung erneut ausgesetzt werden.
Densitometrische Bildanalyse kann durch ein proprietäres Bilderzeugungssystem durchgeführt werden, der eine umfangreiche Kompendium der Anwendungen für die Autoradiographie sowie andere Anwendungen. Kalibrierungsstandards sind in fmol / g nasses Gewebe Gewicht (ein spezifisches Gewicht von einer für das Gewebe unter der Annahme). Jede Standard-Set zusammen mit einem Hintergrund wird eine Standardkurve zu erzeugen. Es gibt mehrere Kurvenanpassung Algorithmen mit und ohne Gewichtung zur Verfügung um eine Standardkurve aus der relativen optometrischer d zu erzeugen,ichte (ROD) Werte für die verschiedenen Kalibrierungsstandards. bietet keine relativen Fehlerwerte für die verschiedenen Standardkurven Auswahl der Kurve, die am besten die Daten repräsentiert wird empirisch als die Subroutine zur Kurvenanpassung durchgeführt. Bei UOVs bis ~ 0,6, ist die Standardkurve pseudolinear. Jedoch beginnt die Folie über diesen Punkt hinaus zu sättigen, eine Kurve bilden, die um 0,8 bis 0,9 Einheiten ROD Asymptoten. Wenn die Standards, die die Proben über 0,9 ROD Einheiten Klammerung, wird empfohlen, den Film für eine kürzere Zeitperiode erneut zu belichten zuverlässigere Werte fmol / g Bindung der Proben näher zu dem pseudolinear Bereich des Standards zu erhalten, Kurve. Werte in dieser Extrem der Standardkurve abgeleitet wird für wesentlich größere Unterschiede in Radioligand-Bindungs in kleine Unterschiede in ROD führen. Daraus ergibt sich die Möglichkeit, Änderungen in Bindung sinkt zu erfassen, wie der Film seinen Sättigungspunkt nähert.
Bei Messungen der spezifischen Regionen,empfohlenen Maßnahmen sind "Dichte" in fmol / g, 'Scan - Bereich "in Pixeln und' Total Zielgebiet 'in Pixel (Abbildung 9). Es ist wichtig , einen Schwellwert so nahe wie möglich bei Null (Abbildung 10) , weil Schwankungen der Filmdichte oder der beliebigen Aspekt der Standardkurve aus den Kalibrierungsstandards abgeleitet setzen manchmal Werte geben kann kleiner als Null ist . Wenn solche Werte für alle Pixel in der Scanbereich gemittelt würde es einen künstlich niedrigen Wert abzuleiten. Die Kriterien, Bereiche zu identifizieren, mit der Bindung kann sehr subjektiv sein, so ist es am besten, die Kontrolle und die experimentellen Gehirn so viel wie möglich zu eng koppeln die Häufigkeit von subjektiven Fehler zu reduzieren. Eine weitere Herausforderung besteht darin, zu entscheiden, wie viele Abschnitte im Durchschnitt eine letzte Lesung zu bekommen. Ein guter Indikator für die Abschnitte analysieren kann durch Anschluss an eine akzeptierte Rattenhirnatlas, zusammen mit den gefärbten Histologiepräparaten bestimmt werden. Die Größe des Abtastbereichs kann auch eine sein,Problem. Um zu kompensieren, kann eine Vorlage erstellt werden, für jede beliebige Größe Unstimmigkeiten zu korrigieren. Die Behandlung der Teile kann auch einen Bereich der Struktur beeinflussen, die hohe Bindungs hat und während der Analyse berücksichtigt werden. Dies erfordert eine alternative Nutzung des "Thresholding" Werkzeug im proprietären Abbildungssystem mit einem Dichteumfang von über einen beliebigen Wert zu setzen, um die anatomischen Merkmale des Gehirns Region darstellen wird innerhalb eines Sampling-Tool wie paraventricularis Kern des Hypothalamus abgetastet dass umfasst die Region von Interesse (Abbildung 11, Panel C). Es ist auch möglich, die Flächenmessung in die Bestimmung der Menge der Bindung aufzunehmen. Dies kann durch Multiplizieren des Wertes für den spezifischen Bindungs mal der Anzahl von Pixeln durchgeführt werden, die gemessen wurden. Pixel kann durch die Abbildung ein Lineal in zwei Ebenen oder ein Rechteck mit bekannten Abmessungen in metrische Einheiten umgewandelt werden. Die Anzahl der Pixel, die auf die entsprechenLänge oder Fläche des Rechtecks kann dann in metrischen Einheiten ausgedrückt werden. Bei 2.400 dpi Auflösung, ~ 9.000 Pixel = 1 mm 2 in unserem System.
Obwohl die Verwendung von radioaktiven Liganden ist nicht mehr eine weit verbreitete Technik; es ist eine der wenigen Möglichkeiten, um die physikalische Verteilung der Rezeptoren zu visualisieren in das Gewebe selbst als funktionelle (binden kann, seine angeborene Ligand) Proben. Zusätzlich kann es die Anzahl der Rezeptoren Quantifizieren Auswertung von Änderungen der funktionellen Rezeptor - Expression zwischen den Behandlungsgruppen, zwischen verschiedenen Gehirnregionen oder andere Strukturen, zwischen verschiedenen Stämmen von Tieren oder Tieren unterschiedlichen Alters zu ermöglichen usw. Alternative Verfahren zur Verfügung zu charakterisieren neuroanatomische Aspekte des AT 1 Rezeptorexpression, jedoch haben sie begrenztem Wert. In - situ - Hybridisierung von mRNA für AT 1 Rezeptoren entspricht nicht immer mit AT 1 Rezeptorexpression oder Verteilung in derGehirn. Während immunologischen Techniken Unterschiede in Rezeptorexpression approximieren kann auf die Intensität der Färbung von Gewebeschnitten basiert, ist es nicht möglich, eine Standardkurve für die Färbung zu erzeugen, für eine numerische Bestimmung der Rezeptor-Expression zu ermöglichen. Rezeptor-Autoradiographie liefert auch einen Grad an Spezifität für Rezeptoren (oder andere Ziele, die spezifisch Radioliganden binden), die keine immunologischen Techniken gewährleistet werden kann. Im Jahr 2009 wurden eine Reihe von Artikeln 37-43 veröffentlicht, die die Gültigkeit von 49 Antikörper in Frage gestellt , die 18 verschiedene G - Protein-gekoppelten Rezeptoren und einen transient receptor potential (TRP) Kanal zu beurteilen , werden verwendet. Im Wesentlichen markierte Antikörper identische Banden auf Western-Blots von Wildtyp und Knockout-Mäuse für die Rezeptoren in Frage. Anschließend wurden verschiedene Gruppen ähnliche Beobachtungen AT 1 und AT 2 - Rezeptor - Antikörper 44-49 im Handel erhältlich unter Verwendung gemacht. Die Verwendung eines bacterial künstlichen Chromosoms , die ein Reportermolekül erzeugt, beispielsweise grün fluoreszierendes Protein, angetrieben durch den AT 1 - Promotor ist ein indirektes Mittel , um die Anwesenheit oder Abwesenheit von AT - 1 - Rezeptor-exprimierenden Zellen in Maus - Bestimmung (aber nicht Ratte) Gehirnen basierend auf ihrer mit ein funktionelles AT 1 -Rezeptor - Promotor 50. Es ist möglich , "positive cells" in mikroskopisch identifiziert Hirnregionen zu zählen, nicht jedoch Änderungen in der Intensität der Expression des AT 1 -Rezeptor in diesen Regionen zu quantifizieren. So zu diesem Zeitpunkt die einzigen validierten Techniken, die direkt sind Ang II-Rezeptor-Expression messen Radioligand Bindungsmethoden zur Verfügung. Und wenn anatomische Auflösung von funktionellen AT 1 Rezeptorprotein auf einer mikroskopischen Ebene erforderlich ist, Rezeptor - Autoradiographie ist die einzige Technik für eine solche direkte Messung.
Rezeptor-Autoradiographie ist nicht ohne Einschränkungen. Der große concern ist, dass die Anforderungen erfüllt werden radioaktive Stoffe in einer Forschungseinrichtung zu verwenden. Es ist notwendig, ein Strahlungssicherheitsprogramm mit strengen Richtlinien an Ort und Stelle, um die Sicherheit von Forschern, die mit radioaktiven Stoffen und die sichere Anordnung der radioaktiven Materialien arbeiten zu gewährleisten. Dies eskaliert die Kosten der Forschung unter Verwendung von radioaktivem Material zu einem Punkt, dass ihre Verwendung in vielen Forschungs Einstellungen ausschließt. Zusätzlich können die Kosten für die Radioliganden erheblich sein. Somit wird ein Experiment Rezeptor-Autoradiographie, in dem eine große Anzahl von Objektträger angebrachten Gewebeschnitten in Behältern von Radioligand inkubiert werden können Hunderte verwenden, wenn nicht Tausende von Dollar an Radioligand. Eine weitere Einschränkung besteht darin, dass Gewebe vor gefroren werden muss auf einem Kryostat dem Schneiden für einen Zeitraum gelagert und schnell ausgespült und getrocknet nach Inkubation mit Radioliganden, von denen alle die Fähigkeit der Rezeptoren oder Protein von Interesse beeinträchtigt die Radioligand-Bindung . Für Liganden, die eine schnelle Arschereinigung / Dissoziationskinetik, kann es nicht möglich sein, die Bindung des Radioliganden an den Rezeptor während der Zeit wegzuspülen unspezifisch gebundene Radioligand erforderlich beizubehalten. Auch bei geringen Mengen an Radioligand lange Zeiträume Filmbelichtungs Bindung - einem Monat oder mehr - erforderlich sein, bevor eine meßbare Bild auf dem Film bilden kann. Eine weitere Herausforderung ist, dass die Zugabe von Jod-125 an einen Liganden die Fähigkeit des Liganden an seinen Zielrezeptor oder Protein zu binden, beeinträchtigen kann aufgrund sterischer Hinderung. Die Verwendung eines kleineren Moleküls, beispielsweise Tritium (3 H) beseitigt das Problem der sterischen Hinderung, aber Tritium hat eine solche niedrige Energie und niedrige spezifische Aktivität (bezogen auf Jod-125) , dass es extrem schwierig ist , ein Filmbild für die meisten zu erzeugen , Rezeptorpopulationen. Angesichts dieser Probleme gibt es viele Situationen, in denen Rezeptor-Autoradiographie nicht in der Lage ist, Rezeptoren oder andere molekulare Strukturen von Interesse zu identifizieren.
Trotz seiner limitations, Rezeptor - Autoradiographie spezifische Strukturen innerhalb eines Gewebes zu identifizieren, beispielsweise Hirnregionen in Reaktion auf experimentellen Variablen verändert im Vergleich zu einem normalen Kontroll Gehirn. Dieses Wissen kann helfen , die Rolle des AT 1 R für Ang II oder einem anderen Rezeptor oder Enzyme in der Pathologie der Krankheit zu bestimmen. Dieses Wissen hat wertvolle pharmakologische Auswirkungen, da es Bereiche für mögliche Therapien Ziel angibt.
Offenlegungen
Robert Speth has licensed antibodies to angiotensin II receptors to a commercial vendor and receives royalties from the sale of said antibodies. The other authors have nothing to disclose.
Danksagungen
This work was supported by NIH Grant HL-113905
Materialien
| Name | Company | Catalog Number | Comments |
| 500 ml Plastic Beakers | Fisher | 02-591-30 | |
| 24 mm x 60 mm Coverslips | Fisher | 22-050-25 | |
| Autoradiography Imaging Film 24 mm x 30 cm | Carestream-Biomax MR Film | 891-2560 | |
| Bacitracin (from Bacillus licheniformis) | Sigma | B-0125 | |
| Cardboard Sheet 8 x 11 | Crescent Illustration Board #201 | 201 | |
| Coplin Jars | Fisher Scientific | E94 | |
| Commercial hair dryers | Conair | Model SD6X | |
| Disposable Culture Tubes | Fisher | 14-961-26 | |
| EDTA (Disodium salt, Dihydrate) | USB Corporation | 15-699 | |
| Ethanol | Fisher | 16-100-210 | |
| Formulary Substitute for D-19 Developer | Photographers Formulary, Inc. | 01-0036 | |
| Glacial Acetic Acid | Fisher | A38 SI-212 | |
| Histoprep/OCT | Fisher | SH75-125D | |
| Film Fixer | Kodak | 5160320 | |
| Photo flo | Kodak | 1464502 | |
| Losartan | Fisher/Tocris | 37-985-0 | |
| MCID™ Core 7.0 | MCID | N/A | |
| NaCl | Fisher | S271 | |
| Peel-A-Way slide grips | VWR | 48440-003 | |
| Permount | Fisher | SP15-100 | |
| PD123319 | Fisher | 13-615-0 | |
| Premium Charged Slides, Fine Ground Edge | Premiere Microscope Slides | 9308W | |
| 125I Ligands | Perkin Elmer | NEX- 248 | |
| 125SI-Ang II | George Washington University | Radioiodinated by Dr. Speth | |
| Slide Mailers | Fisher Scientific | HS15986 | |
| Sodium Dibasic Phosphate Anhydrous (Na2PO4) | Fisher | RDCS0750500 | |
| Sodium Acetate (Anhydrous) | Fisher | BP333-500 | |
| Thionin | Fisher | T409-25 | |
| X-Ray Casette (10 x 12) | Spectronics Corporation | Four Square | |
| Xylene | Fisher | X3P-1GAL |
Referenzen
- Mozaffarian, D., et al. Heart disease and stroke statistics--2015 update: a report from the American Heart Association. Circulation. 131 (4), 29-322 (2015).
- Peart, W. S. The Renin-Angiotensin System. Pharmacol Rev. 17, 143-182 (1965).
- Ganten, D., et al. Angiotensin-forming enzyme in brain tissue. Science. 173 (3991), 64-65 (1971).
- Ganten, D., Fuxe, K., Phillips, M. I., Mann, J. F. E., Ganten, U., Ganong, W. F., Martini, L. . Frontiers in Neuroendocrinology. , 61-99 (1978).
- Fyhrquist, F., Metsarinne, K., Tikkanen, I. Role of angiotensin II in blood pressure regulation and in the pathophysiology of cardiovascular disorders. J Hum Hypertens. 9, 19-24 (1995).
- von Bohlenund und Halbach, O., Albrecht, D. The CNS renin-angiotensin system. Cell Tissue Res. 326 (2), 599-616 (2006).
- Speth, R., Giese, M. Update on the renin-angiotensin system. J Pharmacol Clin Toxicol. 1 (1), 1004 (2013).
- de Kloet, A. D., Liu, M., Rodriguez, V., Krause, E. G., Sumners, C. Role of neurons and glia in the CNS actions of the renin-angiotensin system in cardiovascular control. Am J Physiol Regul Integr Comp Physiol. , (2015).
- Saavedra, J. M., Sanchez-Lemus, E., Benicky, J. Blockade of brain angiotensin II AT1 receptors ameliorates stress, anxiety, brain inflammation and ischemia: Therapeutic implications. Psychoneuroendocrinology. 36 (1), 1-18 (2011).
- Stornetta, R. L., Hawelu-Johnson, C. L., Guyenet, P. G., Lynch, K. R. Astrocytes synthesize angiotensinogen in brain. Science. 242, 1444-1446 (1988).
- Li, W., Peng, H., Seth, D. M., Feng, Y. The Prorenin and (Pro)renin Receptor: New Players in the Brain Renin-Angiotensin System. Int.J.Hypertens. 2012, 290635 (2012).
- Strittmatter, S. M., Kapiloff, M. S., Snyder, S. H. [3H]captopril binding to membrane associated angiotensin converting enzyme. Biochem. Biophys. Res. Commun. 112, 1027-1033 (1983).
- Bild, W., Hritcu, L., Stefanescu, C., Ciobica, A. Inhibition of central angiotensin II enhances memory function and reduces oxidative stress status in rat hippocampus. Prog Neuropsychopharmacol Biol Psychiatry. 43, 79-88 (2013).
- Wright, J. W., Harding, J. W. Brain renin-angiotensin-A new look at an old system. Progress in Neurobiology. 95 (1), 49-67 (2011).
- Tashev, R., Stefanova, M. Hippocampal asymmetry in angiotensin II modulatory effects on learning and memory in rats. Acta Neurobiol Exp (Wars). 75 (1), 48-59 (2015).
- Reudelhuber, T. L. The continuing saga of the AT2 receptor: a case of the good, the bad, and the innocuous. Hypertension. 46 (6), 1261-1262 (2005).
- Carey, R. M. Cardiovascular and renal regulation by the angiotensin type 2 receptor: the AT2 receptor comes of age. Hypertension. 45 (5), 840-844 (2005).
- Valero-Esquitino, V., et al. Direct angiotensin type 2 receptor (AT2R) stimulation attenuates T-cell and microglia activation and prevents demyelination in experimental autoimmune encephalomyelitis in mice. Clin Sci (Lond). 128 (2), 95-109 (2015).
- Chen, J., et al. Neuronal over-expression of ACE2 protects brain from ischemia-induced damage. Neuropharmacology. 79, 550-558 (2014).
- Kalra, J., Prakash, A., Kumar, P., Majeed, A. B. Cerebroprotective effects of RAS inhibitors: Beyond their cardio-renal actions. J Renin Angiotensin Aldosterone Syst. , (2015).
- Zhao, Y., et al. Activation of intracellular angiotensin AT(2) receptors induces rapid cell death in human uterine leiomyosarcoma cells. Clin Sci (Lond). 128 (9), 567-578 (2015).
- Gehlert, D. R., Speth, R. C., Wamsley, J. K. Quantitative autoradiography of angiotensin II receptors in the SHR brain. Peptides. 7 (6), 1021-1027 (1986).
- Mendelsohn, F. A., Quirion, R., Saavedra, J. M., Aguilera, G., Catt, K. J. Autoradiographic localization of angiotensin II receptors in rat brain. Proc Natl Acad Sci U S A. 81 (5), 1575-1579 (1984).
- Gehlert, D. R., Speth, R. C., Wamsley, J. K. Autoradiographic localization of angiotensin II receptors in the rat brain and kidney. Eur J Pharmacol. 98 (1), 145-146 (1984).
- Speth, R. C., et al. Angiotensin II receptor localization in the canine CNS. Brain Res. 326 (1), 137-143 (1985).
- Santos, R. A. S., et al. Angiotensin-(1-7) is an endogenous ligand for the G protein-coupled receptor Mas. Proc Natl Acad Sci U S A. 100 (14), 8258-8263 (2003).
- Karamyan, V. T., Gembardt, F., Rabey, F. M., Walther, T., Speth, R. C. Characterization of the brain-specific non-AT(1), non-AT(2) angiotensin binding site in the mouse. Eur J Pharmacol. 590 (1-3), 87-92 (2008).
- Karamyan, V. T., Speth, R. C. Distribution of the non-AT1, non-AT2 angiotensin-binding site in the rat brain: preliminary characterization. Neuroendocrinology. 88 (4), 256-265 (2008).
- Karamyan, V. T., Stockmeier, C. A., Speth, R. C. Human brain contains a novel non-AT1, non-AT2 binding site for active angiotensin peptides. Life Sci. 83 (11-12), 421-425 (2008).
- Miller-Wing, A. V., et al. Central angiotensin IV binding sites: distribution and specificity in guinea pig brain. J Pharmacol Exp Ther. 266 (3), 1718-1726 (1993).
- Castren, E., Kurihara, M., Saavedra, J. M. Autoradiographic localization and characterization of angiotensin II binding sites in the spleen of rats and mice. Peptides. 8 (4), 737-742 (1987).
- MacGregor, D. P., et al. Angiotensin II receptor subtypes in the human central nervous system. Brain Res. 675 (1-2), 231-240 (1995).
- Plunkett, L. M., Correa, F. M. A., Saavedra, J. M. Quantitative autoradiographic determination of angiotensin-converting enzyme binding in rat pituitary and adrenal glands with 125I-351/A, a specific inhibitor. Regul Pept. 12, 263-272 (1985).
- Armando, I., et al. Increased angiotensin II AT(1) receptor expression in paraventricular nucleus and hypothalamic-pituitary-adrenal axis stimulation in AT(2) receptor gene disrupted mice. Neuroendocrinology. 76 (3), 137-147 (2002).
- Speth, R. C., Harding, J. W., Wang, D. H. . Angiotensin Protocols Vol. 51 Methods in Molecular Medicine. , 275-295 (2001).
- Widdop, R. E., Jones, E. S., Hannan, R. E., Gaspari, T. A. Angiotensin AT2 receptors: cardiovascular hope or hype. Br J Pharmacol. 140 (5), 809-824 (2003).
- Michel, M. C., Wieland, T., Tsujimoto, G. How reliable are G-protein-coupled receptor antibodies. Naunyn Schmiedebergs Arch.Pharmacol. 379 (4), 385-388 (2009).
- Jensen, B. C., Swigart, P. M., Simpson, P. C. Ten commercial antibodies for alpha-1-adrenergic receptor subtypes are nonspecific. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 409-412 (2009).
- Jositsch, G., et al. Suitability of muscarinic acetylcholine receptor antibodies for immunohistochemistry evaluated on tissue sections of receptor gene-deficient mice. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 389-395 (2009).
- Hamdani, N., van der Velden, J. Lack of specificity of antibodies directed against human beta-adrenergic receptors. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 403-407 (2009).
- Bodei, S., Arrighi, N., Spano, P., Sigala, S. Should we be cautious on the use of commercially available antibodies to dopamine receptors. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 413-415 (2009).
- Lu, X., Bartfai, T. Analyzing the validity of GalR1 and GalR2 antibodies using knockout mice. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 417-420 (2009).
- Everaerts, W., et al. Where is TRPV1 expressed in the bladder, do we see the real channel. Naunyn Schmiedebergs Arch Pharmacol. 379 (4), 421-425 (2009).
- Adams, J. M., McCarthy, J. J., Stocker, S. D. Excess dietary salt alters angiotensinergic regulation of neurons in the rostral ventrolateral medulla. Hypertension. 52 (5), 932-937 (2008).
- Herrera, M., Sparks, M. A., Alfonso-Pecchio, A. R., Harrison-Bernard, L. M., Coffman, T. M. Lack of specificity of commercial antibodies leads to misidentification of Angiotensin type 1 receptor protein. Hypertension. 61 (1), 253-258 (2013).
- Rateri, D. L., et al. Endothelial Cell-Specific Deficiency of Ang II Type 1a Receptors Attenuates Ang II-Induced Ascending Aortic Aneurysms in LDL Receptor(-/-) Mice. Circ Res. 108 (5), 574-583 (2011).
- Benicky, J., Hafko, R., Sanchez-Lemus, E., Aguilera, G., Saavedra, J. M. Six Commercially Available Angiotensin II AT(1) Receptor Antibodies are Non-specific. Cell Mol Neurobiol. 32 (8), 1353-1365 (2012).
- Elliott, K. J., Kimura, K., Eguchi, S. Lack of specificity of commercial antibodies leads to misidentification of angiotensin type-1 receptor protein. Hypertension. 61 (4), 31 (2013).
- Hafko, R., et al. Commercially available angiotensin II At(2) receptor antibodies are nonspecific. PLoS One. 8 (7), 69234 (2013).
- Gonzalez, A. D., et al. Distribution of angiotensin type 1a receptor-containing cells in the brains of bacterial artificial chromosome transgenic mice. Neuroscience. 226, 489-509 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten