Method Article
Un hidrogel Construct y fibrina enfoque basado Pegamento para ofrecer Terapéutica en un infarto de miocardio modelo murino.
En este artículo
Resumen
This protocol aims to alleviate the limitation of poor cell engraftment for stem cell treatment of myocardial infarctions through the use of a hydrogel system and a fibrin-based glue. With this approach, cell-to-tissue contact post-infarction can be maintained, increasing the therapeutic potential of beneficial agents at the site of injury.
Resumen
The murine MI model is widely recognized in the field of cardiovascular disease, and has consistently been used as a first step to test the efficacy of treatments in vivo1. The traditional, established protocol has been further fine-tuned to minimize the damage to the animal. Notably, the pectoral muscle layers are teased away rather than simply cut, and the thoracotomy is approached intercostally as opposed to breaking the ribs in a sternotomy, preserving the integrity of the ribcage. With these changes, the overall stress on the animal is decreased.
Stem cell therapies aimed to alleviate the damage caused by MIs have shown promise over the years for their pro-angiogenic and anti-apoptotic benefits. Current approaches of delivering cells to the heart surface typically involve the injection of the cells either near the damaged site, within a coronary artery, or into the peripheral blood stream2-4. While the cells have proven to home to the damaged myocardium, functionality is limited by their poor engraftment at the site of injury, resulting in diffusion into the blood stream5. This manuscript highlights a procedure that overcomes this obstacle with the use of a cell-encapsulated hydrogel patch. The patch is fabricated prior to the surgical procedure and is placed on the injured myocardium immediately following the occlusion of the left coronary artery. To adhere the patch in place, biocompatible external fibrin glue is placed directly on top of the patch, allowing for it to dry to both the patch and the heart surface. This approach provides a novel adhesion method for the application of a delicate cell-encapsulating therapeutic construct.
Introducción
Un infarto de miocardio (MI) se define como la interrupción de la sangre a una región del corazón causada por la oclusión de una arteria coronaria principal. El daño resultante de un MI es debido a la remodelación del tejido cardiaco viable en el tejido de la cicatriz no funcional, lo que disminuye la capacidad del corazón o, más específicamente, el ventrículo izquierdo, a latir correctamente. Esto resulta en una disminución en el volumen de sangre que se puede entregar al cuerpo con cada latido del corazón, conocido como el volumen de carrera, y el porcentaje de sangre que se bombea fuera del corazón con cada latido del corazón, conocida como la fracción de eyección 6. Estos, junto con otras funciones disminuido, aumenta la tensión en el resto del corazón para mantener la función adecuada. A menudo, este aumento de la tensión puede llegar a ser tan grave que provoca un segundo ataque al corazón, un fenómeno visto en aproximadamente el 10% de los individuos 7.
Mientras que las prácticas médicas han evolucionado para tratarInmediatamente después de un infarto de miocardio, ninguna técnica ha sido desarrollada para detener, lento o revertir los efectos secundarios negativos de la remodelación de tejidos. Terapias con células madre han surgido como una posible vía para un tratamiento de este tipo, sin embargo, a pesar de su prometedor potencial, las células madre no han demostrado su eficacia en el ámbito clínico. Una teoría para sus deficiencias es la incapacidad para asegurar las células beneficiosos permanecen en el sitio de miocardio tiempo suficiente para generar resultados favorables 5. Se ha demostrado que no más del 24% de las células que simplemente se inyecta en el lugar de miocardio sobrevivió y se mantuvo en el sitio 1 día después de la entrega dañado 2. Una posible perspectiva para abordar este problema de la retención de células es el desarrollo de sistemas de hidrogel biocompatible que encapsulan cualquiera de las células o la terapéutica, que pueden ser entregados al sitio dañado. El hidrogel de elección en este protocolo es un poli (etilenglicol) dimetacrilato debido a su uso anterior en pr encapsulación de célulasocedures, sin embargo, cualquier hidrogel capaz de encapsulación se puede utilizar 8. La entrega del parche directamente al sitio de la lesión asegura el contacto de célula a tejido durante un período prolongado de tiempo, el aumento de la longitud de tiempo, las células pueden proporcionar factores beneficiosos para el miocardio subyacente.
Un cuello de botella para el enfoque de parche es la dificultad de adherir el parche a la superficie del corazón. Muchos grupos han superado este a través de una variedad de técnicas, la más prevalente ser una sutura simple de atar el constructo a la superficie del corazón 9,10. Esto ha demostrado ser exitosa en una serie de casos en los que el constructo está hecha de un material más rígido, pero falla cuando intento en un sistema de hidrogel, debido a la alta concentración de agua y delicada naturaleza de la construcción de parche. Para superar esto, hemos utilizado un sistema de adhesivo externa pegamento de fibrina que imita la química de la formación de coágulos. El pegamento de fibrina se ha utilizado en numerosas cirugías Medical, IncLuding lágrimas Dura, fístulas bronquiales, y trasplante de córnea, destacando la biocompatibilidad del producto como un sellador herida 11-13. Además, la fibrina se ha utilizado para una variedad de propósitos cardíacas, incluyendo el tratamiento quirúrgico de las rupturas del ventrículo izquierdo y cirugías de bypass de arteria coronaria, sin embargo, su uso como un pegamento de adherencia para un parche cardíaco no se usa comúnmente 14-17. Una formulación sencilla de trombina y fibrinógeno resultados en una cola biocompatible que se puede colocar directamente en el exterior de un parche cardíaco externo, proporcionando un sistema de adhesión viable para asegurar el parche a la interacción corazón.
Protocolo
Procedimiento está en plena compatibilidad con número de protocolo IACUC 13.302 y ha sido aprobado por la división de los recursos animales.
1. Preparación de instrumentos
- Autoclave todos los instrumentos no desechables utilizados antes del procedimiento quirúrgico para garantizar la esterilidad.
- Esterilizar los instrumentos utilizados varias veces en una sesión con un esterilizador de cuentas de cristal entre usos.
2. Preparación de hidrogel
- Descongele y células madre placa al menos 24 horas antes de la creación de la construcción de hidrogel.
- Preparar parches un día antes de la intervención quirúrgica utilizando un aparato de estereolitografía (o instrumento similar) que se ha descrito con todo detalle en publicaciones anteriores 8,18.
- Para crear el hidrogel, primero generar un modelo de diseño asistido por ordenador (CAD) del parche deseado y exportar el diseño a formato estereolitográfico (STL).
- Crear una solución de pre-gel mediante dissolving poli (etilenglicol) dimetacrilato (PEGDMA) en 1X PBS estéril para obtener un 20% w solución / v. Al mismo tiempo, disolver el fotoiniciador 1- [4- (2-hidroxi-etoxi) -fenil] -2-hidroxi-2-metil-1-propano-1-ona en DMSO. Añadir el fotoiniciador a la solución PEGDMA en una final w / v de 0,5%. Directamente antes de la reticulación, añadir 100 ml de la densidad deseada de las células. Nota: Una densidad celular entre 2,0 x 10 5 -2,0 x 10 6 células se recomienda / ml.
- Pipetear la solución de pre-gel en un plato en el centro de la plataforma de SLA y ejecutar el software SLA con el diseño STL formateado previamente cargado.
- Retire los parches desde el aparato e incubar los hidrogeles O / N en medio de Dulbecco modificado por Eagle (DMEM) suplementado con 5% de suero bovino fetal (FBS), 100 U / ml de penicilina, y 100 mg / ml de estreptomicina para permitir células para ajustar al medio ambiente dentro del parche.
3. Animal Preparación y intubati Oralen
- Evaluar cada ratón antes del procedimiento para asegurarse de que el animal se encuentra en buen estado de salud, según se determina a partir de sus hábitos de aseo e interacciones con sus compañeros de jaula. Nota: Mujer 8-10 semanas de edad C57BL / 6J se utilizaron para este procedimiento, sin embargo, cualquier edad ratón o tipo pueden ser utilizados.
- Coloque los animales en una cámara anestésica y exponer a 5% isofluorano con un soporte 1 L / min O 2. Vigilar el nivel de anestesia por reflejo pizca dedo del pie.
- Una vez que el animal está anestesiado adecuadamente, pesar y colocarlos en el stand de la intubación.
- Dirigir una fuente de luz hacia la cavidad del pecho del animal y el uso de fórceps para retraer la superficie de laringe y exponer las cuerdas vocales. Guiar con cuidado un G angiocath 20 entre las cuerdas vocales, y suavemente inserte en la tráquea. Detectar la inserción apropiada por un movimiento mecánico de la cavidad del pecho una vez que el catéter se conecta a la pequeña ventilador animal.
- Ajustar la configuración de ventilación a the peso del animal en base a las instrucciones del fabricante.
- Una vez intubado, coloque el animal en posición supina sobre una almohadilla térmica para evitar la hipotermia. Asegúrese de que la almohadilla térmica no exceda los 40 ° C. Si es necesario, colocar una barrera entre el animal y la almohadilla de calefacción para minimizar la posibilidad de quemaduras.
- Retire el cabello del sitio quirúrgico a través del uso de una crema depilatoria. Esterilizar el sitio por 3 matorrales alternas de betadine y etanol al 75% para asegurar una correcta esterilización. Coloque un paño para exponer sólo el lugar de la cirugía, y coloque un ungüento veterinario en los ojos para evitar la sequedad durante el procedimiento.
4. Procedimiento Quirúrgico
- La toracotomía se realiza en el lado izquierdo del animal, por lo tanto, hacer una incisión en la piel de aproximadamente 1 cm a la izquierda del esternón, que corre a lo largo del esternón.
- El uso de fórceps para separar la capa muscular de la caja torácica subyacente en dos pasos. Observar un delineCIONES línea que representa el pectoral mayor músculos del animal. Levante este músculo ligeramente, separarla del músculo oblicuo externo subyacente y retraer medialmente. A continuación, liberar el músculo oblicuo externo de la caja torácica subyacente de la misma manera, y retraer lateralmente, proporcionando una vista despejada de las segunda, tercera y cuarta costillas.
- Realice la toracotomía entre las tercera y cuarta costillas. Levantar suavemente la cuarta costilla y utilizar un cauterizador para abrir la cavidad torácica entre las costillas tercera y cuarta. Coloque retractores para abrir aún más la cavidad y exponer el corazón.
- El uso de fórceps para romper la delgada pericardio del corazón.
- Ligar la arteria coronaria izquierda con una sutura de nylon monofilamento 8-0. Coloque la sutura aproximadamente 4 mm desde el vértice del corazón, directamente debajo de la punta inferior de la aurícula izquierda. Determinar la colocación de sutura adecuada por un blanqueo del miocardio ventricular y un aumento en el tamaño de la aurícula izquierda después de la suture se ha atado.
5. Colocación de parches y pegamento
- Mantenga los parches a 37 ° C y 5% de CO 2 condiciones hasta su uso.
- Levante suavemente el parche usando una espátula de extremo plano y suavemente colocarlo en la superficie del corazón, en el sitio de miocardio.
Nota: Para evitar que se salga el ventrículo izquierdo, el parche puede ser mantenido en su lugar por el mantenimiento de la ligera contacto utilizando la espátula o la punta de un par de pinzas. - Preparar el pegamento mezclando una proporción de 4: 1 de fibrinógeno a trombina. Mezclar la solución mediante pipeteo repetido hasta que empiece a espesar, generalmente dentro de 1 min después del comienzo de la preparación.
- Una vez que la viscosidad de la solución alcanza el nivel deseado, transferir rápidamente aproximadamente 10 ml a la superficie del parche. Nota: El tiempo de coagulación de la cola de fibrina es rápida, proporcionando una pequeña ventana de oportunidad para la transferencia eficiente de la cola.
6. La sutura
- Realizar todas las suturas de cierre utilizando una sutura de nylon monofilamento 6-0.
- Cierre la capa de costilla con tres y cincuenta y siete suturas interrumpidas individuales.
- Antes del cierre completo de la capa intercostal, insertar una cánula PE-10 en la incisión para evacuar la cavidad del pecho después del cierre es completo y restablecer la presión intrapleural adecuada.
- Cierre los músculos pectorales con tres y cincuenta y siete suturas interrumpidas individuales.
- Sellar la capa de la piel con una sutura continua.
- Tras el cierre completo, adjunte una jeringa 1,0 ml hasta el final de la cánula y utilizarla para evacuar la cavidad torácica.
- Aplicar un adhesivo de tejido para el sitio de la incisión para reforzar el sitio de sutura.
Tratamiento 7. Post-quirúrgica
- Dé ratones una inyección de buprenorfina (0,05-1,0 mg / kg) y carprofeno (2,2 mg / kg) por vía subcutánea inmediatamente después de la ligadura coronaria y menos 20 min antes de la reactivación. Administrar ambos fármacos 6-8 hr después de la cirugía, Y luego dar dos veces al día durante un máximo de tres días para controlar el dolor y la angustia.
- Continuamente monitorear los animales hasta consciente y cada hora durante la primera después de la cirugía de 4 horas. Realizar un segundo chequeo de la noche de la cirugía (2-4 horas más tarde) para administrar una segunda dosis de analgésico.
- Monitorear los animales todos los días después de que el segundo día después del procedimiento, hasta que los animales parecen estables.
8. Análisis de la función del corazón y de Histología
- Realizar ecocardiografías en los ratones 4 semanas siguiendo el procedimiento para determinar la extensión del daño después de la MI.
- Anestesiar ratones con 4-5% isoflurano dentro de una cámara de anestesia para la inducción de la anestesia de inhalación, y luego 2% de isoflurano a través de mascarilla para el mantenimiento de la anestesia.
- Despeje el área de imagen con una crema depilatoria y utilizar un pequeño animal de ultrasonido para obtener una exploración ecocardiografía en modo M 2D del corazón que late y registrar los parámetros asso funcionalciados con él.
- La eutanasia a los ratones en una cámara de dióxido de carbono, a continuación, recoger los corazones de los animales y el lugar en una solución de formalina al 10% durante 24 horas. Después de 24 horas, la transferencia de los corazones de etanol al 70% y mantener a 4 ° C hasta el procesamiento de tejidos.
- Procesar los corazones y les incrustar en bloques de parafina.
- Cortar 5 mm secciones a través de la región ventricular del corazón, comenzando en el vértice y que termina en el atrio.
- Manchas seccionó rebanadas con tanto tricrómico de Masson y hematoxilina y eosina utilizando protocolos estándar.
Resultados
Durante el procedimiento quirúrgico, la ligadura de la arteria coronaria izquierda se puede identificar por un marcado blanqueo de aguas abajo de la arteria ocluida. Como una prueba antes de atar el nudo, la sutura se puede apretar brevemente para comprobar si está en el lugar apropiado. Adicionalmente, puesto que la oclusión de los resultados de la arteria en disminución casi instantánea en la capacidad de la aurícula izquierda a latir correctamente, la aurícula izquierda se agrandará en respuesta a un reflujo de sangre en el sistema.
Mediciones de ecocardiografía en modo M toman ya a los 2 días post-infarto muestran un cese del movimiento de la pared izquierda, indicativo de la reconstrucción muscular. Cálculos cualitativos realizados a partir de los datos muestran una disminución en la fracción de eyección y el volumen sistólico en los corazones infartados. A la terminación del experimento, cuando se recogen los corazones para fines histológicos, una dilatación clara del ventrículo izquierdo se puede ver, junto con un adelgazamiento de la ventricular izquierdapared, y la deposición de colágeno que denota la deposición de tejido de cicatriz en su lugar de funcionamiento de los cardiomiocitos (Figura 1).
También se ve en el análisis histológico es la presencia del hidrogel construir gracias a la administración del gel de fibrina (Figura 2). Para nuestros propósitos, el sistema adhesivo debe ser suficiente para permitir el control de la colocación precisa y minimizar posterior escurrimiento hacia los órganos circundantes viscoso, pero no lo suficientemente maleable para interferir con la función del corazón. Se realizaron pruebas preliminares para calcular la viscosidad, tiempo de gelificación, y la rigidez de diversas relaciones de fibrinógeno / trombina, a fin de determinar la combinación adecuada que se adapte a nuestras necesidades. Se realizó el análisis in vivo para probar la capacidad de la cola de fibrina para mantener patch- -adhesión al tejido al tiempo que permite la función del corazón completo (datos no mostrados). Cabe señalar que el adhesivo de fibrina no dañó el miocardio, como lo demuestra el lack de remodelación tisular o adelgazamiento ventricular en el sitio (Figura 2). Los cardiomiocitos se mantienen intactos a pesar de la adición de los dos un parche cardiaco y su cola que acompaña. Además, las pruebas de viabilidad confirmó que que la administración de pegamento de fibrina a la superficie externa de un parche de hidrogel de células que encapsula no afectó la supervivencia celular dentro del parche (Figura 3).
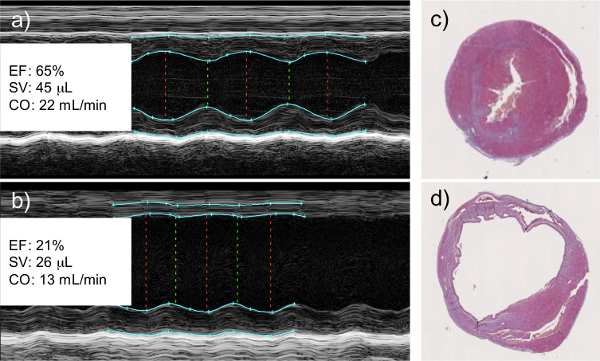
Figura 1:. Coronaria izquierda ligadura de la arteria como resultado una disminución de la función cardíaca, medida por ecocardiografía modo M ecocardiografía de sanos (a) y infartados (b) corazones. Corazones infartados muestran una clara falta de movimiento de la pared donde el tejido viable ha sido reemplazado por tejido cicatricial. Esto se correlaciona con una disminución medible en la fracción de eyección del ventrículo izquierdo (FE), derrame cerebral cardiacavolumen (SV), y el gasto cardíaco (CO). El análisis histológico de saludable (c) y (d) infartados corazones muestra la dilatación del ventrículo izquierdo y el adelgazamiento de la pared ventricular izquierda del miocardio infartado, ambos signos de remodelación de tejidos y deposición de tejido de cicatriz. Imágenes histológicas son rebanadas de sección transversal que capturan la (cámara más pequeña) ventrículos derecho e izquierdo (cámara más grande) y.
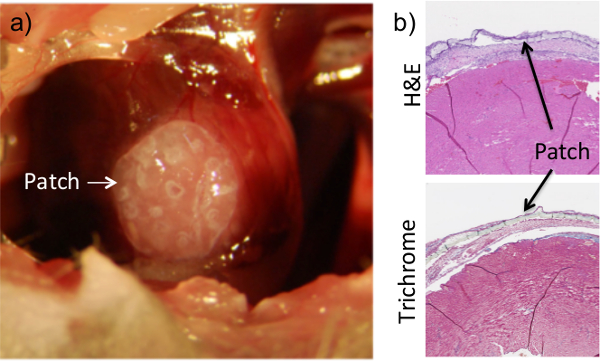
Figura 2:. Aplicación de fibrina Flue Asegura Patch Adhesión al Corazón El parche se coloca sobre la superficie del corazón mientras que la cavidad torácica se expone durante el procedimiento (a). Una vez colocado, se añade una cola a base de fibrina en la parte superior del corazón y se deja secar. El parche se puede ver claramente en las secciones histológicas del tejido del corazón que se recogieron en 1 semana después del procedimiento (b).La disociación del parche de la superficie del corazón en imágenes histológicas es un artefacto del proceso de recolección y seccionamiento. Los resultados son consistentes para un máximo de 8 semanas de la adhesión.

Figura 3: pegamento a base de fibrina no daña los tejidos encapsulados La viabilidad celular se midió mediante el análisis MTT 1 semana después de la administración de un pegamento a base de fibrina usando protocolos descritos en detalle en publicaciones anteriores 8.. La viabilidad de las células dentro del parche no se vio afectada por la adición de la cola a la superficie de la construcción.
Discusión
Con este enfoque para el modelo murino MI, hemos desarrollado un sistema que minimiza el daño a las áreas no miocardio que se asocian con otras técnicas de MI murinos. Estas áreas incluyen los daños causados por una traqueotomía, el corte de la capa muscular, y la rotura de costillas para exponer la cavidad torácica. Creemos que estos cambios mejoran el resultado global gracias quirúrgicos para el cuidado de mantener la mayor cantidad de las principales estructuras, incluyendo las costillas y las capas musculares, intacta durante el procedimiento quirúrgico.
Cabe señalar que existen algunas limitaciones a esta técnica, con la más grande es su naturaleza consume mucho tiempo, resultando en sólo 8-10 procedimientos quirúrgicos completos en un día. Para superar esto, un segundo ventilador se puede utilizar, lo que permite el procedimiento para llevarse a cabo en dos animales al mismo tiempo. Además, los grandes vasos, tales como los vasos intercostales yinterior de la arteria torácica, se debe evitar cuando se realiza la toracotomía. Si cerca de uno de estos vasos, un cauterizador se debe utilizar para prevenir el sangrado debido a la ruptura de una arteria.
El pegamento de fibrina se conoce tanto en el laboratorio y entornos clínicos gracias a su capacidad para ayudar rápidamente en la formación del coágulo, así como su potencial para entregar y MSCs anfitrionas 14-17,19. Para nuestros propósitos, cola de fibrina sirve como un enfoque biocompatible para adherir un hidrogel a base de agua construir a la superficie del corazón. El uso de un pegamento a base de fibrina ha demostrado éxito en mantener el constructo de hidrogel en el sitio dañado para un máximo de 8 semanas, con la posibilidad de contacto con el tejido de una cantidad de tiempo más largo. El uso de este sistema de adhesión permitió el control para la colocación de la delicada constructo sin la necesidad de suturas adicionales que dañan el miocardio, así como el propio constructo. Hemos encontrado que el propio pegamento no es tóxico para las células encapsuladas unand no afecta negativamente al tejido subyacente. El hidrogel y el sistema de pegamento a base de fibrina se pueden aplicar a una variedad de otros fines de ingeniería de tejidos que desean célula o el contacto terapéutico durante un período prolongado de tiempo. Además, con el uso del método de fabricación de SLA, diseños y estructuras pueden ser incorporados dentro del parche para crear un sistema más complejo para la entrega celular 18.
Un revés para el uso de la cola a base de fibrina es el hecho de que más de un investigador debe estar presente en la sala quirúrgica durante la colocación de parches y la adición de pegamento. Es el trabajo del primer investigador para asegurarse de que el parche se mantiene en su lugar y no se pierda en la cavidad torácica, mientras que el segundo investigador se mezcla la solución y lo aplica al parche después de alcanzar la viscosidad adecuada. Para optimizar la sincronización de la entrega de pegamento, se sugiere que el segundo investigador también pone a prueba y los tiempos de la gelificación de la cola antes de la colocación de parches,desde la gelificación adecuada de la cola es crítico para la adhesión del parche.
Hay una serie de pasos críticos y áreas propensas a error en el protocolo, con la primera es la inducción del infarto de miocardio. Es imprescindible verificar si hay signos, como el escaldado de la pared del ventrículo izquierdo y la ampliación de la aurícula izquierda, para garantizar la oclusión de la arteria coronaria izquierda. Esto se puede hacer antes de la adición de la puntada con sólo cruzar y apretando el extremo de las cuerdas de sutura. Si se determina que la arteria coronaria izquierda no está encerrada por la sutura, la cadena se puede sacar y volver a aplicar. Una segunda medida importante es seguir vigilando el tubo de intubación durante todo el procedimiento, para asegurar que se mantiene dentro de la tráquea y no se salgan mediados de la cirugía. Por último, a lo largo de la cirugía, se deben hacer todos los intentos de evitar el contacto con los pulmones, ya que cualquier contacto tiene el potencial de conducir a un colapso pulmonar.Si, durante la cirugía, el colapso pulmonar se produce, simplemente bloquear el tubo de salida de la intubador para un máximo de 3 seg en un intento de volver a inflar las regiones con problemas de los pulmones.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
Este trabajo fue financiado por los EEUU Grant Ejército (W81XWH-08-1-0701) y una beca del Hospital Carle Fundación.
Materiales
| Name | Company | Catalog Number | Comments |
| Harvard Model 687 Mouse Ventilator | Harvard Apparatus | 55-0001 | |
| Inintech Biosciences LLC Dry Glass Bead Sterilizer | Fisher Scientific | NC9531961 | |
| Leica MZ6 surgical microscope | Leica | ||
| Cautery Kit | Gemini | GEM 5917 | |
| Delicate Forceps - 0.4 mm Tips Angled | Fine Science Tools | 11063-07 | |
| Agricola Retractor - 3.5 cm Spread | Fine Science Tools | 17005-04 | |
| Spring Scissors - 2.5 mm Blades Straight | Fine Science Tools | 15000-08 | |
| Castroviejo Needle Holder - w/Lock Tungsten Carbide 14 cm | Fine Science Tools | 12565-14 | |
| Iris Scissors - Delicate Straight 10.5 cm | Fine Science Tools | 14060-10 | |
| 8-0 monofilament suture | Ethicon | 8730P | |
| 6-0 Silk suture | Ethicon | 639G | |
| Thrombin | Sigma | T7009 | |
| Fibrinogen | Sigma | F3879 | |
| Vetbond Tissue Adhesive | 3M | 1469SB |
Referencias
- Kolk, M. V., et al. LAD-ligation: a murine model of myocardial infarction. Journal of visualized experiments : JoVE. , (2009).
- Li, Y., Yao, Y., Sheng, Z., Yang, Y., Ma, G. Dual-modal tracking of transplanted mesenchymal stem cells after myocardial infarction. International journal of nanomedicine. 6, 815-823 (2011).
- Nagaya, N., et al. Intravenous administration of mesenchymal stem cells improves cardiac function in rats with acute myocardial infarction through angiogenesis and myogenesis. American journal of physiology. Heart and circulatory physiology. 287, H2670-H2676 (2004).
- Wang, J. S., Shum-Tim, D., Chedrawy, E., Chiu, R. C. The coronary delivery of marrow stromal cells for myocardial regeneration: pathophysiologic and therapeutic implications. The Journal of thoracic and cardiovascular surgery. 122, 699-705 (2001).
- Cashman, T. J., Gouon-Evans, V., Costa, K. D. Mesenchymal stem cells for cardiac therapy: practical challenges and potential mechanisms. Stem cell reviews. 9, 254-265 (2013).
- Sutton, M. G., Sharpe, N. Left ventricular remodeling after myocardial infarction: pathophysiology and therapy. Circulation. 101, 2981-2988 (2000).
- Smolina, K., Wright, F. L., Rayner, M., Goldacre, M. J. Long-term survival and recurrence after acute myocardial infarction in England, 2004 to 2010. Circulation. Cardiovascular quality and outcomes. 5, 532-540 (2012).
- Chan, V., Zorlutuna, P., Jeong, J. H., Kong, H., Bashir, R. Three-dimensional photopatterning of hydrogels using stereolithography for long-term cell encapsulation. Lab on a chip. 10, 2062-2070 (2010).
- Kai, D., et al. Stem cell-loaded nanofibrous patch promotes the regeneration of infarcted myocardium with functional improvement in rat model. Acta biomaterialia. 10, 2727-2738 (2014).
- Serpooshan, V., et al. The effect of bioengineered acellular collagen patch on cardiac remodeling and ventricular function post myocardial infarction. Biomaterials. 34, 9048-9055 (2013).
- Cavallo, L. M., Solari, D., Somma, T., Savic, D., Cappabianca, P. The Awake Endoscope-Guided Sealant Technique with Fibrin Glue in the Treatment of Postoperative Cerebrospinal Fluid Leak After Extended Transsphenoidal Surgery: Technical Note. World neurosurgery. , (2013).
- Chung, H. W., Mehta, J. S. Fibrin glue for Gundersen flap surgery. Clinical Ophthalmology. 7, 479-484 (2013).
- Dunn, C. J., Goa, K. L. Fibrin sealant: a review of its use in surgery and endoscopy. Drugs. 58, 863-886 (1999).
- Chi, N. H., et al. Cardiac repair achieved by bone marrow mesenchymal stem cells/silk fibroin/hyaluronic acid patches in a rat of myocardial infarction model. Biomaterials. 33, 5541-5551 (2012).
- Erb, M. A., Claus, T., Hartrumpf, M., Bachmann, S., Albes, J. M. The use of Tachosil surgical patch or fibrin glue in coronary artery surgery does not affect quality of anastomosis or provoke postoperative adhesions in pigs. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 36, 703-707 (2009).
- Okada, K., et al. Surgical treatment for rupture of left ventricular free wall after acute myocardial infarction. Interactive cardiovascular and thoracic surgery. 4, 203-206 (2005).
- Simpson, D., Liu, H., Fan, T. H., Nerem, R., Dudley, S. C. A tissue engineering approach to progenitor cell delivery results in significant cell engraftment and improved myocardial remodeling. Stem Cells. 25, 2350-2357 (2007).
- Jeong, J. H., et al. Living' microvascular stamp for patterning of functional neovessels; orchestrated control of matrix property and geometry. Advanced Materials. 24, 58-63 (2012).
- Wu, X., Ren, J., Li, J. Fibrin glue as the cell-delivery vehicle for mesenchymal stromal cells in regenerative medicine. Cytotherapy. 14, 555-562 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados