Elektroplattieren von dünnen Schichten
Überblick
Quelle: Logan G. Kiefer, Andrew R. Falkowski, und Taylor D. Sparks, Department of Materials Science and Engineering, The University of Utah, Salt Lake City, UT
Galvanisieren ist ein Verfahren, bei dem elektrischer Strom verwendet wird, um gelöste Metallkationen so zu reduzieren, dass sie eine dünne Beschichtung auf einer Elektrode bilden. Weitere Dünnschichtabscheidungstechniken sind unter anderem chemische Dampfabscheidung (CVD), Spinbeschichtung, Dip-Beschichtung und Sputterabscheidung. CVD verwendet einen Gasphasenvorläufer des zu deponierenden Elements. Spin-Beschichtung verteilt den flüssigen Vorläufer zentrifugal. Die Dip-Beschichtung ähnelt der Spin-Beschichtung, aber anstatt den flüssigen Vorläufer zu spinnen, wird das Substrat vollständig darin versunken. Sputtering verwendet Plasma, um das gewünschte Material von einem Ziel zu entfernen, das dann das Substrat platten. Techniken wie CVD oder Sputtering produzieren sehr hochwertige Folien, aber dies sehr langsam und zu hohen Kosten, da diese Techniken in der Regel eine Vakuumatmosphäre und eine kleine Probengröße erfordern. Die Elektrodeposition setzt nicht auf eine Vakuumatmosphäre, die die Kosten erheblich reduziert und die Skalierbarkeit erhöht. Darüber hinaus können mit der Elektrodenposition relativ hohe Abscheidungsraten erreicht werden.
Grundsätze
Galvanische Zellen bestehen aus zwei verschiedenen Metallen, die durch eine Salzbrücke oder poröse Membran miteinander verbunden sind. Diese elektrochemischen Zellen haben Oxidation und Reduktion halbzellige Reaktionen, die spontan auftreten, um Energie abzuleiten. Die Elektrodeposition kehrt die galvanische Zelle um, indem sie Energie liefert, um nicht spontane Redoxreaktionen anzutreiben, um eine Elektrode mit einem dünnen Film zu platten. Die Anode besteht aus dem zu verblechenden Metall und wird durch Gleichstrom oxidiert. Diese Oxidation an der Anode erzeugt Ionen, die sich auflösen und durch die elektrolytische Lösung fließen, die Metallsalze und andere Ionen enthält, um den Stromfluss zu ermöglichen. Die gelösten Ionen werden reduziert und auf die Kathode plattiert. Elektrochrome Zellen verändern ihre optische Absorption, wenn sie einer Spannung ausgesetzt sind. Wie bei der Galvanik ermöglichen treibende elektrochrome Redoxreaktionen diesen Materialien den Übergang zwischen gebleichten und farbigen Zuständen, wie beim beschichteten Material Preußenblau.
Das Galvanikverfahren erfordert, dass beide im Prozess verwendeten Materialien leitfähig sind, da solche Metalle und metallische Verbindungen in erster Linie verwendet werden. Damit die Beschichtung erfolgreich ist, muss die Oberfläche des zu vergoldeten Materials vollständig sauber sein. Die Oberflächenreinheit wird durch Dastauchen des Materials in eine starke Säure oder kurze Verbindung des Galvanikkreises im Rückwärtsgang gewährleistet - wenn die Elektrode sauber ist, werden Atome aus dem Beschichtungsmetall effektiv mit ihm verbunden. Selbst wenn die Oberfläche sauber ist, kann es zu einer unwirksamen Beschichtung kommen, wenn Komponenten komplexe Geometrien aufweisen, was zu einer ungleichmäßigen Verteilung der Beschichtungsdicke führt. Die Beschichtungsdicke kann durch Variation der Dauer des elektrischen Stroms zwischen den Metallen und der Stärke des zwischen Metallen angewendeten Stroms gesteuert werden. Wenn Sie eine oder beide von ihnen erhöhen, erhöht sich die Dicke der Beschichtung. Durch die Kontrolle der Dicke der Beschichtung können Beschichtungsprobleme, die sich aus komplexen Geometrien ergeben, vermieden werden.
Ziel der vorgeschlagenen Technik ist es, einen dünnen Film aus Preußenblau auf ein Blatt ITO-beschichtetes PET zu proplateieren und dann die Fähigkeit des Films zu messen, Licht mittels UV-Vis-Spektroskopie zu absorbieren und zu übertragen. Die UV-Vis-Daten des elektrochromen Dünnfilms im gebleichten und farbigen Zustand quantifizieren die Farbunterschiede zwischen dem Film in diesen beiden Zuständen. Außerdem erreichen dickere elektrochrome Filme einen tieferen Farbigen zustand und absorbieren daher im Vergleich zu dünneren Filmen relativ mehr Licht. Daher kann UV-Vis auch für qualitative Dickenvergleiche zwischen Folien verwendet werden.
Verfahren
- Bereiten Sie preußische blaue Lösung durch Mischen von 50 ml 0,05 M Salzsäure (HCl), 100 ml von 0,05 M Kaliumferricyanid (K3[Fe(CN)6]) und 100 ml 0,05 M Eisen(III) Chloridhexahydrat (FeCl3.6H2O).
- Erstellen Sie eine Anode, indem Sie ca. 8 cm Nichromdraht (NiCr) in eine enge Spule wickeln.
- Bereiten Sie das Kathodensubstrat vor, indem Sie die Außenbeschichtung entfernen, die die leitfähige Seite einer 5X5-Zentimeter-Platte mit ITO-beschichtetem PET schützt.
- Bauen Sie die Schaltung, indem Sie die positive Klemme einer 9 Volt (9V) Batterie in Serie an einen 30 Ohm Widerstand anschließen, und dann mit der NiCr-Anode mit einem Alligatorclip. Schließen Sie das negative Ende der Batterie mit einem Alligatorclip an das ITO-Kathodensubstrat an. Stellen Sie sicher, dass die Kathode und die Anode nicht in der Lösung berühren.
- Nach der Vorbereitung der Schaltung und der Preußisch-Blauen Lösung senken Sie die Kathode und Anode in die Lösung, wobei Sie darauf achten, keinen Alligatorclip zu tauchen. Halten Sie für 2 Minuten, dann entfernen und spülen Sie sowohl die Kathode und Anode in DI-Wasser. Dieser Schritt kann mit unterschiedlichen Tauchzeiten wiederholt werden, um die Dicke der Beschichtung zu variieren.
- Analysieren Sie die Probe mit dem Perkin Elmer Lambda 950 UV-Vis Spektrometer und bestimmen Sie deren Transmission von sichtbarem Licht in Wellenlänge von 750-400 nm. Achten Sie darauf, den Hintergrundderizgrad zu analysieren, indem Sie eine ITO-beschichtete PET-Probe scannen, die nicht mit Preußenblau beschichtet wurde.
- Nach dem Ausführen der Preußisch-Blauen Probe im UV-Vis eine 150 ml-Lösung mit 1,0 M Kaliumchlorid (KCl) zubereiten.
- Verwenden Sie die gleiche Schaltung und NiCr-Anode (mit der 9V-Batterie in Serie) und einen zusätzlichen Alligator-Clip, um beide Seiten der Preußisch-Blauen Schicht mit der Schaltung zu verbinden. Untertauchen Sie Die Anode und Kathode 1,5 Minuten in die KCl-Lösung und treiben Sie den elektrochromen Übergang von gefärbt zu gebleicht an.
- Dann entfernen und spülen Sie sowohl die Kathode als auch die Anode in DI-Wasser wie zuvor.
- Führen Sie die gebleichte Probe im UV-Vis mit den oben genannten Transmissions-Scat-Parametern aus.
Ergebnisse
Qualitativ wird die in Preußisch-Blau beschichtete ITO transparent, wenn ein negatives Potential aufgebracht wird, wie in Abbildung 1 unten dargestellt. Diese Änderung kann durch Anwenden einer positiven Spannung rückgängig gemacht werden.

Abbildung 1:Preußisch-Blau in seinen farbigen und gebleichten Zuständen.
Qualitativ kann die Dicke der abgelagerten Schicht auf verschiedene Weise verändert und gemessen werden, unter anderem durch Änderung der Elektrodenpositionsspannung oder der Elektrodenpositionszeit. Bei PreußenBlau beeinflussen unterschiedliche Schichtdicken die prozentuale Lichtdurchlässigkeit durch die Probe. Die Beziehung zwischen der Menge an Preußischem Blau, die auf der ITO deponiert ist, und dem Grad der Deckkraft kann durch UV-sichtbare Spektrophotometrie gemessen und in den Abbildungen 2 und 3 dargestellt.
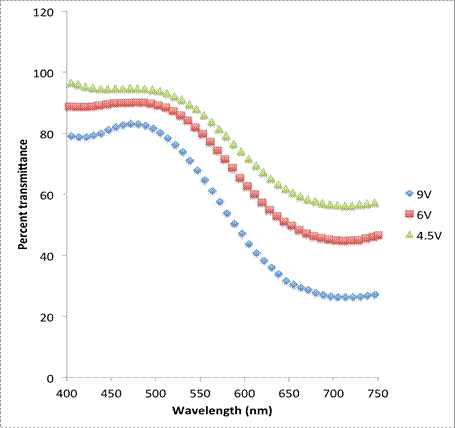
Abbildung 2: UV-Vis-Spektroskopie von Preußenblau in seinem farbigen Zustand für verschiedene elektrochemische Abscheidungsspannungen.

Abbildung 3: UV-Vis-Spektroskopie von Preußenblau in seinem farbigen Zustand für verschiedene elektrochemische Abscheidungszeiten.
Filme, die mit einer höheren Spannung abgelagert wurden, sahen eine niedrigere prozentuale Durchlässigkeit als die, die mit einer niedrigeren Spannung abgelagert wurden. Dies weist darauf hin, dass die Schichten bei höheren Spannungen dicker sind als bei niedrigeren Spannungen. Darüber hinaus sahen Proben, die für längere Zeiten elektrodepositiert wurden, niedrigere prozentuale Durchlässigkeiten, was wiederum darauf hindeutet, dass die Filme bei längeren Abscheidungszeiten dicker sind.
Anwendung und Zusammenfassung
Die Elektrodeposition, wie in diesem Experiment gezeigt, ermöglicht die Veränderung der Oberflächeneigenschaften eines Materials innerhalb einer minimalen Volumenänderung. Bei der Elektrodenposition wird ein elektrischer Strom durch eine elektrolytische Lösung zwischen Anode und Kathode geleitet. Die positiv geladenen Kationen in der Elektrolytlösung werden angezogen und auf die negativ geladene Kathode abgelagert. Einmal abgelagert, gewinnen die Atome in der Schicht Elektronen durch den Prozess der Reduktion.
Die Geschwindigkeit und Menge der Elektrodenposition hängt von der Stärke des elektrischen Stroms ab, der zwischen Kathode und Anode in der Elektrolytlösung aufgebracht wird. Darüber hinaus müssen die bei der Elektrodenposition verwendeten Metalle sorgfältig ausgewählt werden, da einige Metalle miteinander legierungen; in diesen Fällen müssen mehrere Metallschichten hinterlegt werden.
Da die Kationen chemisch das Substrat verklebt sind, hat die Elektrodenposition die Vorteile einer einheitlichen thermischen Ausdehnung, einer besseren Beständigkeit gegen chemische Korrosion und einer erhöhten physikalischen Haltbarkeit. Ein Nachteil der elektrochemischen Ablagerung im Vergleich zu anderen Methoden der Dünnschichtabscheidung ist die Notwendigkeit einer leitfähigen Oberfläche auf dem Substrat vor der Ablagerung. Darüber hinaus führt der Prozess der Elektrodenposition nicht immer zu einer gleichmäßigen Ablagerung, was zu Inkonsistenzen in der Beschichtung des Materials führt.
Elektrodeposition hat viele Anwendungen über die Ablagerung preußen blau. Die Elektrodeposition wird in der Schmuckindustrie ausgiebig eingesetzt, da sie ein hohes Maß an Kontrolle über den Beschichtungsprozess ermöglicht und vielfältige ästhetische Modifikationen ermöglicht. Eine Vielzahl von Farbvariationen kann erreicht werden, indem verschiedene Metalle abgelagert werden, um Legierungen mit einzigartigem Aussehen zu bilden. Darüber hinaus können Metalle einheitlich abgelagert werden, was Farbinkonsistenzen reduziert und Löt- und Komponentenlinien verbergen kann. Durch die Verwendung von Elektrodenposition sind Juweliere in der Lage, funktionale und konsistente Metallbeschichtungen zu schaffen, die ästhetisch ansprechend sind.
Elektrodeposition wird auch in der Automobilindustrie eingesetzt. Fahrzeuge sind ständig Kräften ausgesetzt, die lebenswichtige Komponenten verschleißen. Die Elektrodeposition ermöglicht es, die Eigenschaften verschiedener Teile zu verändern und zu verbessern, ohne das Funktionsvolumen des Teils zu verändern. Abgelagertes Chrom bietet einen überlegenen Verschleiß- und Korrosionsschutz für Fahrzeuge und ermöglicht es Autos, länger zu halten, mit Mindestanforderungen an Wartung und Reparatur.
In der Halbleiterindustrie bietet die Elektrodenposition erhebliche Kosten-, Zuverlässigkeits- und Umweltvorteile gegenüber der klassischen Verdampfungstechnologie und kann sehr unterschiedliche Wafergrößen aufnehmen. Das Elektrodenpositionsverfahren ermöglicht die Abscheidung auf empfindlichen Substraten und ermöglicht auch eine fortschrittliche Formkontrolle oder neue Funktionalitäten. Die Elektrodeposition bietet eine Möglichkeit, preiswerteinzigartige Proben zu verwenden, indem eine Technologie verwendet wird, die leicht an die industrielle Produktion angepasst ist.
Tags
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Elektroplattieren von dünnen Schichten
Materials Engineering
19.6K Ansichten

Optische Materialographie Teil 1: Probenvorbereitung
Materials Engineering
15.3K Ansichten

Optische Materialographie Teil 2: Bildanalyse
Materials Engineering
10.9K Ansichten

Röntgenphotoelektronenspektroskopie
Materials Engineering
21.5K Ansichten

Röntgenbeugung
Materials Engineering
88.2K Ansichten

Ionenfeinstrahlanlage (Focused Ion Beam)
Materials Engineering
8.8K Ansichten

Gerichtete Erstarrung und Phasenstabilisierung
Materials Engineering
6.5K Ansichten

Dynamische Differenzkalorimetrie
Materials Engineering
37.1K Ansichten

Temperaturleitfähigkeit und die Laser-Flash-Methode
Materials Engineering
13.2K Ansichten

Analyse der thermischen Ausdehnung mittels Dilatometrie
Materials Engineering
15.6K Ansichten

Elektrochemische Impedanzspektroskopie
Materials Engineering
23.0K Ansichten

Keramische Faserverbundwerkstoffe und ihre Biegeeigenschaften
Materials Engineering
8.0K Ansichten

Nanokristalline Legierungen und Nanokorngrößenstabilität
Materials Engineering
5.1K Ansichten

Hydrogel-Synthese
Materials Engineering
23.5K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten