Katalytischer Reaktor: Hydrierung von Ethylen
Überblick
Quelle: Kerry M. Dooley und Michael G. Benton, Department of Chemical Engineering, Louisiana Landesuniversität, Baton Rouge, LA
Die Hydrierung von Ethylen (C2H4), Ethan (C2H6) wurde oft als ein Modell Reduktionsreaktion bei der Charakterisierung neuer Metall-Katalysatoren untersucht. 1-2 unterstützten Nickel ist, zwar nicht der aktivste Metall Katalysator für diese Reaktion ist es aktiv genug, dass die Reaktion stattfinden kann, bei < 200 ° C.
Die Reaktion umfasst in der Regel adsorbiert, dissoziierten Wasserstoff (H2) mit adsorbierten Ethylen reagieren. Das heißt, sowohl Wasserstoff-Atomen und Ethylen Moleküle Form verbindet sich mit einer Metall-Website (hier bezeichnet "S"). Die starke Bindung von Ethylen mit S schwächt die Doppelbindung ausreichend um Wasserstoffatome hinzufügen, Ethylen, Ethan, die nicht adsorbiert ist Bildung zu ermöglichen.
Der Zweck dieses Experiments ist zuerst konvertieren von raw Zusammensetzung Messungen Edukt gebrochene Konvertierungen zu begrenzen. 3 diese Konvertierungen in eine Pfropfenströmung Reaktor (PFR) lässt dann an die Daten zu einem standard Potenzgesetz-Kinetik-Modell von der "ganzheitliche Methode". 3 Vergleich der experimentellen Aufträge der Reaktion für Ethylen und Wasserstoff mit den theoretischen Aufträgen ergibt in diesem Fall, dass die Reaktion kinetisch anstatt Masse-Übertragung kontrolliert gesteuert wird.
Grundsätze
Ein Mechanismus für die Reaktion (Vermietung A = Ethylen, E = Ethan und S = Metall Site) kann als geschrieben werden:2
A + S  (1)
(1)
H2 + 2 S  HS + HS (2)
HS + HS (2)
AS + HS  AHS + S (3)
AHS + S (3)
AHS + HS  E + S + S (4)
E + S + S (4)
Wenn wir davon ausgehen die dritte Reaktion ist die Bandbreitenbegrenzung Schritt und der Gesamtbetrag der S Websites ist konstant (S-o), können wir eine ungefähre Massenausgleich:
(S-o) ~ (S) + (AS) + (HS) (5)
und die quasi-Gleichgewicht-Übernahme auf Stufen (1) - (2) um einen theoretischen Kinetik Ausdruck zu erhalten:
R = k (H2)1/2 (A) (S-o)2 [1 + K1 (A) + K21/2 (H2)1/2]-2 (6)
wo k ist eine konstante Rate, K ist eine konstante Gleichgewicht, "1" steht für die erste Reaktion, "2" für die zweite Reaktion und (H2), (A) und (So) sind die Konzentrationen der einzelnen Komponenten. Beachten Sie, dass die ungefähren Gleichgewicht Masse wir davon ausgehen, dass (S) (HS) und (AS) >> (AHS). Beachten Sie auch, dass (So) eine Konstante ist, solange die Gesamtzahl der Metall Seiten gleich bleibt. Wenn die Anzahl der Metall Standorte hinsichtlich der Zeit abnimmt, sagen wir, der Katalysator "deaktiviert;" Wenn er steigt, aktiviert der Katalysator"." In dieser Reaktion kann Deaktivierung durch eine Seite Reaktion mit diesem Stöchiometrie verursacht werden:
C2H4  (CH)2a + H2 (7)
(CH)2a + H2 (7)
Die Polymer Produkt (CH)2a ("Koks") ist zu schwer ("a" ist groß), aus dem Metall desorbieren Websites und so diese Metall Websites werden effektiv aus der Catalyts entfernt. 4 spätere Reaktionsbedingungen Koks zu brechen, führen jedoch so "Reaktivierung" des Katalysators.
Für diese Kinetik, es ist offensichtlich, dass niedrige Konzentrationen von Ethylen die Rate erster Ordnung in Ethylen, während für die hohen Konzentrationen von Ethylen, die Reaktionsgeschwindigkeit-1 Reihenfolge ist. Die Vergleichswerte für den Wasserstoff-Auftrag sind 0,5 bis -0,5. Preis Ausdrücke dieser Art (auch häufig in Enzym-katalysierten Reaktionen) nennt man "Langmuir-Hinshelwood". Da die Gleichgewichts-Konstante K-1 temperaturabhängig ist, erzählt dieser Rate Ausdruck, die der Ordnung m für Ethylen in einem "Power-Gesetz" Rate Ausdruck des Typs:
R = k (A)m (H2)n (8)
mit der Temperatur ändert. Die meisten Rate, die Ausdrücke von Versuchsdaten zurückgebildet sind vom Typ "macht-Gesetz" in standard-Lehrbüchern der chemischen Kinetik zu sehen. 5
Nachstehend finden Sie eine vereinfachte schematische Darstellung des Reaktorsystem (Abb. 1). Viele der Ventile und Komponenten sind auf den Reaktor gekennzeichnet. Der Reaktor ist ein Stahlrohr in einem Sandbath enthalten. Die Sandbath ist mit Luft und erhitzt durch Metall Widerstandsheizungen fluidisiert. Eine große Menge an Wärme kann rasch in die Pilotanlage Reaktor transportiert werden.
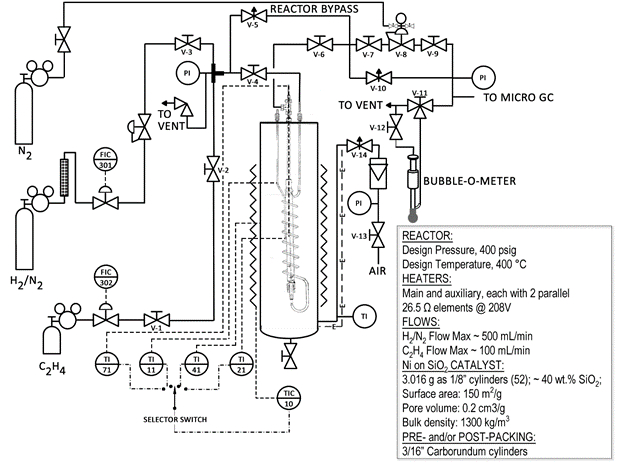
Abbildung 1: Schematische Darstellung der katalytischen Reaktorsystem
Vorkehrungen getroffen wurden, zu einem sicheren System. Gibt es auf dem System eine Hochtemperatur-Abschaltung, Überdruckventile und nur verdünnten Wasserstoff (siehe Datenblatt auf dem Zylinder) dient. Strikter Einhaltung der Sicherheitsvorschriften ist jedoch bei jedem reagierenden System notwendig. Die untere Explosionsgrenze von Wasserstoff in Luft ist 4,0 Vol-%. 6 aus diesem Grund ist es wichtig sicherzustellen, dass der Reaktor nicht Wasserstoff in den umliegenden Sandbath undicht ist. Ein CGD900 brennbare Gas Lecksuchgerät ist für diesen Zweck zur Verfügung.
In dieser Demo (2,0 g) eingesetzten Katalysator nutzt Nickel als aktive Komponente aber etwa 40 wt % Kieselsäure (SiO2). Die Kieselsäure nennt man eine "Unterstützung" für Nickel, und soll eine große Fläche für die Nickel zur Deckung zur Verfügung zu stellen. Ein inertes Material, Siliciumcarbid (SiC), wird verwendet, um den Rest des Reaktors zu füllen. Der Katalysator hat Fläche = 150 m2/g, Porenvolumen = 0,2 cm3/g und eine Rohdichte von ~ 1300 kg/m3.
Der nächste ideale Reaktor zu einem verpackten Bett katalytischen Reaktor ist ein PFR. Ungenauen Reaktor Analyse sprengt den Rahmen dieses Experiments. Der PFR Massenausgleich mit Katalysator Gewicht als unabhängige Variable und gebrochene Konvertierung als abhängige Variable wird:
 (9)
(9)
wo fA die gebrochene Umwandlung der begrenzende Reaktanten, "f" steht für Finale (Ausfahrt) Bedingungen, W ist der Katalysator Gewicht, FAo die molare Futterfluss bei A und R "ist der Preis Ausdruck auf einer Basis pro wt. Wie R' in Bezug auf fA nur für ein ideales Gas wird in einem der standard Kinetik Bezüge abgedeckt. 3 beachten Sie, dass zwei Klassen von Daten, eine Klasse mit Ethylen zu begrenzen und die andere mit dem Wasserstoff zu begrenzen, aber es nur einen gemeinsamen Satz Ausdruck kann. Die gebrochene Konvertierung finden Sie durch die Analyse der Futtermittel und Produkt Gas mit einem Gaschromatographen. Durch Schließen der Massenausgleich, kann die Rate der Reaktion gefunden und im Vergleich zu den nominalen Aktivierungsenergie für diese Art der katalytischen Reaktion. Man kann auch die Aufträge der Reaktion vergleichen.
Verfahren
Das System wird durch einen kommerziellen Prozessleitsystem gesteuert; Es gibt nur eine Bedienoberfläche.
1. Reaktor Startup
- Um die Verlaufsansicht Echtzeit-Prozess zu starten, navigieren Sie zu Start > DeltaV > Operator > Geschichte Prozessansicht, und öffnen Sie dann CATUnitOverview. Diagramm-Skalen können komprimiert oder erweitert durch Klicken auf die Schaltflächen in der Menüleiste. Verfahren zum Herunterladen von Daten von der Steuerung auf eine Excel-Tabelle zur Verfügung, auf dem Computer.
- Stellen Sie sicher, dass die Luft, die Sandbath auf. Der Rotameter lauten ≈5 oder höher und von Ausführung zu Ausführung konstant gehalten werden, einheitliche Heizung bieten.
- Ermöglichen Sie Hauptschalter an der Sandbath-Heizung durch Drücken des Schwarz-bunte auf die Katze Einheit Schalttafel.
- Eingestellte Temperatur-Controller (TIC-10, für die Sandbath) auf gewünschte anfängliche Sollwert, AUTO-Modus. Um schnelle Heizung zu Beginn des Experiments zu verwenden, finden Sie in Anhang A.
- Die Temperaturen können auf dem Chart überwacht werden. Der Reaktor Abwasser Volumenstrom sollte in regelmäßigen Abständen überprüft werden. Wenn Probleme wie Verlust der Strömung oder Ausreißer Temperatur entwickeln, schalten Sie beide Reaktionspartner fließt mit entsprechenden Absperrventile und schalten Sie alle Heizungen ausgeschaltet. Sandbath Luft abgeben.
2. set Flussraten
Eingestellten Durchflussmengen vor der Heizung. Kalibrierungen für die zwei Flow Controller - FIC-301 für die Wasserstoff-Stickstoff-Gemisch- und FIC-302 für Ethylen werden zur Verfügung gestellt werden.
- Legen Sie den digitalen Wert auf die Schnittstelle, die gibt an, ob der Computer oder der Schalttafel auf 1 benutzt wird, um Computerverwendung anzugeben.
- Die GC-Entnahmeleitung zu blockieren.
- Bestimmen Sie der Volumenstrom durch die Anstiegsgeschwindigkeit einer einzelnen Blase zwischen zwei Bände in einer Blase Meter timing. Ein Blase-Meter ist ein Glas-Bürette mit abgestuften Mengen. Stellen Sie sicher, dass die GC-Entnahmeleitung blockiert wird, wenn die Blase Meter aktiv zur Messung des Durchflusses (Kalibrierung, Prüfung Ausfahrt Durchfluss) verwendet wird.
- Nehmen Sie mindestens eine Probe des Futters durch den Bypass (eine leere Probe), seine Zusammensetzung zu überprüfen. Es ist in Ordnung, Durchflussmengen im laufenden Betrieb zu ändern, ohne Umgehung des Reaktors. Ändern die Durchflussmengen auch Veränderungen der relativen Konzentrationen des Futters (der Druck konstant), werden so Flussraten oft geändert werden müssen.
- Die GC-Entnahmeleitung zu entsperren und der Reaktanden durch den Reaktor-Bypass und in der GC-Ansaugöffnung fließen.
- Verwenden Sie einen Gaschromatographen die Gaszusammensetzung Produkt analysieren. Weitere Hinweise sind im Anhang B zum Betreiben der GC und Zusammensetzung enthalten.
(3) Reaktors Herunterfahren
- Shutdown Hauptschalter zur Sandbath Heizung durch Drücken der roten EMERG. STOP-Taste auf der CAT-Einheit Schalttafel.
- Platz TIC-10 Mann Modus und der Ausgang auf 0 %. Hilfsenergie (wenn auf) auf 0 % festgelegt.
- Eingestellten Ethylen Flow 0 % indem man den Controller im Mann und den Ausgang auf 0 % einstellen.
- Schalten Sie beide Ethylen-Block-Ventile vor dem Mischen Abschlag und Absperrung Hauptgasventils Zylinder.
- Lassen Sie Wasserstoff/Stickstoff fließen für ~ 2 min vor dem Abschalten; Dies verlängert die Lebensdauer des Katalysators.
- Beide Ventile vor dem Mischen Abschlag zu blockieren. Dann schalten Sie das Hauptventil für das Wasserstoff/Stickstoff-Gemisch.
- Lassen Sie die Luft in der Wirbelschicht auf.
Ergebnisse
Nichtlineare Regression zum beste Schätzungen (mit Eqs. 8-9) der Reaktion erhalten Bestellungen, m und n und der Rate Konstante k, langweilig sein können. Solch ein Lösungsalgorithmus erfordert eine numerische Integration pro Datenpunkt pro Iteration von m und n, was zu vielen Tausenden von numerische Integrationen. Eine alternative Technik, die fast so gut, aber viel weniger rechnerisch teuer, ist trial Paare von m, n, basierend auf der Struktur von GL. 6 zu formulieren. Alle Werte im Bereich der theoretischen Aufträge ist sicherlich möglich. Dann formulieren Sie eine Zielfunktion des Typs:
 (10)
(10)
Diese Zielfunktion für jedes m, n paar kann berechnet werden, und der Bestwert bestimmt mit seinem Minimum oder in der Nähe von Minimum zusammen mit anderen standard Passformkriterien wie die Zufälligkeit der Fehler in GL. 10 in Abhängigkeit von der Partialdrücke. Beachten Sie auch, dass GL. 9 geht davon aus, dass ein Grundstück auf der linken Seite integraler (nennen Sie es "Y") vs. 1/FAo (nennen Sie es "X") sollte linear auf die optimale m, n. Prüfung den Grad der Linearität und der Zufälligkeit der Fehler dieser Formulierung ist auch eine gültige Methode zur Abschreckung Mine Anpassungsgüte.
Einige Daten, die bei P = 1 atm, T = 80° C, PC2H4 = 0,17-0,42 atm, PH2 = 0,23-0,33 atm (Stickstoff als Verdünnungsmittel) wurden analysiert, wie oben beschrieben. Die lineare Handlung der "best fit" Kinetik ist in Abbildung 2dargestellt. Mehrere andere m wurden n Paare auch in gleicher Weise untersucht und festgestellt, dass um ärmere lineare passt zu geben. Der Bestwert Werte von m und n deuten darauf hin, dass Ethylen ist schwach adsorbiert an der Nickel-Katalysator (keine Hemmung im Nenner von GL. 6), während Wasserstoff stark adsorbiert ist (die negative Reihenfolge kennzeichnet Hemmung). Für die meisten katalytischen Reaktionen zu stark eine Adsorption genauso schlecht wie zu schwach eine Adsorption ist, obwohl in einer negativen Reaktion Reihenfolge, während "zu schwach" spiegelt "zu stark" geringen Umbauten und eine kleine Rate Konstante k wider.

Abbildung 2 . Kinetik-Analyse von Ethylen Hydrierung bei 80° C, 1 atm für 60 Gew.-% Ni Katalysator. Das "a" bezeichnet Daten wo C2H4 ist der begrenzende Reaktanten, während "b" H bezeichnet2 als begrenzende Reaktanten.
Beiden besten Fit Werte von m und n liegen im Bereich der Erwartungen, die anhand der Gleichung (6). Der Wert von "m" ist am höchsten, daher ist die Reaktion nicht Diffusion gesteuert. Für eine Verbreitung-gesteuerte Reaktion sowohl wäre "m" und "n" nahe Null. Die experimentelle Aufträge können manchmal Frage, kinetisch kontrollierten vs. Verbreitung kontrolliert, aber wenn beide Aufträge in der Nähe von Null nichts wurden konnte nachgewiesen werden, da innerhalb des Bereichs des möglichen Aufträge anhand der Gleichung (6) Null ist. Ein Beweis für die oben genannten Aussagen sprengt den Rahmen dieses Experiments.
Anwendung und Zusammenfassung
Die hier beschriebene Methode ist die "ganzheitliche Methode" in den meisten Büchern auf Kinetik und Reaktor-Design genannt. 3 während es mathematisch sehr viel schwieriger, als differenzielle Methoden anzuwenden ist, ist es auch besser an die Arten von Daten zu analysieren, die leicht zu bekommen in den meisten Pilotmaßstab Reaktorsysteme sind wo das Edukt und Produkt-Partialdrücken und gebrochene Konvertierungen können über weite Bereiche variieren. Weil wir nicht auf Batch-Reaktoren oder niedrigen Edukt Umbauten angewiesen sind, sind solche "integrale Daten" auch genauer und relevant für Scale. Der erste Teil der Methode ist es, die Rohdaten des Flow und Zusammensetzung Messungen in gebrochene Konvertierung vs. Raumzeit umwandeln (die Rechte Seite der Gleichung 9 wird oft der Raum-Zeit genannt). Der nächste Schritt ist, angemessene Reaktion Aufträge für die Reaktanden (und manchmal Produkte) zu postulieren, die den Preis beeinflussen. Der letzte Schritt ist, vergleichen Sie so viele Aufträge wie möglich mit Gleichung (10) oder die Linearität Beziehung in Gleichung (9), und wählen Sie das Set alle Daten die beste Passform verleiht.
Fast alle unterstützten Metall Katalysator kann katalysieren die Hydrierung von Ethylen über einige Temperaturbereich und die Katalysatoraktivität, Selektivität (zu Ethan) und Stabilität (Verkokung Widerstand) sind wichtige Deskriptoren für eine mögliche Metall Katalysator-Dienstprogramm. Die kinetische Aufträge der Reaktion sind auch wichtige Deskriptoren. Sie zeigen die adsorptive Stärkeverhältnis der Kohlenwasserstoff vs. Wasserstoff, und ob der Katalysator Preise Edukt oder Produkt Verbreitung eingeschränkt werden könnte (in diesem Fall werden Aufträge in der Nähe von Null gefunden). Die Aufträge können auch vorschlagen, wenn die Annahmen bei der Ableitung der Gleichung 6 (z. B. eine einzelne Rate-limiting Schritt, der die Oberflächenreaktion) in erster Linie auch korrekt sind. In der Regel wissen die experimentelle Rate Ausdruck ist nicht ausreicht, um den richtigen Mechanismus selbst bestimmen, aber wenn der experimentellen Rate Ausdruck eine vorgeschlagene Reaktionsmechanismus widerspricht, dann Letzteres ist sicherlich falsch. In dem hier aufgeführten Beispiel beobachteten Kinetik stehen im Einklang mit der vorgeschlagenen Mechanismus und Bandbreitenbegrenzung Schritt, Kreditvergabe einiges an Glaubwürdigkeit, den Mechanismus.
Mit nur geringfügigen Anpassungen wurden die beschriebenen "integralen Methoden" hier zur Rate Ausdrücke für viele wichtige industrielle katalytische Reaktionen bestimmen. Diese Rate Ausdrücke wurden dann diese Prozesse Tonnage Skalen Skalierung verwendet. Bekannte Beispiele sind der Dampfreformierung von Methan, H2, die Oxidation von o-Xylol, Phthalsäure Anhydrid und Ammoniaksynthese zu generieren. 6 in solchen Fällen könnte die Rate Ausdrücke für Hunderte von Kandidaten Katalysatoren, oft bei mehreren Temperaturen berechnet werden.
Für katalytische Reaktionen auf unterstützten Metalle bilden sie einige der wichtigsten industriellen katalytischen Reaktionen, einschließlich automotive Auspuff Katalyse (eine Kombination von Oxidation von Kohlenmonoxid, unverbrannten Kohlenwasserstoffen Oxidation und Stickoxid Reduktion), die Reform der linear zur verzweigtkettigen Kohlenwasserstoffe erhöhen die Oktanzahl verschiedener Brennstoffe und Dampfreformierung. Für die erste davon das aktive Metall ist in der Regel eine Platin-Palladium-Legierung für den zweiten ist es Platin oder Platin-Legierung wie Platin-Rhenium, und zum dritten ist es Nickel. 7 andere Metalle wie Kupfer, Silber, Gold und Rhodium finden auch Anwendung, entweder alleine oder als Legierungen mit anderen Metallen.
Anhang A – Zusatzheizung Anweisungen
Für schnelles Aufheizen, die Standheizung einschalten (Ausgabe ≤ 90 %), aber achten Sie darauf, um es auszuschalten, wenn die Haut oder die Außenwandtemperatur die gewünschte Reaktortemperatur nähert; die Standheizung ist zu diesem Zeitpunkt nicht kontrolliert und Kühlung (≈10 ° C/h) dauert wesentlich länger als Heizung. Die Reaktortemperatur kann die Heizung Temperatur deutlich lag. Das Haut-Thermoelement kann als Eingabe für TIC-10 ausgewählt werden. Die höchste Temperatur in jedem Experiment zu verwendenden beträgt 200° C. Eine "Kritische" Warnleuchte weist den Benutzer auf hoher Temperatur. Die Steuerung überwacht sowohl die Sandbath als auch im Reaktor Temperaturen und beide sind so programmiert, alarm und Abschaltung der Heizungen bei zu hoch.
Anhang B – Chromatograph Bedienungsanleitung
Die MicroGC ist computergesteuert. Die Standard-GC-Methode ist "Kühlung-1." Laden Sie für die Experimente Methode "PH-CAT4". Klicken Sie auf Steuerelement → Download-Methode. Anzeige des Gerätestatus durch Klicken auf Steuerelement → Gerätestatus. Ein Lauf kann nicht ausgeführt werden, bis alle Parameter in der Gerätestatus in der Nähe ihrer Sollwerte sind.
Wenn Sie bereit sind, einen Lauf durchzuführen, klicken Sie auf Steuerelement → Single ausgeführt. Ein Popup-Menü wird aufgefordert, eine Proben-ID, Datendatei und Ergebnis-Namen eingeben. Klicken Sie für "Datendatei" auf die Pfeilspitze nach rechts und wählen Sie Datum und Uhrzeit. Nachdem auf diese Weise der Bildschirm im Feld werden, und das Datum und die Uhrzeit werden an den Dateinamen angefügt. Klicken Sie für "Ergebnisse" auf die Pfeilspitze nach rechts und wählen Sie Proben-ID, dann wiederholen Sie, wählen Sie Datum und Uhrzeit, dann wiederholen Sie Auswahl Inkrement zu. Zurück zum Feld und fügen Sie eine einzelne Leerstelle zwischen der ersten und zweiten und die zweite und dritte Element. Für "Wiederholungen geben Sie die Anzahl der sequentiellen wiederholte Analysen auf Wunsch. Klicken Sie nun auf "Start". Live Grundstücke für beide Kanäle A und B erscheint, zeigt die Chromatogramme, wie sie erzeugt werden. H2 und N-2 sind auf Kanal A, während H2, CH-4, C2H4, erkannt und C2H6 auf Kanal b derzeit erkannt werden, jedoch wurde die Methode nur für Ethylen und Ethan kalibriert wurde. Wenn alle Wiederholungen abgeschlossen sind, tun die Methode nicht speichern. Das Ergebnissequenz-Fenster wird geöffnet, so dass der Zugang zu den Ergebnissen.
Um die Ergebnisse anzuzeigen, wählen Sie das Fenster der Ergebnissequenz, Rechtsklick (z.B.) der erste laufen Nummer Zelle, wählen Sie Datensatz wählen. Wählen Sie im oberen Menü auf Berichte → Ansicht → Bereich %. Ein Bericht mit den bekannten Verbindungen öffnet sich.
Die GC wird im Bereich % aufnehmen. Konvertierung zu berechnen (A = Bereich %): (11)
(11)
Es ist auch möglich, die Umwandlung von Durchflussmessung Produkt mit der Blase Meter zu berechnen, und dies als einen Scheck über die GC-Ergebnisse dienen kann. Unter der Annahme eines idealen Gases und keine Reaktionen als Ethylen-Hydrierung, die folgende Gleichung abgeleitet werden mit Hilfe einer stöchiometrischen Tabelle:3 (12)
(12)
Wo FT0 der gesamte Volumenstrom von Futtermitteln, FT ist der gesamte Volumenstrom des Produktstroms Blase Meter, gemessen und 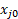 ist der Mol oder Volumen Bruchteil die begrenzende Reaktanten gilt.
ist der Mol oder Volumen Bruchteil die begrenzende Reaktanten gilt.
Referenzen
- O. Beeck, Discuss. Faraday Soc.8, 118 (1950).
- J.B. Butt, AIChE J22, 1 (1976).
- H.S. Fogler, "Elements of Chemical Reaction Engineering," 4th Ed., Prentice-Hall, Upper Saddle River, NJ, 2006, Ch. 2-4; O. Levenspiel, "Chemical Reaction Engineering," 3rd Ed., John Wiley, New York, 1999, Ch. 4-6; C.G. Hill, Jr. and T.W. Root, "Introduction to Chemical Engineering Kinetics and Reactor Design," 2nd Ed., John Wiley, New York, 2014, Ch. 8.
- B. Peri, Discuss. Faraday Soc., 41, 121 (1966).
- Basic chemical kinetics - Fogler, Ch. 3, Levenspiel, Ch. 2, Hill and Root, Ch. 3.
- N. Bartknecht, "Explosions: Course, Prevention, Protection", Springer-Verlag, 1981.
- G.F. Froment, K.B. Bischoff and J. De Wilde, "Chemical Reactor Analysis and Design," 3rd Ed., John Wiley, Hoboken, Ch. 11.
- J.R.H. Ross, "Heterogeneous Catalysis: Fundamentals and Applications," Elsevier, Amsterdam, 2012, Ch. 8.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Katalytischer Reaktor: Hydrierung von Ethylen
Chemical Engineering
30.4K Ansichten

Prüfung der Wärmeübertragungseffizienz eines Rippenrohrwärmetauschers
Chemical Engineering
17.9K Ansichten

Ein Tablett mit Trockner, leitfähige und konvektive Wärmeübertragung zu untersuchen
Chemical Engineering
44.0K Ansichten

Viskosität von Propylenglykol-Lösungen
Chemical Engineering
32.9K Ansichten

Porosimetrie eines Aluminiumsilikatpulvers
Chemical Engineering
9.6K Ansichten

Demonstration des Potenzgesetzmodells durch Extrusion
Chemical Engineering
10.1K Ansichten

Gas-Absorber
Chemical Engineering
36.8K Ansichten

Dampf-Flüssigkeits-Gleichgewicht
Chemical Engineering
89.3K Ansichten

Der Einfluss des Rückflussverhältnisses auf die Effizienz der Tray-Destillation
Chemical Engineering
77.8K Ansichten

Effizienz der Flüssig-Flüssig-Extraktion
Chemical Engineering
48.5K Ansichten

Flüssigphasenreaktor: Inversion von Saccharose
Chemical Engineering
9.7K Ansichten

Kristallisation von Salicylsäure durch chemische Modifikation
Chemical Engineering
24.3K Ansichten

Einphasen- und Zweiphasenströmung in einem Festbettreaktor
Chemical Engineering
19.0K Ansichten

Kinetik der Additionspolymerisation zu Polydimethylsiloxan
Chemical Engineering
16.1K Ansichten

Spin und Chill
Chemical Engineering
7.4K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten