Method Article
Längs Messung der extrazellulären Matrix Steifigkeit in 3D Tumormodelle mit Particle-Tracking Mikrorheologie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Partikel-Tracking Mikrorheologie können zerstörungs quantifizieren und räumlich zuordnen Veränderungen in der extrazellulären Matrix mechanische Eigenschaften im 3D-Tumormodelle verwendet werden.
Zusammenfassung
Die mechanische Mikro wurde gezeigt, als entscheidender Regulator der Tumorwachstumsverhalten und die Signalisierung, die selbst umgebaut wird und als Teil eines Satzes von komplexen, zwei-Wege mechanosensitive Wechselwirkungen modifiziert handeln. Während die Entwicklung von biologisch relevanten 3D-Tumormodellen haben mechanistische Studien über die Auswirkungen der Matrix Rheologie auf das Tumorwachstum erleichtert die inverse Problem der Zuordnung Veränderungen in der mechanischen Umgebung von Tumoren induziert bleibt eine Herausforderung. Hier beschreiben wir die Umsetzung der Partikel-Tracking Mikrorheologie (PTM) in Verbindung mit 3D-Modellen von Bauchspeicheldrüsenkrebs als Teil eines robusten und brauchbarer Ansatz zur Längs Überwachung physikalischer Veränderungen in der Tumor-Mikroumgebung, in situ. Die hier beschriebene Methodik integriert ein System zur Herstellung von 3D-Modellen in vitro in einem Modell der extrazellulären Matrix (ECM) Gerüst aus Typ I-Kollagen eingebettet mit fluoreszenzmarkierten Sonden für gleichmäßig verteilte position-und zeitabhängigen Messungen Mikrorheologie gesamten Probe. In vitro Tumoren werden plattiert und parallel Bedingungen mit Multiwellfolien untersucht. Gestützt auf etablierte Verfahren, sind Videos von Tracer-Sonde Bewegungen über das Generalized Stokes Einstein Beziehung (GSER), um die komplexen frequenzabhängigen viskoelastischen Schermodul G * (ω) berichten umgewandelt. Da dieser Ansatz Imaging-basierte, wird die mechanische Charakterisierung auch auf große Durchlichtraum Feldern zugeordnet, gleichzeitig berichten qualitative Veränderungen in 3D Tumorgröße und Phänotyp. Repräsentative Ergebnisse zeigen, kontras mechanische Reaktion in Teilbereichen mit lokalisierten Invasion-induzierte Matrixabbau sowie System-Kalibrierung, Validierung werden Daten vorgestellt. Unerwünschte Ergebnisse aus gemeinsamen experimentelle Fehler und Problemlösungen dieser Fragen werden ebenfalls vorgestellt. Die 96-Well-Format 3D-Beschichtung Kultur in diesem Protokoll implementiert ist, ist conducive zu Korrelation von Mikrorheologie Messungen mit therapeutischen Screening-Tests oder der molekularen Bildgebung, neue Einblicke in die Auswirkungen der Behandlungen oder biochemische Reize auf die mechanische Mikroumgebung zu gewinnen.
Einleitung
Es ist klar, von einer wachsenden Zahl von Hinweisen in der Literatur, dass Krebszellen, wie bei nicht-malignen Säuger Epithelzellen, reagieren sehr sensibel auf die mechanischen und biophysikalischen Eigenschaften der umgebenden extrazellulären Matrix (ECM) und andere Mikrokomponenten 9.1. Elegante mechanistische Studien Einblicke in die Rolle der extrazellulären Steifigkeit als eine komplexe Signal mechanosensitive Partner, der malignen Wachstumsverhalten und Morphogenese 2,3,10,11 reguliert ist. Diese Arbeit wurde insbesondere durch die Entwicklung von 3D in vitro-Tumormodellen, die biologisch relevante wiederherzustellen Gewebearchitektur und können in Trägermaterialien mit maßgeschneiderten Mechanik angebaut und durch optische Mikroskopie 12-19 abgebildet werden erleichtert. Jedoch ist die andere Seite dieser mechanoregulatory Dialog zwischen Tumor und Mikroumgebung, durch die Krebszellen wiederum Veränderung der Fließeigenschaften ihrer Umgebung bleibt etwasschwieriger zu studieren. Zum Beispiel während der Invasion Prozesse, die Zellen am Rande eines Tumors kann epitheliale mesenchymale Transition (EMT) zu unterziehen und erhöhen die Expression von Matrix-Metalloproteasen (MMPs), die lokalen Abbau von ECM 20-22, die wiederum Einfluss auf mechanosensitive Wachstumsverhalten führen andere proximalen Tumorzellen. Durch eine Vielzahl von biochemischen Prozessen, die Krebszellen die lokale Steifigkeit ihrer Umgebung wählen ständig auf und ab, um verschiedene Prozesse zu unterschiedlichen Zeiten anpassen. Die hier beschriebene Methode ist durch die Notwendigkeit für analytische Werkzeuge, die lokale Veränderungen in der Steifigkeit und Nachgiebigkeit der ECM während des Wachstums, die mit 3D-Tumormodellen integriert ist und in Längsrichtung mit biochemischen und phänotypische Veränderungen korreliert ohne Beendigung der Kultur werden kann berichten motiviert.
Auf der Suche nach einem geeigneten Verfahren in diesem Kontext zu implementieren, tritt Partikelverfolgungs Mikrorheologie (PTM) als starke Kandidaten.Diese Methode, die ursprünglich von Pionier Mason und Weitz 23,24 nutzt die Bewegung der Tracer-Sonden in einem komplexen Fluid eingebettet sind, um die frequenzabhängige komplexe viskoelastische Schermodul G * (ω) in Mikron Längenskalen zu melden. Dieser allgemeine Ansatz wurde mit mehreren Varianten für unterschiedliche Anwendungen in weichen kondensierten Materie, Kolloide, Biophysik und Polymerphysik 25-31 geeignet entwickelt. PTM hat gewisse Vorteile gegenüber anderen Methoden, da die Messwerte von lokalen Viskoelastizität durch zerstörungsfreie Videoabbildungs biochemisch inaktive Tracer-Sonden, die zum Zeitpunkt der Kulturansatz aufgenommen werden und bleiben an Ort und Stelle über einen längeren Zeitraum des Wachstums bereitgestellt. Dies steht im Gegensatz zu Gold Standardmessungen mit einer oszillierenden Schergroß Rheometer, was notwendigerweise erfordert Beendigung der Kultur und meldet den Groß makroskopischen Rheologie der Probe statt Punktmessungen innerhalb der komplexen 3D Tumor microenvironment. In der Tat eine Reihe von Studien haben den Nutzen der Interpretation von Messungen der Sonde Tracer Bewegungen in oder rund um Krebs oder Nicht-Krebs-Zellen, um Verformungen der Zellmigration 32, mechanische Beanspruchung von einem expandierenden Sphäroid 33, intrazelluläre Rheologie 34,35 induziert zu bemessen dargestellt und mechanische Spannungen und Dehnungen in Geweben entwickelt 36, und die Beziehung zwischen Porengröße und Invasion Geschwindigkeit 37 zuzuordnen. Andere Techniken für Mikrorheologie wie Rasterkraftmikroskopie (AFM) implementiert werden kann, sondern in erster Linie zur Untersuchung von Punkten auf der Oberfläche der Probe und kann auch Kultur Sterilität, die Längs Messungen erschweren 38 darstellen.
Hier ein umfassendes Protokoll umfasst Methoden für das Wachstum der 3D Tumorsphäroide geeignet für den Transfer in ECM mit eingebetteten Fluoreszenzsonden für Video-Partikel-Tracking-und Analyse-Methoden für die zuverlässige Abbildung räumlicher beschreiben wirVeränderungen im Laufe der Zeit Mikrorheologie in der Kultur. In der vorliegenden Implementierung werden 3D-Tumormodellen in Multiwell-Format mit Blick auf Einbau von Mikrorheologie Messungen mit anderen traditionellen Tests (zB Zytotoxizität), die dieses Format ist förderlich für gewachsen. In dieser repräsentativen Darstellung dieser Methodik wir Kultur in vitro 3D-Sphäroiden mit PANC-1-Zellen, eine etablierte Pankreaskrebszelllinie bekannt, Sphäroiden 39, sondern alle hier beschriebenen Messungen bilden, sind breit anwendbar zu studieren, von soliden Tumoren mit einer Vielzahl von Zelllinien geeignet für 3D-Kultur. Da diese Methode von Natur-basierte Bildgebung ist es ideal für Co-Registrierung von hochauflösenden Mikrorheologie Daten mit großen Durchlicht-Sichtfelder, die Veränderungen in der Zellwachstum, Migration und Phänotyp berichten geeignet. Die Umsetzung der PTM integrierten Durchlichtmikroskopie auf diese Weise davon ausgegangen, reproduzierbare Positionierung der Mikroskoptisch whICH ist auf motorisierte kommerzielle Weitfeld-Epifluoreszenz biologische Mikroskope der Regel zur Verfügung. Die folgende entwickeltes Protokoll kann mit jedem vernünftig ausgestattet automatisierten Fluoreszenzmikroskop biologischen umgesetzt werden. Dies ist ein von Natur aus datenintensive Methode, die Übernahme von Gigabyte an digitalen Videomikroskopie für die Offline-Verarbeitung erfordert.
In dem folgenden Protokoll, Protokoll 1 bezieht sich auf die anfängliche Herstellung von Tumor-Spheroide, die hier mit Überlagerung auf Agarose beschrieben, konnte aber mit einer Vielzahl von anderen Methoden, wie hängenden Tropfen 40 oder Rotationskultur 41 Techniken ersetzt werden. Protokoll 2 beschreibt den Prozess der Einbettung Sphäroiden in einer Kollagengerüst, obwohl alternativ könnte in vitro 3D Tumoren durch Einkapselung oder Einbettung von resuspendierten Zellen in ECM 12,15, anstatt einzelne vorgeformte nichthaft Sphäroide gezüchtet werden. Nachfolgende Protokolle beschreiben Verfahren zur obtaining zeitaufgelöste Messungen Mikrorheologie durch Erfassen und Verarbeiten von Videomikroskopiedaten. Die Datenverarbeitung wird mit MATLAB, die Nutzung von Open-Source-Routinen für PTM auf Algorithmen ursprünglich von Crocker und Grier 42, die auch ausgiebig für verschiedene Software-Plattformen entwickelt, gebaut beschrieben (siehe http://www.physics.emory.edu/ beschrieben ~ Wochen / IDL /).
Protokoll
1. Kultivierung Tumorsphäroide
- Mischungs 10 ml Zellkultur-Wasser mit 0,1 g Agarose, um ein 1% Agarose-Lösung erhalten.
- Wärme Agarose-Lösung auf über 70 ° C (etwa 14 sec in einer Standard Mikrowelle oder durch Verwendung einer Heizplatte) vor dem Aliquotieren von 40 &mgr; l Agarose-Lösung in eine Vertiefung auf einer Platte mit 96 Vertiefungen.
- Inkubieren Platte bei 37 ° C für mindestens 1 Stunde bei der Ernte-Zellen unter Verwendung von Standardtechniken.
- Verwenden eines Hämazytometers, um die Konzentration der Zellen in der Suspension zu bestimmen.
- Verdünnen Zellsuspension auf 1.000 Zellen / ml und 100 ul dieser Verdünnung auf die Vertiefung, die die ausgehärtete Agarose Bett.
- Legen Sie die Probe auf einem Schüttler über Nacht in einem Brutschrank bei 37 ° C und 5% CO 2 eingestellt.
- Entfernen Probe von Shaker geben und 100 ul Zellkulturmedien.
- Sphäroiden inkubieren, bis der gewünschte Durchmesser erreicht ist. Zum Beispiel nach 9 Tagen eine spHeroid ungefähr 450 um im Durchmesser sein. Während dieser Zeit kann frisches Wachstumsmedium zu den Vertiefungen gegeben werden, aber Aspiration zu vermeiden, da dies bei der Entfernung des Sphäroids führt.
2. Vorbereitung 3D Tumorsphäroide Eingebettet in ECM
- Bereiten Sie einen Arbeitsplatz mit benötigten Materialien innerhalb einer Steril.
- Bereiten Sie eine verdünnte Mischung aus Carboxylat-modifizierte 1 um Durchmesser fluoreszierender Tracer-Sonden durch Zugabe von 2 Teillager Sonden (2% Feststoffe) bis 25 Teile sterilem Wasser.
- Entfernen Sie eine Flasche von 3,1 mg / ml Rinderkollagen aus dem Kühlschrank und legen Sie es auf Eis.
- 125 ul Aliquot von Kollagen in ein leeres 2-ml-Ampulle.
- In 50 ul verdünnte Tracer Sonde Lösung für das Fläschchen mit dem Kollagen und kurz vortexen, um Sonden zu verteilen.
- In 235 ul der entsprechenden Zellkulturmedien, die Phenol-Rot (die gelb wird) mit einem Gesamtvolumen von 410 ml und Wirbel kurz bevor 205 ml (die Hälfte des Gesamtvolumens) und es in ein neues 2-ml-Ampulle. Vial 1 die Tumor Sphäroid enthalten und Fläschchen 2 wird eine Steuer Gemisch sein.
- In ~ 2 ul 1 M NaOH auf Vial 1, um die Lösung wieder auf neutralen pH-Wert (Kulturmedien Phenolrot enthält, sollte auf rot zurück) zu bringen. Beachten Sie, dass dies bewirkt, dass die Mischung der Aushärtung, wenn sie nicht auf Eis gehalten, um zu beginnen. Vortex kurz zu mischen, dann auf Eis Rack sofort zurück.
HINWEIS: Das Sphäroid ist kaum sichtbar, die mit bloßem Auge nach 9 Tagen der Kultur und ihrer Entfernung aus dem Agarose-Bett ist eine heikle Aufgabe. Verwendung eines Dissektionsmikroskop kann hilfreich für einige Nutzer. Die Aufrechterhaltung der Integrität der Sphäroid während der Übertragung ist von größter Bedeutung. - Mit einem breit-Mund-Pipettenspitze, entfernen 40 ul Medium aus dem Brunnen, die das Tumor Sphäroid. Bewahren Sie diese 40 ul bei der Durchführung der nächste Schritt.
- Überprüfen Sie das gut zu sehen, wenn das Sphäroidwurde im vorherigen Schritt entfernt. Wenn ja, fügen Sie die 40 ul, die das Sphäroid zu Vial ein. Falls nicht, legen Sie die 40 ul zurück in den Brunnen, und wiederholen Sie den vorherigen Schritt.
- Rühren Sie leicht Vial 1 (nicht Gefahr, Vortex, kann es die Sphäroid beschädigen) vor der Übertragung der Mischung in 60 ul-Portionen in drei separaten Wells einer 96-Well-Platte. Überprüfen Sie jede Vertiefung mit einem Mikroskop nach Zugabe Mischung zu bestimmen, welche auch enthält das Sphäroid.
- In ~ 2 ul 1 M NaOH und 40 ul Zellkulturmedien zu Vial 2 und Wirbel vor Aliquotierung 60 ul dieser Mischung in einen leeren Brunnen in der 96-Well-Platte und Kennzeichnung als Kontrolle.
- Die Platte wird in einem 37 ° C-Inkubator für mindestens 1 Stunde aushärten.
3. Construct Grid von Probe-Punkte und Nehmen Sie ein Video an jedem Punkt
- Übertragen Sie die Probenplatte aus dem Inkubator auf dem Mikroskoptisch. Erlauben 10 min, bis die Probe Equilibrate mit der Raumtemperatur, wenn ein beheiztes Bühne ist nicht verfügbar.
- Beachten Sie die Probe mit schwacher Stromversorgung Objektive um sicherzustellen, dass sie intakt und bereit für die Bildgebung ist. Ermitteln Sie die Position innerhalb der Tumor gut.
- Entscheiden Sie, wie viele Punkte, um Probe zu nehmen. Typischerweise werden 20 Proben in jeder Vertiefung, in konzentrischen Ringen um das Sphäroid verteilt ausreichend detaillierte Ergebnisse zu produzieren.
- Bewegen Sie die Bühne, um jede gewünschte Position und verwenden Mikroskop Schnittstellen-Software, um die x-und y-Koordinaten (oder Aufnahme-Koordinaten manuell, wenn Schnittstellen-Software nicht erreichbar ist) aufzeichnen.
- Schalten Sie das Mikroskop zu einem Hochleistungs-Objektiv (typischerweise 100X), und wählen Sie die entsprechende Filterwürfel für die Anregungswellenlänge der Tracer-Sonden. Verwenden Sie die Liste der Punkte in Schritt 3.4 erstellt, um auf den ersten Punkt im Netz zu bewegen.
- Stellen Sie den Fokus auf den Boden des gut finden, dann nach oben, um ein Sichtfeld (FOV) mit mehreren In-Fokus-trac findenäh Sonden.
- Beachten Sie die Intensität Histogramm die Belichtung eingestellt und Intensität und Zeit, um den größten Dynamikbereich möglich zu geben, während sichergestellt wird, dass das Bild nicht gesättigt zu werden.
- Besorgen Sie sich eine Videosequenz mit einer Bildrate von 20 bis 30 ms pro Bild (ca. 800 Frames oder 16-24 Sekunden lang wird empfohlen, um eine ausreichende Statistik für robuste MSD Berechnung mit der Notwendigkeit zur Minimierung der Messzeit an jedem Raumgitterpunkt ausgeglichen Verfügung stellen) und sparen Sie mit einer entsprechenden Konvention. Während der Aufnahme nicht berühren das Mikroskop oder Tisch.
- Wiederholen Sie die Schritte 3,6-3,9 für jeden Probenpunkt im Netz.
- Wiederholen Sie die Schritte 3,3-3,10 für jeden auch im Experiment.
4. Analysieren Video Data zu rheologischen Eigenschaften bei jedem Abtastpunkt Berechnen
- Kopieren aller Videodaten auf einer Analyse Ordner (möglicherweise auf einem anderen Computer).
- Import von Bilddaten in MATLAB oder andere Analyse-Software.
NOTE: Umfangreiche Dokumentation über die Reihe von MATLAB hier angenommen Partikelverfolgung Routinen ist verfügbar http://people.umass.edu/kilfoil . Die Verwendung eines kundenspezifischen aufrufenden Funktion für die Automatisierung Verarbeitung mehrerer Dateien an verschiedenen Positionen empfohlen. - Kalibrieren der Software durch die Analyse mehrere Frames des Videos und Ablehnung Parameter (Größe, Bandpass-, usw.) für das Identifizieren der Sonde Mittelpositionen entsprechend zu bestimmen. Umfangreiche Hintergrund für diese entscheidenden Schritte wird von Crocker und Grier beschrieben.
- Verwenden Sie die Software, um jedes Sondenposition für alle Video-Frames automatisch zu ermitteln und verknüpfen diese Positionen in Bahnen.
- Verwenden Sie die Bahndaten, die mittlere quadratische Verschiebung (MSD) als Funktion der Verzögerungszeit zu berechnen, wobei Sie auf die entsprechende Raumkalibrierungsfaktor (um pro Pixel) für die spezifische Objektiv, jeder Pixel-Binning, etc. gelten (in der Regel durchgeführtin Meta-Daten).
- Berechnen G * (mit der verallgemeinerten Stokes-Einstein-Beziehung berücksichtigt die Grenzen der Anwendbarkeit von GSER für eine bestimmte Probe 24,28,43. Alternativ können Benutzer möchten ECM Eigenschaften direkt von MSD durch einen einfachen Vergleich Potenzgesetz Skalierung, Hochebene zu interpretieren Werte, Indices Heterogenität oder andere Parameter.
- Wiederholen Sie die Schritte 4.2 bis 4.6 für jede SFZ im Experiment.
- Zusammen registrieren Positionsdaten aus Schritt 3.4 mit viskoelastischen Moduli bei einer bestimmten Frequenz von Interesse. Je nach Hersteller des Mikroskops verwendet wird, kann dieser Schritt durch eine benutzerdefinierte Routine, die Mikroskop Metadaten oder Positionsdaten können manuell tabellieren liest erleichtert werden.
- Verwenden Sie 3D-Interpolation Funktionen, um eine räumliche Karte Rheologie der ECM zu generieren.
Ergebnisse
Um die Gültigkeit von G * (ω)-Messungen an lokalisierten Positionen in einem komplexen Modell Tumor-Mikroumgebung zu verifizieren, wurden zwei erste Validierungsexperimente durchgeführt. Zuerst haben wir versucht, unsere Messungen gegen den "Goldstandard" der Groß oszillierende Scher rheometry validieren. Wir stellten identische Proben von Kollagenmatrix (ohne Zellen) in einer Konzentration von 1,0 mg / ml Kollagen. Diese Proben wurden mit einer Schütt Rheometers (TA Instruments AR-G2, unter Verwendung von 40 mm-Parallelplattengeometrie) und PTM (unter Verwendung der gleichen Parameter wie in diesem Protokoll), und die resultierenden Messungen von G '(ω) und G "(ω sondiert ) wurden (2A) verglichen. Ausgezeichnet Vereinbarung wurde zwischen den beiden Messungen gefunden. Zweitens, um die Fähigkeit dieses Protokoll, um Wertänderungen in ECM Rheologie wir eine 1,0 mg / ml Kollagen-Matrix eingebettet und Tracer-Kügelchen hergestellt messen zu etablieren. Die Probe wurde dann mit einer behandeltenzentrale Injektion von 5 ul Dispase (2B), die schnell verdaut Kollagen. Nach Inkubation für 3 Stunden, damit lokalisierte Kollagen Verdauung stattfindet, wurde Videodaten in unterschiedlichen Entfernungen von der Injektionsstelle entnommen, und Messungen von G '(ω) und G "(ω) wurden jeweils hergestellt. Die Grße G "(ω = 1 rad / s) wurde festgestellt, größer als der G 'an der Injektionsstelle (ω = 1 rad / Sek.) Messungen mit zunehmender Entfernung von der Injektionsstelle aufgenommen wurden gefunden, um eine Erhöhung der Grße von G *, sowie einen zunehmenden Verhältnis von G "zu G" (Fig. 2C) haben. Die Größe des hoch abgebaute Region von ~ 2 mm ist, die mit einer geschätzten Entfernung der Diffusion eines Proteins mit hydrodynamische Radius R H = 1 nm (das Molekulargewicht von 32,5 kDa Dispase) durch verdaut Kollagen mit einer Viskosität von η = 10 - 3 Pa · s bei 37 ° C:  , wobei
, wobei 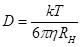 . Daher sind die Ergebnisse stimmen mit der erwarteten Erweichung der Matrix in der Nähe der Injektionsstelle, und zeigen unsere Fähigkeit, präzise, lokalisierte Messungen der Matrix Rheologie zu machen.
. Daher sind die Ergebnisse stimmen mit der erwarteten Erweichung der Matrix in der Nähe der Injektionsstelle, und zeigen unsere Fähigkeit, präzise, lokalisierte Messungen der Matrix Rheologie zu machen.
Repräsentative Daten aus einem 3D-Tumormodell nach diesem Protokoll hergestellt, ist in Fig. 3 gezeigt. Video-Daten wurden bei 19 festen Stellen innerhalb des Kollagengerüst gesammelt, wodurch ein grobes Raster der Umgebung des Tumors (Abbildung 3A). Diese Koordinaten-Daten mit berechneten Werten von G '(ω) kombiniert werden, um eine räumliche Karte der ECM Steifigkeit (3B) zu erzeugen. Diese räumliche Karte zeigt deutlich eine Zone erhöhter Steifigkeit unmittelbar proximal zum Tumor Sphäroids am Tag 2, die mit der Ablagerung von Kollagen IV, Laminin V ein korreliert werden konnted anderen Basalmembrankomponenten von der Sphäroid selbst 17,18,44,45 oder lokale Kompression der ECM durch die expandierende Sphäroid hinterlegt.
Tumorwachstum und die Matrix-Invasion Ereignisse wurden über 4 Tage überwacht. Zwei Bereiche wurden mit entweder keinen Nachweis invasiver Zellen in der Tumorperipherie oder ausgeprägte Nachweis der eindringenden Zellen (Figur 3C) gekennzeichnet. PTM Messungen wurden bei den Regionen 1 und 2 in 4 Tagen. Am Tag 4, gab es einen signifikanten Unterschied in der G '(bei 1 rad / s angegeben) zwischen den beiden Bereichen (Fig. 3D). Frequenzabhängige Messungen von G 'und G "für die Regionen 1 und 2 an Tag 4 zeigen deutliche Erweichung des ECM in Region 2, der invasiven Bereich (3E). Am Tag 4 Region zwei Exponaten einen flüssigkeitsähnlichen viskoelastischen Reaktion, offensichtlich durch viskose Skalierung des G "Grundstück (3E).
Repräsentative suboptimalenErgebnisse von experimentellen und gemeinsamen Analysefehler sind in Abb. 4 gezeigt. vielleicht offensichtlichste Fehlerquelle liegt in der Stabilität der Einrichtung, auf dem Video-Mikroskopie durchgeführt. Wenn der Laborbank verschoben wird, oder wenn es eine andere externe Quelle von Vibrationen, können Wulst Trajektorien künstlich beeinflußt werden, was zu einer Drift in den Daten resultiert. Drift bewirkt, dass der MSD drastisch bei hohen Latenzzeiten zu erhöhen (4A), die auch bewirkt, dass die G '(ω) und G "(ω) berechneten Werte stark bei niedrigen Frequenzen (4B) zu erhöhen. Drift kann durch die Verwendung eines Druckluftpolsterlaborbank reduziert werden und einfach durch die Betreuung, um das Setup nicht stoßen, während Videos aufgezeichnet werden. Zusätzlich kann Drift bei der Nachbearbeitung mit Software-Routinen entfernt werden. Diese Routinen werden zur Entfernung von Drift, die annähernd gleichmäßig über ein bekanntes Zeitintervall. Unregelmäßige Drift (vielleicht verursachtdurch Anstoßen der Bühne während der Datenerfassung) ist problematischer. Deshalb ist es wichtig, sicherzustellen, dass die Probe mechanisch isoliert von der Umwelt während der Datenerfassung bleibt.
Eine weitere mögliche Quelle der unklaren Ergebnisse geht, die durch unsachgemäße Auslegung der Probe Heterogenität. Obwohl die Fähigkeit, in einer Probe zu beobachten und zu quantifizieren, räumliche Heterogenität ist in der Tat eine der Stärken hingewiesen PTM 26 (und etwas, das in der traditionellen Groß Rheologiemessungen verloren geht), kann eine unsachgemäße Gruppierung von Clustern von Sonde Trajektorien zu falschen Schlussfolgerungen führen. Da die Änderungen im ECM Steifigkeit mit dieser Methode berichtet inhärent heterogen, da das Material selbst, in einem bestimmten Sichtfeld, könnte es einige Tracer-Sonden, die nicht elastisch von Kollagenfasern beschränkt sind und somit frei erkunden stochastisch größer Wasser gefüllten Poren (Fig. 4C). Diese "lose"-Sonden zeigen mobility etwa im Einklang mit einer rein viskosen Umgebung. Da die Daten für alle Sonden gemittelt vor viskoelastischen Module berechnet werden, kann mit ein paar lose Sonden in einem bestimmten Stichprobenregion (field of view) frequenzabhängige Grund G * (ω), die stark variieren (4D) zu produzieren.
Unsachgemäße Softwarekalibrierung kann während der Videosammlung und-analyse zu Fehlern führen. Während der Videodatensammlung, ist es wichtig, die Intensität Histogramm beobachten, und stellen Sie die Belichtungszeit, um den größten Dynamikbereich möglich zu geben, während sichergestellt wird, dass das Bild nicht gesättigt zu werden. Die Analyse berechnet raffinierte Mittelpositionen für jeden Tracer-Sonde durch die Integration der Intensitätswert eines jeden Pixels. Wenn das Bild gesättigt ist, wird diese Integration weniger genau aufgrund einer Rubrik "Flat-Top" des Intensitätsprofils sein. Darüber hinaus ist die Funktion Befund Kalibrierung ein äußerst wichtiger Schritt bei der Sicherstellung genaue Ergebnisse. Die richtige Wahl der Auswahlparameter im Vordergrund steht. Dieser Prozess ist weitgehend von Crocker und Grier 42, Savin und Doyle 43, und andere beschrieben.

Fig. 1 ist. Schema Experimentelles. (A) Tumorsphäroide auf Agarose Betten gebildet, und dann in eine 3D-Matrix mit eingebetteten Tracer Sonden übertragen. (B) Videodaten werden an mehreren Punkten innerhalb der Probe entnommen und sowohl benachbart zu und entfernt von dem Tumor Sphäroid. (C) Der stochastische Bewegung der Sonden in jedem Video wird, um die lokalen rheologischen Eigenschaften der Matrix bei jedem Abtastpunkt zu bestimmen. Diese Daten werden in einer räumlichen Zuordnung von ECM-Steifigkeit der gesamten gut zusammengestellt.ad/51302/51302fig1highres.jpg "target =" _blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Überprüfung der Messungen. (A) Die Komponenten von G * (ω) werden hier gezeigt. Die berechneten Werte von G '(ω) und G "(ω) unter Verwendung PTM sind sehr ähnlich zu denen über einen Groß Rheometer erhalten. (B) 5 ul Dispase wurde in die Mitte eines gut mit dem Radius r = 8,5 mm, das 1,0 mg / ml Kollagen, um räumliche Änderungen in G * (ω) zu messen aufgenommen. (C) Die berechneten Werte von G '(ω) und G "(ω) an der Stelle der Injektion Dispase, 1,5 mm von der Stelle, und 3 mm von der Stelle. Zusätzlich wurde eine Kontrollmessung in einer Vertiefung, die die gleiche Kollagengel gemacht but ohne Dispase Behandlung. In der Nähe der Behandlungsstelle G '(ω) kleiner ist als G "(ω). Wie das Gel weiter von der Behandlungsstelle die Werte von G 'abgetastet (ω) größer ist als G "(ω), und der Betrag von G * (ω) zunimmt. Die Messungen wurden 2,5 Stunden nach der Injektion entnommen Dispase. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. Quantifizierung der Veränderungen in der ECM Rheologie gleichzeitig mit Beginn der lokalen Matrix-Invasion. (A) Die Vertiefung, die eine PANC-1-3D-Sphäroid an mehreren Standorten in der Kollagen-ECM um den Tumor untersucht. (B) Koordinatendaten mit c kombinierterechnet G '(ω) für jeden Standort eine räumliche ECM Steifigkeit Karte herzustellen. (C) Das Tumorwachstum und Invasion Verhalten wurden über 4 Tage überwacht. Zwei Regionen wurden als mit entweder keine Interaktion mit eindringenden Zellen (Bereich 1, blaue Sternchen) oder Schwer Interaktion mit eindringenden Zellen, die spontan aus dem großen Haupt vielzelligen Sphäroid Masse (Region 2, rotes Sternchen) verzweigt identifiziert. (D) Die rheologischen Messungen wurden bei den Regionen 1 und 2 in 4 Tagen. Am vierten Tag gab es einen signifikanten Unterschied in der G '(bei 1 rad / s angegeben) zwischen den beiden Regionen. (E) Frequenzabhängige Messungen von G '(ω) und G "(ω) für die Bereiche 1 und 2 am Tag 4 zeigen signifikante Erweichung des ECM bei Bereich 2 genau mit der Anwesenheit von invasiven Populationen korreliert. G '(ω) und G "(ω)-Werte berechnet mit einem Potenzgesetz fit zu MSD-Daten gezeigt, wie gefüllte und ungefüllte Punkt resziehungs. Am Tag 4 Region zwei Exponaten eine flüssigkeitsähnliche viskoelastischen Reaktion wie sich durch viskose Skalierung des G "(ω) Handlung und der Abwesenheit von der Passlinie für G '(ω). Bitte klicken Sie hier, um eine größere Version zu sehen diese Zahl.

Abbildung 4. Daten aus sub-optimale Ergebnisse durch Drift und falsche Interpretation von ECM Heterogenität. (A) Die MSD eines Tracers Sonde in einem komplexen Material beschränkt Potenzgesetz folgt Skalierung <&Dgr; 2 (τ)> ~ τ α (0 ≤ α ≤ 1). Dementsprechend sollte MSD Werte ein Plateau bei langen Verzögerungszeiten nähern. Drift in der Probe künstlich beseitigen dieses Verhalten, leading eskalierenden MSD-Werte bei langen Verzögerungszeiten. (B) Die lange Zeitverzögerung Drift in der MSD werden die Werte von G führen '(ω) und G "(ω) in kurzen Frequenzen deutlich fehlerhaft geworden. Drift kann entweder durch Sicherstellung, dass die Probe mechanisch während der Datensammlung isoliert oder unter Verwendung von Software-Routinen, um eine Drift während der Analyse zu entfernen beseitigt oder verringert werden. (C) Auch in einem kleinen Sichtfeld können zwei verschiedene Sorten von Sonde Bahnen vorhanden sein. In diesem Beispiel sind die meisten der Sonden in der Matrix eingeschlossen, aber einige sind "lose" - deren Trajektorien sind viel weniger eingeschränkt. (D) Der Versuch, MSD Daten sowohl mit und ohne Neben Sonden in der gleichen Zeit ohne richtige Interpretation der Proben Heterogenität Messungen der viskoelastischen Module verwechseln interpretieren. Bitte click Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
In diesem Protokoll führen wir eine robuste und breit anwendbare Strategie für längs Tracking lokale Änderungen in ECM Steifigkeit in 3D-Tumormodellen. Wir stellen uns vor, dass diese Methodik könnte durch Krebs Biologen und Biophysiker interessiert mechanosensitive Verhalten in Matrixumbau bei Tumorwachstum und Invasion Prozesse verwickelt angenommen werden. Präzise Quantifizierung der Matrix Abbaukinetik kann besonders für diejenigen, die Untersuchung der Aktivität von Matrix-Metalloproteasen, Lysyloxidase oder andere relevante biochemische Spezies in 3D-Tumormodellen, die direkt mit den Matrixumbau verknüpft sind. Über die Anwendung von 3D-Tumormodellen hier beschrieben, könnte man sich vorstellen, die weitere Umsetzung dieses Ansatzes in Verbindung mit anderen Krankheitsmodell Systeme, in denen Modifikation der Matrix Rheologie über die Zeit spielt eine wichtige Rolle 46,47. Die Nützlichkeit dieses Verfahrens weiter durch Software-Verbesserungen gesteigert werden, daß weitere Automatene die Verfahren und damit für erhöhten Durchsatz Studien. Dies wird zunehmend detaillierte Momentaufnahmen von der physischen Landschaft der viele Proben gleichzeitig für den Einsatz in Multi-Well-Format führen.
Hier wir speziell auf die Implementierung von passiven Partikelverfolgungs Mikrorheologie 3D-Tumormodelle, die zur Messung der linearen viskoelastischen Reaktion im Bereich von gut geeignet ist ~ Zehn Pascal typisch für im Handel erhältliche Produkte der extrazellulären Matrix (Kollagen, EHS-Tumorextrakten oder kommerzielle Nanofasergerüste). Die Beobachtung von stochastischen, thermisch angetriebene Bewegung, auch mit hoher numerischer Apertur Optik auf kleine Sonde Verschiebungen zu quantifizieren, ist von Natur aus auf den linearen Bereich dieser relativ weichen ECM-Umfeld beschränkt, sondern die Ermittler in dem Wunsch, mehr starren Materialien untersuchen können dieses Protokoll anzupassen für die Verwendung mit aktiven Manipulationen über optische oder magnetische Fang 48 49 von Sonden. Since die optischen oder magnetischen Pinzette Sonde einen einzelnen Punkt in einer Probe und beeinflussen nicht die Integrität der Probe könnten diese Techniken möglicherweise in dem obigen Protokoll integriert werden, um Messungen des Längs steifere Proben zu erhalten.
Es ist wichtig zu beachten, dass andere Zelle erzeugten Kräfte können auch an Tracer Sondenbewegungen zu verschiedenen Zeitskalen beitragen. Beispielsweise bei der Zellmigration im Laufe von Stunden und Tagen in Kultur auftritt, Gruppen von Sonden geschoben und gezogen durch Zellbewegungen und es ist in der Tat, dass diese Bewegung in Traktionskraftmikroskopie 50,51 verwendet wird. Die thermisch angetriebene Sonde Bewegungen, die analysiert werden, um Daten zu erhalten Mikrorheologie statt in der Größenordnung von Sekunden, eine klar trennbare Zeitskala. Zwar ist es auch wahr, dass die langsameren Dynamik der Belastungen mit Traktionskräfte verbunden sind, können lokale Änderungen in der Rheologie 36, einer Stärke von diesem Abbildungs-b beitragenased Ansatzes liegt in der Fähigkeit, visuelle und rheologische Veränderungen in der Probe korreliert. Beispielsweise in den repräsentativen Ergebnissen in Fig. 3 offensichtlich Matrixinvasion und Zellmigration Ereignis mit einer Änderung von G 'fast vier Größenordnungen in der Zeit diese Migration erfolgt korreliert.
Das hier beschriebene Protokoll nimmt an, dass Nutzer Zugang zu einem Mikroskop mit einer motorisierten Stufe, reproduzierbare Positionierung der Probe liefert. Labs, die nicht diese Instrumente haben könnte immer noch Punktmessungen mit Markierungen oder andere visuelle Hinweise in der Probe oder Probenträger auf wiederholte Messungen an der gleichen Stelle zu ermöglichen, obwohl es wahrscheinlich schwierig sein, wie in der Abbildung gezeigt, um die gleiche Reproduzierbarkeit bei der Positionierung zu erreichen repräsentativen Längsschnittmessungen hier. Wurde für die Zwecke dieser repräsentativen obigen Ergebnissen Positionieren auf der z-Achse in etwa konstant gehalten. Doch das Protokoll could geändert werden, um zusätzliche Messungen entlang der z-Achse, um eine 3D-rheologischen Karte von der Probe zu erstellen sind. Das Verfahren könnte auch so modifiziert werden, um ein konfokales Laser-Scanning-oder Multiphotonen-Techniken ein für 3D-Schneiden obwohl Scan-Geschwindigkeiten würde eine Beschränkung auf den oberen Frequenzgrenzen zugänglich, das kann oder nicht problematisch sein kann für eine bestimmte Anwendung zu verhängen zu nutzen.
In diesem Verfahren wird ein erheblicher Zeitbeschränkung durch die Notwendigkeit der Rück lebenden Zellen in den Inkubator eingeführt. Ohne eine Zeitraffer-Wetterstation Gehäuse für Temperatur, Luftfeuchtigkeit und CO 2 Ebenen zu steuern, müssen Bildaufnahmezeit minimiert werden. Auch mit der richtigen Ausrüstung, nimmt der Datenerhebung bis große Mengen an Zeit und digitale Speicher, der sowohl unter praktischen Grenzen sind. Zum Beispiel mit Mikroskop und Kamera in dieser Studie verwendet, würde es rund 35 Stunden dauern, bis die rund 4.000 Videos erforderlichen Maßnahmen, um eine einzige gut auf einer Karte 96-Well-Platte mit einem 100X-Objektiv ohne Leerzeichen zwischen Sichtfelder. Diese Faktoren legen der Anzahl der Datenpunkte, die realistisch gesammelt werden können. Der Detailgrad ist daher unter den Sachzwängen durch die Zeit für die Datenerfassung, Datenspeicherplatz und die Verfügbarkeit eines Umwelt Gehäuse verfügbar auferlegt.
Die Fähigkeit, Änderungen in ECM Rheologie quantifizieren kann ferner neben bildbasierte Verfahren zur Quantifizierung der therapeutischen Antwort in 3D Tumormodellen 17,18,52,53 integriert werden. Die bei beiden Verfahren angenommen Multi-Well-Kultursystem 3D-Modell schlägt vor, eine parallele Implementierung Bereitstellen Korrelation zwischen zytotoxischen Reaktion und Modifikation der mechanischen Umgebung. Dies könnte die Entwicklung weiterer Strategien, die explizit Ziel der mechanischen Phänotyp oder erläutern die Auswirkungen der bestehenden Therapeutika in dieser Eigenschaft zu erleichtern. Solche Erkenntnisse könnten unmittelbar relevant für eine seinpproaches Drug Delivery durch dichten Kollagenreichen Tumor Stroma zu verbessern. Beispielsweise im Rahmen der repräsentativen Darstellung dieses Protokoll vorgestellt hier mit Pankreas in vitro-Tumormodellen, die Auswertung der Matrixabbau folgende Maßnahmen könnte in Screening Stromazellen Verarmungsschemata, eine zunehmend wichtige therapeutische Paradigma für Bauchspeicheldrüsenkrebs 54 verwendet werden.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Wir danken für die Open-Source-Nutzung von MATLAB Partikel-Tracking-Code von Maria Kilfoil vorgesehen ( http://people.umass.edu/kilfoil/ ), zusammen mit dem früheren IDL-Code und eine umfangreiche Dokumentation von John C. Crocker und Eric bereitgestellt R. Weeks. Diese Arbeit durch Mittel aus dem National Cancer Institute (NCI / NIH), K99CA155045 und R00CA155045 (: JPC PI) ermöglicht.
Materialien
| Name | Company | Catalog Number | Comments |
| Bovine type 1 collagen | BD Biosciences, San Jose, CA | 354231 | |
| PANC-1 | American Type Cell Culture, Manassas, VA | CRL1469 | or other appropriate cell type |
| Fluorescent Microspheres | Life Technologies, Carlsbad, CA | 906906 | |
| Matrigel | BD Biosciences, Bedford, MA | 354230 | |
| Agarose | Fisher Bioreagents, Waltham, MA | C12H18O9 | |
| NaOH | Fisher Bioreagents, Waltham, MA | NC0480985 | |
| 96-well Imaging plates | Corning Inc., Corning, NY | 3904 | |
| DMEM | Hyclone, Waltham, MA | SH30243.01 | or appropriate cell culture media |
| Zeiss AxioObsever Microscope | Zeiss, Oberkochen, Germany | includes high-speed camera and imaging software | |
| MATLAB software | The Mathworks, Natick, MA |
Referenzen
- Bissell, M. J., et al. Tissue structure, nuclear organization, and gene expression in normal and malignant breast. Cancer Res. 59, 1757-1763 (1999).
- Kumar, S., Weaver, V. M. Mechanics, malignancy, and metastasis: the force journey of a tumor cell. Cancer metastasis reviews. 28, 113-127 (2009).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer cell. 8, 241-254 (2005).
- Bershadsky, A. D., Balaban, N. Q., Geiger, B. Adhesion-dependent cell mechanosensitivity. Annual review of cell and developmental biology. 19, 677-695 (2003).
- Dupont, S., et al. Role of YAP/TAZ in mechanotransduction. Nature. 474, 179-183 (2011).
- Ingber, D. E. Tensegrity-based mechanosensing from macro to micro. Prog Biophys Mol Biol. 97, 163-179 (2008).
- Peyton, S. R., Ghajar, C. M., Khatiwala, C. B., Putnam, A. J. The emergence of ECM mechanics and cytoskeletal tension as important regulators of cell function. Cell Biochem Biophys. 47, 300-320 (2007).
- Schmeichel, K. L., Bissell, M. J. Modeling tissue-specific signaling and organ function in three dimensions. J Cell Sci. 116, 2377-2388 (2003).
- Nelson, C. M., Bissell, M. J. Of extracellular matrix, scaffolds, and signaling: tissue architecture regulates development, homeostasis, and cancer. Annu Rev Cell Dev Biol. 22, 287-309 (2006).
- Butcher, D. T., Alliston, T., Weaver, V. M. A tense situation: forcing tumour progression. Nat Rev Cancer. 9, 108-122 (2009).
- Assoian, R. K., Klein, E. A. Growth control by intracellular tension and extracellular stiffness. Trends Cell Biol. 18, 347-352 (2008).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nat Methods. 4, 359-365 (2007).
- Debnath, J., Brugge, J. S. Modelling glandular epithelial cancers in three-dimensional cultures. Nature reviews. Cancer. 5, 675-688 (2005).
- Ulrich, T. A., Jain, A., Tanner, K., MacKay, J. L., Kumar, S. Probing cellular mechanobiology in three-dimensional culture with collagen-agarose matrices. Biomaterials. 31, 1875-1884 (2010).
- Abu-Yousif, A. O., Rizvi, I., Evans, C. L., Celli, J. P., Hasan, T. PuraMatrix encapsulation of cancer cells. J. Vis. Exp. (34), e1692(2009).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30, 256-268 (2003).
- Celli, J. P., Rizvi, I., Evans, C. L., Abu-Yousif, A. O., Hasan, T. Quantitative imaging reveals heterogeneous growth dynamics and treatment-dependent residual tumor distributions in a three-dimensional ovarian cancer model. J Biomed Opt. 15, 051603-051610 (2010).
- Rizvi, I., et al. Synergistic Enhancement of Carboplatin Efficacy with Photodynamic Therapy in a Three-Dimensional Model for Micrometastatic Ovarian Cancer. Cancer Res. 70, 9319-9328 (2010).
- Cretu, A., Castagnino, P., Assoian, R. Studying the Effects of Matrix Stiffness on Cellular Function using Acrylamide-based Hydrogels. J. Vis. Exp. (42), e2089(2010).
- Kenny, H. A., Lengyel, E. MMP-2 functions as an early response protein in ovarian cancer metastasis. Cell Cycle. 8, (2009).
- Kenny, H. A., Kaur, S., Coussens, L. M., Lengyel, E. The initial steps of ovarian cancer cell metastasis are mediated by MMP-2 cleavage of vitronectin and fibronectin. J Clin Invest. 118, 1367-1379 (2008).
- Lee, J. M., Dedhar, S., Kalluri, R., Thompson, E. W. The epithelial-mesenchymal transition: new insights in signaling, development, and disease. J Cell Biol. 172, 973-981 (2006).
- Mason, T. G., Weitz, D. A. Optical Measurements of Frequency-Dependent Linear Viscoelastic Moduli of Complex Fluids. Physical Review Letters. 74, 1250(1995).
- Mason, T. G., Ganesan, K., van Zanten, J. H., Wirtz, D., Kuo, S. C. Particle Tracking Microrheology of Complex Fluids. Physical Review Letters. 79, 3282-3285 (1997).
- Crocker, J. C., et al. Two-Point Microrheology of Inhomogeneous Soft Materials. Physical Review Letters. 85, 888(2000).
- Valentine, M. T., et al. Investigating the microenvironments of inhomogeneous soft materials with multiple particle tracking. Physical Review E. 64, 061506(2001).
- Helfer, E., et al. Microrheology of Biopolymer-Membrane Complexes. Physical Review Letters. 85, 457(2000).
- Levine, A. J., Lubensky, T. C. One- and Two-Particle Microrheology. Physical Review Letters. 85, 1774(2000).
- Jonas, M., Huang, H., Kamm, R. D., So, P. T. Fast fluorescence laser tracking microrheometry, II: quantitative studies of cytoskeletal mechanotransduction. Biophys J. 95, 895-909 (2008).
- Celli, J., et al. Viscoelastic properties and dynamics of porcine gastric mucin. Biomacromolecules. 6, 1329-1333 (2005).
- Pelletier, V., Gal, N., Fournier, P., Kilfoil, M. L. Microrheology of microtubule solutions and actin-microtubule composite networks. Phys Rev Lett. 102, 188303(2009).
- Bloom, R. J., George, J. P., Celedon, A., Sun, S. X., Wirtz, D. Mapping local matrix remodeling induced by a migrating tumor cell using three-dimensional multiple-particle tracking. Biophys J. 95, 4077-4088 (2008).
- Gordon, V. D., et al. Measuring the mechanical stress induced by an expanding multicellular tumor system: a case study. Exp Cell Res. 289, 58-66 (2003).
- Li, Y., Schnekenburger, J., Duits, M. H. Intracellular particle tracking as a tool for tumor cell characterization. J Biomed Opt. 14, 064005(2009).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical Mapping of Live Cells by Multiple-Particle-Tracking Microrheology. Biophysical Journal. 83, 3162-3176 (2002).
- Gjorevski, N., Nelson, C. M. Mapping of Mechanical Strains and Stresses around Quiescent Engineered Three-Dimensional Epithelial Tissues. Biophysical Journal. 103, 152-162 (2012).
- Yang, Y. L., Motte, S., Kaufman, L. J. Pore size variable type I collagen gels and their interaction with glioma cells. Biomaterials. 31, 5678-5688 (2010).
- Ludwig, T., Kirmse, R., Poole, K., Schwarz, U. S. Probing cellular microenvironments and tissue remodeling by atomic force microscopy. Pflugers Archiv : European journal of physiology. 456, 29-49 (2008).
- Sipos, B., et al. A comprehensive characterization of pancreatic ductal carcinoma cell lines: towards the establishment of an in vitro research platform. Virchows Archiv : an international journal of pathology. 442, 444-452 (2003).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods Mol Med. 140, 141-151 (2007).
- Kim, J. B. Three-dimensional tissue culture models in cancer biology. Semin Cancer Biol. 15, 365-377 (2005).
- Crocker, J. C., Grier, D. G. Methods of Digital Video Microscopy for Colloidal Studies. Journal of Colloid and Interface Science. 179, 298-310 (1996).
- Savin, T., Doyle, P. S. Static and Dynamic Errors in Particle Tracking Microrheology. Biophysical Journal. 88, 623-638 (2005).
- Evans, C. L., et al. Killing hypoxic cell populations in a 3D tumor model with EtNBS-PDT. PLoS ONE. 6, e23434(2011).
- Debnath, J., et al. The role of apoptosis in creating and maintaining luminal space within normal and oncogene-expressing mammary acini. Cell. 111, 29-40 (2002).
- Celli, J. P., et al. Helicobacter pylori moves through mucus by reducing mucin viscoelasticity. Proc Natl Acad Sci U S A. 106, 14321-14326 (2009).
- Bansil, R., Celli, J. P., Hardcastle, J. M., Turner, B. S. The Influence of Mucus Microstructure and Rheology in Helicobacter pylori Infection. Frontiers in immunology. 4, 310(2013).
- Furst, E. M. Applications of laser tweezers in complex fluid rheology. Current Opinion in Colloid & Interface Science. 10, 79-86 (2005).
- Gosse, C., Croquette, V. Magnetic Tweezers: Micromanipulation and Force Measurement at the Molecular Level. Biophysical Journal. 82, 3314-3329 (2002).
- Dembo, M., Wang, Y. -L. Stresses at the Cell-to-Substrate Interface during Locomotion of Fibroblasts. Biophysical Journal. 76, 2307-2316 (1999).
- Franck, C., Maskarinec, S. A., Tirrell, D. A., Ravichandran, G. Three-dimensional traction force microscopy: a new tool for quantifying cell-matrix interactions. PLoS ONE. 6, e17833(2011).
- Celli, J. P., Petrovic, L., Massdodi, I., Rizvi, I., Hasan, T. Overcoming therapeutic resistance in pancreatic cancer is not a simple mix of PDT and chemotherapy: Evaluation of PDT-chemotherapy combinations in 3D tumor models. Proc SPIE. , 85680R-85680R (2013).
- Glidden, M. D., et al. Image-Based Quantification of Benzoporphyrin Derivative Uptake, Localization, and Photobleaching in 3D Tumor Models, for Optimization of PDT Parameters. Theranostics. 2, 827-839 (2012).
- Celli, J. P., et al. An imaging-based platform for high-content, quantitative evaluation of therapeutic response in 3D tumour models. Scientific reports. 4, 3751-3710 (2014).
- Celli, J. P. Stromal interactions as regulators of tumor growth and therapeutic response: A potential target for photodynamic therapy. Israel journal of chemistry. 52, 757-766 (2012).
- Garber, K. Stromal depletion goes on trial in pancreatic cancer. J Natl Cancer Inst. 102, 448-450 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten