Method Article
种系线虫与胸苷模拟教育的细胞周期分析
摘要
本文描述了一种基于成像的方法, 可用于识别 S 相和分析种系中的细胞周期动力学. 此方法不需要转基因, 并且与免疫荧光染色兼容。
摘要
真核细胞中的细胞周期分析经常利用染色体的形态、表达和/或定位所需的基因产品的各个阶段的细胞周期, 或合并核苷类似物。在 S 阶段, DNA 聚合酶将胸苷类似物 (如教育或 BrdU) 纳入染色体 DNA, 标记细胞进行分析。对于线虫, 核苷模拟教育在常规培养过程中被送入蠕虫, 并与免疫荧光技术兼容。种系是一种功能强大的模型系统, 用于研究信号通路、干细胞、减数分裂和细胞周期, 因为它是透明的、遗传的, 并且减数分裂前期和细胞分化/配子发生在线性装配样的时尚。这些特点使教育成为研究有丝分裂循环细胞和种系发展动态方面的一个很好的工具。该协议描述如何成功地准备教育细菌, 饲料他们到野生类型的线虫雌雄同体, 解剖双性性腺, 染色为教育纳入 DNA, 染色与抗体检测各种细胞周期和发展标记, 形象性腺和分析结果。该协议描述了测量 S 相指数、M 相指数、G2 持续时间、细胞周期持续时间、减数分裂率和减数分裂前期级数的方法和分析的变化。该方法可用于研究其他组织、阶段、遗传背景和生理条件下的细胞周期或细胞史。
引言
在动物发展中, 需要数以百计、数以千计、数以亿计的细胞分裂来形成成年有机体。细胞周期, 由 G1 (间隙)、S (合成)、G2 (间隙) 和 M (有丝分裂) 组成的细胞事件集定义了执行每个单元格除法的一系列事件。细胞周期是动态的, 最好是实时地得到赞赏, 这可能是技术上的困难。本协议中提供的技术允许一个人对静止图像进行细胞周期的相位和时间测量。
用核苷类似物 (如 5-乙炔-2 '-脱氧尿苷) 或 5-溴-2 '-脱氧尿苷 (BrdU) 进行标记, 是确定线虫线虫(线虫) 成人细胞周期动力学研究中 S 相的金标准。双性种系1,2,3,4,5。教育和 BrdU 几乎可以用于任何遗传背景, 因为它们不依赖任何基因结构。可视化 BrdU 需要苛刻的化学处理, 以暴露抗原的抗 BrdU 抗体染色, 这往往是不相容的评估其他细胞标记与其他抗体共同染色可视化。相比之下, 在轻度条件下, 通过单击化学进行可视化, 从而与抗体共染色6、7兼容。
标签的特异性是明确的, 因为原子核只在 S 阶段将胸苷 (5-乙炔-2 '-脱氧尿苷) 类似物纳入 DNA。可视化发生在固定组织中。该教育标签本身是无形的, 直到含有叠氮化物的染料或荧光基团与炔烃的铜催化单击化学8反应共价键。教育标签可以提供即时信息, 其中原子核是在 S 相, 使用短脉冲标记。教育还可以提供动态信息, 使用脉冲追逐或连续标记;例如, 在脉冲追逐实验中, 标签被稀释在每个细胞分裂或传播作为非分裂细胞进展通过开发。
线虫种系是一种强大的模型系统, 用于研究信号通路、干细胞、减数分裂和细胞周期。成人种系是一种极化装配线, 在远端发现了干细胞, 随后通过减数分裂前期进入和级数, 与配子的分期相协调 (图 1)。在近端, 卵母细胞成熟, 是排卵和受精和开始胚胎发生在子宫9,10,11。远端尖端细胞附近的约20个细胞直径长的区域, 包括有丝分裂循环种系茎、祖细胞和减数分裂的 S 相细胞, 而不是减数分裂前期的细胞, 被称为祖区2,4,9,12. 细胞膜在远端种系核之间不完全分离, 但祖细胞在很大程度上独立进行有丝分裂细胞循环。年轻成人雌雄同体种系祖区细胞中有丝分裂细胞周期的中位数为 6.5 h;G1 期短或不存在, 平静未观察到1、2、13。种系干细胞分化发生的主要原因是直接分化, 因此缺乏4的过境放大。在粗线期阶段的分化过程中, 大约4的5核不会形成卵母细胞, 而是通过细胞凋亡, 通过将胞质含量捐献给发育中的卵子12、14 , 作为护士体细胞。,15。
除了用核苷类似物标记 S 相的细胞外, 还可以使用抗体染色识别有丝分裂和减数分裂中的细胞。有丝分裂中的细胞核是免疫的抗磷组蛋白 H3 (Ser10) 抗体 (称为 pH3)7,16。减数分裂中的细胞核是免疫 anti-HIM-3 抗体 (减数分裂染色体轴蛋白)17。祖区的细胞核可以通过缺乏 HIM-3、nucleoplasmic REC-818的存在或 WAPL-119的存在来识别。WAPL-1 强度在体细胞性腺中最高, 祖区高, 早期减数分裂 prophases19。几个细胞周期测量是可能的, 在协议中的一些变化: I) 在 s 相和测量 s 相指数中识别核;II) 确定 m 相核, 测量 m 相指数;III) 确定核是否在有丝分裂或减数分裂的 S 阶段;IV) 测量 G2 的持续时间;V) 测量 G2+M+G1 阶段的 duartion;VI) 测量减数分裂的进入率;VII) 估计减数分裂的进展率。
一个可以做多细胞周期测量从几个类型的湿实验室实验。下面的协议描述了30分钟脉冲标记喂养C. 线虫成人雌雄同体与教育标记细菌和联合标记 M 相细胞通过染色与 anti-pH3 抗体和祖细胞的染色 anti-WAPL-1 抗体。只有在教育饲料的持续时间 (步骤 2.5), 使用的抗体类型 (步骤 5) 和分析 (步骤 8.3) 的变化在额外的测量需要。
研究方案
1. 教育标记细菌的制备
-
培养 MG1693 的初学者文化。大肠杆菌(大肠杆菌) MG1693 在 thyA 中携带突变。
- 将大肠杆菌MG1693 从冷冻甘油储存到120毫米溶源性汤 (LB) 琼脂培养皿中。文化在37摄氏度过夜。
- 从两个单独的大肠杆菌MG1693 菌落接种到两个重复的4毫升液体 LB 管, 37 摄氏度, 16 小时。
注意: MG1693 在 LB 中生长良好, 无需补充胸腺嘧啶或胸苷。
-
在最小培养基中生长大肠杆菌MG1693, 辅以教育。
- 热压罐500毫升锥形烧瓶。
- 使用无菌技术添加5毫升20% 葡萄糖, 50 微升10毫克/毫升的硫胺, 120 微升5毫米胸苷, 100 微升 1 M MgSO4, 200 微升的10毫米教育, 100 毫升的 M9 缓冲液, 和4毫升新鲜生长的过夜 MG1693 文化。
注意: 教育的最终浓度是20微米在这种文化1,7。如果直接应用于培养的哺乳动物细胞, 这种浓度会导致 DNA 损伤和细胞周期骤停20。然而, 只有一小部分此教育被纳入大肠杆菌, 因此可供C. 线虫。没有证据显示细胞周期骤停, 并没有变化的祖区的大小或 M 相指数后, 教育治疗年轻成人雌雄同体。 - 文化过夜, 但不超过24小时在37摄氏度, 震动 200 rpm。
-
浓缩 M9 琼脂培养皿。
- 将台式离心机预冷却至4摄氏度。
- 使用无菌技术将培养基转移到2–4无菌50毫升锥形管中。
- 离心培养在 3000 x g在4摄氏度, 30 分钟, 以颗粒的教育标记大肠杆菌。
注: 根据当地和机构的指导方针, 处理含教育的上清液。 - 用4毫升新鲜 M9 重悬球团。使用无菌1毫升吸管尖端或无菌5毫升血清吸管。重悬颗粒可能需要几分钟时间。
- 使用相同的吸管应用和传播 ~ 8 滴重悬 MG1693 的大肠杆菌标记为室温60毫米 M9 琼脂培养皿的中心。一批产量约16道菜。
- 让盘子在室温下干燥几个小时或一夜之间, 然后用一条实验室胶卷封住每道菜。菜肴的存放时间为15摄氏度, 约为2周, 4 摄氏度为2月。为每套实验使用相同批次的教育菜肴。
2. 向线虫喂食
- 通过定时产卵, 碱性次氯酸盐处理, 然后孵化成 S 培养基与胆固醇, 或选择适当的阶段21同步人口。将动物生长到所需的阶段 (在这里, 24 h post-L4) 的线虫生长培养基种子与大肠杆菌OP50 在20摄氏度。
注意: 每个实验准备50–100动物, 因为有些可能没有解剖好, 其他人将失去在洗涤和转移的过程中。 - 让教育皿加热至20摄氏度 (或实验所需的温度)。
- 使用 M9 或磷酸盐缓冲盐水 (PBS) 将动物从 NGM 盘子中洗净到1.5 毫升管中。允许动物短暂地通过重力或微量离心的短暂旋转来解决。
- 除去上清液, 用约1毫升的 M9 或 PBS 洗涤动物。移除上清液。
- 使用玻璃巴斯德式移液器将动物在 M9 或 PBS 的小滴转移到教育草坪的中心。等待几分钟的液体被吸收, 然后孵育在20摄氏度30分钟 (用于直接 S 相测量) 或更长 (测量 s 相的历史), 根据需要。
注意: 教育信号在种系核中可检测到15分钟的教育喂养1。 - 用约2毫升的 M9 或 PBS 将这些蠕虫从教育皿中洗净, 放入玻璃解剖皿中。
3.线虫种系的解剖和固定
注意: 此协议的解剖, 固定和抗体染色的C. 线虫双性种系几乎相同的热尔韦斯和 Arur (2016)22, 除了1毫升玻璃管可以离心加速洗涤步骤和抽出的玻璃巴斯德移液器可用于更有效地去除1毫升玻璃管中的液体。
-
清洗和解剖线虫他们。
- 允许动物沉降到解剖盘的底部, 漩涡收集中心的动物, 使用长的巴斯德移液器去除 PBS。用约2毫升的 PBS 洗涤。
- 添加2毫升 PBS 和4微升100毫米左旋咪唑固定的动物。再次旋转盘子, 收集食物中心的动物。
注意: 固定可能需要几秒钟和几分钟之间。完全固定是不必要的成功解剖。有些人在解剖不完全固定的动物时有更好的成功。 - 通过切割头部 (大约两个咽球茎之间) 或尾巴, 解剖动物与一对 25G 5/8 "针。注意不要切断种系的循环。肠道和种系应 "弹出" 的体腔由于内部压力, 但保持附着。此协议类似于以前发布的热尔韦斯和 Arur (2016)22。
注意: 将解剖时间保持在 ~ 5 分钟, 当然不超过15分钟. 较长的解剖时间可能导致抗体染色信号 (苏迪尔纳亚克、个人通信) 的损失和 PBS 中的饥饿可能影响动物的生理。学习快速准确地解剖可能需要一些练习。 - 如果需要, 漩涡收集在中心解剖的动物, 并使用一个长的巴斯德移液器尽可能地去除尽可能多的 PBS。
-
修复和脱水组织
- 在 PBS 溶液中加入 2 mL 3% 多聚甲醛 (PFA)。用实验室胶片将盘子松散地盖上, 在长凳上或抽屉里存放10分钟。
注: 在37摄氏度水浴中解冻 PFA 溶液, 然后在解剖他们前冷却至室温。
注意: PFA 溶液是中等毒性的, 可能致癌物和致畸剂。从多聚甲醛溶液发出的蒸汽是易燃的。戴上丁腈橡胶手套。在化学烟雾罩中稀释 PFA 从16% 到3%。在油烟机外面工作时, 要把所有的容器都盖好。 - 将性腺仔细转移到干净的5毫升玻璃离心管。
- 添加 ~ 3 毫升的 PBSTw (PBS 与 0.1% Tween-20) 的菜, 包含性腺, 以帮助检索剩余的性腺和稀释 PFA 溶液。
- 在 870 x g的临床离心机中向下旋转约1分钟. 年轻或较小的动物需要比年龄较大或较大的动物更长的旋转时间。
- 使用长玻璃移液器, 将上清液转移到不需要的材料烧杯中, 最终丢弃在化学遮光罩中不需要的材料瓶中。
- 加入2毫升高品位甲醇预冷至-20 摄氏度。用实验室膜紧紧盖住离心管。
注: 使用新鲜的高品位 "金标签" 甲醇是必要的正确形态学与某些抗体。
注意: 甲醇是一种高度易燃的液体和蒸气, 如果吞咽、吸入或允许接触皮肤, 则有毒。戴上手套和适当的个人防护装备。使用适合小体积易燃物的冰柜。 - 在-20 摄氏度冷藏箱中储存1小时, 甚至一夜甚至数月。
注意: 协议可以在这里暂停。
- 在 PBS 溶液中加入 2 mL 3% 多聚甲醛 (PFA)。用实验室胶片将盘子松散地盖上, 在长凳上或抽屉里存放10分钟。
4. 他们补充水分
- 用 PBSTw 将玻璃离心管填充到顶部, 稀释甲醇并使性腺水化。在 870 x g的临床离心机中向下旋转约1分钟。
- 使用长玻璃巴斯德移液器, 将上清液转移到不需要的材料烧杯中, 最终丢弃在化学遮光罩中不需要的材料瓶中。
- 使用约5毫升的 PBSTw 洗涤性腺3次, 在 870 x g的临床离心机中旋转, 每次1分钟。移除上清液。
- 用 PBSTw 冲洗小1毫升硼硅酸盐玻璃管和长玻璃巴斯德式移液器。
- 加入约700微升的 PBSTw, 使用长玻璃巴斯德式移液器将性腺转移到小管上。使用一些额外的 PBSTw, 以确保所有性腺转移。
- 在 870 x g的临床离心机中向下旋转1分钟. 使用抽出的长玻璃巴斯德式移液器, 尽可能去除尽可能多的液体, 而不会干扰性腺。不要超过50微升。
注意: 如果不需要抗体检测, 请跳至步骤6。
5. 用抗体检测抗原
- 在 PBS 中稀释30% 血清中的原发性抗体。在本例中, anti-WAPL-1 抗体稀释 1:2, 000 和 anti-pH3 抗体稀释1:500。离心新鲜解冻的血清10分钟在一个微量离心在 2万 x g在4摄氏度去除微粒。使用上清, 可以存储在4摄氏度几天。使用适当的血清来匹配第二抗体的宿主有机体 (这里使用山羊血清)。在添加主要抗体之前, 可选择阻塞步骤。
- 将100微升稀释的原抗体应用于每个小玻璃管。在室温下孵育4小时。
注: 孵育时间因抗体而异。对于某些抗体, 室温下2小时就足够了。更长的孵化 (例如, 过夜) 是可能的, 但可能增加背景。 - 用 PBSTw 将管子装入顶部, 在 870 x g的临床离心机中向下旋转1分钟。
- 用约1毫升的 PBSTw 洗涤性腺3次. 每次洗涤孵育5分钟, 使过量的原代抗体扩散到洗涤中。使用抽出的长玻璃巴斯德式移液器, 尽可能去除尽可能多的液体, 而不会干扰性腺。不要超过50微升。
- 在 PBS 中稀释30% 山羊血清中的二次抗体。在本例中, goat-anti-rabbit-594 和 goat-anti-mouse-647 分别在1:400 处稀释。
注: 请仔细选择二次抗体, 确保染料与教育试剂盒中的染料不同。在本例中, 教育套件包含 488 nm 的激发染料。 - 在每个小玻璃管中应用100微升稀释二抗。在室温下孵育2小时。
注: 孵育时间因抗体而异。对于某些二级抗体, 室温下1小时就足够了。更长的孵化 (例如, 过夜) 是可能的, 但可能增加背景。 - 用约1毫升的 PBSTw 洗3次性腺. 每次洗涤孵育约5分钟, 以允许过量的二级抗体扩散到洗涤中。使用抽出的长玻璃巴斯德式移液器, 尽可能去除尽可能多的液体, 而不会干扰性腺。不要超过50微升。
注意: 如果有必要, 可以在100微升的 PBS 中存储性腺, 但这可能会降低信号。在继续之前, 请删除 PBS。
6. 执行教育点击反应来检测教育
注: 在抗体染色步骤 (执行步骤6之前的步骤 5) 之前执行的教育单击反应是可能的, 具体取决于使用的抗体7。然而, 单击试剂可能会干扰某些抗原 (REC-8抗体对固定和透化敏感)。在这里提出的命令产生明亮的抗体染色与 REC-8, WAPL-1, HIM-3, pH3, 标志和 CYE-1 抗体使用, 等等。
-
准备单击教育鸡尾酒8新鲜通过添加以下到一个干净的1.5 毫升管。添加的顺序很重要。保护光线, 并保持冰上的所有试剂。该配方的产量足以满足一个样品 (100 微升);根据需要相乘配方。
- 将2毫升超纯水添加到缓冲添加剂中。这使得10x 缓冲添加剂, 必须在使用前立即稀释到1x。
- 添加8.5 微升的10x 缓冲液到76.5 微升的超纯水。混合好。
- 添加4微升 100 mM 丘索4 (可标记为组件 E)。混合好。
- 加入0.25 微升的 488 nm 染料叠氮化物。它必须在室温下解冻, 因为它的溶剂, 二甲基亚砜, 是固体在4摄氏度。混合好, 防止光。
- 混合9微升的超纯水与1微升的缓冲添加剂在管帽。从盖子的吸管添加到剩余的鸡尾酒, 并通过移液和上下混合好。
-
执行教育点击反应。
- 添加 ~ 100 微升的点击教育鸡尾酒到在小管的性腺。盖上实验室膜, 室温下孵育30-60 分钟。
- 用100微升的反应冲洗缓冲液洗涤一次。
- 用约1毫升的 PBSTw 洗涤性腺4次. 每次洗涤孵育约15分钟, 允许过量的教育鸡尾酒成分扩散到洗涤中。使用抽出的长玻璃巴斯德式移液器, 尽可能去除尽可能多的液体, 而不会干扰性腺。不要超过50微升。
7. 染色 DNA 和准备幻灯片
- 添加1滴 (~ 25 微升) 的抗淬灭安装培养基与 4 ', 6-diamidino-2-苯基吲哚 (DAPI, 用于可视化脱氧核糖核酸) 到性腺。等待几分钟, 以便它可以解决和与性腺混合。
注: 另外, 1:1, 000 稀释的 DAPI (从0.1 毫克/毫升库存) 在 PBS 中可应用5分钟, 其次20微升 14-diazabicyclo [2.2. 2] 辛烷 (DABCO) 在90% 甘油, 或另一种抗淬灭安装介质。 - 在标准玻璃显微镜幻灯片上准备一个大的2.5% 琼脂糖垫。
- 使用新的清洁无尘长玻璃巴斯德移液器将性腺转移到琼脂糖垫上。将所有液体和性腺放在移液器的狭窄底部, 以最小化性腺的损失。
注意: 性腺粘在小玻璃管或长玻璃巴斯德斯吸管可以 "获救" 通过冲洗与 PBSTw, 收集液体在解剖皿, 并采摘单个动物在幻灯片上的睫毛。 - 用一根睫毛 (或一圈薄薄的头发) 粘在牙签上, 将性腺分布在琼脂糖垫上, 去除尘埃颗粒。
- 应用矩形玻璃盖玻片。从一侧缓慢降低, 以避免气泡。使用组织去除过量的溶液, 从而防止盖玻片自由移动。
注: 选择与将使用的显微镜相匹配的盖玻片。#1 和 #1 5 盖玻片工作良好。 - 允许幻灯片在室温或4摄氏度下过夜。这有助于稍微扁平的性腺。幻灯片应存储在4摄氏度。
- 可选: 用指甲油或另一张幻灯片封口机密封幻灯片的边缘。首先密封边角, 然后两侧, 防止盖玻片移位。
8. 共聚焦成像和分析
- 用旋转圆盘共聚焦荧光显微镜成像远端性腺, 配备高能光源、计划复消色差物镜和高效显微镜相机。在 z 栈之间捕获1微米或更紧密间距的图像。注意所有通道的激光功率、灵敏度和曝光时间。
- 使用以下内容: 405 nm 激光线路励磁, 带 485 nm (W60) 发射滤波器, 用于 DAPI, 488 nm 激光线路励磁, 带 527 nm (W55) 发射滤波器, 561 nm 激光线路励磁, 615 nm (W70) 发射滤波器 WAPL-1, 640 nm 激光线 excita用于 pH3 的 705 nm (W90) 排放过滤器。
注意: 信号强度和背景强度将有所不同。同样, 所需的曝光时间也会有所不同, 可能高达10倍。
- 使用以下内容: 405 nm 激光线路励磁, 带 485 nm (W60) 发射滤波器, 用于 DAPI, 488 nm 激光线路励磁, 带 527 nm (W55) 发射滤波器, 561 nm 激光线路励磁, 615 nm (W70) 发射滤波器 WAPL-1, 640 nm 激光线 excita用于 pH3 的 705 nm (W90) 排放过滤器。
- 使用单元格计数器插件23在斐济24,25手动计数每个原子核。根据 pH3、教育和 WAPL-1 的存在和缺失, 对每个单独的原子核进行标记。使用表 1和图 2所述的原子核类, 因为这些类型将促进下面概述的所有计算。
注意: 熟练的实验可以准确地计算3D 图像中的所有原子核, 而不会重复计数或丢失任何原子核。或者, 一个人可以计算每个 z 平面中的每个原子核, 而标记到单元 R 脚本3可用于移除乘法计数的原子核。 - 根据所需的细胞周期测量类型计算来自上述计数的细胞数和频率。原子核的类型在表1和图 2中定义。表2总结了计算结果。
- (变体 I)要确定 S 相的细胞核, 请给动物喂食30分钟。任何显示教育标签的细胞核都是 s-相核。要计算, 取求和 A 和 C 核, 参见表 1和图 2。
注意: 在野生型成人雌雄同体30分钟的教育脉冲中, 所有的教育标记核都与祖区域标记1共同标记。 - 要测量祖区, 用 REC-8 或 WAPL-1 抗体等祖区标记染色。祖区在这里定义为所有 nucleoplasmic REC-818或 WAPL-1 免疫种系核。要计算, 总和所有 WAPL-1 免疫反应核 (A + B + C + D, 请参见表 1和图 2)。
注: WAPL-1 也标记不应计数的 DTC 和体细胞性腺核。体细胞核是很容易识别的极端强烈的 WAPL-1 信号, 位置稍外的种系, 和 "煎蛋" 的细胞核形态。 - 为了测量 S 相指数, 执行30分钟的教育实验和共同标签与 REC-8 或 WAPL-1 抗体。s 相指数定义为在 s 相的祖区的比例。计算, 计数所有 S 相核, 然后除以祖区域原子核的总数 (a + c/A + B + c + D, 见表 1和图 2)。
- (变体 II)识别 M 相的细胞核, 用 pH3 抗体染色。任何 pH3 免疫反应核都是 M 相核。无论教育源的持续时间如何, 此操作都有效。要计算, 取 A 和 B 原子核的总和, 参见表 1和图 2。
注: WAPL-1 也标记不应计数的 DTC 和体细胞性腺核。体细胞核是很容易识别的极端强烈的 WAPL-1 信号, 位置稍外的种系, 和 "煎蛋" 的细胞核形态。 - 测量 M 相指数, 与 pH3 和 REC-8 或 WAPL-1 抗体共同标签。m 相指数定义为在 m 相的祖区的比例。要计算, 计数所有 M 相核, 然后除以祖区域原子核的总数 (a + b/a + b + C + D, 请参见表 1和图 2)。
- (变体 III)核在有丝分裂和减数分裂 S 相两个标签与教育。要区分两个种群, 请确定 S 相是否跟随有丝分裂或减数分裂。为了确定核是否在有丝分裂或减数分裂 S 阶段, 饲料教育为 4 h 和共同标签的 pH3 (M 相标记) 和 HIM-3 (减数分裂染色体轴蛋白) 通过抗体染色。记录显示教育和 pH3 的细胞核 (a 型, 见表 1和图 2) 作为有丝分裂 s 相, 同时显示教育和 HIM-3 的原子核 (E 型, 见表 1和图 2) 作为减数分裂 s 阶段。
- (变体 IV)计算 G2 阶段的持续时间。
注意: G2-phase 从 M 相分离 S 相。虽然没有报告标记 G2 在C. 线虫种系, 一个可以计算 G2 阶段的时间, 通过结合几个实验的数据, 标签 M 相 (在解剖时) 和 S 相 (从几个 h 开始前解剖)。在实验过程中, 显示 M 相和 s-相位标记的单元格已完成 G2-phase。在实验过程中, 仅显示 M 相标记而不是 s-相位标记的单元格不处于 s 阶段。- 为了计算 G2-phase 的持续时间, 2 小时的饲料教育和 pH3 抗体的联合标签。检查只有细胞核, 标签与 pH3 (这些是在 M 相在解剖时) 的存在的教育 (这些是在 S 阶段在2小时的教育标签之前, 解剖)。计算完成 G2-phase 的 M 相原子核的分数 (a/a + B, 见表 1和图 2)。
- 用一个3小时的教育标签重复这个实验, 再用一个4小时的教育标签 (也可以选择一个5小时的教育标签)。绘制 y 轴上的 pH3 正核的百分比和 x 轴上的教育标签持续时间, 如图 3A所示。
- 通过连接图表上的点并确定线与50% 相交的位置, 计算 G2-phase 的中值持续时间, 如图 3A所示。
- 通过连接图表上的点并确定线与99% 相交的位置来计算 G2-phase 的最大持续时间, 如图 3A所示。
- (变体 V)计算 G2+M+G1 的 duraion。
注意: 在线虫种系, G1 期异常短。虽然没有报告标记 G1 在C. 线虫种系中, 但可以估计 G2、M 和 G1 阶段的总和持续时间, 然后将此时间与上面描述的 G2-phase 时间进行比较。G2+M+G1 的最大持续时间估计从所有祖区核 (WAPL-1 免疫反应) 的百分比, 保持教育阴性 (未经历 S 阶段) 后, 教育标签几个小时。- 为了计算 G2+M+G1 的持续时间, 2 小时的饲料教育和 REC-8 或 WAPL-1 抗体的联合标签。确定在此期间经历了 S 阶段的祖先区的分数 (a + c/A + B + c + D, 请参见表 1和图 2)。
- 用一个3小时的教育标签重复这个实验, 再用一个4小时的教育标签 (也可以选择一个5小时的教育标签)。绘制 y 轴上的 REC-8 或 WAPL-1 正核的百分比, 以及 x 轴上的教育标签持续时间, 如图 3B所示。
- 通过连接图表上的点并查找线穿过99% 的位置来计算 G2+M+G1 的最大持续时间, 如图 3B所示。
注意: 通过与 rabbit-anti-WAPL-1 和 mouse-anti-pH3 抗体共同标记, 可以进行实验以确定 G2 和 G2+M+G1 的持续时间为2、3、4和 5 h 的一组实验。
- (变体 VI)为了识别在祖区复制的细胞核, 但后来进入减数分裂, 喂养动物 10 h 和共同标签与 REC-8 或 WAPL-1 抗体。在这10小时内, 任何显示教育标签的细胞核都处于 S 相。任何不显示 nucleoplasmic REC-8 或 WAPL-1 染色的细胞核均处于减数分裂中。简单地数核与教育标签不显示标记与祖区域标记 (E, 请参阅表 1)。
注意: 反之, 如果性腺被染色的减数分裂前期标记 HIM-3 与 anti-HIM-3 抗体, 计数的细胞核与教育标签, 也是积极的 HIM-3。 - 要计算减数分裂的速率, 请使用5小时、10小时和 15 h 的教育标签进行上述实验。绘制在 y 轴上输入减数分裂的原子核数量和 x 轴上的教育标签持续时间, 如图 3C所示。然后使用一个简单的线性回归计算斜率 (原子核从 y = mx + b 输入的减数分裂)。
注意: 使用线性回归计算减数分裂项的速率至关重要。仅仅将进入减数分裂的细胞核数除以教育标签的持续时间是不正确的, 因为 y 截距不是零。 - (变体 VII)测量减数分裂级数的速率。
注意: 由于教育是共价并入 DNA, 它可以用来跟踪细胞的群体通过分化。在祖区接受 S 相的细胞保留了教育标签, 因为它们进入减数分裂, 通过减数分裂的进展, 并接受卵子发生。脉冲追逐实验可以用来测量减数分裂级数的速率。- 给动物喂食4小时 ("脉搏") 的细菌。将动物转移到未标记的 OP50 细菌 48 h ("追逐"), 然后解剖和共同标签与祖区域标记, 如 REC-8 或 WAPL-1 (或减数分裂前期标记, 如 HIM-3), 如果需要。
- 当成像时, 寻找最近端的教育标记核的位置。减数分裂的速度是距离 (在细胞直径从祖区的末端) 旅行由最近的教育标记核在48小时追逐。
- (变体 I)要确定 S 相的细胞核, 请给动物喂食30分钟。任何显示教育标签的细胞核都是 s-相核。要计算, 取求和 A 和 C 核, 参见表 1和图 2。
结果
由于 DNA 合成需要纳入教育, 人们可以得出结论, 在教育标记时间窗口中, 教育标记的核经历了 S 阶段。一个可以解释的细胞核, 标签在30分钟喂养与教育标记细菌作为细胞核在 S 阶段在解剖时。在较长的连续教育喂养实验中标签的细胞核在时间窗口和左 S 相, 或者可能已经标记在教育时间窗口的晚期。本地化信号与 DAPI 信号共用。在某些原子核中, 教育信号涵盖所有染色体, 而在其他核教育信号本地化到斑点明亮的 (图 4)。这些斑点很可能是 X 染色体, 在 S 相13晚期复制。
在这里, 动物被喂养与教育连续30分钟和解剖, 如上文和图 5所述。在一个年轻的成年动物成功的教育染色的一个例子和一个例子, 不成功的教育染色在一个老的成年动物 (见下文) 如图 4所示。教育信号从30分钟标记本地化到大约一半的细胞核在祖区 (由 WAPL-1 抗体标记定义, 但近似 DAPI 形态学26,27,28)。S 相指数, 前祖区的比例是教育阳性, 以前报告在57±5% 和高达70% 在青年成人1,2,3。M 相指数约为 2–3%1,29。在连续喂养4小时或更长时间内, 祖区标签中的所有细胞核和在祖区标记的一些细胞核自进入减数分裂前期1。
虽然这项技术在野生型成年动物中一贯有效, 但交配5天老雌雄同体 (甚至那些含有精子) 的显著比例未能在30分钟的教育脉搏中标注 (图 4E)。然而, 4 小时的教育喂养, 几乎所有这些动物标签。在30的短脉冲的遗传雌性动物中出现零星的标签也被报道。可能会出现其他情况, 导致标签出现零星失败。
一个人可以通过在每个 pH3 标签上执行几个教育标签实验来计算细胞周期的持续时间。通过分析 G2 (pH3 免疫反应) 中的细胞核百分比 (图 6), 对其持续时间进行了估计。此方法提供 G2 的中值和最大持续时间 (图 3A)。中位时间进行插值, 显示在年轻成人雌雄同体的大约 G2 持续时间2.5 小时。G2+M+G1 的持续时间估计从所有祖区核 (WAPL-1 免疫反应) 的百分比是教育阳性 (图 6)。G2+M+G1 方法为组合阶段提供了最大持续时间度量值 (图 3B)。第九十九分位时间值 , 显示在年轻成人雌雄同体的大约 G2+M+G1 持续时间 3 . 4 小时。使用相同实验的数据来计算减数分裂 (核每 h) 的速率。速率是在教育标签持续时间内进入减数分裂 (教育阳性, WAPL-1 阴性或 HIM-3 阳性) 的原子核数量线性回归的斜率 (图 3C)。野生型1天成人雌雄同体的值如表 2所示。
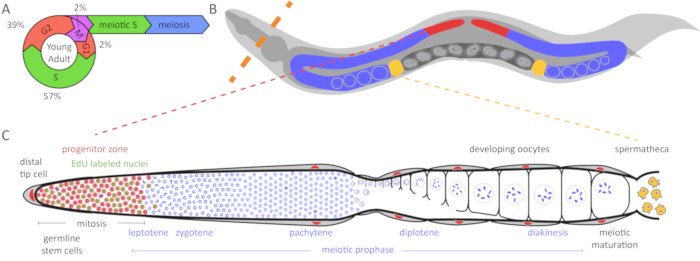
图 1:线虫种系和细胞周期图.(A) 年轻成年双性种系生殖细胞的细胞周期。数字表示每个细胞周期阶段所花时间的近似百分比。(B)线虫雌雄同体有两个 U 形他们 (红色和蓝色)。蝗受精囊以黄色显示, 胚胎发育的子宫呈深灰色。虚线橙色线指示动物被解剖, 以挤出他们。(c) 展开的种系线虫图。DAPI (蓝色) 是一种 DNA 染料, 突出核形态。远端祖区 (以红色突出显示基于 WAPL-1 抗体染色) 包含有丝分裂循环干细胞、祖细胞和减数分裂 S 相的细胞 (WAPL-1 也标记体细胞性腺核)。在有丝分裂和减数分裂 S 相标签的细胞在30分钟的教育脉冲和以绿色表示。两个细胞在 M 相标签与 pH3 抗体和显示在黑色。远端尖端细胞 (DTC) 提供 GLP-1/Notch 配体, 以维持这些细胞的干细胞命运。当细胞从 DTC 迁移离开时, 它们退出祖区并进入减数分裂前期。黄细胞是蝗受精囊的精子。请点击这里查看这个数字的更大版本.
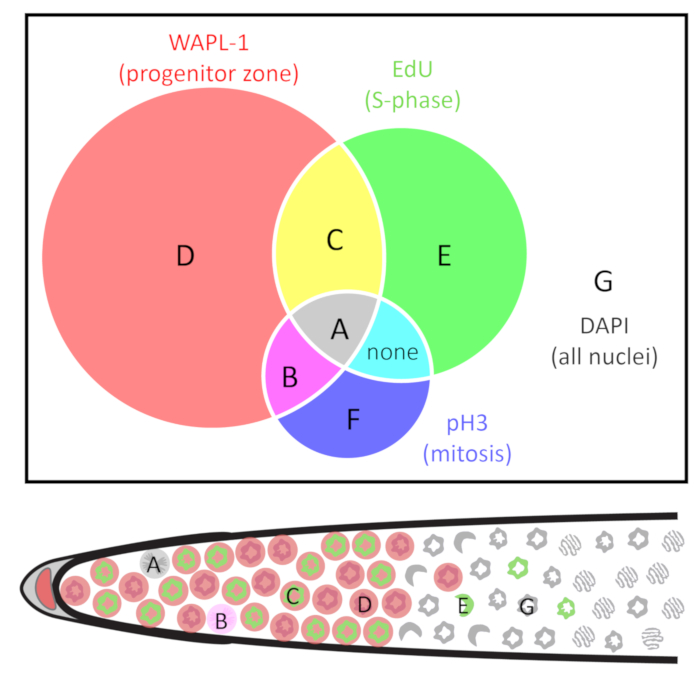
图 2: 原子核类的维恩图.原子核按三标记的存在和缺失进行分组: WAPL-1 表示祖细胞 (红色), 教育指示 S 相细胞 (绿色), pH3 表示 M 相细胞 (蓝色)。单元格类型被标识为-g。请注意, 在野生类型的年轻成人雌雄同体细胞没有找到 F 类型, 和细胞不共同标签与教育和 pH3 外的 (WAPL-1 阳性) 祖区。下面的远端性腺图表示一个 E 和 G 核的一个例子。有关详细信息, 请参阅表 1 。请点击这里查看这个数字的更大版本.

图 3: 细胞周期持续时间和减数分裂进入实验数据的图形显示.(A) G2 阶段的持续时间是从 pH3 中插值的, 并且在不同持续时间的教育脉冲的共同标记下, 灰色线表示第五十和第九十九个百分位, 用于插入中和最大 G2 时间, 由箭头指示。(B) G2、M 或 G1 阶段的细胞不包含教育。因此, G2+M+G1 阶段的最大持续时间可以通过测量产生教育阴性细胞的教育标签的最大持续时间来估计。G2+M+G1 相位的持续时间由教育和 REC-8 在不同持续时间的教育脉冲下的共同标记中插值。灰色线表示用箭头表示的插值最大 G2+M+G1 持续时间中使用的第九十九百分点。不能将中间 G2+M+G1 持续时间插值。(C) 从回归线的斜率计算减数分裂的进入率 (每 h 的原子核-见表 2)。请注意, 由于 y 截距截距不为零, 因此必须进行回归, 才能准确计算减数分裂项 (C) 的速率。.误差线表示标准偏差。图片修改和转载的许可从狐狸等。20111。请点击这里查看这个数字的更大版本.

图 4: 成功和不成功的30分钟教育染色示例.在30分钟的教育标签实验后, 共聚焦显微镜图像的1天 (a-d) 和5天 (e-H) 双性性腺 (非精子耗尽)。虚线白色线标记祖区域的末端。星号标记远端尖端的位置。绿色标记教育染色可视化通过点击化学 (A)。不成功的教育标签导致低水平背景染色, 但没有明亮的教育 + 细胞核 (E)。红色标记 WAPL-1 免疫荧光 (B, F)。黄色表示重叠 (C、G)。蓝色标记 DAPI 染色的 DNA (D, H)。单箭头表示在整个染色质染色的细胞核。双箭头表示一个核与教育斑点只对一对染色体。图像获得了63X 的目标。刻度条 = 10 µm (D、H)。请点击这里查看这个数字的更大版本.

图 5: 实验工作流程.实验协议的总结 (a), 教育标签 (B), 解剖 (C), 抗体染色 (D), 执行点击反应将染料附着到教育 (E), 染色 DNA (F), 图像他们 (G), 和量化教育标签和抗体染色细胞核 (H)。请点击这里查看这个数字的更大版本.

图 6: 成功的4小时教育染色示例.1天成人双性性腺的共聚焦显微镜图像经过4小时的教育标签实验。虚线白色线标记祖区域的末端。星号标记远端尖端的位置。洋红标记 pH3 免疫荧光 (A, C)。绿色标记教育染色可视化的点击化学 (B, C)。红色标记 WAPL-1 免疫荧光 (D)。黄色表示教育和 WAPL-1 (E) 的重叠。蓝色标记 DAPI 染色的 DNA (F)。单箭头表示细胞核与 pH3 和。双箭头标志着一个 pH3+ 的教育核-一个罕见的发生在4小时的教育标签。箭头标记教育 + WAPL-1-核已进入减数分裂。图像获得了63X 的目标。显示一个10µm 刻度条 (F)。请点击这里查看这个数字的更大版本.
| 标记: | pH3 | EdU | WAPL-1 或 REC-8 | HIM-3 | |
| 解释: | 有丝分裂 | S 相 * | 祖区 | 减数 分裂 | |
| 类: | 综合解释: | ||||
| 一个 |  |  |  |  | 在 M 相, 在祖区, 在有丝分裂 S 阶段在教育标签 (完成 G2) |
| B |  |  |  |  | 在 M 相, 在祖区, 不是在 S 阶段在教育标签 |
| C |  |  |  |  | 在界面, 在祖区, 在 S 阶段在教育标签 |
| D |  |  |  |  | 在界面, 在祖区, 不是在 S 阶段在教育标签 |
| 电子邮件 |  |  |  |  | 在减数分裂中, 在教育标签 (减数分裂进入细胞核) 期间在减数分裂 S 阶段 |
| F |  |  |  |  | 返回有丝分裂 (在一些突变体中发现) 或减数分裂 (在精子发生) |
| G |  |  |  |  | 在减数分裂中, 在教育标签中不处于 S 阶段 |
| 总 pH3 阳性总和;M 相中的所有单元格 | 总教育阳性总和;S 相中的所有细胞 | 总 WAPL-1 阳性总和; 祖区中的所有细胞 | 总 HIM-3 阳性总和;减数分裂前期的所有细胞 |
表 1: 原子核的种类.* 请注意, 30 分钟和4小时的教育实验不同于口译。在长期的教育实验中, 细胞有可能超越 S 相。有关实验的教育标签的持续时间, 请参阅导言和步骤 8 。
| 细胞周期部分 | 操作定义 | 计算 | 价值 ** |
| 祖区核 | 所有 WAPL-1 (或 REC-8) 阳性, HIM-3 负核 | A + B + C + D | 231±23核 |
| s-相核 | 核教育阳性后30分钟教育标签和 WAPL-1 阳性 | A + C | 133±20核 |
| M 相核 | pH3 和 WAPL-1 共正核 | A + B | 5.2 ±2.3 核 |
| s-相指数 | s-相核/祖区核 | a + c/a + B + c + D | 细胞周期的57% |
| M 相指数 | M 相核/祖区核 | a + b/a + b + C + D | 细胞周期的2% |
| 减数分裂进入细胞 | 减数分裂中的细胞核标记 | 电子邮件 | 因教育标签的持续时间而异 |
| 减数分裂的进入率 | 每 h 的教育标签的减数分裂进入细胞核 | 图4C 中的坡度 *** | 每小时20.3 核 |
| G2 持续时间 (中位数) | 50% 截距 Figure4A | 2.5 小时 | |
| G2 持续时间 (最大值) | 99% 截距图4A | 3.5 小时 | |
| G2+M+G1 持续时间 (最大值) | 99% 截距图4B | 3.5 小时 | |
| 细胞周期持续时间 (中位数) | 中位 G2 持续时间/G2-index *** | 6.5 小时 | |
| 细胞周期持续时间 (最大值) | 最大 G2 持续时间/G2-index *** | 8.1 小时 | |
表 2: 细胞周期计算.* 字母代表表 1和图 3中定义的原子核类。计算被修改从狐狸等。20111。** 值 (±标准差) 的野生型雌雄同体提出在20摄氏度岁至24小时后 mid-L4 阶段。请注意, 由于 y 截距截距不是零, 因此必须进行回归, 才能准确计算减数分裂进入的速率。G2-index 的确定方法是减去 S 相指数、M 相指数和近似 G1-index (2%) 从 100%, 如狐狸等. 20111。
讨论
教育标记细菌的制备 (步骤 1) 对此协议至关重要, 也是解决问题的第一步。野生型年轻成人雌雄同体标签非常可靠地在一个4小时的教育脉冲, 使这对每一批新的教育标记细菌是一个有用的控制。此外, 完整的教育标记细菌进入肠道 (在老动物或某些咽/磨床缺陷突变体) 将标签与点击化学和显示为明亮的长方形斑点在肠道。用于标记雌雄同体的另一种技术是在3的高浓度 (1 mM) 中使用 "浸泡"。这种技术在标记的持续时间内使动物挨饿, 但它提供了一个有用的方法来绕过在诊断固定和单击化学的情况下进行教育标记的细菌。如果一个教育 "浸泡" 实验是成功的, 而教育饲料不是, 然后准备新鲜的教育标记的细菌。为了达到足够的细菌密度, 同时也达到了高的教育含量, 人们可能需要调整教育和胸苷的浓度。
该技术对 S 相标记的主要局限性在于需要向动物饲料中标记细菌。不能喂饲的动物 (由于基因型或阶段) 可能不会用这种技术标记。然而, 核苷类似物目前是唯一的方法来识别 S 相原子核在C. 线虫种系, 他们的使用不要求任何转基因存在于动物。此外, 一旦合并, 教育仍然在细胞核, 即使他们退出 S 阶段, 通过细胞周期, 分裂或分化的进展。信号在每个细胞分裂时会减弱一半。这使得教育完美的跟踪细胞的历史, 甚至通过几个细胞分裂。
教育的稳定性使脉冲追逐实验变得简单明了;只需在所需的持续时间脉冲完成后从动物身上冲洗过量的教育细菌, 并将动物转移到未标记的细菌。教育仍留在 DNA 中, 即使在多个细胞分裂后仍然可见。然而, 实验仅限于一种 S 相标签 (教育的单一脉冲)。与教育和 BrdU 的共同标签是可能的在哺乳动物细胞31 , 但尚未报告在C. 线虫。注射吸毒和 CldU 的联合标记在哺乳动物中使用32 , 但也没有在C. 线虫报告。
教育标签的主要优点是, 该方法不需要转基因, 可以在常规培养过程中对线虫进行喂养, 化学与免疫荧光技术相容, 在进食后长期保持在 DNA 中很长一段时间。停止。这些特点使教育成为研究细胞周期和生殖细胞动力学的许多方面的一个很好的工具。
细胞周期和生殖细胞动力学分析与教育可以应用于各种研究问题。这一方法的进一步应用的几个例子: 细胞周期基因突变对动物细胞周期变化的动态影响?生理条件如何影响干细胞的细胞周期、生殖细胞进入减数分裂前期的速率, 以及通过减数分裂前期的生殖细胞进展率?幼虫发育过程中细胞周期如何变化?除了细胞命运的改变 (如异位增殖), 主要信号通路的干扰如何影响细胞周期?这个系统可以修改, 以研究细胞在许多不同的条件下做什么。
披露声明
作者没有什么可透露的。
致谢
我们感谢 MG1693 的大肠杆菌库存中心;Wormbase;线虫遗传学中心, 由国立卫生研究院的研究基础设施项目 (P40OD010440) 资助, 用于菌株;统计咨询;陈爱萍丰试剂;Scharf, 安德烈. 施耐德, 桑迪普, 和约翰的培训, 建议, 支持和有益的讨论;Kornfeld 和施德实验室对这份手稿的反馈意见。这项工作由国家卫生研究院 (R01 AG02656106A1 到 KK、R01 GM100756 到 TS) 和国家科学基金会 predoctoral 奖学金 [DGE-1143954 和 DGE-1745038] 部分支持。无论是国家卫生研究院还是国家科学基金会, 在设计研究、收集、分析和解释数据方面, 都没有任何作用, 也没有写手稿。
材料
| Name | Company | Catalog Number | Comments |
| E. coli MG1693 | Coli Genetic Stock Center | 6411 | grows fine in standard unsupplemented LB |
| E. coli OP50 | Caenorhabditis Genetics Center | OP50 | |
| Click-iT EdU Alexa Fluor 488 Imaging Kit | Thermo Fisher Scientific | C10337 | |
| 5-Ethynyl-2′-deoxyuridine | Sigma | 900584-50MG | or use EdU provided in kit |
| Glucose | Sigma | D9434-500G | D-(+)-Dextrose |
| Thiamine (Vitamin B1) | Sigma | T4625-5G | Reagent Grade |
| Thymidine | Sigma | T1895-1G | BioReagent |
| Magnesium sulfate heptahydrate | Sigma | M1880-1KG | MgSO4, Reagent Grade |
| Sodium Phosphate, dibasic, anhydrous | Fisher | BP332-500G | Na2HPO4 |
| Potassium Phosphate, monobasic | Sigma | P5379-500G | KH2PO4 |
| Ammonium Chloride | Sigma | A4514-500G | NH4Cl, Reagent Plus |
| Bacteriological Agar | US Biological | C13071058 | |
| Calcium Chloride dihydrate | Sigma | C3881-500G | CaCl |
| LB Broth (Miller) | Sigma | L3522-1KG | Used at 25g/L |
| Levamisole | Sigma | L9756-5G | 0.241g/10ml |
| Phosphate buffered saline | Calbiochem Omnipur | 6506 | homemade PBS works just as well |
| Tween-20 | Sigma | P1379-500ML | |
| 16% Paraformaldehyde, EM-grade ampules | Electron Microscopy Sciences | 15710 | 10ml ampules |
| 100% methanol | Thermo Fisher Scientific | A454-1L | Gold-label methanol is critical for proper morphology with certain antibodies |
| Goat Serum | Gibco | 16210-072 | Lot 1671330 |
| rabbit-anti-WAPL-1 | Novus biologicals | 49300002 | Lot G3048-179A02, used at 1:2000 |
| mouse-anti-pH3 clone 3H10 | Millipore | 05-806 | Lot#2680533, used at 1:500 |
| goat-anti-rabbit IgG-conjugated Alexa Fluor 594 | Invitrogen | A11012 | Lot 1256147, used at 1:400 |
| goat-anti-mouse IgG-conjugated Alexa Fluor 647 | Invitrogen | A21236 | Lot 1511347, used at 1:400 |
| Vectashield antifade mounting medium containing 4',6-Diamidino-2-Phenylindole Dihydrochloride (DAPI) | Vector Laboratories | H-1200 | mounting medium without DAPI can be used instead, following a separate DAPI incubation |
| nail polish | Wet n Wild | DTC450B | any clear nail polish should work |
| S-medium | various | see wormbook.org for protocol | |
| M9 buffer | various | see wormbook.org for protocol | |
| M9 agar | various | same recipe as M9 buffer, but add 1.7% agar | |
| Nematode Growth Medium | various | see wormbook.org for protocol | |
| dissecting watch glass | Carolina Biological | 42300 | |
| Parafilm laboratory film | Pechiney Plastic Packaging | PM-996 | 4 inch wide laboratory film |
| petri dishes | 60 mm diameter | ||
| Long glass Pasteur pipettes | |||
| 1ml centrifuge tubes | MidSci Avant | 2926 | |
| Tips | |||
| Serological pipettes | |||
| 500 mL Erlenmyer flask | |||
| Aluminum foil | |||
| 25G 5/8” needles | BD PrecisionGlide | 305122 | |
| 5ml glass centrifuge tube | Pyrex | ||
| Borosilicate glass tubes 1ml | |||
| glass slides | |||
| no 1 coverslips 22 x 40 mm | no 1.5 may work, also | ||
| 37 °C Shaker incubator | |||
| Tabletop Centrifuge | |||
| Clinical Centrifuge | IEC | 428 | with 6 swinging bucket rotor |
| Mini Centrifuge | |||
| 20 °C incubator | |||
| 4 °C refrigerator | |||
| -20 °C freezer | |||
| Observer Z1 microscope | Zeiss | ||
| Plan Apo 63X 1.4 oil-immersion objective lens | Zeiss | ||
| Ultraview Vox spinning disc confocal system | PerkinElmer | Nikon spinning disc confocal system works very well, also, as described here: http://wucci.wustl.edu/Facilities/Light-Microscopy |
参考文献
- Fox, P. M., Vought, V. E., Hanazawa, M., Lee, M. -H., Maine, E. M., Schedl, T. Cyclin E and CDK-2 regulate proliferative cell fate and cell cycle progression in the C. elegans germline. Development. 138 (11), Cambridge, England. 2223-2234 (2011).
- Crittenden, S. L., Leonhard, K. A., Byrd, D. T., Kimble, J. Cellular analyses of the mitotic region in the Caenorhabditis elegans adult germ line. Molecular biology of the cell. 17 (7), 3051-3061 (2006).
- Seidel, H. S., Kimble, J. Cell-cycle quiescence maintains Caenorhabditis elegans germline stem cells independent of GLP-1/Notch. eLife. 4, (2015).
- Fox, P. M., Schedl, T. Analysis of Germline Stem Cell Differentiation Following Loss of GLP-1 Notch Activity in Caenorhabditis elegans. Genetics. 201 (9), 167-184 (2015).
- Kocsisova, Z., Kornfeld, K., Schedl, T. Cell cycle accumulation of the proliferating cell nuclear antigen PCN-1 transitions from continuous in the adult germline to intermittent in the early embryo of C. elegans. BMC Developmental Biology. 18 (1), (2018).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of Sciences. 105 (7), 2415-2420 (2008).
- vanden Heuvel, S., Kipreos, E. T. C. elegans Cell Cycle Analysis. Methods in Cell Biology. , 265-294 (2012).
- ThermoFisher. Click-iT EdU Imaging Kits. , https://assets.thermofisher.com/TFS-Assets/LSG/manuals/mp10338.pdf (2011).
- Pazdernik, N., Schedl, T. Germ Cell Development in C. elegans. , Springer. 1-16 (2013).
- Hirsh, D., Oppenheim, D., Klass, M. Development of the reproductive system of Caenorhabditis elegans. Developmental Biology. 49 (1), 200-219 (1976).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Hansen, D., Schedl, T. Stem cell proliferation versus meiotic fate decision in Caenorhabditis elegans. Advances in Experimental Medicine and Biology. 757, 71-99 (2013).
- Jaramillo-Lambert, A., Ellefson, M., Villeneuve, A. M., Engebrecht, J. Differential timing of S phases, X chromosome replication, and meiotic prophase in the C. elegans germ line. Developmental Biology. 308 (1), 206-221 (2007).
- Agarwal, I., Farnow, C., et al. HOP-1 presenilin deficiency causes a late-onset notch signaling phenotype that affects adult germline function in Caenorhabditis elegans. Genetics. 208 (2), 745-762 (2018).
- Gumienny, T. L., Lambie, E., Hartwieg, E., Horvitz, H. R., Hengartner, M. O. Genetic control of programmed cell death in the Caenorhabditis elegans hermaphrodite germline. Development. 126 (5), Cambridge, England. 1011-1022 (1999).
- Hendzel, M. J., Wei, Y., et al. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation. Chromosoma. 106 (6), 348-360 (1997).
- Zetka, M. C., Kawasaki, I., Strome, S., Mü Ller, F. Synapsis and chiasma formation in Caenorhabditis elegans require HIM-3, a meiotic chromosome core component that functions in chromosome segregation. Genes & development. 13 (17), https://www.ncbi.nlm.nih.gov/pmc/articles/PMC317003/pdf/x8.pdf 2258-2270 (1999).
- Hansen, D., Hubbard, E. J. A., Schedl, T. Multi-pathway control of the proliferation versus meiotic development decision in the Caenorhabditis elegans germline. Developmental Biology. 268 (2), 342-357 (2004).
- Crawley, O., Barroso, C., et al. Cohesin-interacting protein WAPL-1 regulates meiotic chromosome structure and cohesion by antagonizing specific cohesin complexes. eLife. 5 (2), 1-26 (2016).
- Zhao, H., Halicka, H. D., et al. DNA damage signaling, impairment of cell cycle progression, and apoptosis triggered by 5-ethynyl-2′-deoxyuridine incorporated into DNA. Cytometry Part A. 83 (11), 979-988 (2013).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Gervaise, A. L., Arur, S. Spatial and Temporal Analysis of Active ERK. in the C. elegans Germline. Journal of Visualized Experiments. 117 (117), e54901-e54901 (2016).
- Vos, K. De Cell Counter Plugin. , https://imagej.nih.gov/ij/plugins/cell-counter.html (2015).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Rasband, W. ImageJ. , http://imagej.nih.gov/ij/> (2016).
- Michaelson, D., Korta, D. Z., Capua, Y., Hubbard, E. J. A. Insulin signaling promotes germline proliferation in C. elegans. Development. 137 (4), Cambridge, England. 671-680 (2010).
- Qin, Z., Jane, E., Hubbard, A., Hubbard, E. J. A. Non-autonomous DAF-16/FOXO activity antagonizes age-related loss of C. elegans germline stem/progenitor cells. Nature communications. 6 (5), 7107(2015).
- Luo, S., Kleemann, G. A., Ashraf, J. M., Shaw, W. M., Murphy, C. T. TGFB and Insulin Signaling Regulate Reproductive Aging via Oocyte and Germline Quality Maintenance. Cell. 143 (2), 299-312 (2010).
- Narbonne, P., Maddox, P. S., Labbe, J. -C. daf-18/PTEN locally antagonizes insulin signalling to couple germline stem cell proliferation to oocyte needs in C. elegans. Development. , 4230-4241 (2015).
- Cinquin, A., Chiang, M., et al. Intermittent Stem Cell Cycling Balances Self-Renewal and. Senescence of the C. elegans Germ Line. PLoS Genetics. 12 (4), 1005985(2016).
- Invitrogen EdU (5-ethynyl-2’-deoxyuridine). , https://assets.thermofisher.com/TFS-Assets/LSG/manuals/mp10044.pdf 1-7 (2010).
- Tuttle, A. H., Rankin, M. M., et al. Immunofluorescent Detection of Two Thymidine Analogues (CldU and IdU) in Primary Tissue. Journal of Visualized Experiments. 46 (46), e2166-e2166 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。