Method Article
半自动适应循环肿瘤细胞(CTC)分析临床和临床前研究中的应用
摘要
循环肿瘤细胞(CTCs的)是影响预后的几个转移性癌症。此手稿描述的金标准CellSearch系统(CSS)四氯化碳枚举平台和亮点常见的误分。此外,两个适配协议被描述为的CTC和CTC枚举在转移的使用这种技术的临床前小鼠模型中的用户定义的标记物的表征。
摘要
多数癌症相关死亡的发生转移性疾病的后续发展。这种高度致命性疾病分期与循环肿瘤细胞(CTCs的)的存在有关。这些罕见的细胞已被证明是在转移性乳腺癌,前列腺癌和大肠癌的临床意义。在临床CTC检测和计数目前的黄金标准是FDA批准CellSearch系统(CSS)。这个手稿概述了该平台所使用的标准协议,以及描述用户自定义标记优化患者CTCs的蛋白质特性和极低的血量可比协议CTC捕捉的详细过程,使用标准的两个附加议定书改编CSS的试剂, 在转移的体内临床前小鼠模型研究。另外,在健康供者血液的CTC质量差异掺入细胞从组织培养物与患者血液SAMP文件被高亮显示。最后,一些可能导致四氯化碳误分常用物品不符的概述。两者合计,这些协议将提供一个有用的资源为这个平台感兴趣的有关转移和CTCs的临床前和临床研究的用户。
引言
在2013年估计580,350人死于癌症,这种疾病是1660290新病例被诊断在美国就有1。其中大多数死亡发生转移性疾病2的后续发展。目前尚缺乏有效的治疗方法在治疗转移灶和转移级联的了解有限,使这一阶段的疾病死亡率很高。血液中的循环肿瘤细胞(CTCs的)的存在已被证实与转移性疾病3。这些细胞是极为罕见的,他们的检测是反映整体生存的转移性乳腺癌4,前列腺癌5和6大肠癌癌。在这些患者中,存在≥时相比,这些患者具有更少或在SAM中没有可检测到的CTC 5(乳腺癌和前列腺癌)或≥3(大肠癌),7.5毫升血液的CTC指示预后较差的Ë血容量。此外,期间或之后的治疗干预中的四氯化碳数的变化已被证明是有用的治疗响应的预测,通常早于目前所使用的技术7-10。
据估计,在转移性癌症患者中,发生的CTC在约1 CTC每10 5 -10 7血单核细胞的频率和患者的局部疾病,这个频率可以是什至更低(〜1 10 8)。这些细胞的罕见的性质可以使其难以精确地和可靠地检测和分析的CTC 11。有几种方法(先前12-14审阅)已用于通过利用从周围血液成分区分它们的属性来丰富和检测这些细胞。在一般情况下,四氯化碳枚举是一个两部分的过程,既需要一个浓缩步骤和检测步骤。传统上,富集步骤依赖于物理差异车辆检验中心(细胞大小,密度,变形)或蛋白质标志物的表达( 即上皮细胞粘附分子[EpCAM的],细胞角蛋白[CK])的iCal属性。以下浓缩,CTC检测可以以许多不同的方式,其中最常见的是基于核酸的测定法和/或流式细胞术的方法来进行。这些策略都是独一无二的,具有不同的优点和缺点,但他们都缺乏标准化;一个必要进入临床设置。因此CellSearch系统(CSS)的开发是为了提供一个标准化的方法,用荧光显微镜和基于抗体的技术4-6在人体血液中罕见的CTC的检测和计数。该平台目前正在考虑在CTC枚举的金标准,是在临床使用15通过了美国食品和药物管理局(FDA)唯一技术。
这个CSS是一种双组份平台consistin克,(1)本CellTracks AutoPrep系统(以下简称为制备仪),它能够自动人体血液样品的制备方法,和(2)的CellTracks分析器II(以下简称为分析仪),该扫描这些下面的样品制备。从污染的白细胞准备仪器分辨的CTC采用介导的抗体,铁磁流体基磁性分离法与差分荧光染色。最初,该系统采用共轭铁纳米颗粒抗EpCAM抗体标记的CTC。然后将样品孵育在磁场中,并且所有未标记的细胞被吸出。选择的肿瘤细胞重新悬浮,并孵育在差分荧光染色,包括荧光标记的抗体和核染色试剂。最后,将样品转移到一个磁盒,称为MagNest(以下简称为磁性装置),以及SCanned使用分析仪器。
该分析仪被用来使用不同的荧光过滤器,每个优化,以适当的荧光颗粒,使用10X物镜扫描准备样品。的CTC被确定为是由抗EpCAM,抗泛CK-藻红蛋白(PE)结合的细胞(CK8,18,和19),以及核染色剂4',6 - 二脒基-2 - 苯基吲哚(DAPI)。相反,白细胞污染被确定为是由抗CD45-别藻蓝蛋白(APC)和DAPI结合的细胞。下面扫描,计算机定义的潜在的肿瘤细胞被呈现给用户。从这些图像时,用户必须使用定义的参数和差分染色上面所讨论的,以确定哪些事件的CTC采用定性分析。
除了四氯化碳枚举提供了一种标准化的方法,该CSS允许的CTC的基于感兴趣的蛋白标志物分子特征。这个审讯Ç一个可以在单细胞水平进行,采用不需要四氯化碳识别16异硫氰酸荧光素(FITC)荧光通道。虽然这个平台提供了分子鉴定的能力,协议开发和优化的详细过程没有明确界定。三种市售的标记物已被开发由生产用于与CSS的使用,包括表皮生长因子受体(EGFR),人表皮生长因子受体2(HER2),胰岛素样生长因子1受体(IGF-1R)。 HER2分析,与CSS结合,已动用了几组,以说明四氯化碳表征的潜力,告知临床决策,并有可能改变现有的治疗指南。例如,Fehm 等 17证实,乳腺癌患者的HER-2原发肿瘤大约有三分之一HER2阳性的CTC。此外,刘等人。18近日报道,患者的HER +转移性乳腺癌高达50%的人没有HER2阳性的CTC。赫赛汀,一个HER2受体干扰单克隆抗体证明大大有利于患者的肿瘤表达HER2的足够的水平,是一个为患者常用的治疗HER2阳性的原发性肿瘤19-21。然而,这些研究表明,曲妥珠单抗可以是亚最优利用和四氯化碳表征可以在预测治疗反应助剂。最终,CTC表征可能要提高个性化服务的潜力。
CTC的研究是独一无二的,它已经在很大程度上利用了床边到台式办法。这种方法,不像台式到床边的研究,而这往往需要几年时间才能影响病人护理,已经允许的CTC快速进入临床。然而,医生正在犹豫中病人的治疗决策麦从使用四氯化碳分析结果ING由于缺乏它们的基础生物学的理解。因此,转移和互补CTC分析技术,适当的临床前小鼠模型必须被利用,以调查这些悬而未决的问题。一般而言,有两种类型的临床前模型中的用于学习的转移级联,(1)自发转移模型,它允许在转移级联中的所有步骤的研究,和(2)实验性转移模型,只允许该研究在转移过程的后续步骤,如外渗和继发性肿瘤的形成22。自发转移模型,涉及肿瘤细胞注射到适当的原位位置( 如注射前列腺癌细胞进入前列腺前列腺癌的研究)。然后细胞被给定的时间,形成原发肿瘤和转移自发到辅助站点,如骨,肺和淋巴结肿大。在相比之下,实验性转移模型涉及直接注射肿瘤细胞进入血液( 经尾静脉或心腔内注射,例如对靶细胞的特定位置),因此跳过血管内和传播的最初步骤,二级机关22。到目前为止,大部分在体内模型系统CTC分析一直采用流式细胞仪要么基于23或改装以人为本的CTC技术( 如 AdnaTest)24执行。虽然有用,没有这些技术使用金标准的CSS充分反映四氯化碳枚举。根据临床审批,规范的性质,和CSS的广泛使用, 在体内建模四氯化碳捕获和检测技术,利用等效的样品制备,加工,鉴定标准的发展将是有利的,因为结果将是媲美从患者样本获得的。然而,由于该卷的REQ制备仪器uirements不可能处理的血液使用该自动化平台小卷。此外,以前的工作由ELIANE 等人 25表明,与小鼠上皮细胞样品(其也符合标准CTC定义[EpCAM的+ CK + DAPI + CD45 - ])的污染可导致小鼠鳞状上皮细胞误判为车辆检验中心。解决这些问题的一个适应的技术,使CSS的四氯化碳试剂盒试剂结合的手动分离过程的利用率被开发。另外一个FITC标记的人白细胞抗原(HLA)抗体的测定法允许人肿瘤细胞是从小鼠鳞状上皮细胞区别开来。
这份手稿描述了标准,商业开发和优化的CSS协议处理病人的血液样本和常见的陷阱可能遇到的,包括discrepan吨的项目,可导致四氯化碳误分。此外,CSS试验,以检查捕获的CTC和可比适于CSS技术,其允许的CTC的由小体积的血液中转移的临床前小鼠模型的富集和检测的用户定义的蛋白质的特性进行自定义进行说明。
研究方案
在这个手稿中描述的所有的人进行了研究,根据批准的西方大学的人类研究伦理委员会的协议。所有动物实验均按照加拿大理事会关于动物保护的建议进行的,根据批准的西方大学动物使用小组委员会的协议。
1。标准四氯化碳枚举从病人的血液样本使用的CSS
1。人体血液样品采集和加工准备的制备仪器
- 使用标准无菌采血技术,绘制一个最小为8.0毫升人类血液到10ml CellSave管(以下简称为CTC防腐剂管),其中包含乙二胺四乙酸(EDTA)和专有的蜂窝防腐剂。逆转管5倍,以防止血液凝固。样本可立即被处理或在室温下保存长达96小时。
- 祛瘀从冰箱里éCSS的试剂,并允许他们使用前加热到室温。
- 使用一次性装置10毫升吸管和自动移液器,收集7.5毫升血液从四氯化碳防腐管,慢慢地血液分配到一个适当标记的制备仪器加工管。
- 加6.5毫升的稀释缓冲液对每个样品。颠倒样品5倍混合。在800×g离心10分钟,在“关”位置的制动离心样品。请按照准备仪器的屏幕上的说明来加载所有患者样本在系统上进行处理。样品必须在1小时内准备处理。
2。控制加工配制的制备仪器
- 然后振荡控制小瓶和反转5X混合。
- 小心地控制瓶取下瓶盖并放置一个倒置的准备仪器加工管上不封顶的小瓶的顶部。在一个迅速的动作,反转管制瓶,倒内容到处理管。而倒,轻轻一抖控制小瓶的两侧,以排出残留的内容。
- 小心地从处理管取出反转控制小瓶中,确保没有液体丢失,并放置在一边。使用1,000微升移液器,收集小瓶和盖任何剩余的内容,轻轻地吸取到处理管。
- 按照关于编制仪器屏幕上的指示来控制加载到系统中进行处理。
3。对分析仪器的样品扫描
- 请按照准备仪器的屏幕上的说明卸载所有样品从系统中。松散封顶每个磁性装置盒,用双手或实验室工作台上释放被粘在盒的边缘任何气泡挖掘磁性器件。一旦所有的泡沫已被删除,坚决帽筒,奠定了磁性器件平坦,而我ncubate在黑暗中为至少20分钟,在室温下进行。样品必须在准备24小时扫描。
- 打开分析仪和初始化灯泡。一旦回暖(约15分钟),加载系统验证匣放入分析仪器并选择QC测试选项卡。按照屏幕上的说明进行必要的质量控制措施。
- 样品加载到分析仪器并选择病人测试标签。从准备仪器内的所有保存的信息将被显示。单击开始初始化样本扫描。该系统将磁器件盒上进行粗调焦和边缘检测。
- 调整所有的边按需要使用方向键。选择接受 。该系统将进行微调对焦,并开始样品扫描。
- 下面的控制扫描的结果,应使用尖高(CK + DA对细胞的定义的标准进行验证PI + CD45 - APC +)和低(CK + DAPI + CD45 - FITC +)的浓度。下列患者样本扫描结果应使用四氯化碳定义的标准(CK + DAPI + CD45 - )捕获的CTC进行审查。
2。 CTC表征使用CSS的用户自定义标记
1。用户自定义的标记和仪器初始化准备
- 稀释的使用下面的公式,其中,工作浓度是抗体除了样品和库存浓缩后的浓度使用债券初级抗体稀释液中的标记试剂杯的期望浓度感兴趣的抗体是抗体的浓度试剂杯。对于多个样品,调整为表1中所述的抗体量。将标记试剂杯到试剂盒和L在位置1OAD墨盒上的CSS。
股票集中度=(工作浓度X 850微升)/ 150微升 - 收集血液,制备样品,并载入准备仪器如上面的标准四氯化碳枚举从病人的血液样本使用了CSS协议描述。要启用自定义标记此外,选择用户定义检测时的准备仪器提示。输入标记名称,然后选择保存 。由于样品装载到机器上,操作员将被提示来指示应根据需要选择是或否接收自定义标记。
2。对分析仪器用户定义的标记样品扫描
- 打开分析仪,初始化灯,并作为标准四氯化碳枚举的第3.2节从病人的血液样本使用CSS的描述进行质量控制和系统验证的协议。
- 样品加载到分析仪器,然后选择设置选项卡。要初始化FITC通道,选择CellSearch四氯化碳作为下测试协议部分套件的ID。从这个菜单中,选择四氯化碳研究 ,单击编辑按钮,并根据需要设置曝光时间。建议在1.0秒的曝光时间不使用的CSS四氯化碳组件时,因为这可以提高渗色成用于反恐委员会确定的其他荧光通道超标。
3。标准CSSProtocol适应于临床前小鼠模型的使用
*从Veridex的鼠标/鼠CellCapture套件改编(不再市售)
1。小鼠血液收集和存储
- 前采血,跑〜30微升0.5M的EDTA通过22号针头来回,留下少量的EDTA的枢纽。
- 收集至少50微升小鼠血液从小鼠通过原位,尾静脉或心内途径与人类肿瘤细胞预先注入。收集血液从大隐静脉(串行CTC分析)或通过心脏穿刺(终端CTC分析)。卸下针和血液分配到1毫升EDTA的微量血液收集管。通过倒置或轻轻一抖管混匀,以防止血液凝结。长达48小时,在加入CytoChex蜂窝防腐剂等体积的血液可以被立即处理或在室温下保存。
2。 CTC富集
- 从冰箱中取出的CSS试剂,并允许他们使用前加热到室温。
- 转移的50微升全血的相当于12毫米×75毫米流式细胞管。加入500微升的稀释缓冲液中向每个样品,洗下残留在管的两侧任何血液。如果需要的话,短离心机旋可用于收集任何残留的血液。
- 然后振荡的抗-EpCAM的铁磁流体,并添加25μl的各样品通过将移液管的尖端直接进样。加入25微升捕获增强试剂和旋涡轻轻混匀。孵育的样品在室温下放置15分钟。
- 放置样品管放置在磁体并孵育10分钟。而试样管仍然在磁体中,使用玻璃吸管小心吸出残留的液体不接触所述管的壁旁的磁铁并丢弃。
3。 CTC法
- 从磁体,重悬在50μl核酸染料,加入50μl染色试剂,1.5微升抗小鼠CD45-APC,5.0微升的抗人HLA-的Alexa Fluor 488,和100微升的透化的的取出样品管试剂。对于多个样品,这些试剂可预混和206.5微升的混合物可以被加入到每个管中。涡轻轻混匀孵育20分钟,在室温下在黑暗中。
- 加入500微升的稀释缓冲液,轻轻涡旋,这里的样品管插入磁铁,并孵育10分钟。而试样管仍然在磁体中,使用玻璃吸管小心吸出残留的液体不接触所述管的壁旁的磁铁并丢弃。从磁体取出样品管,并重新悬浮于350微升的稀释缓冲液。轻轻旋涡混匀。
4。磁性设备装载
- 使用凝胶加载提示,小心地从样品管的整个体积转移到磁性装置中的墨盒。开始在盒的底部,并慢慢抽出尖的样品分配。
- 一旦整个样品已转移,松松盖住磁性装置盒,用双手或实验室工作台上释放在SECTIO描述了被粘在盒的边缘任何气泡挖掘磁性器件N 从使用的CSS病人的血液样本标准四氯化碳枚举的3.1。
- 用无菌22号针头的斜面和卡盒的边缘之间将它们俘获弹出任何气泡。一旦所有的泡沫已被删除,坚决帽筒,奠定了磁性器件平坦,孵育在黑暗中至少10分钟。样品必须在准备24小时扫描。
5。对分析仪器手工分离样品扫描
- 打开分析仪,初始化灯,并作为标准四氯化碳枚举的使用CSS的协议病人的血液样本 3.2节所述的方法进行质量控制和系统验证。
- 样品加载到分析仪器,然后选择设置选项卡。通过单击格式示例按钮清除磁器件的数据按钮的任何现有数据。使FITC通道次的曝光时间设置为1.0秒如四氯化碳表征使用CSS用户定义的标记第2.2节所述。
- 点击病人测试选项卡上,选择编辑输入样品信息。选择CellSearch四氯化碳作为工具包的ID和CTC作为研究的测试协议 。输入的星号所指示的其余必要的信息。 保存样品信息,并单击开始 。
结果
标准CTC枚举含量
在CSS的敏感性和特异性得到了很好的记载在文献中。然而,要验证等效四氯化碳回收,尖刺(1,000 LNCaP人前列腺癌细胞)和来自健康志愿者供体无稀释剂的人类血液的样品用标准的CSSCTC协议上的CSS处理。正如预期的那样,未加标的样品是免费的CTC的,0.00±0.00%,和CTC恢复被证明是86.9±4.71%,加标样品(图1A)。从加标样品获得的CSS画廊图像进行的最佳质量和CTCs的人易从非CTCs的区分。但是,处理从癌症患者获得的样品时,识别的CTC的是稍微更有挑战性的,与许多细胞出现较小的尺寸和被从非的CTC(图1B)更不容易区分。此外,审查病人样品时6类事件是身分编辑的审稿人(图1C)之间通常有差异的项目。这6个类别包括,(1)小事件,不符合4微米尺寸要求CTC分类;(2)昏暗的CK和/或DAPI染色的物品;(3)合理(应该算作一个CTC)与不合理(不应该算作一个CTC)出血透进引起的明亮CK-PE染色CD45-APC的渠道;(4)FITC +事件;(5)像素化图像中的CK和/或DAPI通道;和(6)事件用DAPI染色,比对照的图像或那些用DAPI染色,不与对照图像重叠> 50%大。四氯化碳分类类别(2)和(5)的具体标准存在。对于类别(2),与暗淡CK / DAPI项可以被分类为CTCs的前提是一个完整的膜所用的CK信道进行观察和一个适当大小的DAPI图像注意。对于类(5),像素化的CK / DAPI项目不能如有像素被在长江通道观察列为检验中心。然而,像素化是可以接受的DAPI通道提供,这是不是太严重( 即图像是在一个背景全白,没有灰色地带-由扬森诊断(原Veridex的),白色的油漆在黑色背景描述)或弥漫性(必须仍然会出现椭圆形和适应CK内)。
用户定义的标记实验开发
CSS的表征CTCs的用户自定义标记的适应需要显著工作了严格的控制和以前已经16描述。作为一般规则,用户定义的任何标记物的适当的优化要求,阴性对照可以采用,以确保结果是特定的。最好的结果是当加标样品用两处理得到非特异性IgG对照代替靶抗体,并与单独使用如前面所描述的抗体稀释液。各个目标抗体的浓度和暴露时间也应加以评估和使用的细胞系具有高,低和不存在(阴性)抗原密度的验证。当检测表明高灵敏度从非特异性的靶抗原和低背景噪音结合16最佳的协议条件得以实现。
在此使用的是癌症干细胞标记物,CD44工作了一个例子,在这里提出。用这种标记物的初步测试开始使用标准的CSS四氯化碳试剂盒(以下称为传统的四氯化碳试剂盒),它利用FITC通道用于用户定义的标记物的开发。采用传统的反恐工具包,它被证实,显著优化后,可能被归类为CD44 +的CTC的最大数目是用样本69.3±2.67%,加标1,000 MDA-MB-468呼玛Ñ 乳腺癌细胞,称为证明CD44的高表达与多数细胞(98.4±0.90%;通过流式细胞仪检测)表达这种蛋白(图2A)。基于这些发现有人推测市售的CSS思套件可能会产生更好的结果。该套件允许以较低的抗原密度(〜50,000抗原/细胞)标记改进的可视化与传统的四氯化碳试剂盒通过反转荧光通道中的CK8 /(用于〜100,000抗原/细胞的密度指标优化)相比, 18/19(传统上的PE通道为代表)和利息(在FITC通道历来代表)用户的标记来表示(因此以下的CXC套件将被称为低抗原密度反恐套件)26。之后显著优化,它表明,这种变化允许改进CD44染色,而分类为CD44 + 的98.8±0.51%/ SUP>用CD44-PE为1.0微克/毫升的浓度和0.6秒的曝光时间(图2A)。任何用户定义的标记适当的优化也需要验证采用高抗原密度(MDA-MB-468),低抗原密度(21 NT),并针对感兴趣的标记物(图2B)阴性(LNCaPs)细胞系。
在临床前小鼠模型四氯化碳分析
以确定适于小鼠的CSS协议的敏感性和特异性,尖刺(1,000 LNCaP人前列腺癌细胞)和未加标鼠标血样手动处理和扫描的分析仪器,并与使用相同的细胞系获得的结果使用标准的处理关于编制仪器(图3A)自动化的CSS协议。正如预期的那样,未加标的样品免费使用这两种检测检验中心的,0.00±0.00%,并使用适合的鼠标套件(90.8±5.18%),金霉素回收率为不发ignificantly不同于使用标准的自动化系统所获得的结果(86.9±4.71%,P> 0.05)。使用手动小鼠适应协议所获得的图像并没有从那些使用标准自动化技术观察到的不同,除了在加入HLA-FITC标记的。此外,小鼠鳞状上皮细胞不用于HLA-FITC(图3B)染色为阳性。以确认该技术是作为标准的CSS协议的的CTC数低的隔离敏感,连续稀释均采用加标血样和细胞与细胞的回收次数的预计数之间的相关性进行了评估(图3C)。结果表明CTCs的能有效回收下降到5 cells/50微升全血使用该测定的敏感性。这些值与一个r 2 = 0.99预期的结果相关。
图1。 CTC列举和解释使用标准的CSS协议。 (A)四氯化碳恢复测定加标细胞数的百分比。细胞用血细胞计数器计数和〜1,000 LNCaP人前列腺癌细胞中掺入7.5毫升人血。无稀释剂的人血样品作为阴性对照组(n = 3)。数据表示为平均值±标准差(B)的加标血样( 即健康人的血液掺入从培养的肿瘤细胞)对来自癌症患者采集的样品中观察到的CTC质量的差异代表的CSS画廊图像(C)代表那往往是错误分类通常有差异的项目的CSS画廊图像。橙色方块表示接受车辆检验中心,确定为CK + / DAPI + / CD45- 。在10倍物镜放大倍率获得的图像。 点击这里查看大图。
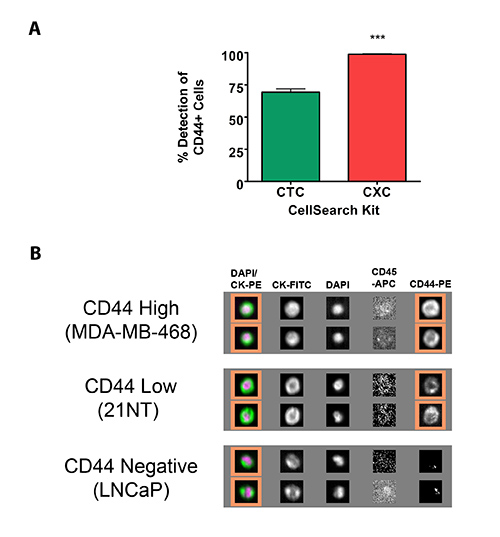
图2。车辆检验中心的使用CSS的用户自定义标记鉴定。(一)细胞的百分比分为上使用了CSS的反恐委员会和CXC套件CD44 +(N = 3)。数据表示为平均值±标准差。 *** =显著差异(P <0.0005),(B)的血从健康志愿者供体(7.5毫升)代表的CSS画廊图像,掺有〜1,000细胞所识别的细胞系与抗为1.5微克/毫升-CD44-PE和扫描以0.2秒的曝光时间。橙色方块表示CD44 + </ SUP>的CTC,确定为CK + / DAPI + / CD45 - / CD44 - PE + 点击这里查看大图。
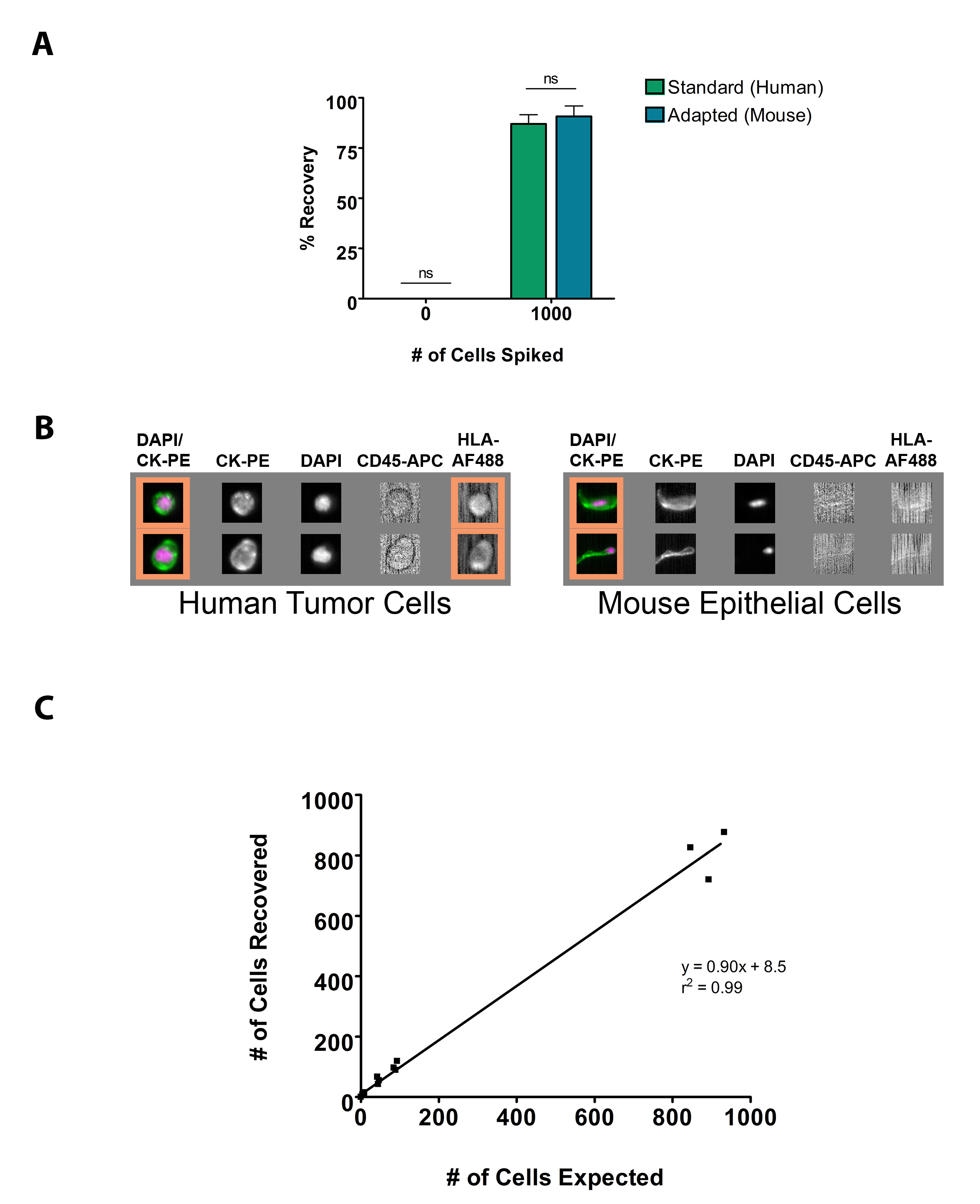
图3。在转移的临床前小鼠模型中使用CSS的过程中适应。(一)使用计量刺细胞的数量的百分比,相比于使用标准的CSS人协议获得的结果的适应鼠标的CSS协议CTC恢复。细胞用血细胞计数器计数和〜1,000 LNCaP人前列腺癌细胞中掺入7.5毫升人血。无稀释剂的人血样品作为阴性对照组(n = 3)。数据表示为平均值±标准差。 ns =不显著(B) 的CTC的代表CSS画廊图像捕获的适应鼠标的CSS协议证明HLA-AF488能够从小鼠细胞区分人(C)的相关性和线性回归分析的预期与尖刺的肿瘤细胞在不同浓度的回收数量。 LNCaP人前列腺癌细胞最初由血细胞计数器计数,并随后掺入小鼠血液在〜1,000肿瘤cells/50微升血液中的浓度。尖刺小鼠血然后连续稀释至5肿瘤cells/50微升的浓度,用鼠标调整CSS协议(N = 3)。处理点击这里查看大图。
| #样品与用户自定义标记添加的 | 总VOLU我要加入试剂杯(微升) |
| 1 | 450 |
| 2 | 600 |
| 3 | 750 |
| 4 | 900 |
| 5 | 1,050 |
| 6 | 1,200 |
| 7 | 1,350 |
| 8 | 1,500 |
表1中。 ,总成交量的要求加工各种数字与用户定义的标记样品时为CSS **改编自Veridex的白皮书(网址为: http://www.veridex.com/pdf/CXC_Application_Guideline.PDF )。
讨论
尽管自2004年实行了CSS的许多新的反恐技术的发展,这种技术仍然是唯一在市场上临床批准的技术今天,因此它被认为是目前的黄金标准CTC检测和计数。这个手稿表明,虽然CSS有严格的质量控制标准也可以是有待诠释偏见和四氯化碳识别患者样本是从识别太大的不同加标样品中。确定了六大类常用物品不符,可能会导致四氯化碳错误分类的发生。这些差异的项目突出了需要对每一个病人样品多个审阅本仪器处理。此外,得到的CTC中尖刺与患者中观察到的差异表明,有必要对任何新CTC技术都掺入和患者样品中进行验证。此外,这些新技术必须bË相比,同时使用加标和患者样本,分割抽取样本化验高效CTC捕捉从加标样品仅不一定反映患者样本在CTC捕获效率的黄金标准的CSS。
虽然CSS有执行捕捉CTCs的表征能力,那是相当的限制与问候高度可定制的优化。在一般情况下,可以在该仪器被改变为用户定义的标记物优化的唯一参数是该抗体的浓度和时间,该荧光基团暴露在水银灯的长度。这种有限的容量优化可以提出问题,当工作了用户自定义的标记在CSS的。在该原稿提出的一种解决方案(详细先前16描述的)是使用低抗原密度四氯化碳试剂盒,其切换的FITC和PE荧光通道允许更好的可视化具有低抗原密度的标记的。无论该试剂盒是利用(传统的或低抗原密度反恐套件)有必须进行,以确保适当的标志物的敏感性,特异性和优化几个必要的步骤。首先,测定灵敏度,必须在比较良好验证的用户的方法,如流式细胞术,将允许判定预期的检测电平( 即细胞在细胞群中表达所关心的标记物的百分比)的评估定义标记。其次,该法必须进行评估,其检测的细胞系中感兴趣的标记物具有不同的表达水平( 即高和低抗原密度)和其特异性的能力,必须在细胞系中是阴性的感兴趣的标记进行验证。在所有情况下,所有的细胞系,必须使用细胞只对照(未添加抗体),适当的IgG对照,和感兴趣的各种浓度和暴露时间的抗体,以确定莫待测试ST适当的设置,以确保用户自定义标记的优化。然而,应该指出的是,虽然CTCs的表征是可能在CSS中,目前只有一个用户定义的兴趣标记可以在每个样品中探索,并且该系统是非常有限的问候下游应用由于苛刻的加工样品。
独特的床头到台式做法在CTC研究利用已经允许快速进入这个有用的检测进入临床。然而,它导致了这些罕见细胞的基本生物学的认识不足。因此,测定了允许在临床前癌症的体内小鼠模型中评估的CTC的发展和优化是必要的。这个手稿描述了一个适应的CSS协议,允许车辆检验中心在50微升体积的小鼠血液,非常适合于串行CTC收集实验模型进行评估。这个手稿ðemonstrates,使用此协议CTC枚举相当于使用了CSS结合传统的反恐套件,具有自动和手动分离技术之间在CTC捕获效率无显著差异获得的结果。另外,该测定法的发展过程中,人们认识,如先前在文献25中所述,该小鼠鳞状上皮细胞污染可做出准确识别的CTC的更困难,有时甚至是不可能的。因此,要解决这一问题,一个用户自定义的HLA-的Alexa Fluor 488加入此协议,以确保只有人类细胞(CK + DAPI + CD45 - HLA -的Alexa Fluor 488 +)正在适当地指定为车辆检验中心。要注意,在该原稿用的LNCaP细胞系是HLAlow,因此HLA-的Alexa Fluor 488可能需要对细胞系进行滴定,具有不同的HLA表达是重要的。虽然我们增加了一个HLA-Alexa的荧光粉ř488我们的通讯协议,以确保准确识别车辆检验中心的,值得注意的是,鼠标的鳞状上皮细胞绝大多数是由形态易于识别和细胞数量是有限的(0.33±0.24 events/50微升,N = 9)。较高的细胞数量(最多11 events/50微升)只观察到血液采集( 通过心脏穿刺)难以和反复的尝试是必要的。因此,我们建议,如果需要的话,车辆检验中心对系统特性可以省略此标记来完成。另外,虽然这里没有描述,我们预计,收集的CTC和使用其他方法的CTC的更下游的表征可以被容易地实现如先前使用的CSS 27,28证实。
虽然CSS已经被临床使用,以有效地检测CTCs的转移性乳腺癌,前列腺癌和大肠癌患者4,10,29血液,它确实有几个利mitations。在患者的各种转移癌高达35%,车辆检验中心是检测不到的,尽管广泛的全身性疾病,30的存在。这种缺乏检测已经提出那样的上皮至间质转变,一个已知能够提高癌细胞的侵袭,转移良好的记录过程,而整体侵略性31的结果。这个过渡已经与显著减少上皮细胞标记物,如EpCAM的关联,并且在间充质相应增加标记32。一些研究最近证明,这些间质标记物的CTCs的存在是指示预后较差的,而且许多这些细胞缺乏上皮标记使用的CSS 24,33-38这将是必要的检测表达。这表明,标准的CSS定义,可能会丢失一些最激进的CTC的。
尽管所描述的限制,它是预期的日在这个手稿中描述é协议将是使用CSS,开发新颖的CTC技术,用户自定义标记的优化,和CTC生物学认识的提高使用的体内临床前小鼠模型改进CTC分析的重要工具。两者合计,这些协议将提供一个有用的资源为这个平台感兴趣的有关转移和CTCs的临床前和临床研究的用户。
披露声明
笔者(ALA)收到由扬森肿瘤,其母公司强生公司还拥有扬森诊断有限责任公司,主要生产在这篇文章中使用的试剂和仪器提供的资金。
致谢
这项工作是由癌症研究协会安大略省(#08NOV230),加拿大创新基金会(#13199),前列腺癌加拿大,扬森肿瘤,在伦敦地区癌症计划,并从约翰和唐娜布里斯托尔通过捐助者的支持赠款支持伦敦健康科学基金会(以ALA)。 LEL是由弗雷德里克班廷和查尔斯最佳加拿大研究生奖学金博士奖的支持。 ALA是由CIHR新研究者奖,并从研究和创新的安大略省的早期研究者奖支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA | |||
| Anti-human CD44-FITC | BD Pharmigen | 555478 | |
| Anti-human CD44-PE | BD Pharmigen | 555479 | |
| Anti-human HLA-Alexa Fluor 488 | BioLegend | 311415 | |
| Anti-mouse CD45-APC | eBioscience | 17-0451-82 | |
| Bond Primary Antibody Diluent | Leica | AR9352 | |
| CellSave Preservative Tubes | Veridex | 952820 (20 pack) 79100005 (100 pack) | |
| CellSearch CTC Control Kit | Veridex | 7900003 | |
| CellSearch CTC Kit | Veridex | 7900001 | |
| CellSearch CXC Control Kit | Veridex | 7900018RUO | |
| CellSearch CXC Kit | Veridex | 7900017RUO | |
| Instrument Buffer | Veridex | 7901003 | |
| Streck Cell Preservative (aka CytoChex) | Streck | 213350 | |
| 1 ml Syringe | |||
| 10 ml Serological pipette | |||
| 1,000 µl Pipette | |||
| 1,000 µl Pipette tips | |||
| 12 mm x 75 mm Flow tubes | |||
| 200 µl Gel loading tips | |||
| 200 µl Pipette | |||
| 22 G Needle | |||
| 5 3/4 in Disposible Pasteur pipet | VWR | 14672-200 | |
| 5 ml Serological pipette | |||
| Automated pipettor | |||
| Capillary Blood Collection Tube (EDTA) | BD Microtainer | 365974 | |
| CellSearch Analyzer II | Veridex | 9555 | Includes magnests and verification cartirdges |
| CellSearch AutoPrep System | Veridex | 9541 | |
| Centrifuge | |||
| MagCellect Magnet | R&D Systems | MAG997 | |
| Small Latex Bulb | VWR | 82024-550 | |
| Vortex |
参考文献
- Siegel, R., Naishadham, D., Jemal, A. Cancer statistics. 63 (1), 11-30 (2013).
- Chambers, A. F., Groom, A. C., MacDonald, I. C. Dissemination and growth of cancer cells in metastatic sites. Nat. Rev. Cancer. 2 (8), 563-572 (2002).
- Pantel, K., Brakenhoff, R. H. Dissecting the metastatic cascade. Nat. Rev. Cancer. 4 (6), 448-456 (2004).
- Cristofanilli, M., Budd, G. T., et al. Circulating tumor cells, disease progression, and survival in metastatic breast cancer. New Engl. J. Med. 351 (8), 781-791 (2004).
- De Bono, J. S., Scher, H. I., et al. Circulating tumor cells predict survival benefit from treatment in metastatic castration-resistant prostate cancer. Clin. Cancer Res. 14 (19), 6302-6309 (2008).
- Cohen, S. J., Ja Punt, C., et al. Prognostic significance of circulating tumor cells in patients with metastatic colorectal cancer. Ann. Oncol. 20 (7), 1223-1229 (2009).
- Hayes, D. F., Cristofanilli, M., et al. Circulating tumor cells at each follow-up time point during therapy of metastatic breast cancer patients predict progression-free and overall survival. Clin. Cancer Res. 12 (14), 4218-4224 (2006).
- Budd, G. T., Cristofanilli, M., et al. Circulating tumor cells versus imaging--predicting overall survival in metastatic breast cancer. Clin. Cancer Res. 12 (21), 6403-6409 (2006).
- Olmos, D., Arkenau, H. -. T., et al. Circulating tumour cell (CTC) counts as intermediate end points in castration-resistant prostate cancer (CRPC): a single-centre experience. Ann. Oncol. 20 (1), 27-33 (2009).
- De Bono, J. S., Scher, H. I., et al. Circulating tumor cells predict survival benefit from treatment in metastatic castration-resistant prostate cancer. Clin. Cancer Res. 14 (19), 6302-6309 (2008).
- Allan, A. L., Keeney, M. Circulating tumor cell analysis: technical and statistical considerations for application to the clinic. J. Oncol. 2010, 426218 (2010).
- Lowes, L. E., Goodale, D., Keeney, M., Allan, A. L. Image cytometry analysis of circulating tumor cells. Methods Cell Biol. 102, 261-290 (2011).
- Lianidou, E. S., Markou, A. Circulating tumor cells in breast cancer: detection systems, molecular characterization, and future challenges. Clin. Chem. 57 (9), 1242-1255 (2011).
- Alix-Panabières, C., Pantel, K. Circulating tumor cells: liquid biopsy of cancer. Clin. Chem. 59 (1), 110-118 (2013).
- Parkinson, D. R., Dracopoli, N., et al. Considerations in the development of circulating tumor cell technology for clinical use. J. Transl. Med. 10, 138 (2012).
- Lowes, L. E., Hedley, B. D., Keeney, M., Allan, A. L. User-defined protein marker assay development for characterization of circulating tumor cells using the CellSearch system. Cytomet. A. 81 (11), 983-995 (2012).
- Fehm, T., Müller, V., et al. HER2 status of circulating tumor cells in patients with metastatic breast cancer: a prospective, multicenter trial. Breast Cancer Res. Treat. 124 (2), 403-412 (2010).
- Liu, Y., Liu, Q., et al. Circulating tumor cells in HER2-positive metastatic breast cancer patients: a valuable prognostic and predictive biomarker. BMC Cancer. 13, 202 (2013).
- Slamon, D. J., Leyland-Jones, B., et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. New Engl. J. Med. 344 (11), 783-792 (2001).
- Marty, M., Cognetti, F., et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment: the M77001 study group. J. Clin. Oncol. 23 (19), 4265-4274 (2005).
- Slamon, D., Eiermann, W., et al. Adjuvant trastuzumab in HER2-positive breast cancer. New Engl. J. Med. 365 (14), 1273-1283 (2011).
- Welch, D. R. Technical considerations for studying cancer metastasis in vivo. Clin. Exp. Metast. 15 (3), 272-306 (1997).
- Goodale, D., Phay, C., Postenka, C. O., Keeney, M., Allan, A. L. Characterization of tumor cell dissemination patterns in preclinical models of cancer metastasis using flow cytometry and laser scanning cytometry. Cytometry A. 75 (4), 344-355 (2009).
- Gorges, T. M., Tinhofer, I., et al. Circulating tumour cells escape from EpCAM-based detection due to epithelial-to-mesenchymal transition. BMC Cancer. 12, 178 (2012).
- Eliane, J. -. P., Repollet, M., et al. Monitoring serial changes in circulating human breast cancer cells in murine xenograft models. Cancer Res. 68 (14), 5529-5532 (2008).
- Flores, L. M., Kindelberger, D. W., et al. Improving the yield of circulating tumour cells facilitates molecular characterisation and recognition of discordant HER2 amplification in breast. 102 (10), 1495-1502 (2010).
- Sieuwerts, A. M., Kraan, J., et al. Molecular characterization of circulating tumor cells in large quantities of contaminating leukocytes by a multiplex real-time PCR. Breast Cancer Res. Treat. 118 (3), 455-468 (2009).
- Cohen, S. J., Ja Punt, C., et al. Relationship of circulating tumor cells to tumor response, progression-free survival, and overall survival in patients with metastatic colorectal cancer. J. Clin. Oncol. 26 (19), 3213-3221 (2008).
- Allard, W. J., Matera, J., et al. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin. Cancer Res. 10 (20), 6897-6904 (2004).
- Thiery, J. P., Acloque, H., Huang, R. Y. J., Nieto, M. A. Epithelial-mesenchymal transitions in development and disease. Cell. 139 (5), 871-890 (2009).
- Yang, J., Weinberg, R. A Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis. Dev. Cell. 14 (6), 818-829 (2008).
- Gradilone, A., Raimondi, C., et al. Circulating tumour cells lacking cytokeratin in breast cancer: the importance of being mesenchymal. J. Cell. Mol. Med. 15 (5), 1066-1070 (2011).
- Königsberg, R., Obermayr, E., et al. Detection of EpCAM positive and negative circulating tumor cells in metastatic breast cancer patients. Acta Oncol. 50 (5), 700-710 (2011).
- Kasimir-Bauer, S., Hoffmann, O., Wallwiener, D., Kimmig, R., Fehm, T. Expression of stem cell and epithelial-mesenchymal transition markers in primary breast cancer patients with circulating tumor cells. Breast Cancer Res. 14 (1), (2012).
- Mego, M., Mani, S. A., et al. Expression of epithelial-mesenchymal transition-inducing transcription factors in primary breast cancer: The effect of neoadjuvant therapy. Int. J. Cancer. 130 (4), 808-816 (2012).
- Yu, M., Bardia, A., et al. Circulating breast tumor cells exhibit dynamic changes in epithelial and mesenchymal composition. Science. 339 (6119), 580-584 (2013).
- Armstrong, A. J., Marengo, M. S., et al. Circulating tumor cells from patients with advanced prostate and breast cancer display both epithelial and mesenchymal markers. Mol. Cancer Res. 9 (8), 997-1007 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。