Method Article
استخراج وتنقية بروتين FAHD1 من كبد الخنازير والكلى والفئران
In This Article
Summary
يصف هذا البروتوكول كيفية استخراج البروتين 1 (FAHD1) المحتوي على مجال هيدرولاز fumarylacetoacetate من كبد الخنازير والفئران. يمكن تكييف الطرق المذكورة مع البروتينات الأخرى ذات الأهمية وتعديلها للأنسجة الأخرى.
Abstract
فوماريلاسيتواتواتات هيدرولاز يحتوي على البروتين 1 (FAHD1) هو أول عضو محدد في عائلة FAH الفائقة في حقيقيات النوى ، حيث يعمل كأوكسالواسيتات ديكاربوكسيلاز في الميتوكوندريا. تقدم هذه المقالة سلسلة من الطرق لاستخراج وتنقية FAHD1 من كبد الخنازير والفئران. الطرق المغطاة هي كروماتوغرافيا التبادل الأيوني مع كروماتوغرافيا سائلة سريعة البروتين (FPLC) ، وترشيح هلام تحضيري وتحليلي مع FPLC ، ونهج بروتينية. بعد استخراج البروتين الكلي ، تم استكشاف هطول الأمطار كبريتات الأمونيوم وكروماتوغرافيا التبادل الأيوني ، وتم استخراج FAHD1 عبر استراتيجية متسلسلة باستخدام التبادل الأيوني وكروماتوغرافيا استبعاد الحجم. يمكن تكييف هذا النهج التمثيلي مع البروتينات الأخرى ذات الأهمية (التي يتم التعبير عنها بمستويات كبيرة) وتعديلها للأنسجة الأخرى. قد يدعم البروتين النقي من الأنسجة تطوير أجسام مضادة عالية الجودة ، و / أو مثبطات دوائية قوية ومحددة.
Introduction
يعمل البروتين 1 (FAHD1) المحتوي على مجال FAH حقيقيات النواة كثنائي الوظيفة من أوكسالواسيتات (OAA) ديكاربوكسيلاز (ODx)1 وهيدرولاز أسيلبيروفات (ApH)2. وهي مترجمة في الميتوكوندريا 2 وتنتمي إلى عائلة FAH الفائقة الواسعة من الإنزيمات1،2،3،4،5،6. في حين أن نشاط ApH الخاص به ليس له أهمية تذكر فقط ، فإن نشاط ODx الخاص ب FAHD1 يشارك في تنظيم تدفق دورة TCA1،7،8،9. OAA ليس مطلوبا فقط لتفاعل سينثاز السترات المركزي في دورة حمض ثلاثي الكربوكسيل ولكنه يعمل أيضا كمثبط تنافسي لنازعة هيدروجيناز السكسينات كجزء من نظام نقل الإلكترون وكمستقلب كاتابليروتي. أدى انخفاض تنظيم التعبير الجيني FAHD1 في الخلايا البطانية الوريدية السرية البشرية (HUVEC) إلى انخفاض كبير في معدل تكاثر الخلايا10 ، وتثبيط كبير لإمكانات غشاء الميتوكوندريا ، المرتبط بالتحول المصاحب إلى تحلل السكر. يشير نموذج العمل إلى خلل الميتوكوندريا المرتبط بالشيخوخة (MiDAS) 11 الشبيه بالنمط الظاهري 8 ، حيث يتم تنظيم مستويات OAA الميتوكوندريا بإحكام بواسطة نشاط FAHD1 1,8,9.
من الأسهل الحصول على البروتين المؤتلف عن طريق التعبير والتنقية من البكتيريا12 بدلا من الأنسجة. ومع ذلك ، قد يكون البروتين المعبر عنه في البكتيريا متحيزا بسبب احتمال عدم وجود تعديلات ما بعد الترجمة ، أو قد يكون ببساطة مشكلة (أي بسبب فقدان البلازميد ، واستجابات الإجهاد البكتيري ، وروابط ثاني كبريتيد المشوهة / غير المشوهة ، وعدم وجود إفراز أو سوء إفراز ، وتجميع البروتين ، والانقسام البروتيني ، وما إلى ذلك). بالنسبة لبعض التطبيقات ، يجب الحصول على البروتين من تحلل الخلايا أو الأنسجة ، من أجل تضمين مثل هذه التعديلات و / أو استبعاد القطع الأثرية المحتملة. يدعم البروتين النقي من الأنسجة تطوير أجسام مضادة عالية الجودة ، و / أو مثبطات دوائية قوية ومحددة لإنزيمات مختارة ، مثل FAHD113.
تقدم هذه المخطوطة سلسلة من الطرق لاستخراج وتنقية FAHD1 من كبد الخنازير والفئران. تتطلب الطرق الموصوفة كروماتوغرافيا سائلة سريعة البروتين (FPLC) ولكنها تستخدم معدات مختبرية شائعة. يمكن العثور على طرق بديلة في أماكن أخرى14،15،16،17. بعد الاستخراج الكلي للبروتين ، يتضمن البروتوكول المقترح مرحلة اختبار ، حيث تتم مناقشة البروتوكولات الفرعية لهطول الأمطار بكبريتات الأمونيوم وكروماتوغرافيا التبادل الأيوني (الشكل 1). بعد تحديد هذه البروتوكولات الفرعية ، يتم استخراج البروتين محل الاهتمام عبر استراتيجية متسلسلة باستخدام التبادل الأيوني وكروماتوغرافيا استبعاد الحجم مع FPLC. وبناء على هذه المبادئ التوجيهية، يمكن تكييف البروتوكول النهائي بشكل فردي مع البروتينات الأخرى ذات الأهمية.
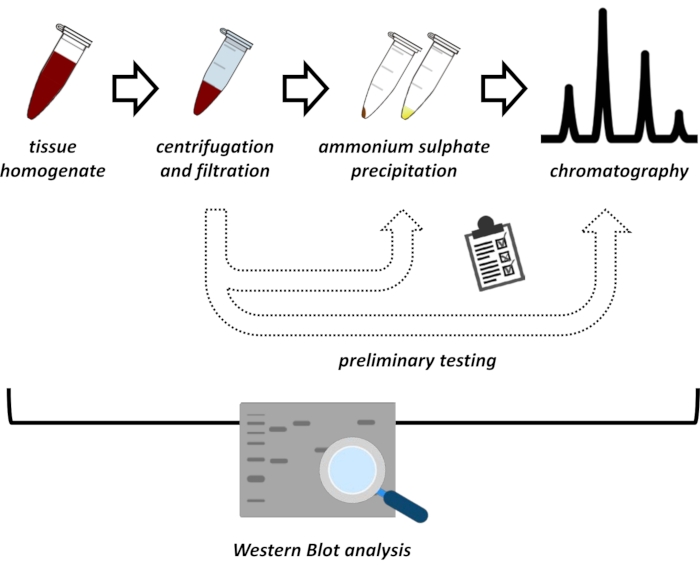
الشكل 1: الاستراتيجية العامة لهذا البروتوكول. من أعلى إلى أسفل: يتم استخراج البروتين من الأنسجة. يتم إعداد تجانس الأنسجة وطردها مركزيا وترشيحها. لكل زوج من العينات الفائقة والمستمدة من الكريات ، يجب إجراء اختبارات لهطول الأمطار كبريتات الأمونيوم وكروماتوغرافيا التبادل الأيوني (FPLC) للتحقيق في الظروف المثلى. بعد إنشاء هذه البروتوكولات الفرعية ، يمكن استخراج البروتين عن طريق إجراء متسلسل لهطول الأمطار بكبريتات الأمونيوم ، وكروماتوغرافيا التبادل الأيوني ، وكروماتوغرافيا استبعاد الحجم المتكرر (FPLC) عند تركيزات متفاوتة من الأس الهيدروجيني والملح. يجب التحكم في جميع الخطوات بواسطة اللطخة الغربية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
وأجريت جميع التجارب وفقا للمبادئ التوجيهية المؤسسية. تم الحصول على كلية الخنازير طازجة من السوبر ماركت المحلي. تم حصاد أنسجة الكبد من الفئران من النوع البري C57BL6 التي تم الاحتفاظ بها في معهد أبحاث الشيخوخة الطبية الحيوية في جامعة إنسبروك ، Rennweg 10 ، 6020 Innsbruck ، النمسا تحت إشراف Uniiv.-Doz. الدكتور بيدر يانسن دور، مشمول بإذن أخلاقي كقائد للمشروع صدر في عام 2013 (BMWF-66.008/0007-II/3b/2013). يتم تغطية صيانة واستخدام الفئران للمشروع بموجب الإذن الأخلاقي رقم 2020-0.242.978 من 5 مايو 2020 ، الصادر عن وزارة التعليم والعلوم والبحوث النمساوية (BMBWF).
1. التحضيرات
ملاحظة: قبل بدء البروتوكول ، يجب إعداد العديد من الأشياء ، أي المخزن المؤقت لتحلل البروتين ، وعينة الأنسجة الخام ، وجسم مضاد محدد ، إلى جانب المواد الكيميائية والمواد العامة.
- تحضير 250 مل من المخزن المؤقت لتحلل البروتين لكل 100 غرام من الوزن الصافي للأنسجة: 250 مل من 1x PBS مع 50 mM NaF ، و 1 mM PMSF ، و 2 ميكروغرام / مل من الأبروتينين ، و 1 mM orthovanadate المنشط (انظر الجدول 1). قم بتصفية الحل باستخدام وحدة تصفية حقنة 0.22 ميكرومتر.
ملاحظة: مطلوب تنشيط orthovanadate قبل الاستخدام لتحويله إلى مثبط أكثر فعالية من بروتين التيروزين فوسفاتيز18. يمكن الحصول على تقويم العظام المنشط من الموردين التجاريين ، ولكن أيضا إعداده على النحو التالي.- قم بإعداد محلول مخزون 200 mM من (الصوديوم) orthovanadate في ddH2O. لإعداد 10 مل من المحلول ، أضف 368 ملغ من Na3VO4 إلى 9 مل من الماء وتذوب عن طريق التحريك. بمجرد إذابتها ، قم بتكوين الحجم إلى 10 مل باستخدام ddH2O.
ملاحظة: قد يختلف الرقم الهيدروجيني الأولي لمحلول أورثوفانادات الصوديوم باختلاف مصدر المادة، ويجب تعديل الرقم الهيدروجيني إلى 10 في نهج متكرر على النحو التالي. - اعتمادا على الرقم الهيدروجيني الأولي للمحلول ، اضبط الرقم الهيدروجيني إلى 10 باستخدام NaOH أو HCl. عند درجة الحموضة > 10 ، سيكون للمحلول لون أصفر. قم بغلي المحلول حتى يصبح عديم اللون ، وقم بتبريده إلى درجة حرارة الغرفة ، وتحقق من درجة الحموضة. إذا كان الرقم الهيدروجيني >10 ، أضف كمية صغيرة من HCl لضبط الرقم الهيدروجيني إلى 10. في هذه المرحلة ، قد يتحول الحل إلى اللون الأصفر مرة أخرى.
- كرر الغليان والتبريد حتى يظل المحلول عديم اللون ويستقر الرقم الهيدروجيني عند 10 (حوالي 5-7 مرات). عند هذه النقطة ، تؤدي إضافة HCl إلى ظهور باهت للون الأصفر في المحلول. تخزين orthovanadate المنشط في 1 مل aliquots في -20 درجة مئوية.
- قم بإعداد محلول مخزون 200 mM من (الصوديوم) orthovanadate في ddH2O. لإعداد 10 مل من المحلول ، أضف 368 ملغ من Na3VO4 إلى 9 مل من الماء وتذوب عن طريق التحريك. بمجرد إذابتها ، قم بتكوين الحجم إلى 10 مل باستخدام ddH2O.
- تحضير أنابيب مع 2 مل من المحلل التحلل لكل غرام من الأنسجة ووضعها على الجليد.
ملاحظة: استخدم هذا البروتوكول ثمانية أنابيب سعة 50 مل، كل منها مملوء ب 30 مل من المخزن المؤقت للتحلل في المجموع لكلية خنازير واحدة (حوالي 100-150 جم)، وأنبوبين مملوء كل منهما ب 40 مل من المخزن المؤقت للتحلل ل 20 كبد فأر (كل منهما 1-2 جم) في المجموع. - تحضير الأنسجة: تشريح الأنسجة على لوحة زجاجية نظيفة مسبقا موضوعة على الجليد في صندوق رغوة البوليسترين. قطع قطع الأنسجة من حوالي 100 ملغ لكل منها ليتم نقلها بسهولة إلى الأنابيب المعنية للتحلل اللاحق. انقل قطع الأنسجة إلى الأنابيب المحضرة (الخطوة 1.2).
- تحضير محلول كبريتات الأمونيوم المشبعة: تسخين 500 مل من ddH2O إلى 70 درجة مئوية وأثناء التحريك ، أضف تدريجيا مسحوق كبريتات الأمونيوم (انظر جدول المواد) حتى لا يتم إذابة المزيد من كبريتات الأمونيوم. قم بتبريد هذا المحلول المشبع (الزائد) إلى درجة حرارة الغرفة وقم بتخزينه عند 4 درجات مئوية بين عشية وضحاها.
2. استخراج البروتين الكلي
ملاحظة بعد تحضير العينة في مخزن مؤقت لتحلل البروتين البارد (انظر الخطوة 1.3) ، قم بتجانس الأنسجة بأفضل شكل ممكن عن طريق الصوتنة بواسطة مسبار بالموجات فوق الصوتية ، أو باستخدام مجانس كهربائي على النحو التالي.
- تجانس الأنسجة
- في حالة الكلى الخنازير ، يفضل أن يكون التعليق عن طريق مسبار بالموجات فوق الصوتية مع الحفاظ على العينة على الجليد (10 دورات من نبض 15 ثانية ، مع فترات من 30 ثانية بين النبضات لتبريد العينة على الجليد ، بسعة متوسطة مع دورة عمل 50٪).
- في حالة أعضاء الفأر ، قم بتجانس التعليق باستخدام مجانس كهربائي (يبدأ بقوة منخفضة ، ويتسارع ببطء إلى قوة متوسطة) مع الحفاظ على العينة على الجليد. اغسل المجانس الكهربائي بانتظام في PBS لإزالة أي مادة عضوية تسد الجهاز.
- خذ 20 ميكرولتر من العينات وتحقق تحت المجهر مما إذا كانت خلايا الأنسجة المتجانسة قد دمرت بشكل صحيح ؛ خلاف ذلك ، كرر التجانس.
- جهاز الطرد المركزي للأنابيب في جهاز طرد مركزي على الطاولة عند 10000 × g لمدة 30 دقيقة عند 4 درجات مئوية.
ملاحظة: اختياريا، قم بطرد مركزي للغاز الخارق مرة ثانية بسرعة 20000 × جم لمدة 30 دقيقة عند 4 درجات مئوية للتخلص من الأجزاء الصغيرة من الكريات الأولية التي ربما تم نقلها. سيؤدي ذلك إلى تبسيط الترشيح اللاحق في الخطوة 2.3. - جمع supernatant في أنبوب جديد ووضعه على الجليد. قم بتصفية supernatant بالتتابع باستخدام وحدات مرشح حقنة 0.45 ميكرومتر و 0.22 ميكرومتر. Aliquot supernatant في دفعات 10 مل وتجميدها عند -20 درجة مئوية للتخزين على المدى القصير أو عند -80 درجة مئوية للتخزين لفترة أطول.
ملاحظة: يزيل الترشيح المسبق باستخدام 0.45 ميكرومتر غالبية الجسيمات قبل أن تزيل خطوة الترشيح الثانية ب 0.22 ميكرومتر الجسيمات الدقيقة. يمكن أن يؤدي استخدام مرشح 0.22 ميكرومتر مباشرة إلى خطر انسداد المرشحات. - قم بإعداد عينة 50 ميكرولتر لتحليل اللطخة SDS-PAGE/Western عن طريق إضافة 10 ميكرولتر من المخزن المؤقت لعينة SDS 5x (انظر الجدول 1) إلى 40 ميكرولتر من supernatant ، ثم الغليان عند 95 درجة مئوية لمدة 10 دقائق.
- اختياريا، أعد تعليق حوالي 100 ميكرولتر من الكريات التي تم الحصول عليها في الخطوة 2.2 في 900 ميكرولتر من ddH2O، وقم بإعداد عينة لتحليل البقع الغربية SDS-PAGE/Western كما هو موضح أعلاه.
ملاحظة: إن إدراج العينات المشتقة من الكريات في تحليل اللطخة الغربية ، بالإضافة إلى التحكم الإيجابي ، سيشير إلى ما إذا كان التعبير عن البروتين منخفضا ، أو أن الجسم المضاد يمثل مشكلة.
- اختياريا، أعد تعليق حوالي 100 ميكرولتر من الكريات التي تم الحصول عليها في الخطوة 2.2 في 900 ميكرولتر من ddH2O، وقم بإعداد عينة لتحليل البقع الغربية SDS-PAGE/Western كما هو موضح أعلاه.
3. SDS-PAGE وتحليل اللطخة الغربية
ملاحظة: يلزم تحليل اللطخة الغربية للتحقق من قابلية ذوبان البروتين. فيما يلي وصف لبروتوكول النشاف الكهربائي ، باستخدام نظام النشاف الرطب / الخزان (انظر جدول المواد). ويمكن العثور على بروتوكول بديل ل SDS-PAGE في مكان آخر19.
- قم بإعداد هلام متقطع 12.5٪ من البولي أكريلاميد SDS-PAGE وفقا لتعليمات الشركة المصنعة (أي هلام التراص فوق هلام الحل ؛ انظر الجدول 1). قم بتشغيل العينات التي تم إعدادها مسبقا خلال الخطوة 2 (على غرار الخطوات 4 و5 و6؛ راجع أدناه).
- قم بتحميل سلم علامة البروتين في البئر الأول (انظر جدول المواد). تحميل 5 نانوغرام من البروتين المؤتلف hFAHD1 (الذي تم الحصول عليه من البكتيريا12 ؛ انظر الجدول 1) كعنصر تحكم إيجابي في البئر الثاني.
- بعد ذلك ، قم بتحميل 20 ميكرولتر من العينة المراد تحليلها ، واملأ جميع الآبار المتبقية ب 20 ميكرولتر من المخزن المؤقت لعينة SDS-PAGE 1x المحضر (أي مخزن مؤقت للعينة 5x مخفف ب ddH2O). قم بتشغيل المواد الهلامية SDS-PAGE على 125 فولت باستخدام المخزن المؤقت الذي يعمل بنظام SDS (انظر الجدول 1).
- بعد اكتمال SDS-PAGE ، قم بإجراء تحليل لطخة غربية وفحص الأغشية باستخدام الجسم المضاد المتاح المرفوع ضد FAHD1 (انظر الجدول 1).
ملاحظة: نظرا لأن العينات مأخوذة من تجانس الأنسجة الخام، عادة ما تتعرض جودة SDS-PAGE وتحليل اللطخة الغربية في هذه المرحلة للخطر؛ ومع ذلك ، من المهم التحقق مما إذا كان البروتين المراد استخراجه قابلا للذوبان في supernatant. تم اختبار البروتوكول التالي لكليتي الخنازير ، وأعضاء الفئران المختلفة ، بما في ذلك الكبد والقلب والدماغ والكلى.- قم بإعداد المخزن المؤقت لنقل اللطخة الغربية 10x (انظر الجدول 1). قم بإعداد المخزن المؤقت لنقل اللطخة الغربية 1x (انظر الجدول 1) وقم بتبريده إلى 4 درجات مئوية.
- تنشيط غشاء PVDF لمدة 2 دقيقة في الميثانول. اغسل الغشاء في ddH2O لمدة دقيقتين. قم بموازنة الغشاء لمدة 15 دقيقة في 1x مخزن مؤقت لنقل اللطخة الغربية.
- اغسل جل SDS ب 1x PBS لمدة 10 دقائق أثناء الاهتزاز لإزالة المخزن المؤقت الذي يعمل بنظام SDS ، ثم احتضن الجل في مخزن مؤقت لنقل اللطخة الغربية لمدة 10 دقائق لتحقيق التوازن. قم بتجميع كاسيت النشاف الكهربائي (أي الجمع بين غشاء PVDF المنشط والمواد الهلامية) وفقا لتعليمات الشركة المصنعة.
- قم بتشغيل اللطخة عن طريق النشاف الكهربائي عند 300 مللي أمبير لمدة 1 ساعة في صندوق رغوة البوليسترين المملوء بالثلج أو في الغرفة الباردة (4 درجات مئوية). انقل غشاء PVDF إلى أنبوب 50 مل مع جانبه المكشوف المواجه للجانب الداخلي من الأنبوب. احتضن الغشاء في 20 مل من المخزن المؤقت الغربي لحجب اللطخة (انظر الجدول 1) بين عشية وضحاها عند 4 درجات مئوية أثناء التدحرج على بكرة أنبوب (انظر جدول المواد).
- في اليوم التالي ، اغسل الغشاء لمدة 5 دقائق باستخدام 20 مل من المخزن المؤقت لغسل اللطخة الغربية (PBS مع 0.1٪ (v / v) Tween 20) في نفس الأنبوب أثناء التدحرج. احتضان الغشاء في نفس الأنبوب مع الجسم المضاد الأساسي2 (الذي يستهدف FAHD1 ؛ انظر الجدول 1) المخفف 1: 500 في المخزن المؤقت الغربي لحجب اللطخة لمدة 1 ساعة في درجة حرارة الغرفة أثناء التدحرج.
- اغسل الغشاء في نفس الأنبوب ثلاث مرات لمدة 10 دقائق لكل منها مع 20 مل من المخزن المؤقت لغسيل اللطخة الغربية أثناء التدحرج. احتضن الغشاء لمدة 30 دقيقة في درجة حرارة الغرفة باستخدام الجسم المضاد الثانوي المقترن ب HRP (انظر جدول المواد) المخفف بنسبة 1:3000 في 5 مل من المخزن المؤقت لحجب اللطخة الغربية.
- اغسل الغشاء في نفس الأنبوب ثلاث مرات لمدة 10 دقائق لكل منها مع 20 مل من المخزن المؤقت لغسيل اللطخة الغربية ومرتين لمدة 5 دقائق لكل منهما باستخدام 1x PBS. جفف الغشاء عن طريق الإمساك به بعناية باستخدام ملاقط على حافة واحدة ، وعن طريق لمس قطعة من السليلوز أو قطعة من ورق Whatman مع الحافة المقابلة (السفلية) من الغشاء. ضع الغشاء (الجانب المكشوف لأعلى) على لوحة زجاجية نظيفة.
- قم بتغطية الغشاء بالكامل بعناية ب 1 مل من ركيزة اللطخة الغربية ECL المعدة باستخدام ماصة ، مع الحرص على عدم إنشاء أي فقاعات هواء. دع محلول ECL يحضن لمدة 3 دقائق ، وقم على الفور بتطوير الغشاء باستخدام فيلم الأشعة السينية أو باستخدام نظام تصوير.
ملاحظة: إذا لم يتم الكشف عن البروتين في أي من العينات ولكن فقط في التحكم الإيجابي ، فقد يشير ذلك إلى أن البروتين غير قابل للذوبان ، أو غير موجود بكميات كافية ليتم اكتشافه بواسطة الجسم المضاد. إذا تم تحميل نانوغرام فقط من التحكم الإيجابي ، فإن السيناريو الأول يكون أكثر احتمالا. إذا لم يتم اكتشاف أي بروتين على الإطلاق ، فتحقق من جودة الجسم المضاد ، وربما انتقل إلى جسم مضاد متعدد النسيلة بدلا من جسم مضاد أحادي النسيلة. في حالات نادرة ، أي بالنسبة لبعض البروتينات الكارهة للماء ، قد يكون البروتين قابلا للكشف بعد الطرد المركزي ، ولكن ليس بعد الترشيح. في مثل هذه الحالة ، يوصى باستخدام وحدات تصفية خاصة للبروتينات الكارهة للماء.
- اختياريا ، قم بتلطيخ أغشية PVDF بعد اللطخة الغربية للتحكم في النقل الناجح للبروتين من جل SDS-PAGE إلى غشاء PVDF.
ملاحظة: يوصى باستخدام تلطيخ Coomassie لاستكشاف الأخطاء وإصلاحها وتطوير الطريقة والتوثيق ، ولكن ضع في اعتبارك أنه بعد تطبيق هذا البروتوكول ، يتم فقدان الأغشية لمزيد من تحليل اللطخة الغربية. يعطي تلطيخ Ponceau S تلطيخا أضعف ولكن يمكن استخدامه إذا كان سيتم إعادة فحص الأغشية.- تحضير صواني صغيرة تحتوي على تلطيخ (Coomassie أو Ponceau S) وحلول إزالة التلطيخ.
- باستخدام ملاقط ، ضع الغشاء في محلول التلطيخ ورجه بلطف حتى يلطخ الغشاء جيدا (5-10 دقائق).
- انقل الغشاء إلى محلول إزالة البقع ورجه حتى يشبع المحلول (5-10 دقائق). كرر خطوة إزالة البقع حتى يمكن ملاحظة نطاقات البروتين على الغشاء ؛ إذا لم يتم ملاحظة أي عصابات على الإطلاق ، كرر التلطيخ مع وقت حضانة أطول. جفف الغشاء عن طريق وضعه على طبق زجاجي باستخدام ملاقط.
4. اختبار: هطول الأمطار كبريتات الأمونيوم
ملاحظة: هطول الأمطار كبريتات الأمونيوم هو وسيلة لتنقية البروتين عن طريق تغيير ذوبان البروتين. في تجربة أولية ، يتم زيادة تركيز كبريتات الأمونيوم بالتتابع إلى قيمة ترسب أكبر قدر ممكن من ملوثات البروتين ، مع ترك FAHD1 في المحلول. يتم فحص قابلية ذوبان البروتين مرة أخرى عن طريق تحليل اللطخة الغربية.
- انتقل من الخطوة 2.3: إما إذابة أليكوت من العينة أو المتابعة مباشرة بعد استخراج البروتين (أي دون تجميد العينة). قم بتصفية العينة باستخدام وحدة مرشح 0.22 ميكرومتر لاستبعاد الرواسب المحتملة بعد الذوبان. قم بإعداد ستة أنابيب سعة 1.5 مل على الجليد ، وانقل 250 ميكرولتر من العينة إلى كل أنبوب.
- إعداد سلسلة تخفيف من 5 ٪ ، 10 ٪ ، 15 ٪ ، 20 ٪ ، 25 ٪ ، و 30 ٪ كبريتات الأمونيوم في الأنابيب المعدة أعلاه ، وتشكل الحجم النهائي إلى 1000 ميكرولتر مع المخزن المؤقت لتحلل البروتين. احتضان العينات عند 4 درجات مئوية بين عشية وضحاها على دوار أنبوب (انظر جدول المواد).
- باستخدام جهاز طرد مركزي على الطاولة ، جهاز طرد مركزي عند 10000 × g لمدة 30 دقيقة عند 4 درجات مئوية ونقل جميع المواد الفائقة بعناية إلى أنابيب منفصلة. جفف الكريات الناتجة في الهواء وأعد تعليق كل منها في 1000 ميكرولتر من ddH2O.
- لكل زوج من الكريات المعاد تعليقها و supernatant من الخطوة السابقة ، امزج 40 ميكرولتر مع 10 ميكرولتر من المخزن المؤقت لعينة SDS 5x واغلي عند 95 درجة مئوية مع أغطية مفتوحة حتى يتبخر معظم السائل. ثم ، أعد تعليق الكريات في خليط من 50٪ DMSO في ddH2O.
- قم بإجراء SDS-PAGE (الخطوة 3) ولكن قم بتشغيل المواد الهلامية عند 80 فولت لمدة 3 ساعات. لكل تركيز من كبريتات الأمونيوم, تحميل العينات المشتقة من بيليه المعاد تعليقها وsupernatant (الخطوة 4.3) في أزواج. قم بإجراء تحليل اللطخة الغربية (الخطوة 3).
- تحقق من وجود أعلى تركيز لكبريتات الأمونيوم ، حيث يبقى البروتين المراد تنقيته (أي FAHD1) في العينة المشتقة من supernatant. استنادا إلى النتائج, تحديد بروتوكول هطول الأمطار كبريتات الأمونيوم للبروتين من الفائدة, لاستخدامها في التجارب المستقبلية.
ملاحظة: من المعروف جيدا أن كبريتات الأمونيوم تشوه SDS-PAGE واللطخة الغربية. مع زيادة تركيز كبريتات الأمونيوم ، سيتم اختراق جودة تحليل اللطخة الغربية. ومع ذلك ، كما هو الحال مع الخطوة 3 من قبل ، يتم استخدام هذا التحليل للتحقق من قابلية ذوبان البروتين محل الاهتمام عند تركيزات معينة من كبريتات الأمونيوم. يهدف هذا البروتوكول إلى ترسيب البروتينات الأخرى ، في حين أن البروتين المراد تنقيته يجب أن يظل قابلا للذوبان.
5. اختبار: كروماتوغرافيا التبادل الأيوني مع FPLC
ملاحظة: ترتبط الجزيئات ذات المجموعات الوظيفية المشحونة بعمود جسيمات السيليكا ل FPLC ، مما يتيح تمايز البروتينات وفقا لشحنة سطحها. نفذ هذه الخطوة مرتين، باستخدام عمود التبادل الكاتيوني وعمود التبادل الأنيوني (انظر جدول المواد). وخطوات البروتوكول هي نفسها بالنسبة لكروماتوغرافيا التبادل الكاتيونية أو الأنيونية، ولكن المخازن المؤقتة التي ستستخدم مختلفة (انظر الجدول 1)؛ كلاهما مع ظروف "الملح المنخفض" 15 mM NaCl و "الملح العالي" 1 M NaCl. بالنسبة للأعمدة المستخدمة ، يوصى بمعدل تدفق يبلغ 1 مل / دقيقة.
- قم بإعداد نظام FPLC باستخدام عمود التبادل الأنيوني أو الكاتيوني. اغسل العمود ب 5 أحجام أعمدة (CVs) بنسبة 20٪ EtOH (في H 2 O) ، متبوعة ب 5 CVs من ddH2O. بدلا منذلك ، اغسل العمود ب 1 CV من المخزن المؤقت منخفض الملح ، والمخزن المؤقت عالي الملح ، ومرة أخرى المخزن المؤقت منخفض الملح بالترتيب حتى لا يتم ملاحظة المزيد من القمم في الكروماتوجرام ، ولكن اغسل مرة واحدة على الأقل.
- بعد تحديد البروتوكول الأمثل لهطول الأمطار كبريتات الأمونيوم على نطاق صغير (الخطوة 4) ، قم بتطبيق بروتوكول هطول الأمطار على 10 مل من تجانس الأنسجة الأصلي (الخطوة 2). اختياريا، قم بتدوير العينة مقابل المخزن المؤقت منخفض الملح.
- ضع العينة على العمود (على سبيل المثال ، عن طريق الحقن أو باستخدام مضخة عينة) وجمع التدفق من خلالها. اغسل العمود ب 1 CV من المخزن المؤقت منخفض الملح.
- قم بإعداد إزالة التدرج الخطي من 100٪ مخزن مؤقت منخفض الملح / 0٪ مخزن مؤقت عالي الملح إلى 0٪ مخزن مؤقت منخفض الملح / مخزن مؤقت عالي الملح بنسبة 100٪ ضمن 3 CVs. بعد انتهاء التدرج ، استمر في الجري باستخدام المخزن المؤقت العالي الملح حتى لا يتم اكتشاف المزيد من القمم المرتبطة بالبروتين (امتصاص الأشعة فوق البنفسجية عند 280/255 نانومتر) في الكروماتوجرام على مدى 1 CV.
- ضع 1 مل من 25٪ SDS المذاب في 0.5 M NaOH (في ddH2O) لتنظيف العمود. على التوالي ، اغسل العمود ب 3 CVs من ddH 2 O و 3CVs من 20٪ EtOH (في ddH2O).
- جمع عينات SDS-PAGE من جميع كسور الذروة والتدفق من خلالها ، والتحقيق فيها عبر اللطخة الغربية لوجود البروتين محل الاهتمام (الخطوة 3). قم بتجميد الكسور المجمعة في النيتروجين السائل وتخزينها عند -80 درجة مئوية.
- بعد اكتمال تحليل اللطخة الغربية ، قم بإذابة وتجميع الكسور التي تحتوي على البروتين محل الاهتمام وتجاهل الأجزاء الأخرى. كرر الخطوات من 5.1 إلى 5.5 مع العمود البديل (أي عمود التبادل الكاتيوني أو الأنيوني).
- بعد فحص كلا العمودين ، حدد بروتوكول FPLC للبروتين محل الاهتمام ، لاستخدامه في التجارب المستقبلية. قلل من حجم محلول البروتين باستخدام وحدات مرشح الطرد المركزي الفائق (10 كيلو دالتون، انظر جدول المواد) إلى 2 مل.
ملاحظة: هناك نتيجتان متوقعتان لهذه السلسلة من التجارب. إما أن يكون البروتين محل الاهتمام قد على أحد الأعمدة ، ومحلول البروتين نقي بالفعل بعد الاستخلاص ، أو بقي البروتين في التدفق في كلتا الحالتين. في السيناريو الأخير ، على الرغم من أن البروتين في التدفق ، إلا أن تأثير التنظيف لهذه الخطوة قد لا يزال كبيرا. في مثل هذه الحالة ، كما هو الحال بالنسبة ل FAHD1 في كبد الخنازير والفئران ، ستظل هذه الخطوة من التبادل الأيوني تؤدي. إذا لم يتمكن عمود التبادل الكاتيوني أو الأنيوني من توفير تأثير تنظيف مناسب ، فقد يحاول المرء تعديل الرقم الهيدروجيني للمحللات والمخزن المؤقت ، وتحويل العينة مقابل المخزن المؤقت قيد التشغيل قبل التطبيق على FPLC.
6. استخراج البروتين باستخدام بروتوكولات فرعية محددة لهطول الأمطار كبريتات الأمونيوم و FPLC
ملاحظة: الجسيمات المسامية في عمود هلام السيليكا ل FPLC (انظر جدول المواد) تمكن من تمييز البروتينات وفقا لنصف قطرها الهيدروديناميكي. يجب تنفيذ الخطوات الموضحة باستخدام نظام FPLC ، باستخدام كروماتوغرافيا استبعاد الحجم (SEC). بالنسبة لعمود SEC المستخدم (انظر جدول المواد) ، يوصى بمعدل تدفق يبلغ 0.3 مل / دقيقة.
- قم بإعداد جميع المواد المطلوبة (انظر الخطوة 1) ، واستخرج البروتين الكلي من الأنسجة (انظر الخطوة 2). إجراء هطول الأمطار كبريتات الأمونيوم مع جميع الأنسجة المتجانسة التي لم تستخدم للاختبار (انظر الخطوة 4). بالنسبة للأحجام الأكبر حجما، ركز الليزات باستخدام وحدات مرشح الطرد المركزي الفائقة (10 كيلودادين؛ انظر جدول المواد) وصولا إلى حجم أصغر يبلغ 50 مل أو أقل.
- قم بإجراء خطوة تنقية أولى باستخدام كروماتوغرافيا التبادل الأيوني (انظر الخطوة 5).
- قم بإعداد عينات للبقع الغربية ، كما هو موضح في الخطوات السابقة. إجراء تحليل اللطخة الغربية وتجميع جميع FAHD1 التي تحتوي على كسور من كروماتوغرافيا التبادل الأيوني.
- قلل حجم محلول البروتين إلى 2 مل باستخدام وحدات مرشح الطرد المركزي الفائقة (10 كيلو دالتون). قم بتصفية المحلول بالتتابع باستخدام وحدات تصفية حقنة 0.45 ميكرومتر و 0.22 ميكرومتر لإزالة أي هطول متناهي الصغر.
- قم بموازنة عمود SEC مع 1 CV من المخزن المؤقت قيد التشغيل في SEC (انظر الجدول 1) ، الذي يحتوي على 1 mM DTT. قم بتحميل العينة على العمود وقم بتشغيل الكروماتوغرافيا حتى يتم التخلص من جميع البروتينات (1-2 CV).
- جمع كسور من 1 مل من التدفق من خلال التي تتوافق مع قمم كبيرة في كروماتوجرام (امتصاص الأشعة فوق البنفسجية عند 280/255 نانومتر) وإعداد عينات 50 ميكرولتر من كل كسر تم جمعه ل SDS-PAGE وتحليل البقع الغربية ، كما هو موضح في الخطوات السابقة. قم بتجميد جميع الكسور باستخدام النيتروجين السائل ، وتخزينها عند -80 درجة مئوية.
- اغسل عمود SEC على التوالي ب 1 CV من ddH 2 O و 1 CV من20٪ EtOH (في ddH2O). قم بإجراء تحليل اللطخة الغربية، وقم بتجميع جميع الكسور التي تحتوي على FAHD1. قلل حجم محلول البروتين إلى 2 مل باستخدام وحدات مرشح الطرد المركزي الفائقة (10 كيلو دالتون، انظر جدول المواد).
- تقييم تركيز البروتين باستخدام مجموعة فحص BCA تجارية (انظر جدول المواد).
ملاحظة: قد يؤثر محتوى الأس الهيدروجيني والملح في المرحلة المتنقلة على ملف تعريف الاستخلاص للبروتينات الكروية20. قد تؤدي الظروف الحمضية أو الأساسية إلى أن تكون القمم أقل تحديدا وزيادة تفاعلات مصفوفة البروتين مما يؤدي إلى الاحتفاظ الجزئي بالبروتين في العمود20. يمكن استغلال هذا التأثير لمزيد من تنقية البروتين. تكرار الخطوة 6 مع معدلات تدفق مختلفة ، ودرجة الحموضة ، وتركيزات الملح قد يعزز نقاء البروتين20.
7. تلطيخ الفضة
ملاحظة: يلزم تحليل تلطيخ الفضة للمواد الهلامية SDS-PAGE للتحقق من وجود ملوثات البروتين التي قد لا تظهر مع تلطيخ Coomassie. البروتوكول التالي هو واحد من بين العديد من الإصدارات التي يمكن العثور عليها في الأدبيات21. قم بتنفيذ جميع خطوات الحضانة عن طريق الاهتزاز في صينية زجاجية نظيفة. جمع جميع السوائل المحتوية على الفضة والفورمالديهايد في حاوية نفايات خاصة والتخلص منها بشكل صحيح.
- احتضن المواد الهلامية SDS-PAGE في محلول تثبيت تلطيخ الفضة (انظر الجدول 1) بين عشية وضحاها في الغرفة الباردة. احتضان المواد الهلامية في محلول حضانة تلطيخ الفضة (انظر الجدول 1) لمدة 3 ساعات في درجة حرارة الغرفة. اختياريا ، أضف glutaraldehyde (انظر الجدول 1) لتحسين اكتشاف العصابات الخافتة. اغسل المواد الهلامية أربع مرات في ddH2O لمدة 10 دقائق لكل منهما.
- احتضان المواد الهلامية في محلول الفضة تلطيخ الفضة (انظر الجدول 1) لمدة 1 ساعة.
ملاحظة: ضع في اعتبارك أنه من الآن فصاعدا تحتوي جميع السوائل والجل نفسه على الفضة والفورمالديهايد السامة. - احتضان المواد الهلامية في محلول مطور تلطيخ الفضة (انظر الجدول 1) مع اهتزاز قوي حتى تكون الأشرطة مرئية بوضوح. لوقف التفاعل ، تخلص من محلول المطور واحتضن المواد الهلامية على الفور في محلول إيقاف تلطيخ الفضة (انظر الجدول 1) لمدة لا تقل عن 10 دقائق.
ملاحظة: ستصبح النطاقات الملطخة بالخطوتين 7.2 و 7.3 أكثر تطورا باستمرار. قد يكون من الضروري إضافة المزيد من الفورمالديهايد إلى المحلول أكثر مما هو مذكور إذا كان التلطيخ ضعيفا.
النتائج
تم استخراج بروتين FAHD1 من كبد الخنازير والفئران باستخدام البروتوكول المعروض. بالنسبة لأنسجة الفأر ، يلزم وجود أعضاء متعددة للحصول على عدة ميكروغرام بعد خطوة التنقية النهائية. لهذا السبب ، تركز هذه المقالة على استخراج FAHD1 من كلى الخنازير ، وهي تجربة أكثر مثالية. يتم استخراج FAHD1 من كبد الفأر لعرض الصعوبات والمزالق المحتملة لهذا البروتوكول. يوصى عموما باستخدام الأعضاء التي تظهر مستوى تعبيرا عاليا عن البروتين الذي يريد المرء تنقيته. قد يساعد أطلس البروتين البشري22 في تقدير التعبير في النظام النموذجي ، أو قد يقوم المرء بإجراء تجارب لطخة غربية أولية مع محللات الأنسجة الخام المختلفة لتقييم هذه المستويات. كان التحكم الإيجابي المستخدم في جميع تحليلات اللطخة الغربية عبارة عن بروتين مؤتلف موسوم ، يعمل بوزن جزيئي أعلى قليلا.
كتجربة أولى ، يتم تقديم استخراج FAHD1 من كلية الخنازير. يتم عرض عملية تجانس الأنسجة (الخطوة 1) واستخراج البروتين الكلي (الخطوة 2) في الشكل التكميلي 1 (انظر وسيلة الإيضاح للحصول على وصف للخطوات الفردية). تم استخدام عشر الليزات الإجمالية للتجارب التالية.
تم اختبار هطول الأمطار كبريتات الأمونيوم مرة واحدة لهذا الليزات ، عن طريق إضافة كبريتات الأمونيوم إلى الليزات بتركيزات مختلفة (الخطوة 4) (الشكل 2). بعد الطرد المركزي ، تم أخذ عينات من الكريات والمواد الفائقة وتحليلها باستخدام لطخة غربية باستخدام جسم مضاد متعدد النسيلةمحدد 2 تم رفعه ضد FAHD1 البشري. تم تحميل 200 نانوغرام من المؤتلف His/S الموسوم بالإنسان FAHD1 الذي تم الحصول عليه من E. coli12 كعنصر تحكم إيجابي. يمكن رؤية نطاق البروتين FAHD1 عند 25 كيلو دال ، في حين أن التحكم الإيجابي الموسوم يعمل عند 34 كيلو دالتون. بناء على هذه البيانات ، تم تعريف بروتوكول حيث يتم التعامل مع lysate مع 25 ٪ كبريتات الأمونيوم ، أي الظروف التي FAHD1 لا يزال في supernatant ، في حين يتم ترسيب غالبية البروتينات الأخرى. هذه خطوة رئيسية في استراتيجية التنقية. هطول الأمطار كبريتات الأمونيوم هو خطوة تنظيف فعالة قبل الشروع في طرق أخرى. من الجدير بالذكر ، لن يتم استخدام كميات من كبريتات الأمونيوم أعلى من 30 ٪ ، لأن كبريتات الأمونيوم تشوه تدريجيا جودة SDS-PAGE واللطخة الغربية.

الشكل 2: هطول الأمطار كبريتات الأمونيوم وفحص اللطخة الغربية للخنازير FAHD1 . (A) تمت إضافة كبريتات الأمونيوم إلى الليزات بتركيزات مختلفة (5٪ إلى 25٪ كحد أقصى) لترسيب البروتينات من المحلول. (ب) تم تحديد وجود الخنازير FAHD1 (25 kDa) في الأزواج الفردية من الكريات و supernatant المقابلة لتركيزات كبريتات الأمونيوم المختلفة عبر اللطخة الغربية باستخدام جسم مضاد متعدد النسيلة مرفوع ضد FAHD1 البشري. لا يزال supernatant المقابل لهطول الأمطار بكبريتات الأمونيوم بنسبة 25٪ يظهر وجود الخنازير FAHD1 في supernatant ، وفي الوقت نفسه يعجل بكمية جيدة من البروتينات الأخرى. تم تحميل 200 نانوغرام من البروتين المؤتلف الموسوم ب His/S كعنصر تحكم إيجابي (34 كيلو دالتون). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
بعد اختبار أعمدة التبادل الأيوني مع FPLC ، تم تحديد استراتيجية حيث يبقى الخنازير FAHD1 في تدفق كروماتوغرافيا التبادل الأنيوني عند الرقم الهيدروجيني 9 (الخطوة 5). بدءا من الليزات التي تم الحصول عليها عن طريق هطول الأمطار بكبريتات الأمونيوم بنسبة 25٪ (كما هو محدد في تجارب الاختبار السابقة) ، تم استخدام كروماتوغرافيا التبادل الأنيوني للقضاء على المزيد من البروتينات من المحلول (الشكل 3A). تمت إزالة البروتينات الملزمة عن طريق الاستخلاص من العمود ، في حين تم تنقية التدفق عبر SEC عند الرقم الهيدروجيني 7.4 (الشكل 3B). بعد كلتا الخطوتين ، حدد تحليل اللطخة الغربية جميع الكسور التي تحتوي على الخنازير FAHD1 ، والتي تم تجميعها وتركيزها إلى 2 مل.
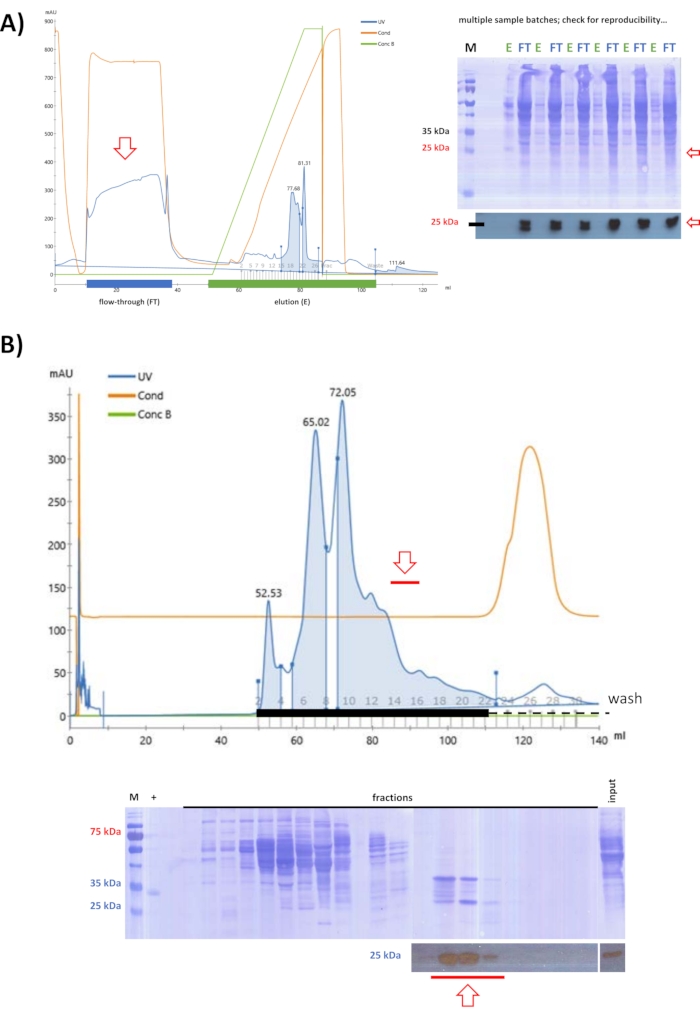
الشكل 3: تنقية الخنازير FAHD1 مع FPLC - الجزء 1. تشير الأسهم الحمراء في الكروماتوجرام والبقع إلى وجود FAHD1. في الكروماتوجرام ، تشير "UV" إلى امتصاص الأشعة فوق البنفسجية عند 280 نانومتر ، و "Cond" إلى الموصلية (المتعلقة بتركيز الملح في المخزن المؤقت) ، و "Conc B" تشير إلى النسبة المئوية للمخزن المؤقت للملح العالي في تدرج المخزن المؤقت (0٪ المخزن المؤقت النقي منخفض الملح ؛ 100٪ المخزن المؤقت عالي الملح النقي). (أ) تنقية الخنازير FAHD1 من الليزات التي تم الحصول عليها عن طريق هطول الأمطار كبريتات الأمونيوم بنسبة 25٪ مع عمود تبادل أنيوني (FPLC). في حين أن العديد من البروتينات ترتبط بالعمود ، تم العثور على الخنازير FAHD1 في التدفق. تتم إزالة الملوثات الأوساخ وغير البروتينية عن طريق الاستخلاص من العمود ، بينما تتم معالجة التدفق بشكل أكبر. (ب) يتم تنقية التدفق من خلال كروماتوغرافيا التبادل الأنيوني السابقة في (أ) عن طريق كروماتوغرافيا استبعاد الحجم (FPLC) عند الرقم الهيدروجيني 7.4. (أ، ب) حدد تحليل اللطخة الغربية (البقع المقطوعة في الأسفل) الكسور التي تحتوي على الخنازير FAHD1 ، والتي يتم تجميعها وتركيزها. تصور البقع الكاملة الغشاء الملطخ ب Coomassie بعد تحليل اللطخة الغربية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم تطبيق العينة المصفاة مرة أخرى على SEC ولكن في ظروف المخزن المؤقت عند الرقم الهيدروجيني 9 (انظر الجدول 1) (الشكل 4). الأساس المنطقي وراء هذا النهج هو أن محتوى الأس الهيدروجيني والملح في المرحلة المتنقلة قد يؤثر على ملف تعريف الاستخلاص للبروتينات الكروية20 ، وتم العثور على ملف تعريف استخلاص محسن ل FAHD1 في ظل هذه الظروف المؤقتة. يحتوي جزء واحد على بروتين بمستويات نقاء كافية لفحوصات نشاط الإنزيم الأساسي12 لتأكيد هوية البروتين في النهاية.
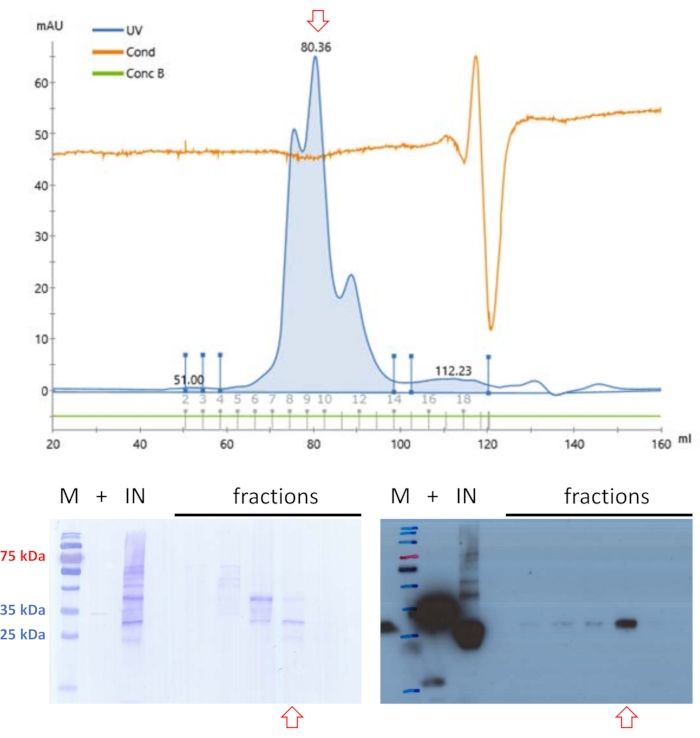
الشكل 4: تنقية الخنازير FAHD1 مع FPLC - الجزء 2. تشير الأسهم الحمراء في الكروماتوجرام والبقع إلى وجود FAHD1. يتم تنقية عينات البروتين التي تم تنقيتها سابقا باستخدام التبادل الأنيوني والكروماتوغرافيا الاستبعاد الحجمي بشكل أكبر من خلال كروماتوغرافيا استبعاد الحجم (FPLC) عند الرقم الهيدروجيني 9 (اللوحة العلوية). يحدد تحليل اللطخة الغربية المصور في أسفل اليمين الكسور التي تحتوي على الخنازير FAHD1 ، والتي يتم تجميعها وتركيزها (الألواح السفلية). تظهر اللطخة في أسفل اليسار تلطيخ Coomassie للغشاء بعد اللطخة الغربية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تم اختبار استراتيجية بديلة (أي SEC متبوعة بكروماتوغرافيا التبادل الأيوني) مع 2 مل من الليزات التي تم الحصول عليها بعد هطول كبريتات الأمونيوم (الخطوة 4) (الشكل التكميلي 2). الأساس المنطقي لهذه التجربة هو أنه باستخدام SEC أولا ، يمكن فصل الكسور التي تحتوي على FAHD1 عن غالبية البروتينات الأخرى ، في حين يمكن استخدام كروماتوغرافيا التبادل الأيوني اللاحقة لزيادة تنقية البروتين. أولا ، تم تجزئة lysate باستخدام SEC عند الرقم الهيدروجيني 7.4 (الخطوة 6). حدد تحليل اللطخة الغربية جميع الكسور التي تحتوي على الخنازير FAHD1. ثانيا ، تم تركيز هذه الكسور ونقيتها بشكل أكبر باستخدام عمود تبادل أنيوني عند الرقم الهيدروجيني 9 (الخطوة 5). يظهر الكروماتوغرام وتحليل اللطخة الغربية (الشكل التكميلي 2) أن هذه الاستراتيجية مشجعة لأن كروماتوغرام التبادل الأيوني يظهر ذروة ضيقة محددة مرتبطة بمستويات البروتين المخصب في اللطخة الغربية. ومع ذلك ، فإن عيب هذه الاستراتيجية هو أنها محدودة بالحجم الأولي الذي سيتم تطبيقه على SEC (2 مل) ، وبالتالي فإن إنتاجية هذه الطريقة منخفضة للغاية. معالجة كلية الخنازير بأكملها ، على سبيل المثال ، ليست عملية.
كتعديل آخر لهذا البروتوكول ، تم تضمين عمود تبادل كاتيوني قبل عمود التبادل الأنيوني عندما كان الخنازير FAHD1 موجودا أيضا في التدفق. وفي كل خطوة من خطوات البروتوكول، أخذت عينات من الخنازير FAHD1 التي تحتوي على كسور واختبرت باستخدام مقايسة ODx، كما هو موضح في مكان آخر12 (الشكل التكميلي 3). يزداد النشاط الأنزيمي المحدد جنبا إلى جنب مع مستوى النقاء ، أي إلى جانب زيادة الكمية النسبية من FAHD1 لكل بروتين كلي.
كمثال ثان ، يتم تقديم استخراج FAHD1 من كبد الفأر ، أي مجموعة من أنسجة الكبد التي تم الحصول عليها من 20 فأرا. بالمقارنة مع استخراج FAHD1 من كلية الخنازير المذكورة أعلاه ، ثبت أن هذا الاستخراج أكثر مملة. وقد ووجهت مشاكل في عدة خطوات من البروتوكول، والتي ستعرض في ما يلي. تم استخراج البروتين الكلي كما هو موضح في الخطوة 2 (الشكل التكميلي 4). نظرا لأن تجانس كبد الفأر يميل إلى أن يكون كيانا لزجا وغروي للغاية ، فقد تم استخدام أوراق الترشيح (على غرار وحدات تصفية القهوة) لتصفية الليزات مسبقا ، والتي تم تخفيفها بنسبة 1: 3 في مخزن التحلل المخزن المؤقت بعد الاستخراج ، لجعل المحلول أشبه بالسائل. وقد عزز هذا التخفيف من إجراءات الترشيح؛ ومع ذلك ، فقد جعل الكشف اللاحق عن البروتين مع لطخة غربية أكثر مملة. بعد الترشيح ، كان لا بد من تركيز الليزات المحضرة قبل الاستخدام الإضافي. تم استخدام عشر الليزات الإجمالية للتجارب التالية.
أظهرت خطوة الاختبار الأولى لهطول الأمطار كبريتات الأمونيوم (الشكل التكميلي 4I) مشكلة محتملة قد تواجهها. كبريتات الأمونيوم بتركيزات أعلى تعطل المواد الهلامية SDS-PAGE وتسبب تأثير ابتسامة عند تشغيلها عند 150 فولت (الشكل التكميلي 5A ؛ النتيجة السلبية). ويعرض نفس تشغيل SDS-PAGE عند 80 فولت نتيجة إيجابية (الشكل التكميلي 5B). في الحالة الأخيرة ، يتشكل تأثير الابتسامة في البداية ولكن يتم حله في النهاية بسبب الجهد المنخفض المطبق. نظرا لأنه كان لا بد من تخفيف المحلول الأولي بشدة حتى يتمكن من ترشيح الليزات ، فإن التحليل الأولي للبقع الغربية لهذه العينات لم يكن ناجحا ، أي أن التحكم الإيجابي تم اكتشافه بواسطة الجسم المضاد ، ولكن ليس البروتين في العينات المطبقة. تم حل هذه المشكلة باستخدام تركيز أعلى لكل من الليزات (المركزة باستخدام وحدات مرشح الطرد المركزي) والجسم المضاد ، وعن طريق تطبيق الجسم المضاد بين عشية وضحاها في الغرفة الباردة أثناء الاهتزاز. في نهاية المطاف ، قدم تحليل اللطخة الغربية كلا من المعلومات التي تفيد بأن البروتين كان موجودا في الليزات ، وأن البروتين كان لا يزال موجودا في supernatant بنسبة 15٪ من كبريتات الأمونيوم (الشكل التكميلي 5C). تجدر الإشارة إلى أن عينات SDS التي تحتوي على كميات أعلى من كبريتات الأمونيوم (>15٪) ترسبت أثناء التسخين وفقد البروتين. ويمكن ملاحظة ذلك أيضا في تلطيخ كوماسي واللطخة الغربية (الشكل التكميلي 5C). لم يلاحظ هذا التأثير على كلية الخنازير ، لذلك قد يكون خاصا بالأنسجة.
بعد هطول الأمطار كبريتات الأمونيوم في 15٪, تم تطبيق 10 مل من lysate على كروماتوغرافيا تبادل كاتيوني في درجة الحموضة 6.8. أظهر تحليل اللطخة الغربية بروتين FAHD1 للفأر ليكون في التدفق (الشكل 5A). يبدو أن جزء البروتين المنبوذ طفيف. ومع ذلك، يعرض هذا المثال تأثيرا ثانويا لكروماتوغرافيا التبادل الأيوني. في هذه الخطوة من البروتوكول ، قد لا يزال المحلول يحتوي على العديد من المركبات التي قد لا تكون بروتينا. كروماتوغرافيا التبادل الأيوني هي طريقة سريعة وسهلة للتخلص من هذه التلوثات. بالنظر إلى أن إجراء كروماتوغرافيا التبادل الأيوني يستغرق بضع ساعات لتنفيذه (بما في ذلك جميع خطوات الغسيل ، تستغرق التجربة نفسها نصف ساعة) ، فإنه يوفر طريقة بسيطة لمسح العينة من الملوثات غير البروتينية.
الشكل 5: تنقية الماوس FAHD1 مع FPLC. تشير الأسهم الحمراء في الكروماتوجرام والبقع إلى وجود FAHD1. (أ) بعد هطول الأمطار بكبريتات الأمونيوم بنسبة 15٪ ، تم طرد العينة مركزيا ، وتصفيتها (0.22 ميكرومتر) ، وتطبيقها على عمود تبادل كاتيوني. يظهر تحليل اللطخة الغربية أن البروتين في التدفق من خلال ويظهر الكروماتوجرام أنه لم تتم إزالة الكثير من البروتينات الأخرى بهذه الخطوة. ومع ذلك ، فإن مقارنة مظهر ولزوجة المدخلات مع التدفق من خلال يظهر أن التدفق الذي تم جمعه أكثر وضوحا (اللوحة اليمنى تقارن بين الإدخال والتدفق من خلال). (ب) خفض التدفق الذي تم جمعه من عمود التبادل الكاتيوني إلى 2 مل عن طريق مرشحات الطرد المركزي وطبق على كروماتوغرافيا استبعاد الحجم عند الرقم الهيدروجيني 7.4. (ج) تم تجميع الكسور التي تحتوي على FAHD1 وتركيزها وتطبيقها على جولة ثانية من كروماتوغرافيا استبعاد الحجم عند الرقم الهيدروجيني 9. (دال) تم تجميع الكسور التي تحتوي على FAHD1 مرة أخرى وتطبيقها على SDS-PAGE مع تلطيخ الفضة ، لمعرفة الملوثات المتبقية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
وطبقت العينة كذلك على كروماتوغرافيا استبعاد الحجم عند الرقم الهيدروجيني 7.4 (الشكل 5 باء). أظهر تحليل اللطخة الغربية كسور تحتوي على بروتين FAHD1 للفأر ، والتي تم تجميعها وتركيزها إلى 2 مل. تم تجميد هذا التركيز 2 مل عند -20 درجة مئوية مع 10 ميكرولتر من β-mercaptoethanol وإذابته في اليوم التالي. تم تشكيل راسب تمت تصفيته عبر وحدات تصفية حقنة (0.22 ميكرومتر). تم أخذ عينات ل SDS-PAGE وتحليل اللطخة الغربية للتأكد من أن بروتين FAHD1 للفأر لا يزال في المحلول.
تم تجميع العينات التي تحتوي على البروتين (من تحليل اللطخة الغربية) ، وتركيزها عبر مرشحات الطرد المركزي ، وتطبيقها على SDS-PAGE مع تلطيخ الفضة لرؤية الملوثات المتبقية (الشكل 5D). كشف هذا أن محلول البروتين ليس نقيا للغاية وأن كميات البروتين التي تم الحصول عليها عبر هذه الطريقة من كبد الفأر لم تكن عالية جدا أيضا (بضعة ميكروغرام في المجموع كما هو محدد باستخدام مجموعة فحص BCA ؛ انظر جدول المواد). كان إنتاج البروتين أعلى بكثير في حالة الخنازير FAHD1 (حوالي 1 ملغ في هذه الخطوة). يبلغ مستوى نقاء بروتين FAHD1 المستخرج من كلية الخنازير حوالي 80٪ (يقدر بعد تلطيخ الفضة ؛ البيانات غير معروضة). يمكن زيادة هذا النقاء عن طريق ، على سبيل المثال ، كروماتوغرافيا التقارب باستخدام جسم مضاد محدد. وستناقش هذه القيود وغيرها من القيود الواردة في هذا البروتوكول بمزيد من التفصيل أدناه.
| اسم المخزن المؤقت / الحل / المواد | تكوين | ||
| Coomassie حل إزالة البقع | 30٪ (v / v) EtOH ؛ 5 ٪ (v / v) HOAc ؛ في DDH2O | ||
| حل تلطيخ Coomassie | 0.05٪ كوماسي بريليانت بلو R-250 ؛ 50 ٪ (v / v) MeOH ؛ 10 ٪ (v / v) HOAc ؛ في DDH2O | ||
| مونو Q عالية الملح العازلة | 20 ملليمتر تريس هيدروكلورايد ؛ 1 م كلوريد الصوديوم. 10 ٪ الجلسرين. في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 9.0 باستخدام NaOH | ||
| مونو Q مخزن مؤقت منخفض الملح | 20 ملليمتر تريس هيدروكلورايد ؛ 15 ملليمتر كلوريد الصوديوم ؛ في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 9.0 باستخدام NaOH | ||
| عازل أحادي S عالي الملح | 44 mM NaH2PO4 ؛ 6 mM Na2HPO4 ؛ 1 م كلوريد الصوديوم. في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 6.8 مع HCl | ||
| عازل أحادي S منخفض الملح | 44 mM NaH2PO4 ؛ 6 mM Na2HPO4 ؛ 15 ملليمتر كلوريد الصوديوم ؛ في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 6.8 مع HCl | ||
| المخزن المؤقت لتحلل البروتين | 1x PBS (250 مل) ؛ 50 ملليمتر NaF ؛ 1mM PMSF. 2 ميكروغرام / مل من الأبروتينين ، 1 ملليمتر من الأورثوفانادات المنشطة ؛ في DDH2O | ||
| الأرنب المضادة المضادة hFAHD1 متعددة النسيلة (تقارب معزول) | حسب الطلب; الأجسام المضادة متعددة النسيلة المضادة ل hFAHD1 المنقاة من مصل الأرانب وتنقيتها باستخدام FPLC وفقا للمرجع 12 | ||
| عنصر التحكم في اللطخة الغربية من بروتين hFAHD1 المؤتلف | بروتين التحكم في اللطخة الغربية المعبر عنه في E.coli وتنقيته باستخدام FPLC وفقا للمرجع 12. | ||
| SDS-PAGE 5x نموذج المخزن المؤقت | 300 ملليمتر تريس هيدروكلورايد ؛ 500 mM DDT ؛ 10٪ (ث / v) SDS ؛ 50 ٪ (v / v) الجلسرين ؛ 0.05 ٪ (ث / v) بروموفينول الأزرق ؛ في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 6.8 مع HCl | ||
| جل حل SDS-PAGE (12.5٪) للصفحة المتقطعة | ddH2O (9.5 مل) ؛ 3 M Tris HCl (2.2 مل) ؛ 5.5 مل من محلول الأكريلاميد / مكرر 40٪ (نسبة 29: 1) ؛ 20٪ SDS (175 ميكرولتر) ؛ TEMED (17 ميكرولتر) ؛ 10 ٪ من كبريتات الأمونيوم (175 ميكرولتر) ؛ يلقي قبل هلام التراص والسماح لها بالبلمرة ؛ يلقي هلام التراص على القمة | ||
| SDS-PAGE تشغيل المخزن المؤقت | 25 ملليمتر تريس حمض الهيدروكلوريك. 190 ملليمتر جليسين. 0.5 ٪ (ث / v) SDS ؛ في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 8.3 مع NaOH | ||
| جل تكديس SDS-PAGE (12.5٪) للصفحة المتقطعة | ddH2O (3.8 مل) ؛ 1 M تريس حمض الهيدروكلوريك (630 ميكرولتر) ؛ 500 ميكرولتر من محلول الأكريلاميد / مكرر 40٪ (حصة 29: 1) ؛ 20٪ SDS (25 ميكرولتر) ؛ TEMED (5 ميكرولتر) ؛ 10 ٪ من بيرسلفات الأمونيوم (50 ميكرولتر) ؛ يلقي بعد أن يتبلمر هلام الحل ؛ تطبيق مشط هلام لإنشاء الآبار | ||
| SEC (G75) تشغيل المخزن المؤقت | 15 ملليمتر تريس هيدروكلورايد ؛ 300 ملليمتر كلوريد الصوديوم ؛ في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 7.4 مع NaOH | ||
| حل تطوير تلطيخ الفضة | 250 mM Na 2 CO3 في ddH2O ؛ أضف 12 ميكرولتر من الفورمالديهايد 37٪ (v / v) إلى 100 مل قبل الاستخدام | ||
| حل تثبيت تلطيخ الفضة | 40٪ (v / v) EtOH ؛ 10٪ (v / v) HOAc ؛ في DDH2O | ||
| حل حضانة تلطيخ الفضة | 30٪ (v / v) EtOH ؛ 500 mM NaOAc ؛ 8 mM Na 2 S2O3 ؛ في ddH2O ؛ اختياري: أضف 600 ميكرولتر من 50٪ (v / v) glutaraldehyde لكل 100 مل قبل الاستخدام | ||
| حل الفضة تلطيخ الفضة | 0.1٪ (ث / v) AgNO3 ؛ في ddH2O ؛ أضف 25 ميكرولتر من الفورمالديهايد 37٪ (v / v) إلى 100 مل قبل الاستخدام | ||
| حل إيقاف تلطيخ الفضة | محلول EDTA 40 mM عند درجة الحموضة 7.6 ؛ نقل 744 ملغ من EDTA إلى 40 مل ddH2O ثم إضافة NaOH لإذابة وضبط درجة الحموضة إلى 7.6. أخيرا ، اضبط الحجم الإجمالي على 50 مل. | ||
| المخزن المؤقت لمنع اللطخة الغربية | PBS مع 0.1 ٪ (v / v) Tween 20 و 5 ٪ (ث / v) مسحوق الحليب الخالي من الدسم ؛ مرشحة | ||
| مخزن مؤقت لنقل اللطخة الغربية (10x) | Tris-HCl 250 mM ؛ الجلايسين 1.92 م ؛ في ddH2O ؛ ضبط الرقم الهيدروجيني إلى 8.3 مع NaOH ؛ يخزن في درجة حرارة الغرفة | ||
| مخزن مؤقت لنقل اللطخة الغربية (1x) | المخزن المؤقت لنقل اللطخة الغربية (10x) 100 مل ؛ 800 مل من ddH2O ؛ 100 مل من MeOH ؛ يخزن على درجة حرارة 4 درجات مئوية | ||
| المخزن المؤقت الغربي لغسيل البقع (PBS-T) | PBS مع 0.1٪ (v / v) Tween 20 | ||
الجدول 1.
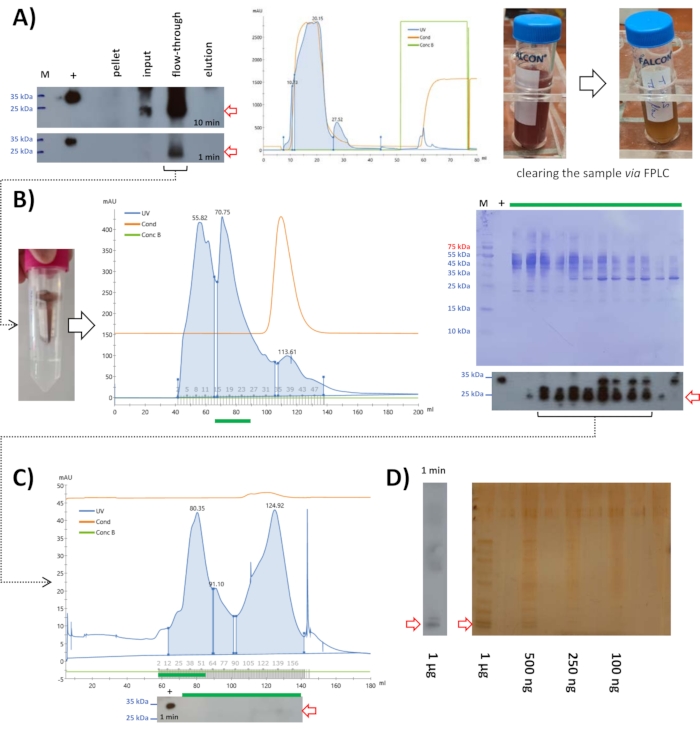
الشكل التكميلي 1: استخراج البروتين الكلي من كلية الخنازير. (أ) قطعت أنسجة الكلى باستخدام مشرط على صفيحة زجاجية معدة بشكل صحيح وضعت على رغوة البوليسترين لمنع الانزلاق ؛ (ب) يتم تحضين أنابيب سعة 50 مل تحتوي على 20 مل من المخزن المؤقت للتحلل البارد مع مثبطات البروتين/الأنزيم البروتيني على الجليد؛ (ج) وضعت قطع أنسجة الكلى في المخزن المؤقت حتى وصل الحجم إلى حوالي 30 مل؛ (د) تم تجانس أنسجة الكلى باستخدام الموجات فوق الصوتية (أي الصوتنة) ؛ (ه) تم طرد المتجانس الخام مركزيا في جهاز طرد مركزي على الطاولة بسرعة متوسطة لمدة 30 دقيقة؛ (و) تمت معالجة عدة عينات في وقت واحد؛ (ز) بعد الطرد المركزي الأول، تم نقل الطرد المركزي إلى أنابيب أجهزة الطرد المركزي (مقارنة ب E)، وتم طرده مركزيا بسرعة عالية (10000 × جم) لمدة 30 دقيقة؛ (ح) تسفر خطوة الطرد المركزي هذه عن حبيبات ومواد فائقة أخرى، تنقل إلى أنابيب سعة 50 مل؛ (I/J) يتم ترشيح التحلل المسبق بالتتابع بواسطة وحدات ترشيح 0.45 ميكرومتر و 0.2 ميكرومتر ، ويتم اقتباسها إلى دفعات 10 مل ، ويتم تجميدها بالنيتروجين السائل لتخزينها لاحقا عند -80 درجة مئوية. يستخدم تحليل اللطخة الغربية للتحقق من وجود البروتين في جميع العينات (الكريات ، supernatants ، الليزات المصفاة). يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: تنقية الخنازير FAHD1 مع FPLC ؛ استراتيجية بديلة. تشير الأسهم الحمراء في الكروماتوجرام والبقع إلى وجود FAHD1. (أ) تنقية الخنازير FAHD1 من الليزات التي تم الحصول عليها عن طريق هطول الأمطار كبريتات الأمونيوم بنسبة 25٪ مع كروماتوغرافيا استبعاد الحجم (FPLC) عند درجة الحموضة 7.4. حدد تحليل اللطخة الغربية الكسور التي تحتوي على الخنازير FAHD1 ، والتي تم تجميعها وتركيزها. (ب) تم تنقية عينات البروتين التي تم تنقيتها سابقا باستخدام كروماتوغرافيا استبعاد الحجم (اللوحة A) عن طريق كروماتوغرافيا التبادل الأنيوني (FPLC). يحدد تحليل اللطخة الغربية الكسور التي تحتوي على الخنازير FAHD1 ، والتي تم تجميعها وتركيزها. يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: نشاط الإنزيم المحدد للخنازير FAHD1. قياس نشاط إنزيم معين كدالة لزيادة مستوى النقاء. يقارن الجدول نشاط الإنزيم النسبي (نانومول / دقيقة) مع نشاط إنزيم محدد (ميكرومول / دقيقة / ملغ). يظهر الفحص نشاطا متزايدا باستمرار للخنازير FAHD1 بعد كل خطوة تنقية. مقارنة بالمؤتلف His/S-human FAHD1 (الأخضر) الذي تم الحصول عليه من الإشريكية القولونية. 12 ، أظهر الخنازير FAHD1 نشاطا أعلى قليلا (أحمر) (n = 3). يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 4: إجمالي استخراج البروتين من كبد الفأر. (أ، ب، ج) تم تحضير أنسجة الكبد المجمدة من 20 فأرا ومخزن التحلل العازل على الجليد في أنابيب 50 مل. (D,E,F) تم تجانس أنسجة الكبد باستخدام الموجات فوق الصوتية (أي الصوتنة)؛ تم طرد المتجانس الخام في جهاز طرد مركزي على الطاولة بسرعة متوسطة لمدة 30 دقيقة ؛ تم نقل السوبرنات إلى أنابيب أجهزة الطرد المركزي ، وتم طرده بسرعة عالية (10000 × جم) لمدة 30 دقيقة ؛ (G,H,I) يتم ترشيح التحلل المسبق بالتتابع بواسطة مرشحات ورقية ، ووحدات ترشيح 0.45 ميكرومتر و 0.2 ميكرومتر ، ويتم اقتباسها إلى دفعات 10 مل ، ويتم تجميدها بالنيتروجين السائل لتخزينها لاحقا عند -80 درجة مئوية ؛ (ي) أضيفت كبريتات الأمونيوم إلى الليزات بتركيزات مختلفة (5٪ إلى 30٪ كحد أقصى) لترسيب البروتين من المحلول. (K) الكريات التي تم الحصول عليها بعد هطول الأمطار كبريتات الأمونيوم (اللوحة J) أعيد تعليقها في H2O لأخذ عينات ل SDS-PAGE وتحليل اللطخة الغربية. يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 5: هطول الأمطار كبريتات الأمونيوم وفحص اللطخة الغربية للفأر FAHD1. تشير الأسهم الحمراء في البقع إلى وجود FAHD1. (أ) SDS-PAGE مع العينات التي تم الحصول عليها بعد هطول الأمطار كبريتات الأمونيوم في 125 V. أظهر هذا الجل تأثير ابتسامة جذري ، ولا يمكن تقييم مثل هذا الجل. هذا مثال على نتيجة سلبية. (ب) تم تشغيل SDS-PAGE مع نفس العينات (اللوحة A) عند 80 فولت حتى اكتماله. لا يوجد تأثير ابتسامة في هذا الجل ، وهذا مثال على نتيجة إيجابية. (C) SDS PAGE وتحليل اللطخة الغربية للعينات التي تم الحصول عليها بعد هطول الأمطار كبريتات الأمونيوم. العينات بتركيزات أعلى من كبريتات الأمونيوم قد تترسب داخل المخزن المؤقت للعينة, كما هو مبين. يتم فقدانها ولا يمكن اكتشافها بعد الآن ، إما عن طريق تلطيخ Coomassie (يسار) أو تحليل البقع الغربية (يمين). تم تحديد أفضل تركيز لكبريتات الأمونيوم ، في هذه الحالة ، ليكون 15٪. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
الخطوات الحاسمة في البروتوكول
يعد اتباع الإرشادات الشائعة للتعامل مع البروتينات أمرا ضروريا ، مثل العمل على الجليد وفي ظروف معتدلة من الأس الهيدروجيني والملح. استخدام مثبطات الأنزيم البروتيني مفيد لهذه الطريقة ، في حين يوصى بشدة باستخدام مثبطات البروتيازوم. قد يؤدي تجميد العينة وإذابتها دائما إلى هطول الأمطار البروتينية (جزئيا على الأقل) ، لذلك يجب معالجة أي أليكوت مذاب من محللات البروتين الأولية (الخطوة 2) بشكل مستمر دون انقطاع. يوصى عموما بالطرد المركزي والترشيح بعد الذوبان لإزالة هطول الأمطار الدقيقة.
لا يزال البروتين الأولي الذي تم الحصول عليه من الأنسجة يحتوي على العديد من المواد إلى جانب البروتينات. يمكن استخدام أعمدة كروماتوغرافيا التبادل الأيوني لمسح الليزات. حتى لو كان البروتين الذي يريد المرء استخراجه لا يرتبط بعمود التبادل الأيوني ، فقد يكون التدفق أكثر وضوحا من محلول الإدخال ، وأسهل في المعالجة في الخطوات اللاحقة. يظهر هذا لاستخراج FAHD1 من كلى الفئران (انظر الشكل 5A).
القيود والتعديلات على الطريقة
يصف هذا البروتوكول بروتوكولا لاستخراج FAHD1 من الأنسجة. بناء على هذه الاستراتيجية ، يمكن اشتقاق نهج عام لاستخراج بروتينات FAHD (FAHD1 ، FAHD2) من الأنسجة الأخرى ، في حين قد تكون هناك حاجة إلى تكيفات محددة للحالات الفردية. القيد الضمني لهذه الطريقة هو مستويات التعبير النسبية ل FAHD1 (أو بروتينات FAHD) في نسيج معين وتوافر هذا النسيج بكميات كافية. يتطلب المخطط العام الموصوف في هذا البروتوكول تعبيرا عاليا عن البروتين في كمية مناسبة من الأنسجة للبدء بها. تم تقديم أمثلة لاستخراج FAHD1 من كبد الخنازير والفئران ، وهما عضوان يظهران مستويات تعبير عالية من البروتين. في كل خطوة موصوفة في هذا البروتوكول ، هناك فقدان ضمني للعينة ، أي أن الكمية الأولية المنخفضة من البروتين تقل أكثر. في نهاية المطاف ، يمكن تحقيق كميات منخفضة فقط من البروتين باستخدام هذا البروتوكول. نظرا لأن كلية الخنازير هي عضو كبير ، يمكن استخراج حوالي غرام من البروتين (حوالي 80٪ من النقاء ؛ تقديري) من خلال هذا النهج من كليتين. يتطلب تطبيق نفس البروتوكول لاستخراج FAHD1 من كبد الفئران جمع عينات الكبد من 20 فأرا ، للحصول على بضعة ميكروغرام فقط من البروتين في النهاية. قد يكون الحصول على نقاء أعلى للبروتين باستخدام الطرق الموضحة أمرا مملا ، ويكشف تلطيخ الفضة أنه بعد استبعاد الحجم قد لا يزال هناك العديد من البروتينات الأخرى في المحلول. يمكن للمرء زيادة هذا البروتوكول عبر كروماتوغرافيا التقارب (أعمدة NHS المنشطة) ، باستخدام جسم مضاد أحادي النسيلة (على سبيل المثال ، CAB025530).
تتطلب جميع البروتوكولات المدرجة هنا أن يكون البروتين الذي يريد المرء استخراجه قابلا للذوبان. الظروف المثلى لهطول الأمطار كبريتات الأمونيوم وتعديلات الرقم الهيدروجيني / الملح للكروماتوغرافيا تحتاج إلى اختبار وتعريف. في حالة عدم توفير كروماتوغرافيا التبادل الأيوني أي نتائج تنقية جيدة ، قد يكون غسيل الكلى مقابل مخزن كروماتوغرافي مؤقت قبل إجراء FPLC خيارا لتحسين قابلية ذوبان البروتين ودقة الكروماتوغرافيا. ومع ذلك ، لا ينصح بتحليل الليزات الخام ، لأن هذا قد يؤدي إلى هطول كميات هائلة وغير منضبطة من البروتين داخل أنبوب غسيل الكلى. قد تحدث مشاكل إذا كان البروتين يميل إلى أن يكون مسعورا ، وقد لا تكون البروتوكولات قابلة للتطبيق إذا كان البروتين مسعورا للغاية (على سبيل المثال ، بروتينات الغشاء). إذا كانت بروتينات FAHD غير قابلة للذوبان جزئيا كما هو موجود في FAHD2 (البيانات غير معروضة) في محللات أنسجة معينة ، فقد يتم استكشاف أنواع أخرى من الكروماتوغرافيا ، على سبيل المثال ، كروماتوغرافيا التفاعل الكارهة للماء (HIC) وكذلك12.
وقد عرض تعديلان للبروتوكول القياسي في قسم النتائج. لتنقية FAHD1 من كلية الخنازير ، تم استخدام كروماتوغرافيا استبعاد الحجم قبل كروماتوغرافيا التبادل الأيوني (انظر الشكل التكميلي 2). تتمثل إحدى مشكلات هذه الطريقة في أن كروماتوغرافيا استبعاد الحجم تتميز بمسارات تشغيل أكبر ، ويزداد حجم العينة بقوة أثناء التشغيل. يجب ألا يتجاوز حجم العينة 2٪ من حجم السرير لتحقيق دقة عالية23 ، ويعتمد عامل التخفيف النهائي أيضا على حجم الاستخلاص الذي تم جمعه. في المثال المقدم باستخدام عمود 120 مل ، يوصى بحجم أولي قدره 2 مل. يمكن جمع العينة الأولية من عدة مل من الليزات بعد هطول الأمطار بكبريتات الأمونيوم ، عن طريق التركيز باستخدام وحدات مرشح الطرد المركزي ، دون تجميع أو قطع أثرية لهطول الأمطار. يتم تقديم مثال لتنقية FAHD1 من كلية الخنازير كنتيجة تمثيلية (انظر أيضا الشكل التكميلي 2). ومع ذلك، فإن الاقتصار على أحجام العينات الصغيرة فقط قد يجعل هذا النهج غير عملي.
تطبيقات أو اتجاهات الطريقة
يعد التعبير عن البروتينات المؤتلفة وتنقيتها من البكتيريا طريقة مباشرة وراسخة ، للحصول على كميات مجدية (بالجرام) من البروتين24,25. وقد تم تقديم هذا ل FAHD112. ومع ذلك ، هناك العديد من العيوب المحتملة في استخدام هذه الطرق ، مثل النمو الضعيف المحتمل للمضيف ، وتكوين جسم التضمين ، وفقدان أو تغيير نشاط البروتين ، وبالتالي ، إمكانية عدم الحصول على أي بروتين على الإطلاق ، أو يؤدي إلى شكل منحاز من البروتين (سوء الطي ، والتعديلات السيئة بعد الترجمة ، وما إلى ذلك). وبالتالي ، فإن تطوير طرق يمكنها استخراج البروتين المطوي جيدا والمعدل بشكل صحيح من الأنسجة مباشرة أمر جذاب. ومع ذلك ، فإن المشكلة الرئيسية هي أن معظم البروتينات لا يتم التعبير عنها بمستويات كبيرة ، وبالمقارنة مع الحث الضمني والاستخراج اللاحق للبروتين من البكتيريا ، فإن كمية البروتين التي سيتم الحصول عليها عادة ما تكون أقل بعدة مراتب. هناك مفاضلة بين الاستخراج غير المكلف والسهل للبروتين المؤتلف من البكتيريا والاستخراج الأكثر تكلفة والممل للبروتين من الأنسجة. التقدم الرئيسي مع هذا الأخير هو أنه يمكن للمرء أن يستخرج البروتين في شكله الفسيولوجي الموجود في الأنسجة ، بما في ذلك جميع التأثيرات المتبادلة التي قد تؤثر على نشاطه القابل للطي و / أو الحفاز.
سيساعد البروتين المستخرج والمنقى بواسطة هذا البروتوكول على تحديد المثبطات المختصة ل FAHD113 ، وشركاء تفاعل البروتين المحتملين 9 ، والأدوار المحتملة غير المكتشفة للبروتين9. يتم دعم دراسة المثبطات الأنزيمية ، وتطوير الأجسام المضادة وحيدة النسيلة ، ودراسة بنية البروتين في المقام الأول بشكل كبير عند وجود بروتين عالي النقاء مستخرج من الأنسجة بدلا من استخراجه من البكتيريا.
Disclosures
ليس لدى المؤلفين مصالح مالية متنافسة.
Acknowledgements
والمؤلفان ممتنان جدا للمساعدة التقنية التي قدمتها آيسي أوزتورك وإيفا ألبرتيني. تم الحفاظ على الفئران المستخدمة لتوليد أنسجة الكبد تحت إشراف Uniiv.-Doz. الدكتور بيدر يانسن دور (معهد أبحاث الشيخوخة الطبية الحيوية في جامعة إنسبروك ، Rennweg 10 ، 6020 Innsbruck ، النمسا).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | - | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | - | - | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | - | - | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
References
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 - a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily - A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved