Method Article
فحص الأجسام المضادة الحرة لتحليل نشاط الحمض النووي الريبي ميثيل ترانسفيراز
In This Article
Summary
هنا، يتم وصف فحص الأجسام المضادة الخالية في المختبر للتحليل المباشر لنشاط ميثيل ترانسفيراز على الحمض النووي الريبي الاصطناعية أو في المختبر.
Abstract
هناك أكثر من 100 تعديلات متميزة كيميائيا من الحمض النووي الريبي، ثلثيها تتكون من ميثيلات. وقد ظهر الاهتمام بتعديلات الحمض النووي الريبي، وخاصة المثيلية، مرة أخرى بسبب الأدوار الهامة التي تقوم بها الإنزيمات التي تكتب وتمحوها في العمليات البيولوجية ذات الصلة بالمرض والسرطان. هنا، يتم توفير تحليل حساس في المختبر لتحليل دقيق لنشاط كاتب مثيلالحمض النووي الريبي على RNAs الاصطناعية أو في المختبر المنقولة. يستخدم هذا الاختبار شكل ثلاثي الجوانب من S-adenosyl-methionine، مما يؤدي إلى وضع العلامات المباشرة على الحمض النووي الريبي الميثيلي مع التريتيوم. الطاقة المنخفضة من إشعاع التريتيوم يجعل الأسلوب آمن، والأساليب الموجودة من قبل من تضخيم إشارة التريتيوم، تجعل من الممكن لتحديد وتصور الحمض النووي الريبي الميثيلي دون استخدام الأجسام المضادة، والتي هي عادة عرضة للقطع الأثرية. في حين أن هذه الطريقة مكتوبة لمثيلة الحمض النووي الريبي، عدد قليل من القرص جعله ينطبق على دراسة التعديلات الحمض النووي الريبي الأخرى التي يمكن وصفها إشعاعيا، مثل أسيتيل الحمض النووي الريبي مع 14C أسيتيل الإنزيم A. عموما، وهذا الفحص يسمح لتقييم بسرعة RNA شروط المثيلة، تثبيط مع مثبطات جزيء صغير، أو تأثير RNA أو متحولة الإنزيم، ويوفر أداة قوية للتحقق من صحة وتوسيع النتائج التي تم الحصول عليها في الخلايا.
Introduction
الحمض النووي، الحمض النووي الريبي والبروتينات تخضع للتعديلات التي تنظم بإحكام التعبير الجيني1. ومن بين هذه التعديلات، تحدث المثيلة على جميع البوليمرات الحيوية الثلاثة. وقد تم دراسة الحمض النووي والبروتين الميثيل بشكل جيد جدا خلال العقود الثلاثة الماضية. وعلى النقيض من ذلك، لم يتجدد الاهتمام بمثيلة الحمض النووي الريبي إلا مؤخراً في ضوءالأدوار الهامة التي تلعبها البروتينات التي تكتب أو تمحو أو تربط المثيلة في التنمية والمرض 2. بالإضافة إلى وظائف معروفة في ribosomal وفيرة ونقل RNAs، مسارات مثيلة RNA تنظيم محددة رسول RNA الاستقرار3،4، الربط5 والترجمة6،7، ميرنامعالجة 8،9 والتوقف النسخي والإفراج 10،11.
هنا، يتم الإبلاغ عن طريقة بسيطة وقوية للتحقق في المختبر من نشاط الحمض النووي الريبي ميثيل ترانسفيراز في إعداد مختبر البيولوجيا الجزيئية (ملخصة في الشكل1). كثير دراسات يقيّم النشاط من [رنا] [مثلترانسفيرس] كلّيّا [دوت-بلووت] مع جسم مضادّ ضدّ ال [رنا] تعديل الفائدة. ومع ذلك، لا تحقق نقطة وصمة عار من سلامة الحمض النووي الريبي عند الحضانة مع الحمض النووي الريبي methyltransferase. وهذا أمر مهم لأنه حتى التلوث الطفيف للبروتينات المؤتلفة مع النوكلورات يمكن أن يؤدي إلى تدهور جزئي للRNA ونتائج مربكة. وعلاوة على ذلك، حتى الأجسام المضادة تعديل RNA محددة للغاية يمكن التعرف على RNAs غير معدلة مع تسلسلات محددة أو هياكل. في المختبر الحمض النووي الريبي ميثيل ترانسفيراز الفحص ذكرت هنا يستفيد من حقيقة أن الميثيونين S-adenosyl يمكن أن تكون tritiated على المانحة مجموعة الميثيل (الشكل1)،مما يسمح لRNA ميثيلات إلى الكشف بدقة دون استخدام الأجسام المضادة . يتم توفير التعليمات للنسخ في المختبر وتنقية نسخة من الاهتمام واختبار مثيلة من النص المذكور من قبل إنزيم الفائدة. هذه الطريقة مرنة وقوية، ويمكن تعديلها وفقا لاحتياجات أي مشروع معين. على سبيل المثال، في المختبر منقولة ونقية RNAs، توليفها كيميائيا RNAs، ولكن أيضا RNAs الخلوية يمكن استخدامها. يوفر هذا التحليل معلومات كمية في شكل حساب التلألؤ، فضلا عن المعلومات النوعية من خلال إظهار المكان الذي يعمل فيه الحمض النووي الريبي المثيلي على هلام. وهذا يمكن أن يوفر رؤية فريدة من نوعها في وظيفة ميثيل ترانسفيراز RNA، لا سيما عند استخدام RNAs الخلوية كالركيزة، كما أنه يوفر طريقة لمراقبة مباشرة حجم RNA أو RNAs التي تستهدف الميثيل.
Protocol
1. في المختبر النسخ وتنقية هلام من RNA الهدف
- استنساخ تسلسل الاهتمام في بلازميدات تحتوي على T7 و /أو SP6 المروجين باستخدام تقنيات الاستنساخ الجزيئي المعمول بها12 أو مجموعات.
- خطية قالب الحمض النووي للنسخ في المختبر
- تضخيم تسلسل الاهتمام من قبل PCR من بلازميد مع التمهيديات المصممة لتشمل منطقة المروج T7 من خلال إدراج، +20-30 bp المنبع والمصب كما سبق وصفه13.
- بدلا ً من ذلك، هضم 5 ميكروغرام من بلازميد باستخدام أنزيم تقييدي (RE) قطع الموقع متاح المصب إدراج وفقا للتعليمات المقدمة من المورد من RE.
ملاحظة: تذكر للتحقق المزدوج من عدم قطع الإدراج بواسطة RE المحدد. اختيار RE المستخدمة في هذه الخطوة يمكن أن تؤثر بشكل كبير على العائد من النص. بشكل تفضيلي، خطي مع نهاية حادة أو 5 '-المتدلية إنتاج RE لتجنب تبديل قالب من بوليميراز T7 RNA على حبلا الحمض النووي المعاكس14. حاول إعادة التجدد المختلفة إذا كانت العوائد الأولية غير كافية.
- تنقية الحمض النووي الناتج باستخدام مجموعة لاستخراج هلام أغاروز الحمض النووي وتنظيف. اولوت الحمض النووي مع 30 ميكرولتر من الماء.
- مزيج جيدا عن طريق الدوامة، pipet 1.5 € L وقياس تركيز الحمض النووي مع مطياف الحجم الدقيق.
- استخدام 250 نانوغرام من الحمض النووي للتحقق من جودة وحجم الحمض النووي النقي على 1٪ الأوروز جل الكهربائي في 1X TBE العازلة هاجر لمدة 1 ساعة في 4 V / سم.
- إذابة الكواشف المجمدة من عدة النسخ في المختبر. ضع مزيج بوليميراز T7 RNA على الجليد، والكواشف الأخرى على مُقمّن في درجة حرارة الغرفة. مباشرة بعد ذوبان كامل، تدور سريعة أنابيب rNTP لمدة 5 ق لجمع الحل في الجزء السفلي من الأنابيب ووضعها على الجليد. الحفاظ على 10X رد الفعل العازلة في درجة حرارة الغرفة لتجنب هطول الأمطار.
- الأنابيب في أنبوب 1.5 مل المكونات التالية من رد فعل النسخ 20 ميكرولتر في درجة حرارة الغرفة في الترتيب المشار إليه: 6 ميكرولتر من الماء، 2 ميكرولتر (0.1 - 1 ميكروغرام) من قالب الحمض النووي الخطي، 2 ميكرولتر من 75 مل حل ATP، 2 ميكرولتر من 75 مل GTP الحل ، 2 ميكرولتر من 75 مل CTP الحل، 2 ميكرولتر من 75 مل UTP الحل، 2 ميكرولتر من 10X رد الفعل العازلة و 2 ميكرولتر من T7 RNA بوليميراز ميكس.
ملاحظة: بالنسبة لقالب الحمض النووي الذي ينشئه PCR، استخدم 100-200 نانوغرام من الحمض النووي؛ لقالب الحمض النووي التي تم إنشاؤها بواسطة تقييد هضم الإنزيم منبلازميد، واستخدام ~ 1 ميكروغرام. - خلط الأنبوب جيدا. تدور سريعة لمدة 5 ثوان لجمع حل رد الفعل في الجزء السفلي من الأنبوب، ثم حضانة في 37 درجة مئوية لمدة 2-4 ساعة.
ملاحظة: كل نسخة سوف يتصرف بشكل مختلف اعتمادا على قالب الحمض النووي، طوله، تسلسله أو هيكلها. تحسين ظروف النسخ في المختبر عن طريق اختبار أوقات حضانة مختلفة تصل إلى 6 ساعة. تركيزات مختلفة من قالب الحمض النووي، T7 RNA بولميراز، أو NTP؛ أو إضافة مكل إضافية2 إلى ما هو موجود في T7 RNA Polymerase ميكس. - في نهاية فترة الحضانة، أضف 1 ميكرولتر من DNase I لكل 20 درجة مئوية من رد الفعل والحضانة عند 37 درجة مئوية لمدة 15 دقيقة.
ملاحظة: يمكن الاحتفاظ برد فعل النسخ مؤقتا على الجليد حتى هلام polyacrylamide جاهزة. - المضي قدما في تنقية من قبل هلام بولياكريلاميد.
ملاحظة: بما أن الحمض النووي الريبي حساس للتلوث بدرجة الحموضة وRNase، استخدم المعدات المخصصة لRNA والكواشف الخالية من RNase. - تحديد النسبة المئوية للبوليأكريلاميد للهلام اعتمادا على حجم نسخة من الفائدة: 3.5٪ ل100-2000 nt (XC: 460 nt ; BB: 100 nt)، 5٪ ل80-500 nt (XC: 260 nt ؛ BB: 65 nt), 8% ل 60-400 nt (XC: 160 nt ; BB: 45 nt), 12% ل40-200 nt (XC: 70 nt; BB: 20 nt), 15% ل 25-150 nt (XC: 60 nt ; BB: 15 nt)، و 20٪ ل6-100 nt (XC: 45 nt ; BB: 12 nt).
- إعداد هلام بولياكريلاميد denaturing اليوريا عن طريق الجمع بين الكواشف التالية في أنبوب مخروطي 50 مل: 9.6 غرام من اليوريا الصف الجزيئي، 2 مل من 10X TBE، س مل من 40٪ أكريلاميد: بيس أكريلاميد مزيج (29:1) والماء تصل إلى علامة 20 مل على الأنبوب ، حيث x = 20 مل / (40٪ / هلام٪ ٪ ٪
تحذير: غالباً ما تحتوي المواد الهلامية البولي أكريلاميد على أكريلاميد غير بوليمرة وهو مادة سامة يمكن أن تنتج خطراً عند إدخالها إلى البيئة. التخلص من المواد الهلامية البولي أكريلاميد من خلال برنامج المؤسسة للنفايات الكيميائية. - ميكروويف لمدة 15 s في 30٪ من الطاقة. توضع على النوتاتور لمدة 10 دقائق في درجة حرارة الغرفة أو حتى يذوب اليوريا تماما.
- في حين أن خليط هلام هو الدورية، واسترداد كاسيت هلام (18 جيدا، 1 ملم سميكة؛ 13.3 × 8.7 سم (W × L))، وإزالة المشط ووضع كاسيت لالصب هلام.
- تدور سريعة أنبوب 50 مل لمدة 5 s لجمع هلام الحل في الجزء السفلي من الأنبوب. إضافة 125 ميكرولتر من 10٪ محلول بيرسولات الأمونيوم (APS). ضعيها على النوتاتور لمدة 1 دقيقة تقريبًا.
- إضافة 25 ميكرولتر من رباعي ميثيل الإيثيلينdiamine (TEMED) ومزيج بعناية عن طريق الأنابيب صعودا وهبوطا 5 مرات مع ماصة 25 مل تجنب فقاعات.
- ماصة في الجل يلقي وبعناية إدراج مشط هلام تجنب فقاعات.
- تشديد الختم عن طريق إضافة مقطع الموثق كبيرة على الجزء العلوي من كاسيت.
- السماح للجل للبلمرة لمدة 1 ساعة.
- بمجرد أن يتعزز الجل، قم بإزالة مشبك الموثق. أدخل الكاسيت في المربع الكهربائي. إضافة 1X TBE العازلة في خزانات أعلى وأسفل.
- استرداد رد فعل النسخ. إضافة الماء تصل إلى 100 درجة مئوية، ثم إضافة 100 درجة مئوية من 2X هلام تحميل المخزن المؤقت. إعداد سلم عن طريق خلط الكمية الموصى بها مع الماء إلى 10 درجة مئوية و 10 ميكرولتر من 2X هلام تحميل العازلة إلى أنبوب منفصل 1.5 مل.
- احتضان كل من السلم ورد فعل النسخ في المختبر في خلاط حراري في 70 درجة مئوية لمدة 15 دقيقة.
- في حين أن العينات هي denaturing في 70 درجة مئوية، وإزالة بعناية المشط، وتنظيف الآبار عن طريق الأنابيب صعودا وهبوطا كل بئر مع ماصة P1000، وعلى الفور قبل تشغيل لمدة 10 دقيقة في 100 V.
- بمجرد الانتهاء من العينات denaturation 15 دقيقة في 70 درجة مئوية، وإزالة الأنابيب من خلاط حراري ووضع على الفور على الجليد.
- تنظيف كل بئر من هلام مرة أخرى مع ماصة P1000. تحميل 20 درجة مئوية من سلم على البئر الأول إلى اليسار، 20 درجة مئوية من عينة RNA على 10 آبار منفصلة، و 20 ميكرولتر من 1X هلام تحميل العازلة على الآبار غير المستخدمة.
- تشغيل هلام في 100 V لمدة 60-240 دقيقة، اعتمادا على البولي أكريلاميد٪ من هلام.
ملاحظة: سيتم فصل الأصباغ في مخزن تحميل الجل إلى شريطين أثناء اجتيازها للجل، وشريط أزرق بطيء يهاجر بروموفينول (BB)، وشريط سماوي سريع للزلين سيانول (XC). الهجرة تقريبيّة من هذا نطاق في مختلفة% [بولكريلميد] هلام معروفة (رأيت خطوة 1.11) ويستطيع كنت استعملت أن يقدّم الهجرة ال [رنا] في الهلام. - بمجرد إيقاف الجل، قم بإزالة الجل بعناية من الكاسيت.
- ضع الجل في صندوق نظيف يحتوي على حل من 50 مل من 1X TBE العازلة مع 50 درجة مئوية من وصمة عار هلام الحمض النووي وحضانة لمدة 5 دقائق على الروك لوصمة عار الحمض النووي الريبي.
- التقاط صورة الختان قبل وبعد الفرقة من هلام على نظام التصوير هلام، ويفضل استخدام الضوء الأزرق بدلا من الأشعة فوق البنفسجية عبر الإضاءة.
- قم باستئصال كل نطاق من الاهتمامات باستخدام طرف قطع جل خالي من النوكل. بعد كل بئر، نقل غيض التي تحتوي على شريحة هلام إلى أنبوب 1.5 مل وتدور لفترة وجيزة لجمع شريحة هلام. كرر حتى يتم جمع جميع العصابات في نفس أنبوب 1.5 مل.
- بمجرد جمع جميع شرائح الجل، أضف 100 لتر من المياه الخالية من النوكليس أو إلى أنبوب 1.5 مل. يُحفظ عند 4 درجات مئوية لمدة 48 ساعة تقريبًا. وهذا يسمح للRNA للخروج من شرائح هلام في الحل.
- بعد 48 ساعة، pipet الماء أو TE العازلة إلى أنبوب 1.5 مل جديدة. تخلص من شرائح الجل المتبقية. تنقية الحمض النووي الريبي عن طريق مجموعة تنظيف على النحو التالي.
- معادلة العمود تدور في درجة حرارة الغرفة لمدة 30 دقيقة على الأقل.
- إلى 100 درجة مئوية من محلول RNA في أنبوب 1.5 مل جديد من الخطوة 1.32، إضافة 350 درجة مئوية من المخزن المؤقت RLT ومزيج جيدا لمدة 2 دقيقة على nutator. تدور ل1 s في 200 × ز لجمع الحل في الجزء السفلي من الأنبوب.
- إضافة 675 درجة مئوية من EtOH 100٪ وتخلط جيدا لمدة 2 دقيقة على nutator. تدور ل1 s في 200 × ز والمضي قدما على الفور إلى الخطوة التالية.
- نقل 565 درجة مئوية من الخليط على عمود تدور وتدور لمدة دقيقة واحدة في 15،000 × ز. إفراغ أنبوب جمع عن طريق الطموح.
- كرر الخطوة السابقة مع النصف الثاني من العينة.
- إضافة 500 درجة مئوية من المخزن المؤقت RPE إلى العمود وتدور لمدة دقيقة واحدة في 15،000 × ز. إفراغ أنبوب جمع عن طريق الطموح.
- إضافة 750 درجة مئوية من الإيثانول 80٪ إلى العمود وتدور لمدة دقيقة واحدة في 15،000 × ز. إفراغ أنبوب جمع عن طريق الطموح.
- ضع العمود في أنبوب جمع جديد بـ 2 مل مع فتح الغطاء وتدور عند 15000 × ز لمدة 5 دقائق.
- نقل العمود إلى أنبوب جديد 1.5 مل.
- إضافة 17 درجة مئوية من الماء على وسط العمود وتدور في 15،000 × ز لمدة دقيقة واحدة إلى elute. Elute مرة أخرى باستخدام آخر 17 ميكرولتر من الماء. يجب أن يكون إجمالي حجم المستردة 32 درجة مئوية.
- مزيج جيدا عن طريق الدوامة، pipet 1.5 € L وقياس تركيز الحمض النووي الريبي باستخدام مقياس الطيف ية الحجم الدقيق.
- تحقق من جودة تنقية الحمض النووي الريبي عن طريق اليوريا denaturing هلام بولياكريلاميد كما هو الحال في الخطوات 1.11-1.29.
2. في المختبر الحمض النووي الريبي ميثيل ترانسفيراز الاختبار
- إعداد 100 ميكرولتر من الحمض النووي الريبي ميثيل ترانسفيراز في أنبوب 1.5 مل على الجليد على النحو التالي: 23 ميكرولتر من الماء، 10 ميكرولتر من 10X TBS (500 mM Tris-HCl، درجة الحموضة 7.5؛ 1.5 M كلوريد اللون)، 2 ميكرولتر من 0.05 M EDTA، 5 ميكرولتر من 100 MM DTT ، 40 ميكرولتر من 50٪ الجلسرين، 4 ميكرولتر من 58 ميكرومتر 3H-SAM، 5 ميكرولتر من 20X كوكتيل مثبط البروتياز، 1 ميكرولتر من RNaseOUT (اختياري)، 5 ميكرولتر من الحمض النووي الريبي و 5 ميكرولتر من ميثيل ترانسفيراز.
تحذير: المواد المشعة ثلاثية التطفل خطرة وينبغي التعامل معها فقط أثناء ارتداء القفازات، ومعطف المختبر وأي معدات الوقاية الشخصية الضرورية الأخرى. وتعتبر جميع نصائح الماصات والأنابيب التي تلامس المواد المشعة نفايات مشعة صلبة. التخلص من جميع النفايات المشعة الصلبة والسائلة وفقا لبروتوكول النفايات المشعة المعتمد ة في المختبر.
ملاحظة: تضمين عينات التحكم دون methyltransferase وبدون الحمض النووي الريبي. قد تتطلب تركيزات الكاشف تحسين و/أو إدراج أملاح الموجبة ثنائية التكافؤ، مثل MgCl2، أو SAM غير المسمى. والنطاق الأمثل لتركيز الحمض النووي الريبي النهائي هو من 50 نم إلى 1 ميكرومتر، في حين أن تركيز ميثيل ترانسفيراز يتراوح بين 25 نم و300 نم. - يُمزج المزيج جيداً عن طريق التفواث برفق على الأنبوب. تدور 5 s في 200 × ز لجمع الحل في الجزء السفلي من الأنبوب. احتضان الأنبوب (ق) في 37 درجة مئوية لمدة 2 ساعة.
- تنظيف رد الفعل باستخدام تنقية العمود كما هو الحال في الخطوة 1.32.
تحذير: كن حذراً جداً للتخلص بشكل صحيح من أي مواد مشعة، لا سيما أثناء غسيل العمود (ماصة من النفايات بدلاً من تَقَوِل النفايات من أنابيب التجميع). - إجراء عدد من التلألؤ السائل
- إعداد رف عدد التلألؤ مع قارورة واحدة لكل عينة، قارورة واحدة لقياس الخلفية وقارورة واحدة لاختبار انتقاد. ملء قارورة مع 5 مل من حل العد التلألؤي.
- إضافة 10 درجة مئوية من كل عينة RNA المشعة في 1 قارورة، وتشديد الغطاء ومزيج بلطف.
- إعداد قارورة اختبار انتقاد. فرك مسحات القطن بدقة على جميع الأسطح والمعدات المستخدمة خلال البروتوكول. إضافة مسحات إلى قارورة مليئة 5 مل من محلول التلألؤ وتشديد الغطاء.
- تشغيل العينات على عداد التلألؤ على النحو التالي. فتح غطاء محرك السيارة العداد، وإدراج الرف في الجهاز وإغلاق غطاء محرك السيارة. حدد عدد حامل واحد . حدد تحديد برنامج المستخدم . حدد أو قم بإنشاء برنامج يقيسالتريتيوم (3 H) لمدة 60 s. Hit Count Rack. كرر عدد التلألؤ ثلاث مرات.
ملاحظة: ستقوم المعدات بقياس عدد اللمعة لكل عينة وإخراج لكل من الشاشة والنسخة المطبوعة. يمكن إيقاف البروتوكول مؤقتاً هنا إذا رغبت في ذلك. يجب تجميد عينات الحمض النووي الريبي المتبقية من الخطوة 2.3 عند -80 درجة مئوية للاستخدام في وقت لاحق.
- المضي قدما في التصوير التلقائي
- إعداد والتشغيل المسبق اليوريا denaturing هلام بولياكريلاميد كما هو الحال في الخطوات 1.11-1.20.
- ماصة 20 ميكرولتر من مادة الحمض النووي الريبي المشعة في أنبوب جديد 1.5 مل يحتوي على 20 ميكرولتر من 2X جل تحميل العازلة. اخلطي جيداً. إعداد السلم كما هو الحال في الخطوة 1.21. حضانة العينات في 70 درجة مئوية لمدة 15 دقيقة.
- غسل آبار هلام مرة أخرى على الفور قبل تحميل العينة. تحميل 20 درجة مئوية من سلم أعدت، 20 ميكرولتر من العينات، و 20 ميكرولتر من 1X هلام تحميل العازلة على الممرات المتبقية. تشغيل هلام في 100 V لمدة 60-180 دقيقة، اعتمادا على نسبة بوليأكريلاميد.
- بمجرد انتهاء الجل من التشغيل، قم بإزالة الجل من الكاسيت وضعه في صندوق يحتوي على 50 مل من 1x TBE العازلة مع 5 ميكرولتر من وصمة عار هلام الحمض النووي فائقة الحساسية.
- حضانة لمدة 5 دقائق على الروك لوصمة عار الحمض النووي الريبي.
- خذ الجل بعناية من الصندوق وضعه على جهاز الأشعة فوق البنفسجية من نظام التصوير هلام مع الآبار حتى وسلم على اليسار.
- تركيز الكاميرا على هلام، تشغيل ضوء الأشعة فوق البنفسجية ومن ثم التقاط صورة للهلام عن طريق تعريض من 50 مللي ثانية إلى 1 ثانية اعتمادا على شدة الإشارة.
- قم بإيقاف تشغيل التعرض للأشعة فوق البنفسجية، واحفظ الصورة كملف Tiff.
- ضع الجل مرة أخرى في المربع. إزالة TBE. إصلاح هلام مع 50 مل من إصلاح الحل (50٪ الميثانول، 10٪ حمض الخليك، 40٪ المياه النقية جدا) لمدة 30 دقيقة في درجة حرارة الغرفة على الروك.
- حرك الجل برفق مرة أخرى إلى صندوق أسود جديد يحتوي على 25 مل من محلول تعزيز التصوير الشعاعي التلقائي. في غياب مربع أسود، وتغطية مربع مع رقائق الألومنيوم لحماية الحل من الضوء.
- حضانة لمدة 30 دقيقة في درجة حرارة الغرفة على الروك.
- رفع بلطف هلام ووضعها وجها إلى أسفل على ورقة من البلاستيك التفاف مع الآبار حتى وسلم على الجانب الأيمن. وضع ورقتين من ورقة الكروماتوغرافيا على الجزء الخلفي من هلام. قم بقلب المكدس بأكمله بلطف.
- سخني مجفف الجل مسبقاً إلى 80 درجة مئوية. العودة إلى الغطاء البلاستيك على مجفف هلام. إدراج التفاف، هلام والكروماتوغرافيا كومة الورق تحت الغطاء البلاستيك ونقل الغطاء البلاستيك مرة أخرى إلى أسفل لإنشاء ختم.
- يجف لمدة 1 ساعة عند 80 درجة مئوية في مجفف الجل.
- قم بإيقاف مجفف الجل وإزالة المكدس برفق. قم بإزالة اللف والورق اللوني الثاني. الشريط ورقة الكروماتوغرافيا المتبقية مع هلام المجففة في كاسيت autoradiogram.
- أضف ورقة واحدة من فيلم التصوير الشعاعي التلقائي في الغرفة المظلمة.
- وضع كاسيت في -80 درجة مئوية وتطوير الفيلم بعد 1 ساعة إلى 4 أسابيع اعتمادا على كثافة الإشارة، والتي يمكن الحكم عليها على أساس عدد التلألؤ قياسها سابقا: 1-4 أسابيع ل 250-1000 cpm، 24 ساعة إلى 1 أسبوع ل 1،000-10،000 كب م و 1 ساعة إلى 24 ساعة ل > 10،000 cp م.
- بمجرد تطوير الفيلم، ضع الفيلم على رأس الكاسيت ووضع علامة بعناية مع علامة مختبر حواف 4 من هلام، كل بئر، وموقف الأصباغ XC وBB.
- امسح الفيلم بالمسح الضوئي بدقة 300 أو 600 بكسل لكل بوصة واحفظ الصورة كملف Tiff.
النتائج
رد فعل النسخ في المختبر
الشكل 2 يمثّل [ا] شوط نموذجيّة من [إينترو فيترو] نسخ ردّ فعل مع ال [ت7] [رنا] [بولمرس] من ال [7سك] [سنرنا], أيّ يكون نسبيّا قصيرة (331 [نت]) وجدّا ينظّم [رنا]. كما هو مبين في تلك الصورة الخام، هناك العديد من العصابات غير المرغوب فيها، على حد سواء أقصر وأطول من 7SK، وربما الناجمة عن بدء النسخ العشوائي أو أحداث الإنهاء. وبسبب هذا، تنقية هلام بعد رد فعل النسخ في المختبر من المهم الحصول على عينة RNA نظيفة كما هو مبين في الشكل 2B. عند هذه النقطة، يمكن تحديد الحمض النووي الريبي من الفائدة من قبل موقعه بالنسبة إلى السلم وتنقيتها عن طريق تنقية هلام.
كما ذكر سابقا، قد يكون من الضروري تحسين طول رد فعل النسخ قبل خطوة تنقية هلام. ردود الفعل النسخ التي تعمل لفترة طويلة جدا يمكن أن يؤدي إلى كميات عالية للغاية من إنتاج الحمض النووي الريبي، مما يجعل تحديد المصب من النص الصحيح من الصعب. ومن المهم أيضا التحقق من هوية النسخة النقية عن طريق النسخ العكسي وPCR الكمي (RTqPCR) باستخدام مواد أولية محددة.
في المختبر الحمض النووي الريبي ميثيل ترانسفيراز الاختبار
ويبين الشكل 3 نتيجة تمثيلية لدراسة ميثيل ترانسفيراز الحمض النووي الريبي الموصوفة في البروتوكول باستخدام الحد الأدنى لتركيزات الحمض النووي الريبي والبروتين الموصى بها. هذا التحليل يسمح لكل من النتائج الكمية من التهم التلألؤ، فضلا عن النتائج النوعية من autoradiogram. هنا, MePCE, وهو ميثيل ترانسفيراز RNA المعروف لميثيلات 7SK10, وقد تبين أن تكون قادرة على أيضا ميثيلات U6. وعلاوة على ذلك، كما هو مبين مؤخرا ل7SK16، ملزمة من H4 الهيستون إلى MePCE يمنع أيضا المثيلة U6. كنا قادرين على ملاحظة هذا في كل من عدد التلألؤ (الشكل3C) وautoradiogram (الشكل3B)، مما يدل على قوة هذا البروتوكول.
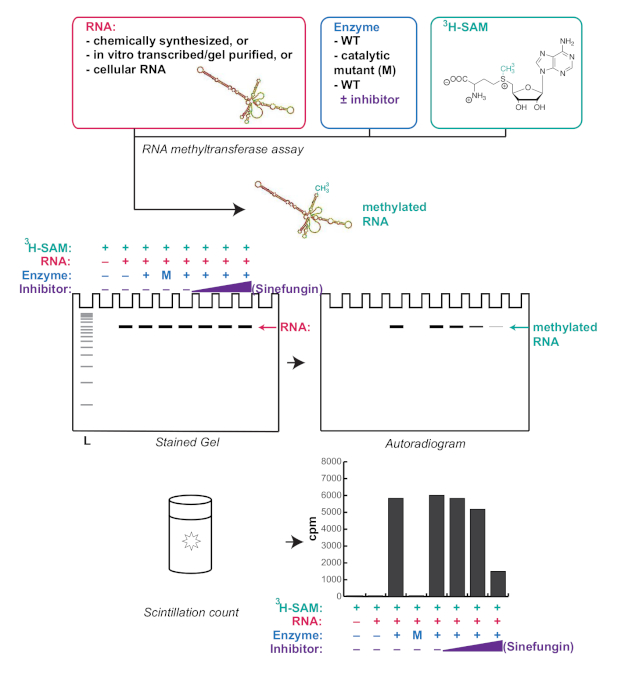
الشكل 1 . التمثيل التخطيطي لسير عمل نموذجي لـ RNA methylTransferase والنتائج المتوقعة. Sinefungin هو مثبط ميثيل ترانسفيراز تنافسية. L: سلم; WT: نوع البرية; M: متحولة الحفاز; cpm: التهم لكل دقيقة.
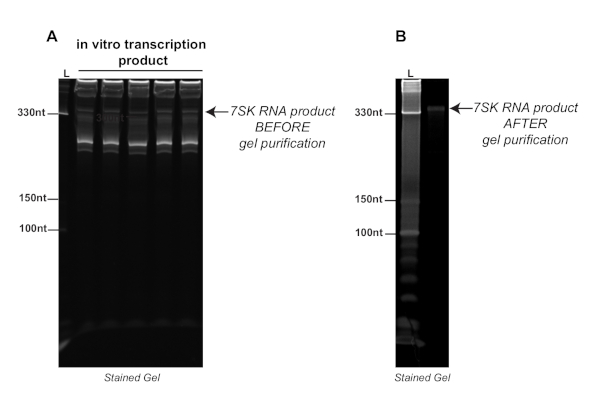
الشكل 2 . تجربة تمثيلية تظهر نتاج النسخ في المختبر قبل (A) وبعد (ب) تنقية على اليوريا-بولياكريلاميد 8٪ هلام ملطخة وصمة عار حمض نووي. تشير الأسهم إلى نسخة 7SK قبل وبعد تنقية هلام. L: سلم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3 . في المختبر الحمض النووي الريبي ميثيل ترانسفيراز الاختبار التي أجريت مع MePCE ضد U6. في المختبر ميثيل ترانسفيراز الاختبار باستخدام المؤتلف GST-MePCE (25 nM)، 3H-المشعة SAM كمتبرع مجموعة الميثيل وفي المختبر نسخ U6 RNA (50 nM) كالركيزة. تم الكشف عن التصوير التلقائي لمدة أسبوعين من أجل الكشف عن النشاط المتبقي (250 cpm) في عينة H4 +Histone. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا، يتم الإبلاغ عن طريقة بسيطة وقوية للتحقق في المختبر من نشاط الحمض النووي الريبي ميثيل ترانسفيراز نحو نسخ محددة. ويستفيد الفحص من حقيقة أن الميثيونين S-adenosyl يمكن أن يكون tritiated على المانحة مجموعة الميثيل (الشكل1)،مما يسمح لRNA ميثيلات إلى الكشف بدقة دون استخدام الأجسام المضادة. ومع ذلك، من المهم أن نلاحظ أن هذا التقييم لا يمكن أن تشير إلى أي بقايا أو مجموعة كيميائية هو ميثيلات من قبل الإنزيم. ولتحديد أو التحقق من أن بقايا معينة قد طُرِّمت، يمكن استخدام أساليب أخرى مثل تحليل الطفرات أو كتلة النسخ العكسي أو تحليل قياس الطيف الكتلي لالركيزة الرنا ية بالاقتران مع فحص الحمض النووي الريبي (RNA methylTransferase)
يعتمد اختيار RNAs وطريقة توليفها على حجم الحمض النووي الريبي. RNAs محددة من الأحجام بين 18 و 120 nt يمكن أن تكون مريحة مخصصة توليفها من العديد من مقدمي الأحماض النووية سمعته الطيبة. ومع ذلك، الأكثر شيوعا، RNAs محددة من مختلف الأحجام هي في المختبر منقولة. يمكن إنشاء قوالب الحمض النووي للنسخ في المختبر بطرق مختلفة، وتتطلب تسلسل الاهتمام أن يكون موجودا ً في أسفل مجرى مروج T7 أو SP6. عندما تكون النهايات الدقيقة من RNAs مهمة، ينصح بلازميد pRZ17. الحساسية العالية للفحص (الشكل 3) يسمح أيضا لاستبدال الحمض النووي الريبي النقي مع خليط من الحمض النووي الريبي الخلوية، إما المجموع أو رسول RNAs على سبيل المثال. في الواقع، يوفر الجل وautoradiogram طريقة لمراقبة حجم الحمض النووي (الحمض النووي) المستهدف ة للمثيلة مباشرة.
الظروف المبلغ عنها هنا في الخطوة 2.1 من البروتوكول هي الأمثل لعائلة BIN3 من methyltransferases، التي لديها اثنين من homologs في البشر، MePCE10 و BCDIN3D9. من المهم التأكيد على أن شروط التقييم تحتاج إلى تعديل للبروتين محددة والحمض النووي الريبي من الفائدة. على سبيل المثال، تبين أن وجود MgCl2 يقلل من نشاط BCDIN3D18، ومع ذلك ، MgCl2 يمكن أن يكون منسقا هاما لهيكل الحمض النووي الريبي ، وبالتالي يمكن أن يشكل عنصرا هاما من الفحص لRNA أخرى ميثيل ترانسفيراز.
ميزة استخدام التصوير التلقائي، والتي يمكن أن تتعرض لفترة طويلة من الزمن، هو أنه يمكن أن تسمح للكشف عن نشاط ضعيف جدا التي لم يتم الكشف عنها في فحص التلألؤ. عادة ما يشير هذا إلى أن البروتين هو methyltransferase، ولكن أن واحدا أو أكثر من ظروف التفاعل أو الكواشف تحتاج إلى تحسين: إنزيم. الركيزة، عامل مساعد، ظروف المخزن المؤقت، الخ9. على سبيل المثال، قد تحتاج تنقية الإنزيم إلى تحسين لإزالة أو تغيير موضع العلامة. قد يكون أيضا أن الحمض النووي الريبي المستخدمة كالركيزة يحتاج إلى طي بشكل صحيح أو للتفاعل مع بروتين آخر أو عامل RNA أن يكون ميثيلات من قبل الإنزيم. وهكذا، يجب مراجعة المؤلفات الموجودة من قبل و/أو النتائج الخاصة في الخلايا بعناية لإعداد شروط فحص الإنزيم والحمض النووي الريبي من الفائدة.
كما أن هذا التبيّر مرن للغاية. على سبيل المثال، يمكن أن يكون خطوة مقدمة لنوع آخر من الفحص، بحيث يتم استخدام الحمض النووي الريبي الميثيلي المشع في الاختبارات الكمية والنوعية demethylase11،أو في الاختبارات الملزمة RNA السماح لتصور على وجه التحديد سلوك [مثلتد] [رنا] يقارن إلى ال [أوندّلد] واحدة. ويمكن أيضا أن يتم تعديل الفحص طفيفة لتحليل تعديل RNAs التي تستخدم الإنزيمات الكترونية التي يمكن وصفها إشعاعيا، مثل أسيتيل الإنزيم المساعد A لدراسة أسيتيل RNA19،20.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ويود المؤلفان أن يشكرا الدكتور تورجا كانتي ديبناث على مساعدته في شركة ChemDraw. ويدعم البحوث في مختبر Xhemalçe من قبل وزارة الدفاع - برنامج البحوث الطبية الموجهة من الكونغرس - جائزة اختراق سرطان الثدي (W81XWH-16-1-0352)، NIH منحة R01 GM127802 والأموال الناشئة من معهد الخلوية والخلوية البيولوجيا الجزيئية وكلية العلوم الطبيعية في جامعة تكساس في أوستن، الولايات المتحدة الأمريكية.
Materials
| Name | Company | Catalog Number | Comments |
| 10 bp DNA Ladder | Invitrogen | 10821-015 | 10 bp DNA Ladder kit. |
| 10% Ammonium Persulfate (APS) | N/A | N/A | For urea denaturing polyacrylamide gel (For 10 mL, dissolve 1g in 8 mL of milliQ water; adjust volume to 10 mL with milliQ water; filter the solution using a 10 mL syringe equiped with a 0.45 µm filter). |
| 10X TBE Buffer | N/A | N/A | For urea denaturing polyacrylamide gel (For 1L, add 108 g of Tris Base, 55 g of Boric Acid to a cylinder with a stir bar; add 800 mL of distilled water and let dissolve; add 40mL of 0.5 M Na2EDTA (pH 8.0); adjust volume to 1L with milliQ water; filter the solution using a 0.22µm filter). |
| 10X TBS | N/A | N/A | For 1L, add 60.5 g of Tris Base, 87.6 g of NaCl to a cylinder with a stir bar; add 800 mL of distilled water and let dissolve; adjust pH to 7.5 with concentrated HCl; adjust volume to 1L with milliQ water; filter the solution using a 0.22 µm filter. |
| Acrylamide: Bis-Acrylamide 29:1 (40% Solution/Electrophoresis), Fisher BioReagents | Fisher | BP1408-1 | For urea denaturing polyacrylamide gel. |
| ADENOSYL-L-METHIONINE, S-[METHYL-3H]; (SAM[3H]) | Perkin Elmer | NET155V250UC | For in vitro methylation of RNA; Concentration = 1.0 mCi/mL; Specific activity = 17.1 Ci/mmol; Molarity= (1.0 Ci/L)/(83.2 Ci/mmol) = 0.0584 mmol/L = 58.4 µM. Upon receipt of the frozen 3H-SAM tube, thaw it at 4°C, make 20 µL aliquots, and freeze them at -30°C. Never refreeze and reuse a partially used aliquot. |
| Amersham Hypercassette Autoradiography Cassettes | GE Healthcare | RPN11649 | For autoradiogram gel exposure. |
| Amersham Hyperfilm MP | GE Healthcare | 28906846 | For autoradiogram gel exposure. |
| Beckman Scintillation Counter | Beckman | LS6500 | For liquid scintillation count. |
| Biorad Mini Horizontal Electrophoresis System | Biorad | 1704466 | Mini Horizontal Electrophoresis System. |
| cOmplete Mini EDTA-free Protease Inhibitor Cocktail Tablets | Roche Applied Science | 4693159001 | For a 20X solution, dissolve 1 tablet in 0.525 mL of nuclease free water. |
| Criterion Cell | Biorad | 345-9902 | RNase free empty cassette for polyacrylamide gel. |
| Criterion empty Cassettes | Biorad | 1656001 | Vertical midi-format electrophoresis cell. |
| DeNovix DS-11 Microvolume Spectrophotometer | DeNovix | DS-11-S | Microvolume Spectrophotometer for measuring DNA and RNA concentration. |
| Ecoscint Original | National Diagnostics | LS-271 | For liquid scintillation count. |
| Fisherbrand 7mL HDPE Scintillation Vials | Fisher | 03-337-1 | For liquid scintillation count. |
| Fluoro-Hance-Quick Acting Autoradiography Enhancer | RPI CORP | 112600 | For autoradiogram gel pretreatment. |
| Gel dryer | Biorad | 1651745 | For drying gel. |
| Gel Loading Buffer II | Ambion | AM8547 | For loading RNA in denaturing polyacrylamide urea gel (composition: 95% Formamide, 18 mM EDTA, and 0.025% SDS, Xylene Cyanol, and Bromophenol Blue). |
| GeneCatcher disposable gel excision tips | Gel Company | NC9431993 | For removing bands from agarose and polyacrylamide gels. |
| Megascript Kit | Ambion | AM1333 | For in vitro transcription with T7 RNA polymerase. |
| Perfectwestern Extralarge Container | Genhunter Corporation | NC9226382 (clear)/ NC9965364 (black) | Gel staining box. |
| pRZ | Addgene | #27663 | Plasmid for producing in vitro transcripts with homogeneous ends |
| Qiagen RNeasy MinElute Cleanup | Qiagen | 74204 | For RNA clean-up, use modified protocol provided in the protocol. |
| QIAquick Gel Extraction Kit (50) | Qiagen | 28704 | Kit for gel extraction and clean up of dsDNA fragment used for in vitro transcription. |
| Saran Premium Plastic Wrap | Saran Wrap | Amazon | For drying gel. |
| SYBR Gold | Invitrogen | S11494 | Ultra sensitive nucleic acid gel stain. |
| SYBR Safe | Invitrogen | S33102 | Nucleic acid gel stain. |
| TE | Sigma | 93283-100ML | 10 mM Tris-HCl, 1 mM disodium EDTA, pH 8.0 |
| TEMED | Fisher | 110-18-9 | For urea denaturing polyacrylamide gel. |
| Thermomixer with SMARTBLOCK 24X 1.5mL TUBES | eppendorf | 5382000023/5361000038 | For temperature controlled incubation of 1.5 mL tubes. |
| TOPO TA Cloning Kit | life technologies | Kits for fast cloning of Taq polymerase–amplified PCR products into vectors containing T7 and/or SP6 promoters for in vitro RNA transcription. | |
| TURBO DNase (2 U⁄µL) | Ambion | AM2238 | For DNA removal from in vitro transcription reactions. |
| Urea | Sigma | 51456-500G | For urea denaturing polyacrylamide gel. |
| Whatman 3MM paper | GE Healthcare | 3030-154 | Chromatography paper for drying gel. |
References
- Xhemalce, B. From histones to RNA: role of methylation in cancer. Briefings in Functional Genomics. 12 (3), 244-253 (2013).
- Shelton, S. B., Reinsborough, C., Xhemalce, B. Who Watches the Watchmen: Roles of RNA Modifications in the RNA Interference Pathway. PLoS Genetics. 12 (7), 1006139 (2016).
- Mauer, J., et al. Reversible methylation of m(6)Am in the 5' cap controls mRNA stability. Nature. 541 (7637), 371-375 (2017).
- Wang, X., et al. N6-methyladenosine-dependent regulation of messenger RNA stability. Nature. 505 (7481), 117-120 (2014).
- Pendleton, K. E., et al. The U6 snRNA m(6)A Methyltransferase METTL16 Regulates SAM Synthetase Intron Retention. Cell. 169 (5), 824-835 (2017).
- Meyer, K. D., et al. 5' UTR m(6)A Promotes Cap-Independent Translation. Cell. 163 (4), 999-1010 (2015).
- Wang, X., et al. N(6)-methyladenosine Modulates Messenger RNA Translation Efficiency. Cell. 161 (6), 1388-1399 (2015).
- Alarcon, C. R., Lee, H., Goodarzi, H., Halberg, N., Tavazoie, S. F. N6-methyladenosine marks primary microRNAs for processing. Nature. 519 (7544), 482-485 (2015).
- Xhemalce, B., Robson, S. C., Kouzarides, T. Human RNA methyltransferase BCDIN3D regulates microRNA processing. Cell. 151 (2), 278-288 (2012).
- Jeronimo, C., et al. Systematic analysis of the protein interaction network for the human transcription machinery reveals the identity of the 7SK capping enzyme. Molecular Cell. 27 (2), 262-274 (2007).
- Liu, W., et al. Brd4 and JMJD6-associated anti-pause enhancers in regulation of transcriptional pause release. Cell. 155 (7), 1581-1595 (2013).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Molecular Cloning. Journal of Visual Experimentation. , (2019).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. Journal of Visual Experimentation. (63), e3998 (2012).
- Rong, M., Durbin, R. K., McAllister, W. T. Template strand switching by T7 RNA polymerase. Journal of Biological Chemistry. 273 (17), 10253-10260 (1998).
- Rio, D. C. Expression and purification of active recombinant T7 RNA polymerase from E. coli. Cold Spring Harb Protocols. 2013 (11), (2013).
- Shelton, S. B., et al. Crosstalk between the RNA Methylation and Histone-Binding Activities of MePCE Regulates P-TEFb Activation on Chromatin. Cell Reports. 22 (6), 1374-1383 (2018).
- Walker, S. C., Avis, J. M., Conn, G. L. General plasmids for producing RNA in vitro transcripts with homogeneous ends. Nucleic Acids Research. 31 (15), 82 (2003).
- Blazer, L. L., et al. A Suite of Biochemical Assays for Screening RNA Methyltransferase BCDIN3D. SLAS Discovery. 22 (1), 32-39 (2017).
- Arango, D., et al. Acetylation of Cytidine in mRNA Promotes Translation Efficiency. Cell. 175 (7), 1872-1886 (2018).
- Ito, S., et al. Human NAT10 is an ATP-dependent RNA acetyltransferase responsible for N4-acetylcytidine formation in 18 S ribosomal RNA (rRNA). Journal of Biological Chemistry. 289 (52), 35724-35730 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved